4.2 元素周期律 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2 元素周期律 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 159.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 14:03:29 | ||
图片预览




文档简介
4.2 元素周期律 同步练习题
一、选择题
1.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Y是空气中含量最高的两种元素,W的单质能与Z的最高价氧化物对应水化物溶液(R)反应产生氢气。下列说法不正确的是
A.X、Y两种元素可形成6种化合物
B.W是一种应用广泛的金属材料
C.简单离子半径:Z>X>Y
D.1molW的单质与足量R反应时可得到1.5mol气体
2.向KI溶液中加入氯水,发生,下列说法错误的是
A.氯气可用于自来水的杀菌、消毒
B.停止反应后,取少量溶液滴加淀粉溶液,溶液变蓝
C.溶液颜色变化说明:
D.实验结果说明:氯的非金属性强于碘
3.下列有关碱金属的说法不正确的是
A.均为ⅠA族元素,最外层均有1个电子
B.单质的还原性:Li>Na>K>Rb>Cs
C.单质的熔、沸点逐渐降低
D.由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
4.2017年5月,中国科学院、国家语言文字工作委员会、全国科学技术名同审定委员会正式向社会发布元素115号(Mc)的中文名称为填。下列说法错误的是
A.288Mc原子的中子数是173
B.Mc在元素周期表中位于第七周期VIA族
C.Mc的同位素具有相同的电子数
D.在同族元素中,Mc的非金属性最弱
5.下列叙述错误的是
A.我国化学家徐光宪院士在稀土元素的提取和应用方面取得了卓越的成就
B.在过渡元素中寻找优良的催化剂
C.在元素周期表的金属元素和非金属元素分界线附近寻找半导体材料
D.根据元素周期律,由可以类推出氟元素的最高价氧化物的水化物为
6.下列元素原子的原子半径最小的是
A.Na B.Mg C.S D.Cl
7.碱金属元素都是典型的活泼金属,其原因是
A.密度小,熔、沸点低 B.最外层只有一个电子,容易失去
C.常温下易液化 D.在自然界中无游离态存在
8.某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1)。下列说法不正确的是
A.X形成的含氧酸均为强酸
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X的最简单气态氢化物一定极易溶于水
二、非选择题
9.元素周期律的发现和元素周期表的诞生,开创了化学科学的新纪元。
Ⅰ.2019年是门捷列夫提出元素周期表150周年。下表为元素周期表的一部分,回答下列问题。
IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)中国青年化学家、北京大学教授雷晓光被国际组织推选为“元素④代言人”,④与①能形成10e-分子,用电子式表示该分子的形成过程: 。
(2)⑤⑥⑧⑨中形成的简单离子半径由大到小的顺序是 (用离子符号表示)。
(3)用一个化学反应证明元素③比元素⑦的得电子能力强,该反应的离子方程式为 。
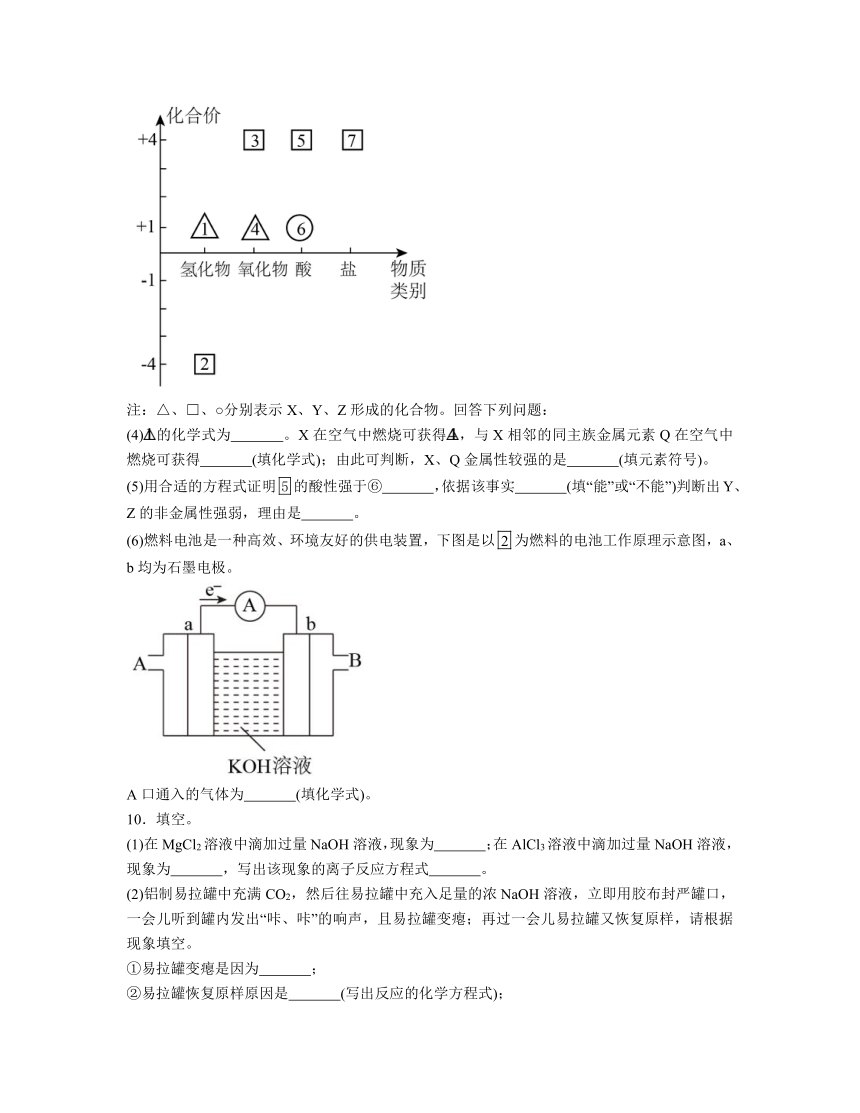
II.短周期元素X、Y、Z原子序数依次增大,其中Y元素的一种同位素可用于文物年代的断定,且其最外层电子数等于X、Z最外层电子总和的一半。Y、Z可形成YZ4型化合物且分子中每个原子均满足8电子稳定结构。关于三种元素的价类二维图如下所示:
注:△、 、○分别表示X、Y、Z形成的化合物。回答下列问题:
(4)的化学式为 。X在空气中燃烧可获得,与X相邻的同主族金属元素Q在空气中燃烧可获得 (填化学式);由此可判断,X、Q金属性较强的是 (填元素符号)。
(5)用合适的方程式证明的酸性强于⑥ ,依据该事实 (填“能”或“不能”)判断出Y、Z的非金属性强弱,理由是 。
(6)燃料电池是一种高效、环境友好的供电装置,下图是以为燃料的电池工作原理示意图,a、b均为石墨电极。
A口通入的气体为 (填化学式)。
10.填空。
(1)在MgCl2溶液中滴加过量NaOH溶液,现象为 ;在AlCl3溶液中滴加过量NaOH溶液,现象为 ,写出该现象的离子反应方程式 。
(2)铝制易拉罐中充满CO2,然后往易拉罐中充入足量的浓NaOH溶液,立即用胶布封严罐口,一会儿听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又恢复原样,请根据现象填空。
①易拉罐变瘪是因为 ;
②易拉罐恢复原样原因是 (写出反应的化学方程式);
(3)有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A是 ,B是 ,C是 。
11.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)元素⑦的名称为 ,在周期表中的位置 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合 物的电子式是 。
(3)用电子式表示元素④和⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(4)写出一种由元素③和④组成的既有离子键又有共价键的物质的电子式 。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是 (用离子符号表 示)
12.某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表.
实验操作 实验现象
1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 (B)产生气体,可在空气中燃烧,溶液变成浅红色 (C)反应不十分强烈,产生的气体可以在空气中燃烧 (D)剧烈反应,产生可燃性气体
2.钠与滴有酚酞试液的冷水反应
3.镁带与2mol.L﹣1的盐酸反应
4.铝条与2mol.L﹣1的盐酸反应
请你帮助该同学整理并完成实验报告
(1)实验目的: .
(2)实验用品:仪器:① ② ③烧杯 ④试管夹 ⑤镊子 ⑥小刀 ⑦玻璃片⑧砂纸 ⑨胶头滴管等
药品:钠、镁带、铝条、2mol.L﹣1的盐酸、AlCl3溶液、NaOH溶液等.
(3)请你写出上述的实验操作与对应的现象
1 ,2 ,3 ,4 (用A﹣D表示)
(4)实验结论: .
【参考答案】
一、选择题
1.C
【分析】X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Y是空气中含量最高的两种元素,即X为N,Y为O,W的单质能与Z的最高价氧化物对应水化物溶液(R)反应产生氢气,则W是Al,Z是Na。据此作答。
解析:A.根据分析,N、O能形成NO、NO2、N2O4、N2O5、N2O、N2O3,A正确;
B.根据分析,W是Al,是一种应用广泛的金属材料,B正确;
C.X、Y、Z的离子核外电子层数都是两层,核电荷数越大,半径越小,所以离子半径半径:N3-> O2->Na+,C错误;
D.根据Al与NaOH溶液反应的方程式系数关系:2Al~2NaOH~3H2,1molAl能生成1.5molH2,D正确;
故选C。
2.C
解析:A.氯气具有强氧化性,可用于自来水的杀菌、消毒,A正确;
B.反应生成I2,淀粉遇I2变蓝,B正确;
C.Cl元素得电子化合价降低,I元素失电子化合价升高,箭头应指向Cl2,C错误;
D.Cl2的氧化性强于I2,故氯的非金属性强于碘的,D正确;
故选C。
3.B
解析:A.碱金属位于周期表第ⅠA族,主族序数等于原子最外层电子数,最外层电子数为1,选项A正确;
B.同主族从上到下电子层数依次增加,半径逐渐增大,失电子能力越来越强,还原性增强,单质的还原性:Li<Na<K<Rb<Cs,选项B错误;
C.碱金属,从上到下,单质的熔、沸点逐渐降低,选项C正确;
D.同一主族,从上到下,电子层数依次增大,核电荷数依次增加,电子层数、原子半径依次增大,选项D正确;
答案选B。
4.B
解析:A.Mc原子序数为115,288为Mc的质量数,因此中子数为288-115=173,故A说法正确;
B.第七周期最后一种元素的原子序数为118,Mc的原子序数为115,因此Mc位于第七周期ⅤA,故B说法错误;
C.同位素的质子数相同,对原子来说,质子数=核外电子数,因此同位素具有相同的电子数,故C说法正确;
D.同主族从上到下,金属性增强,非金属性减弱,因此同族元素中,Mc的非金属性最弱,故D说法正确;
答案为B。
5.D
解析:A.我国化学家徐光宪院士长期从事物理化学和无机化学的教学和研究,涉及量子化学、化学键理论、配位化学、萃取化学、核燃料化学和稀土科学等领域,故A不选
B.制取催化剂的元素通常位于元素周期表第ⅢB族至第ⅡB族之间,属于过渡金属元素,故不选;
C.在元素周期表的金属元素和非金属元素分界线附近的元素既有金属性又有非金属性,常用于制备半导体材料,故C不选;
D.F元素无正价,不能形成含氧酸,故选D。
答案选D
6.D
解析:同周期,从左向右,原子半径依次减小,故r(Cl)7.B
解析:碱金属元素最外层均只有1个电子,在化学反应中极易失去电子,化学性质非常活泼,即碱金属元素都是典型的活泼金属的原因是最外层只有一个电子,容易失去;
故答案选B。
8.A
【分析】根据原子核外最外层电子数不超过8可知,2n -1<8,则n≤ 4.5,讨论:当n=1时,电子层数为1-1 =0,不符合题意;当n =2时,电子层数为2-1=1,最外层电子数为2×2-1 =3,不存在;当n=3时,电子层数为3-1=2,最外层电子数为2×3-1=5,为N元素;当n= 4时,电子层数为4-1=3,最外层电子数为2× 4-1 =7,为Cl元素;
解析:A.HNO2和HClO都是弱酸,故A错误;
B.X可能形成化学式为KNO3,KClO3,故B正确;
C.N的核电荷数为7,最外层电子数为5,Cl的核电荷数17,最外层电子数为7,都是奇数,故C正确;
D.X的最简单气态氢化物为NH3或者HCl,二者极易溶于水,故D正确;
故选A。
二、非选择题
9.(1)
(2)S2- > Cl- > Na+ > Al3+
(3)CO2+H2O+SiO= H2SiO3↓+CO或2CO2+2H2O+SiO= H2SiO3↓+2HCO
(4) LiH Na2O2 Na
(5) Ca(ClO)2 + CO2 + H2O= CaCO3↓+2HClO或NaClO + CO2 + H2O= NaHCO3 + HClO 不能 HClO不是氯元素的最高价含氧酸
(6)CH4
【分析】Ⅰ.根据元素在周期表中的位置,①是H元素;②是Be元素;③是C元素;④是N元素;⑤是Na元素;⑥是Al元素;⑦是Si元素;⑧是S元素;⑨是Cl元素;
II.Y元素的一种同位素可用于文物年代的断定,Y是C元素;X的氢化物、氧化物化合价为+1,则,X是Li元素; Y、Z可形成YZ4型化合物且分子中每个原子均满足8电子稳定结构,Z可以形成+1价含氧酸,Z是Cl元素。
解析:(1)N与H能形成10e-分子是NH3 ,NH3是共价化合物,用电子式表示该分子的形成过程为;
(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小,故简单离子半径由大到小的顺序是S2- > Cl- > Na+ > Al3+。
(3)碳酸的酸性大于硅酸,证明C比元素Si的得电子能力强,该反应的离子方程式为CO2+H2O+SiO= H2SiO3↓+CO。
(4)X是Li元素,是Li的氢化物,化学式为LiH。Li在空气中燃烧可获得Li2O,与Li相邻的同主族金属元素Q是Na元素,Na在空气中燃烧可获得Na2O2;由此可判断,Li、Na金属性较强的是Na。
(5)二氧化碳通入漂白粉溶液生成碳酸钙沉淀和次氯酸,证明碳酸的酸性强于次氯酸,反应方程式为Ca(ClO)2 + CO2 + H2O= CaCO3↓+2HClO,依据该事实不能判断出S、Cl的非金属性强弱,理由是HClO不是氯元素的最高价含氧酸。
(6)是甲烷,电子由a流向b,a是负极、b是正极;a极甲烷失电子发生氧化反应,A口通入的气体为CH4。
10.(1)有白色沉淀生成 先产生白色沉淀,后沉淀逐渐溶解 Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=+2H2O
(2)二氧化碳与氢氧化钠溶液反应,使得罐内气体的压强减小 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(3) BaCl2 K2CO3 Na2SO4
解析:(1)在MgCl2溶液中滴加过量NaOH溶液,反应生成氢氧化镁沉淀,观察到有白色沉淀生成;在AlCl3溶液中滴加NaOH溶液,先生成氢氧化铝沉淀,当氢氧化钠溶液过量,氢氧化铝会溶于氢氧化钠溶液,观察到的现象为先产生白色沉淀,后沉淀逐渐溶解;反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=+2H2O;故答案为:有白色沉淀生成;先产生白色沉淀,后沉淀逐渐溶解;Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=+2H2O;
(2)①二氧化碳与氢氧化钠溶液发生反应2NaOH+CO2=Na2CO3+H2O,使得罐内气体的压强减小,外界空气将易拉罐压瘪;故答案为:二氧化碳与氢氧化钠溶液反应,使得罐内气体的压强减小;
②铝制的易拉罐与氢氧化钠溶液反应产生氢气,导致罐内气体压强又增大,易拉罐又鼓起来,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)BaCl2与H2SO4反应生成BaSO4白色沉淀,所以A为BaCl2;K2CO3与H2SO4反应生成CO2气体,所以B为K2CO3;Na2SO4与H2SO4不反应,C中无明显现象,所以C为Na2SO4,故答案为:BaCl2;K2CO3;Na2SO4。
11.氯 第三周期第ⅦA族 HClO4 离子 S2->Cl->K+
【分析】由元素在周期表中的位置可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,以此答题。
解析:(1)由题可知元素⑦处于周期表中第三周期第ⅦA族,是氯元素,故答案为:氯、第三周期第ⅦA族。
(2)由分析可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,即最高价氧化物的水化物中,酸性最强的化合物是HClO4,其中元素K的金属性最强,KOH的碱性最强,其电子式为,故答案为: HClO4;。
(3)元素④为Na,⑥为S,即元素④和⑥形成的化合物为Na2S,属于离子化合物,用电子式表示其形成过程为:,故答案为:;离子。
(4)由分析可知,③为O、④为Na,即由元素③和④组成的既有离子键又有共价键的物质是Na2O2,故电子式为:;
(5) ⑥、⑦、⑨三种元素分别S、C1、K,即形成的离子分别为:S2-、Cl-、K+,三者电子层结构相同,核电荷数越大离子半径越小,故离子半径由大到小的顺序:S2->Cl->K+。
12. 探究同周期元素性质的递变规律 试管 酒精灯 B A D C Na>Mg>Al
解析:(1)根据实验方案知,实验1、2、3、4是证明金属的金属性强弱,且这几种金属都是同一周期的金属,所以实验目的是为探究同周期元素性质的递变规律;
(2)①用于盛放药品进行实验的仪器是试管;②用于进行加热的仪器是酒精灯;
(3)1、镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢气是可燃性气体,且氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,所以溶液呈浅红色,故选B;
2、钠与滴有酚酞试液的冷水反应,钠的密度小于水的密度,所以会浮在水面上;钠的熔点较低,钠和水反应放出大量热,钠和水反应很剧烈,生成氢氧化钠和氢气,氢气是可燃性气体,氢氧化钠是易溶于水的碱,所以其水溶液呈红色,故选A;
3、镁带与2mol·L-1的盐酸反应,盐酸中氢离子浓度较大,所以反应剧烈,产生可燃性气体,故选D;
4、铝条与2mol·L-1的盐酸反应,盐酸和铝反应不如和镁反应剧烈,且反应时都生成可燃性气体,故选C;
(4)由实验可知金属性Na>Mg>Al,则实验结论为同周期元素随原子序数增大,元素金属性逐渐减弱,故答案为金属性:Na>Mg>Al
一、选择题
1.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Y是空气中含量最高的两种元素,W的单质能与Z的最高价氧化物对应水化物溶液(R)反应产生氢气。下列说法不正确的是
A.X、Y两种元素可形成6种化合物
B.W是一种应用广泛的金属材料
C.简单离子半径:Z>X>Y
D.1molW的单质与足量R反应时可得到1.5mol气体
2.向KI溶液中加入氯水,发生,下列说法错误的是
A.氯气可用于自来水的杀菌、消毒
B.停止反应后,取少量溶液滴加淀粉溶液,溶液变蓝
C.溶液颜色变化说明:
D.实验结果说明:氯的非金属性强于碘
3.下列有关碱金属的说法不正确的是
A.均为ⅠA族元素,最外层均有1个电子
B.单质的还原性:Li>Na>K>Rb>Cs
C.单质的熔、沸点逐渐降低
D.由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
4.2017年5月,中国科学院、国家语言文字工作委员会、全国科学技术名同审定委员会正式向社会发布元素115号(Mc)的中文名称为填。下列说法错误的是
A.288Mc原子的中子数是173
B.Mc在元素周期表中位于第七周期VIA族
C.Mc的同位素具有相同的电子数
D.在同族元素中,Mc的非金属性最弱
5.下列叙述错误的是
A.我国化学家徐光宪院士在稀土元素的提取和应用方面取得了卓越的成就
B.在过渡元素中寻找优良的催化剂
C.在元素周期表的金属元素和非金属元素分界线附近寻找半导体材料
D.根据元素周期律,由可以类推出氟元素的最高价氧化物的水化物为
6.下列元素原子的原子半径最小的是
A.Na B.Mg C.S D.Cl
7.碱金属元素都是典型的活泼金属,其原因是
A.密度小,熔、沸点低 B.最外层只有一个电子,容易失去
C.常温下易液化 D.在自然界中无游离态存在
8.某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1)。下列说法不正确的是
A.X形成的含氧酸均为强酸
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X的最简单气态氢化物一定极易溶于水
二、非选择题
9.元素周期律的发现和元素周期表的诞生,开创了化学科学的新纪元。
Ⅰ.2019年是门捷列夫提出元素周期表150周年。下表为元素周期表的一部分,回答下列问题。
IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)中国青年化学家、北京大学教授雷晓光被国际组织推选为“元素④代言人”,④与①能形成10e-分子,用电子式表示该分子的形成过程: 。
(2)⑤⑥⑧⑨中形成的简单离子半径由大到小的顺序是 (用离子符号表示)。
(3)用一个化学反应证明元素③比元素⑦的得电子能力强,该反应的离子方程式为 。
II.短周期元素X、Y、Z原子序数依次增大,其中Y元素的一种同位素可用于文物年代的断定,且其最外层电子数等于X、Z最外层电子总和的一半。Y、Z可形成YZ4型化合物且分子中每个原子均满足8电子稳定结构。关于三种元素的价类二维图如下所示:
注:△、 、○分别表示X、Y、Z形成的化合物。回答下列问题:
(4)的化学式为 。X在空气中燃烧可获得,与X相邻的同主族金属元素Q在空气中燃烧可获得 (填化学式);由此可判断,X、Q金属性较强的是 (填元素符号)。
(5)用合适的方程式证明的酸性强于⑥ ,依据该事实 (填“能”或“不能”)判断出Y、Z的非金属性强弱,理由是 。
(6)燃料电池是一种高效、环境友好的供电装置,下图是以为燃料的电池工作原理示意图,a、b均为石墨电极。
A口通入的气体为 (填化学式)。
10.填空。
(1)在MgCl2溶液中滴加过量NaOH溶液,现象为 ;在AlCl3溶液中滴加过量NaOH溶液,现象为 ,写出该现象的离子反应方程式 。
(2)铝制易拉罐中充满CO2,然后往易拉罐中充入足量的浓NaOH溶液,立即用胶布封严罐口,一会儿听到罐内发出“咔、咔”的响声,且易拉罐变瘪;再过一会儿易拉罐又恢复原样,请根据现象填空。
①易拉罐变瘪是因为 ;
②易拉罐恢复原样原因是 (写出反应的化学方程式);
(3)有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A是 ,B是 ,C是 。
11.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)元素⑦的名称为 ,在周期表中的位置 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合 物的电子式是 。
(3)用电子式表示元素④和⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(4)写出一种由元素③和④组成的既有离子键又有共价键的物质的电子式 。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是 (用离子符号表 示)
12.某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表.
实验操作 实验现象
1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 (B)产生气体,可在空气中燃烧,溶液变成浅红色 (C)反应不十分强烈,产生的气体可以在空气中燃烧 (D)剧烈反应,产生可燃性气体
2.钠与滴有酚酞试液的冷水反应
3.镁带与2mol.L﹣1的盐酸反应
4.铝条与2mol.L﹣1的盐酸反应
请你帮助该同学整理并完成实验报告
(1)实验目的: .
(2)实验用品:仪器:① ② ③烧杯 ④试管夹 ⑤镊子 ⑥小刀 ⑦玻璃片⑧砂纸 ⑨胶头滴管等
药品:钠、镁带、铝条、2mol.L﹣1的盐酸、AlCl3溶液、NaOH溶液等.
(3)请你写出上述的实验操作与对应的现象
1 ,2 ,3 ,4 (用A﹣D表示)
(4)实验结论: .
【参考答案】
一、选择题
1.C
【分析】X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Y是空气中含量最高的两种元素,即X为N,Y为O,W的单质能与Z的最高价氧化物对应水化物溶液(R)反应产生氢气,则W是Al,Z是Na。据此作答。
解析:A.根据分析,N、O能形成NO、NO2、N2O4、N2O5、N2O、N2O3,A正确;
B.根据分析,W是Al,是一种应用广泛的金属材料,B正确;
C.X、Y、Z的离子核外电子层数都是两层,核电荷数越大,半径越小,所以离子半径半径:N3-> O2->Na+,C错误;
D.根据Al与NaOH溶液反应的方程式系数关系:2Al~2NaOH~3H2,1molAl能生成1.5molH2,D正确;
故选C。
2.C
解析:A.氯气具有强氧化性,可用于自来水的杀菌、消毒,A正确;
B.反应生成I2,淀粉遇I2变蓝,B正确;
C.Cl元素得电子化合价降低,I元素失电子化合价升高,箭头应指向Cl2,C错误;
D.Cl2的氧化性强于I2,故氯的非金属性强于碘的,D正确;
故选C。
3.B
解析:A.碱金属位于周期表第ⅠA族,主族序数等于原子最外层电子数,最外层电子数为1,选项A正确;
B.同主族从上到下电子层数依次增加,半径逐渐增大,失电子能力越来越强,还原性增强,单质的还原性:Li<Na<K<Rb<Cs,选项B错误;
C.碱金属,从上到下,单质的熔、沸点逐渐降低,选项C正确;
D.同一主族,从上到下,电子层数依次增大,核电荷数依次增加,电子层数、原子半径依次增大,选项D正确;
答案选B。
4.B
解析:A.Mc原子序数为115,288为Mc的质量数,因此中子数为288-115=173,故A说法正确;
B.第七周期最后一种元素的原子序数为118,Mc的原子序数为115,因此Mc位于第七周期ⅤA,故B说法错误;
C.同位素的质子数相同,对原子来说,质子数=核外电子数,因此同位素具有相同的电子数,故C说法正确;
D.同主族从上到下,金属性增强,非金属性减弱,因此同族元素中,Mc的非金属性最弱,故D说法正确;
答案为B。
5.D
解析:A.我国化学家徐光宪院士长期从事物理化学和无机化学的教学和研究,涉及量子化学、化学键理论、配位化学、萃取化学、核燃料化学和稀土科学等领域,故A不选
B.制取催化剂的元素通常位于元素周期表第ⅢB族至第ⅡB族之间,属于过渡金属元素,故不选;
C.在元素周期表的金属元素和非金属元素分界线附近的元素既有金属性又有非金属性,常用于制备半导体材料,故C不选;
D.F元素无正价,不能形成含氧酸,故选D。
答案选D
6.D
解析:同周期,从左向右,原子半径依次减小,故r(Cl)
解析:碱金属元素最外层均只有1个电子,在化学反应中极易失去电子,化学性质非常活泼,即碱金属元素都是典型的活泼金属的原因是最外层只有一个电子,容易失去;
故答案选B。
8.A
【分析】根据原子核外最外层电子数不超过8可知,2n -1<8,则n≤ 4.5,讨论:当n=1时,电子层数为1-1 =0,不符合题意;当n =2时,电子层数为2-1=1,最外层电子数为2×2-1 =3,不存在;当n=3时,电子层数为3-1=2,最外层电子数为2×3-1=5,为N元素;当n= 4时,电子层数为4-1=3,最外层电子数为2× 4-1 =7,为Cl元素;
解析:A.HNO2和HClO都是弱酸,故A错误;
B.X可能形成化学式为KNO3,KClO3,故B正确;
C.N的核电荷数为7,最外层电子数为5,Cl的核电荷数17,最外层电子数为7,都是奇数,故C正确;
D.X的最简单气态氢化物为NH3或者HCl,二者极易溶于水,故D正确;
故选A。
二、非选择题
9.(1)
(2)S2- > Cl- > Na+ > Al3+
(3)CO2+H2O+SiO= H2SiO3↓+CO或2CO2+2H2O+SiO= H2SiO3↓+2HCO
(4) LiH Na2O2 Na
(5) Ca(ClO)2 + CO2 + H2O= CaCO3↓+2HClO或NaClO + CO2 + H2O= NaHCO3 + HClO 不能 HClO不是氯元素的最高价含氧酸
(6)CH4
【分析】Ⅰ.根据元素在周期表中的位置,①是H元素;②是Be元素;③是C元素;④是N元素;⑤是Na元素;⑥是Al元素;⑦是Si元素;⑧是S元素;⑨是Cl元素;
II.Y元素的一种同位素可用于文物年代的断定,Y是C元素;X的氢化物、氧化物化合价为+1,则,X是Li元素; Y、Z可形成YZ4型化合物且分子中每个原子均满足8电子稳定结构,Z可以形成+1价含氧酸,Z是Cl元素。
解析:(1)N与H能形成10e-分子是NH3 ,NH3是共价化合物,用电子式表示该分子的形成过程为;
(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小,故简单离子半径由大到小的顺序是S2- > Cl- > Na+ > Al3+。
(3)碳酸的酸性大于硅酸,证明C比元素Si的得电子能力强,该反应的离子方程式为CO2+H2O+SiO= H2SiO3↓+CO。
(4)X是Li元素,是Li的氢化物,化学式为LiH。Li在空气中燃烧可获得Li2O,与Li相邻的同主族金属元素Q是Na元素,Na在空气中燃烧可获得Na2O2;由此可判断,Li、Na金属性较强的是Na。
(5)二氧化碳通入漂白粉溶液生成碳酸钙沉淀和次氯酸,证明碳酸的酸性强于次氯酸,反应方程式为Ca(ClO)2 + CO2 + H2O= CaCO3↓+2HClO,依据该事实不能判断出S、Cl的非金属性强弱,理由是HClO不是氯元素的最高价含氧酸。
(6)是甲烷,电子由a流向b,a是负极、b是正极;a极甲烷失电子发生氧化反应,A口通入的气体为CH4。
10.(1)有白色沉淀生成 先产生白色沉淀,后沉淀逐渐溶解 Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=+2H2O
(2)二氧化碳与氢氧化钠溶液反应,使得罐内气体的压强减小 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(3) BaCl2 K2CO3 Na2SO4
解析:(1)在MgCl2溶液中滴加过量NaOH溶液,反应生成氢氧化镁沉淀,观察到有白色沉淀生成;在AlCl3溶液中滴加NaOH溶液,先生成氢氧化铝沉淀,当氢氧化钠溶液过量,氢氧化铝会溶于氢氧化钠溶液,观察到的现象为先产生白色沉淀,后沉淀逐渐溶解;反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=+2H2O;故答案为:有白色沉淀生成;先产生白色沉淀,后沉淀逐渐溶解;Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=+2H2O;
(2)①二氧化碳与氢氧化钠溶液发生反应2NaOH+CO2=Na2CO3+H2O,使得罐内气体的压强减小,外界空气将易拉罐压瘪;故答案为:二氧化碳与氢氧化钠溶液反应,使得罐内气体的压强减小;
②铝制的易拉罐与氢氧化钠溶液反应产生氢气,导致罐内气体压强又增大,易拉罐又鼓起来,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)BaCl2与H2SO4反应生成BaSO4白色沉淀,所以A为BaCl2;K2CO3与H2SO4反应生成CO2气体,所以B为K2CO3;Na2SO4与H2SO4不反应,C中无明显现象,所以C为Na2SO4,故答案为:BaCl2;K2CO3;Na2SO4。
11.氯 第三周期第ⅦA族 HClO4 离子 S2->Cl->K+
【分析】由元素在周期表中的位置可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,以此答题。
解析:(1)由题可知元素⑦处于周期表中第三周期第ⅦA族,是氯元素,故答案为:氯、第三周期第ⅦA族。
(2)由分析可知, ①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为C1、⑧为Ar、⑨为K、⑩为Br,即最高价氧化物的水化物中,酸性最强的化合物是HClO4,其中元素K的金属性最强,KOH的碱性最强,其电子式为,故答案为: HClO4;。
(3)元素④为Na,⑥为S,即元素④和⑥形成的化合物为Na2S,属于离子化合物,用电子式表示其形成过程为:,故答案为:;离子。
(4)由分析可知,③为O、④为Na,即由元素③和④组成的既有离子键又有共价键的物质是Na2O2,故电子式为:;
(5) ⑥、⑦、⑨三种元素分别S、C1、K,即形成的离子分别为:S2-、Cl-、K+,三者电子层结构相同,核电荷数越大离子半径越小,故离子半径由大到小的顺序:S2->Cl->K+。
12. 探究同周期元素性质的递变规律 试管 酒精灯 B A D C Na>Mg>Al
解析:(1)根据实验方案知,实验1、2、3、4是证明金属的金属性强弱,且这几种金属都是同一周期的金属,所以实验目的是为探究同周期元素性质的递变规律;
(2)①用于盛放药品进行实验的仪器是试管;②用于进行加热的仪器是酒精灯;
(3)1、镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢气是可燃性气体,且氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,所以溶液呈浅红色,故选B;
2、钠与滴有酚酞试液的冷水反应,钠的密度小于水的密度,所以会浮在水面上;钠的熔点较低,钠和水反应放出大量热,钠和水反应很剧烈,生成氢氧化钠和氢气,氢气是可燃性气体,氢氧化钠是易溶于水的碱,所以其水溶液呈红色,故选A;
3、镁带与2mol·L-1的盐酸反应,盐酸中氢离子浓度较大,所以反应剧烈,产生可燃性气体,故选D;
4、铝条与2mol·L-1的盐酸反应,盐酸和铝反应不如和镁反应剧烈,且反应时都生成可燃性气体,故选C;
(4)由实验可知金属性Na>Mg>Al,则实验结论为同周期元素随原子序数增大,元素金属性逐渐减弱,故答案为金属性:Na>Mg>Al
