1.2.1 有机化合物的分离、提纯课件(共27张PPT)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1 有机化合物的分离、提纯课件(共27张PPT)2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 14:22:49 | ||
图片预览







文档简介
(共27张PPT)
第1课时 有机化合物的分离、提纯
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
屠呦呦获诺贝尔医学奖
分离、提纯
元素定量分析
确定实验式
相对分子质量
确定分子式
确定结构式
蒸馏、萃取分液、重结晶
研究有机物的一般步骤
2.条件:
有机物热稳定性较强
与杂质的沸点相差较大(一般大于30℃)
1.原理:
混合物沸点不同,除去难挥发或不挥发杂质。
液态有机物
3.适用范围:
一、蒸馏
蒸馏烧瓶、冷凝管、牛角管(尾接管)
冷凝管
蒸馏烧瓶
球形冷凝管
直形冷凝管
牛角管(尾接管)
蒸馏时用直形冷凝管
主要实验仪器
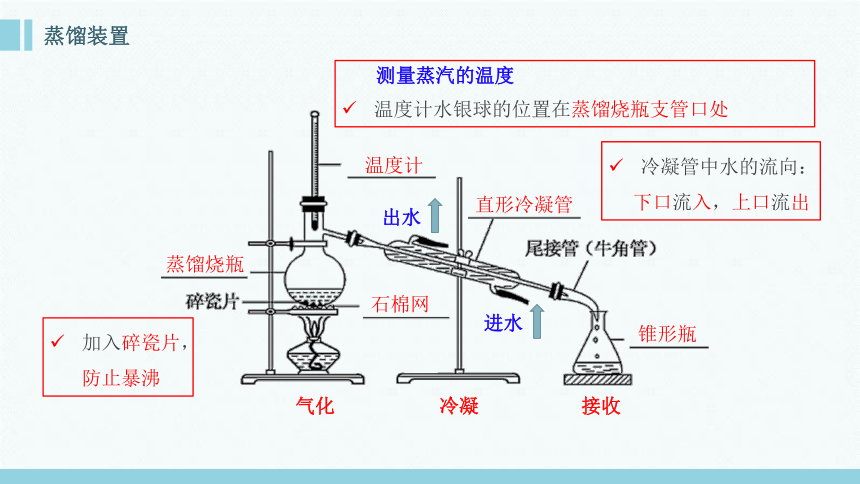
蒸馏装置
蒸馏烧瓶
石棉网
温度计
直形冷凝管
锥形瓶
气化
冷凝
接收
测量蒸汽的温度
温度计水银球的位置在蒸馏烧瓶支管口处
出水
进水
冷凝管中水的流向:
下口流入,上口流出
加入碎瓷片,防止暴沸
已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物(沸点78.15℃)。共沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
物质 乙醇 水
沸点/℃ 78.5 100
沸点差距小
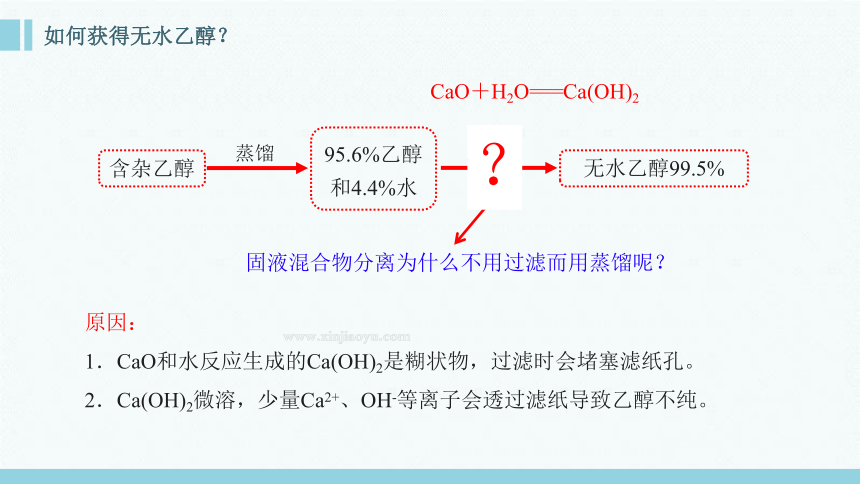
任务一:如何利用蒸馏方法提纯工业乙醇?
含杂乙醇
95.6%乙醇 和4.4%水
无水乙醇99.5%
蒸馏
CaO+H2O===Ca(OH)2
固液混合物分离为什么不用过滤而用蒸馏呢?
原因:
1.CaO和水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔。
2.Ca(OH)2微溶,少量Ca2+、OH-等离子会透过滤纸导致乙醇不纯。
加CaO
蒸馏
?
如何获得无水乙醇?
东晋葛洪的《肘后备急方》记载了“青蒿一握,以水二升渍,绞取汁,尽服之”,屠呦呦受其启发,利用乙醚提炼出抗疟有效成分青蒿素。
有机物在两种互不相溶溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中的过程。
萃取
溶质溶解度:萃取剂中比原溶剂中大
和原溶剂不相溶,不反应
01
02
03
萃取剂与被萃取物质要易于分离
萃取剂的选择
萃取剂
二、萃取
注意事项:
检查是否漏水。
放液时,上口塞子的凹槽和漏斗口颈上的小孔要对准或者打开塞子。
下层液体从下口放出,上层液体从上口放出。
分液漏斗
分液
静置
装液
振荡
分液:将两种互不相溶的液体分开的操作。
萃取的操作
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 棕黄 紫红色 紫红色
表一:碘溶解于不同溶剂中的颜色
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 0.029 g 14.1 g 2.9 g
表二:碘在不同溶剂中的溶解度(25℃)
溶解性:水不溶于四氯化碳、苯
密度:水1.0 g/mL;苯0.88 g/mL(比水轻);四氯化碳1.59 g/mL(比水重)
萃取剂:
苯
四氯化碳
任务二:如何提纯碘水中的碘单质?
用CCl4萃取碘水中的碘
实验步骤 实验现象
量取10 mL碘的饱和水溶液,倒入分液漏斗,注入4 mL CCl4,盖好玻璃塞。 CCl4不溶于水,在下层
用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来用力振荡。
将分液漏斗放在铁架台上,静置。 静置后,CCl4层变紫色,水层黄色变浅
液体分层后, 将分液漏斗上的玻璃塞打开,分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下。
分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
蒸馏
用CCl4萃取碘水中的碘
溶解、蒸发浓缩、冷却结晶、过滤
如何除KNO3固体中少量NaCl固体
重结晶
状态变化 操作
结晶 l → s 蒸发结晶/冷却结晶
重结晶 s →l→s 溶解、蒸发浓缩、冷却结晶
结晶和重结晶
04
重结晶
被提纯物与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
方法
原理
适用
范围
试剂
要求
被提纯物和杂质为固态
杂质在此溶剂中溶解度很小或者很大,易于除去。
被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶。
三、重结晶
【资料】苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色
结晶,其结构可表示为 ,熔点122℃,沸点249℃,
苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸、氯化钠在水中的溶解度如下:
温度 25℃ 50℃ 95℃
苯甲酸 0.34 g 0.85 g 6.8 g
NaCl 36.0 g 37.0 g 39.1 g
任务三:某粗苯甲酸样品中含有少量氯化钠和泥沙,如何提纯苯甲酸?
【实验过程】
(1)观察粗苯甲酸样品的状态。
(2)将1 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
加热溶解
趁热过滤
冷却结晶
过滤洗涤
干燥称量
重结晶法提纯苯甲酸
加热溶解
趁热过滤
冷却结晶
重结晶法提纯苯甲酸
任务四:归纳总结
1.两种液体
不互溶
分液
互溶
化学反应
沸点差别大
蒸馏
沸点差别不大
沸点差别大
蒸馏
其中一种易溶于另一种溶剂
萃取
2.两种固体
一种可溶于水,一种难溶于水
过滤
均能溶于同一种溶剂,被提纯的物质的溶解度受温度的影响较大,杂质的溶解度要么很大,要么很小
重结晶
1.甲烷与氯气在光照条件下反应,得到的产物中含有二氯甲烷(液体,沸点40℃)、三氯甲烷(液体,沸点62℃)和四氯化碳(液体,沸点77℃),分离它们的操作方法是 ( )
A.萃取 B.蒸馏
C.过滤 D.重结晶
课堂练习
B
下列提纯乙酰苯胺使用的溶剂和操作方法都正确的是 ( )
A.水;分液 B.乙醇;过滤
C.水;重结晶 D.乙醇;重结晶
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
2.乙酰苯胺是一种具有解热镇痛作用的白色晶体,某种乙酰苯胺样品中混入了少量氯化钠杂质。已知:①20℃时乙酰苯胺在乙醇中的溶解度为36.9 g;②氯化钠可分散在乙醇中形成胶体;③乙酰苯胺在水中的溶解度如下表:
C
课堂练习
3.下列有关实验的说法错误的是 ( )
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和硝基苯的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
D
课堂练习
4.下列除去杂质的方法正确的是( )
A.除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏
C.除去CO2中少量的SO2:气体通过盛有饱和碳酸钠溶液的洗气瓶
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
D
课堂练习
下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
5.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
C
课堂练习
本节内容结束
第1课时 有机化合物的分离、提纯
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
屠呦呦获诺贝尔医学奖
分离、提纯
元素定量分析
确定实验式
相对分子质量
确定分子式
确定结构式
蒸馏、萃取分液、重结晶
研究有机物的一般步骤
2.条件:
有机物热稳定性较强
与杂质的沸点相差较大(一般大于30℃)
1.原理:
混合物沸点不同,除去难挥发或不挥发杂质。
液态有机物
3.适用范围:
一、蒸馏
蒸馏烧瓶、冷凝管、牛角管(尾接管)
冷凝管
蒸馏烧瓶
球形冷凝管
直形冷凝管
牛角管(尾接管)
蒸馏时用直形冷凝管
主要实验仪器
蒸馏装置
蒸馏烧瓶
石棉网
温度计
直形冷凝管
锥形瓶
气化
冷凝
接收
测量蒸汽的温度
温度计水银球的位置在蒸馏烧瓶支管口处
出水
进水
冷凝管中水的流向:
下口流入,上口流出
加入碎瓷片,防止暴沸
已知工业乙醇(主要成分是乙醇,含有水、甲醇杂质),通过蒸馏可获得95.6%乙醇和4.4%水的共沸混合物(沸点78.15℃)。共沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
物质 乙醇 水
沸点/℃ 78.5 100
沸点差距小
任务一:如何利用蒸馏方法提纯工业乙醇?
含杂乙醇
95.6%乙醇 和4.4%水
无水乙醇99.5%
蒸馏
CaO+H2O===Ca(OH)2
固液混合物分离为什么不用过滤而用蒸馏呢?
原因:
1.CaO和水反应生成的Ca(OH)2是糊状物,过滤时会堵塞滤纸孔。
2.Ca(OH)2微溶,少量Ca2+、OH-等离子会透过滤纸导致乙醇不纯。
加CaO
蒸馏
?
如何获得无水乙醇?
东晋葛洪的《肘后备急方》记载了“青蒿一握,以水二升渍,绞取汁,尽服之”,屠呦呦受其启发,利用乙醚提炼出抗疟有效成分青蒿素。
有机物在两种互不相溶溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂中的过程。
萃取
溶质溶解度:萃取剂中比原溶剂中大
和原溶剂不相溶,不反应
01
02
03
萃取剂与被萃取物质要易于分离
萃取剂的选择
萃取剂
二、萃取
注意事项:
检查是否漏水。
放液时,上口塞子的凹槽和漏斗口颈上的小孔要对准或者打开塞子。
下层液体从下口放出,上层液体从上口放出。
分液漏斗
分液
静置
装液
振荡
分液:将两种互不相溶的液体分开的操作。
萃取的操作
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 棕黄 紫红色 紫红色
表一:碘溶解于不同溶剂中的颜色
水(H2O) 苯(C6H6) 四氯化碳 (CCl4)
碘(I2) 0.029 g 14.1 g 2.9 g
表二:碘在不同溶剂中的溶解度(25℃)
溶解性:水不溶于四氯化碳、苯
密度:水1.0 g/mL;苯0.88 g/mL(比水轻);四氯化碳1.59 g/mL(比水重)
萃取剂:
苯
四氯化碳
任务二:如何提纯碘水中的碘单质?
用CCl4萃取碘水中的碘
实验步骤 实验现象
量取10 mL碘的饱和水溶液,倒入分液漏斗,注入4 mL CCl4,盖好玻璃塞。 CCl4不溶于水,在下层
用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来用力振荡。
将分液漏斗放在铁架台上,静置。 静置后,CCl4层变紫色,水层黄色变浅
液体分层后, 将分液漏斗上的玻璃塞打开,分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下。
分液后应如何分离碘的四氯化碳有机溶液?
(已知:四氯化碳沸点:76.8 ℃ 碘单质沸点:184.35 ℃)
蒸馏
用CCl4萃取碘水中的碘
溶解、蒸发浓缩、冷却结晶、过滤
如何除KNO3固体中少量NaCl固体
重结晶
状态变化 操作
结晶 l → s 蒸发结晶/冷却结晶
重结晶 s →l→s 溶解、蒸发浓缩、冷却结晶
结晶和重结晶
04
重结晶
被提纯物与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
方法
原理
适用
范围
试剂
要求
被提纯物和杂质为固态
杂质在此溶剂中溶解度很小或者很大,易于除去。
被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶。
三、重结晶
【资料】苯甲酸可用作食品防腐剂,纯净的苯甲酸为无色
结晶,其结构可表示为 ,熔点122℃,沸点249℃,
苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸、氯化钠在水中的溶解度如下:
温度 25℃ 50℃ 95℃
苯甲酸 0.34 g 0.85 g 6.8 g
NaCl 36.0 g 37.0 g 39.1 g
任务三:某粗苯甲酸样品中含有少量氯化钠和泥沙,如何提纯苯甲酸?
【实验过程】
(1)观察粗苯甲酸样品的状态。
(2)将1 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
加热溶解
趁热过滤
冷却结晶
过滤洗涤
干燥称量
重结晶法提纯苯甲酸
加热溶解
趁热过滤
冷却结晶
重结晶法提纯苯甲酸
任务四:归纳总结
1.两种液体
不互溶
分液
互溶
化学反应
沸点差别大
蒸馏
沸点差别不大
沸点差别大
蒸馏
其中一种易溶于另一种溶剂
萃取
2.两种固体
一种可溶于水,一种难溶于水
过滤
均能溶于同一种溶剂,被提纯的物质的溶解度受温度的影响较大,杂质的溶解度要么很大,要么很小
重结晶
1.甲烷与氯气在光照条件下反应,得到的产物中含有二氯甲烷(液体,沸点40℃)、三氯甲烷(液体,沸点62℃)和四氯化碳(液体,沸点77℃),分离它们的操作方法是 ( )
A.萃取 B.蒸馏
C.过滤 D.重结晶
课堂练习
B
下列提纯乙酰苯胺使用的溶剂和操作方法都正确的是 ( )
A.水;分液 B.乙醇;过滤
C.水;重结晶 D.乙醇;重结晶
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
2.乙酰苯胺是一种具有解热镇痛作用的白色晶体,某种乙酰苯胺样品中混入了少量氯化钠杂质。已知:①20℃时乙酰苯胺在乙醇中的溶解度为36.9 g;②氯化钠可分散在乙醇中形成胶体;③乙酰苯胺在水中的溶解度如下表:
C
课堂练习
3.下列有关实验的说法错误的是 ( )
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和硝基苯的混合物
C.在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大
D
课堂练习
4.下列除去杂质的方法正确的是( )
A.除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏
C.除去CO2中少量的SO2:气体通过盛有饱和碳酸钠溶液的洗气瓶
D.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
D
课堂练习
下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
5.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
C
课堂练习
本节内容结束
