2.2.2 炔烃课件(共33张PPT)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 2.2.2 炔烃课件(共33张PPT)2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 799.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 16:37:46 | ||
图片预览









文档简介
(共33张PPT)
第二章 烃
第二节 烯烃 炔烃
第2课时 炔烃
1.认识炔烃的组成和结构特点。
2.通过乙炔的学习,掌握炔烃的性质和变化规律。
3.通过实验设计理解乙炔的实验室制备原理。
学习目标
宏观辨识与微观探析:
认识炔烃的组成和结构特点,比较烷烃、烯烃、炔烃的组成、结构与性质的差异。
科学探究与创新意识:
能根据已知气体制备原理学习乙炔的实验室制法,并能通过实验探究掌握乙炔主要化学性质。
核心素养
活动探究
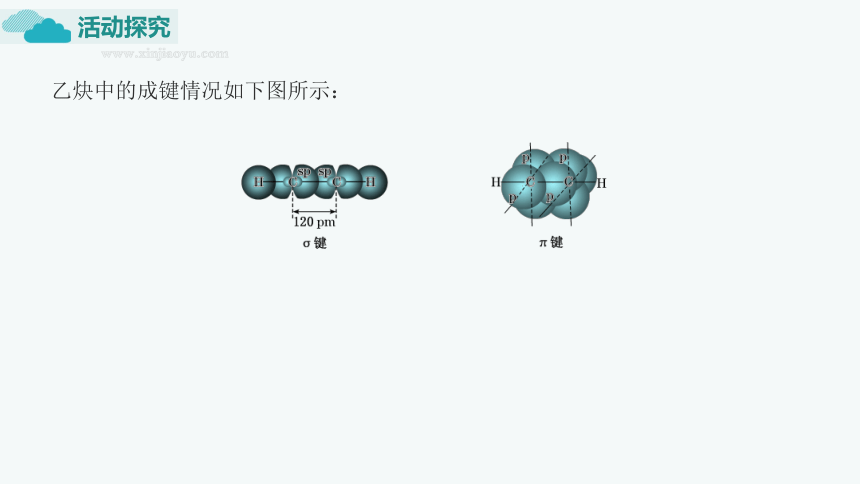
乙炔中的成键情况如下图所示:
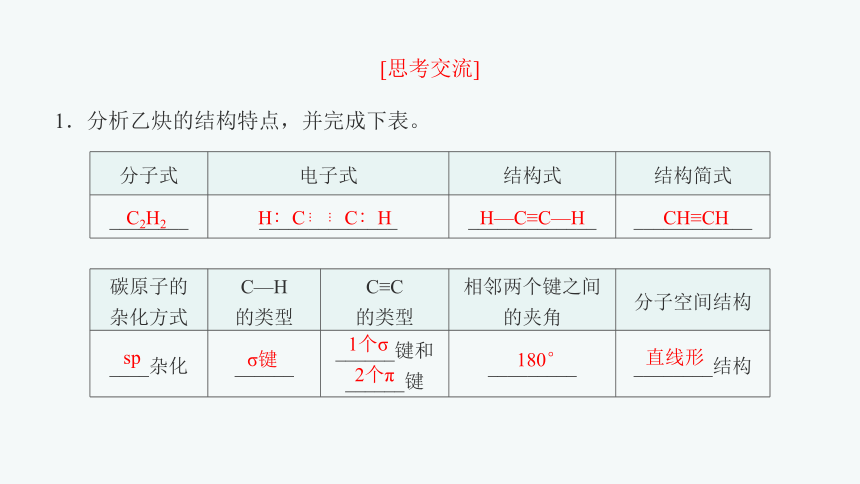
1.分析乙炔的结构特点,并完成下表。
分子式 电子式 结构式 结构简式
________ ______________ _____________ ____________
碳原子的 杂化方式 C—H 的类型 C≡C 的类型 相邻两个键之间的夹角 分子空间结构
____杂化 ______ ______键和 ______键 _________ ________结构
[思考交流]
C2H2
H∶C C∶H
H—C≡C—H
CH≡CH
sp
σ键
1个σ
2个π
180°
直线形
2.炔烃与烯烃的特征反应均为加成反应,不同的是烯烃只有一步加成,而炔烃可以分两步加成,并且可以通过控制条件使加成反应发生一步或两步。请你用乙炔和氯化氢为原料,制取聚氯乙烯树脂,写出其化学反应方程式。
提示:CH≡CH+HCl CH2==CHCl
催化剂
△
催化剂
1.炔烃
(1)概念:分子里含有碳碳三键的一类脂肪烃的总称。
(2)物理性质:与烷烃、烯烃相似,随碳原子数目的增加而递变。
(3)通式:CnH2n-2(n≥2,炔烃分子中只含有一个碳碳三键时)。
一、炔烃的结构与性质
归纳总结
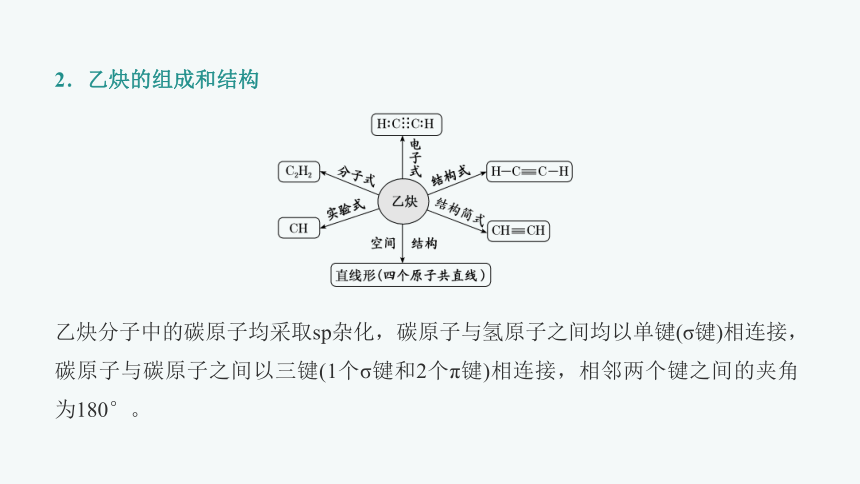
乙炔分子中的碳原子均采取sp杂化,碳原子与氢原子之间均以单键(σ键)相连接,碳原子与碳原子之间以三键(1个σ键和2个π键)相连接,相邻两个键之间的夹角为180°。
2.乙炔的组成和结构
颜色 状态 气味 密度 溶解性
无色 气体 无臭 比空气略小 微溶于水,易溶于有机溶剂
3.乙炔的物理性质
在空气中燃烧 化学方程式:2C2H2+5O2 4CO2+2H2O
现象:火焰明亮,并伴有浓烈的黑烟
与酸性KMnO4 溶液反应 现象:酸性KMnO4溶液褪色
解释:乙炔被酸性KMnO4溶液氧化
点燃
4.乙炔的化学性质
(1)氧化反应
(2)加成反应
与溴反应 CH≡CH+Br2―→CHBr==CHBr (1,2-二溴乙烯)
CHBr==CHBr+Br2―→CHBr2CHBr2(1,1,2,2-四溴乙烷)
与H2反应 CH≡CH+H2 CH2==CH2
与HCl反应 CH≡CH+HCl CH2==CHCl
与H2O反应 CH≡CH+H2O CH3CHO
催化剂
△
催化剂
△
催化剂
△
(3)加聚反应
CH≡CH ,产物为聚乙炔,可用于制备导电高分子材料。
催化剂
1.下列关于炔烃的描述正确的是( )
A.分子里含有碳碳三键的不饱和链烃叫炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色
【解析】B中,例如1-丁炔中所有碳原子就不在同一直线上,是折线形;C中,炔烃易发生加成反应难发生取代反应;D中,炔烃既能使溴水褪色,也可以使酸性高锰酸钾溶液褪色。
巩固练习
A
2.含有一个三键的炔烃,氢化后得到的烷烃结构式如下所示 ,此炔烃可能有的结构简式有( )
A.1种 B.2种 C.3种 D.4种
【解析】根据炔烃与H2加成反应的原理可知,烷烃分子中相邻碳原子上均带2个氢原子才可以形成C≡C,由烷烃的结构简式可知,该烷烃有如下所示的3个
位置可以形成C≡C, 其中1、2两位置相同,故该炔烃共有2种。
B
实验室中用如图所示装置制取乙炔,并探究乙炔的化学性质。思考并回答下列问题:
活动探究
1.实验室制取乙炔时用饱和食盐水代替蒸馏水的目的是什么?如何滴加饱和食盐水?
提示:电石与水反应非常剧烈,为了减小其反应速率,可用饱和食盐水代替水作反应试剂,并用分液漏斗控制水流的速率,让食盐水逐滴慢慢地滴入。
2.制取时常在导气管口附近塞入少量棉花的作用是什么?
提示:用试管作反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
[思考交流]
提示:装置②的作用是除去H2S等杂质。反应方程式为CuSO4+H2S===CuS↓+H2SO4。
4.装置③、④、⑤是为了验证乙炔的化学性质,各个装置中的现象是怎样的?乙炔反应的类型是什么?
提示:装置③中现象是溶液褪色,乙炔发生氧化反应;装置④中现象是溶液褪色,乙炔发生加成反应;装置⑤的现象是有明亮的火焰并有浓烟产生,乙炔发生氧化反应。
3.装置②的作用是什么?写出反应的化学方程式。
1.反应原料:电石、水。
2.反应原理:CaC2+2H2O―→Ca(OH)2+CH≡CH↑。
3.发生装置:使用“固+液―→气”的装置(如图所示)。
4.收集方法:排水集气法。
二、乙炔的实验室制法
归纳总结
5.注意事项
(1)用试管作反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
(2)电石与水反应非常剧烈,为了减小其反应速率,可用饱和食盐水代替水作反应试剂,并用分液漏斗控制水流的速率,让食盐水逐滴慢慢地滴入。
(3)因反应放热且电石易变成粉末,所以制取乙炔时不能使用启普发生器。
(4)由于电石中含有与水反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
1.如图是实验室用电石和水反应制取乙炔的装置,其中正确的是( )
【解析】实验室制取乙炔是用CaC2和水反应,不需要加热,由于CaC2与水反应剧烈,且反应放出大量的热,因此不能用启普发生器,也不能用长颈漏斗,导气管也不能伸入液面以下,否则气体无法导出。
巩固练习
C
2.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是( )
A.将生成的气体直接通入溴水中,溴水褪色,说明有乙炔生成
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.逐滴加入饱和食盐水可控制生成乙炔的速率
D.将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
A
【解析】生成的气体中含乙炔、硫化氢,均与溴水反应,溴水褪色不能说明乙炔生成,故A错误;乙炔能被高锰酸钾氧化,则酸性KMnO4溶液褪色,说明乙炔具有还原性,故B正确;逐滴加入饱和食盐水可控制生成乙炔的速率,反应平稳,故C正确;乙炔含碳量高,将纯净的乙炔点燃,有浓烈的黑烟,即乙炔不饱和程度高,故D正确。
(1)图中A管的作用是___________________________________,
制取乙炔的化学方程式是______________________________,
为避免反应太迅速,可采取的措施为___________________。
(2)乙炔通入酸性KMnO4溶液中观察到的现象是____________________,
乙炔发生了_________反应。
(3)乙炔通入溴的CCl4溶液中可观察到的现象是____________________,
乙炔发生了________反应。
(4)为了安全,点燃乙炔前应__________________,乙炔燃烧时的实验现象是______________________________________________________。
3.如图中的实验装置可用于制取乙炔。请填空:
调节水面高度以控制反应的发生和停止
CaC2+2H2O―→Ca(OH)2+C2H2↑
把水换成饱和食盐水
酸性KMnO4溶液褪色
氧化
溴的CCl4溶液褪色
加成
检验乙炔的纯度
火焰明亮并伴有浓烈的黑烟
【解析】(1)由题图可以看出A管通过橡胶软管与右侧相连,通过调节A管的高低可控制右管中的水是否与电石接触,从而控制反应的发生和停止。若反应太快,可把水换成饱和食盐水。(2)乙炔易被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色。(3)乙炔可与溴发生加成反应生成无色的溴代烃使溴的CCl4溶液褪色。(4)可燃性气体点燃前都应检验纯度。由于乙炔的含碳量较高,所以燃烧时火焰明亮并伴有浓烈的黑烟。
1.关于乙炔的说法错误的是( )
A.乙炔的键角为180°,是非极性分子
B.碳原子sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且互相垂直
C.碳碳三键中三条键能量大小相同,其键长是碳碳单键的
D.乙炔分子中既有极性键也有非极性键
当堂检测
C
【解析】乙炔为直线形分子,键角为180°,属于非极性分子,故A正确;碳原子形成乙炔时,一个2s轨道和一个2p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变,其中一个sp轨道与氢原子的1s轨道头碰头重叠形成C—H σ键,另一个sp轨道则与另一个碳原子的sp轨道头碰头重叠形成C—C σ键,碳原子剩下的两个p轨道则肩并肩重叠形成两个C—C π键,且这两个π键相互垂直,故B正确;碳碳三键的三条键能量大小不同,键长大于碳碳单键的,故C错误;乙炔中C—H为极性共价键,碳碳三键属于非极性共价键,故D正确。
2.乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是( )
A.正四面体烷的二氯代物只有1种
B.乙炔生成乙烯基乙炔是加成反应
C.等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同
D. 与环辛四烯互为同分异构体
C
【解析】正四面体烷中每个C原子上只有1个H原子,且只有一种相邻位置,则正四面体烷的二氯代物只有1种,故A正确;乙炔生成乙烯基乙炔,发生碳碳三键的加成反应,故B正确;苯与乙烯基乙炔的最简式均为CH,所以等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同,故C错误; 与环辛四烯分子式都为C8H8,属于同分异构体,故D正确。
3.实验室制乙炔的实验中,下列说法错误的是( )
A.反应的原料之一——CaC2,俗称电石,是由焦炭、熟石灰在电炉中高温反应
制得
B.在实验中可用饱和食盐水代替纯水,有利于控制反应速率
C.该反应原理是CaC2+2H2O―→Ca(OH)2+HC≡CH↑
D.反应过程中会闻到难闻的气味是电石中含有的杂质造成的
A
【解析】焦炭固体与氧化钙固体在电炉中高温制得电石,反应为CaO+3C ==== CaC2+CO↑,故A错误;用饱和食盐水代替纯水能减缓反应速率,从而可以得到较平缓的乙炔气流,故B正确;CaC2与H2O反应生成Ca(OH)2和C2H2,故化学方程式为CaC2+2H2O―→Ca(OH)2+HC≡CH↑,故C正确;电石中含有磷化物和硫化物,与水反应生成臭鸡蛋气味的硫化氢气体和磷化氢气体,故D正确。
高温
4.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,下图所示是有关合成路线图。
已知反应:nCH2==CH—CH==CH2
催化剂
请完成下列各题:
(1)写出物质的结构简式A___________________,C____________________。
(2)写出反应的化学方程式
反应②_________________________________________________________;
反应③_________________________________________________________;
反应⑥________________________________________________________。
CH2==CHCl
CH≡C—CH==CH2
催化剂
nCH2==CHCl
催化剂
△
CH≡CH+HCN CH2==CH—CN
催化剂
△
CH≡C—CH==CH2+HCl
【解析】由合成路线图进行正推(由反应物―→生成物)和反推(由生成物―→反
应物)。如由 ,可推A为CH2==CHCl(氯乙烯),由A可推反应①为
CH≡CH+HCl CH2==CHCl。根据加成原理,可写出反应③为CH≡CH+HCN CH2==CHCN。
催化剂
△
催化剂
△
本节内容结束
第二章 烃
第二节 烯烃 炔烃
第2课时 炔烃
1.认识炔烃的组成和结构特点。
2.通过乙炔的学习,掌握炔烃的性质和变化规律。
3.通过实验设计理解乙炔的实验室制备原理。
学习目标
宏观辨识与微观探析:
认识炔烃的组成和结构特点,比较烷烃、烯烃、炔烃的组成、结构与性质的差异。
科学探究与创新意识:
能根据已知气体制备原理学习乙炔的实验室制法,并能通过实验探究掌握乙炔主要化学性质。
核心素养
活动探究
乙炔中的成键情况如下图所示:
1.分析乙炔的结构特点,并完成下表。
分子式 电子式 结构式 结构简式
________ ______________ _____________ ____________
碳原子的 杂化方式 C—H 的类型 C≡C 的类型 相邻两个键之间的夹角 分子空间结构
____杂化 ______ ______键和 ______键 _________ ________结构
[思考交流]
C2H2
H∶C C∶H
H—C≡C—H
CH≡CH
sp
σ键
1个σ
2个π
180°
直线形
2.炔烃与烯烃的特征反应均为加成反应,不同的是烯烃只有一步加成,而炔烃可以分两步加成,并且可以通过控制条件使加成反应发生一步或两步。请你用乙炔和氯化氢为原料,制取聚氯乙烯树脂,写出其化学反应方程式。
提示:CH≡CH+HCl CH2==CHCl
催化剂
△
催化剂
1.炔烃
(1)概念:分子里含有碳碳三键的一类脂肪烃的总称。
(2)物理性质:与烷烃、烯烃相似,随碳原子数目的增加而递变。
(3)通式:CnH2n-2(n≥2,炔烃分子中只含有一个碳碳三键时)。
一、炔烃的结构与性质
归纳总结
乙炔分子中的碳原子均采取sp杂化,碳原子与氢原子之间均以单键(σ键)相连接,碳原子与碳原子之间以三键(1个σ键和2个π键)相连接,相邻两个键之间的夹角为180°。
2.乙炔的组成和结构
颜色 状态 气味 密度 溶解性
无色 气体 无臭 比空气略小 微溶于水,易溶于有机溶剂
3.乙炔的物理性质
在空气中燃烧 化学方程式:2C2H2+5O2 4CO2+2H2O
现象:火焰明亮,并伴有浓烈的黑烟
与酸性KMnO4 溶液反应 现象:酸性KMnO4溶液褪色
解释:乙炔被酸性KMnO4溶液氧化
点燃
4.乙炔的化学性质
(1)氧化反应
(2)加成反应
与溴反应 CH≡CH+Br2―→CHBr==CHBr (1,2-二溴乙烯)
CHBr==CHBr+Br2―→CHBr2CHBr2(1,1,2,2-四溴乙烷)
与H2反应 CH≡CH+H2 CH2==CH2
与HCl反应 CH≡CH+HCl CH2==CHCl
与H2O反应 CH≡CH+H2O CH3CHO
催化剂
△
催化剂
△
催化剂
△
(3)加聚反应
CH≡CH ,产物为聚乙炔,可用于制备导电高分子材料。
催化剂
1.下列关于炔烃的描述正确的是( )
A.分子里含有碳碳三键的不饱和链烃叫炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色
【解析】B中,例如1-丁炔中所有碳原子就不在同一直线上,是折线形;C中,炔烃易发生加成反应难发生取代反应;D中,炔烃既能使溴水褪色,也可以使酸性高锰酸钾溶液褪色。
巩固练习
A
2.含有一个三键的炔烃,氢化后得到的烷烃结构式如下所示 ,此炔烃可能有的结构简式有( )
A.1种 B.2种 C.3种 D.4种
【解析】根据炔烃与H2加成反应的原理可知,烷烃分子中相邻碳原子上均带2个氢原子才可以形成C≡C,由烷烃的结构简式可知,该烷烃有如下所示的3个
位置可以形成C≡C, 其中1、2两位置相同,故该炔烃共有2种。
B
实验室中用如图所示装置制取乙炔,并探究乙炔的化学性质。思考并回答下列问题:
活动探究
1.实验室制取乙炔时用饱和食盐水代替蒸馏水的目的是什么?如何滴加饱和食盐水?
提示:电石与水反应非常剧烈,为了减小其反应速率,可用饱和食盐水代替水作反应试剂,并用分液漏斗控制水流的速率,让食盐水逐滴慢慢地滴入。
2.制取时常在导气管口附近塞入少量棉花的作用是什么?
提示:用试管作反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
[思考交流]
提示:装置②的作用是除去H2S等杂质。反应方程式为CuSO4+H2S===CuS↓+H2SO4。
4.装置③、④、⑤是为了验证乙炔的化学性质,各个装置中的现象是怎样的?乙炔反应的类型是什么?
提示:装置③中现象是溶液褪色,乙炔发生氧化反应;装置④中现象是溶液褪色,乙炔发生加成反应;装置⑤的现象是有明亮的火焰并有浓烟产生,乙炔发生氧化反应。
3.装置②的作用是什么?写出反应的化学方程式。
1.反应原料:电石、水。
2.反应原理:CaC2+2H2O―→Ca(OH)2+CH≡CH↑。
3.发生装置:使用“固+液―→气”的装置(如图所示)。
4.收集方法:排水集气法。
二、乙炔的实验室制法
归纳总结
5.注意事项
(1)用试管作反应容器制取乙炔时,由于CaC2和水反应剧烈并产生泡沫,为防止产生的泡沫涌入导气管,应在导气管附近塞入少量棉花。
(2)电石与水反应非常剧烈,为了减小其反应速率,可用饱和食盐水代替水作反应试剂,并用分液漏斗控制水流的速率,让食盐水逐滴慢慢地滴入。
(3)因反应放热且电石易变成粉末,所以制取乙炔时不能使用启普发生器。
(4)由于电石中含有与水反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
1.如图是实验室用电石和水反应制取乙炔的装置,其中正确的是( )
【解析】实验室制取乙炔是用CaC2和水反应,不需要加热,由于CaC2与水反应剧烈,且反应放出大量的热,因此不能用启普发生器,也不能用长颈漏斗,导气管也不能伸入液面以下,否则气体无法导出。
巩固练习
C
2.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是( )
A.将生成的气体直接通入溴水中,溴水褪色,说明有乙炔生成
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.逐滴加入饱和食盐水可控制生成乙炔的速率
D.将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
A
【解析】生成的气体中含乙炔、硫化氢,均与溴水反应,溴水褪色不能说明乙炔生成,故A错误;乙炔能被高锰酸钾氧化,则酸性KMnO4溶液褪色,说明乙炔具有还原性,故B正确;逐滴加入饱和食盐水可控制生成乙炔的速率,反应平稳,故C正确;乙炔含碳量高,将纯净的乙炔点燃,有浓烈的黑烟,即乙炔不饱和程度高,故D正确。
(1)图中A管的作用是___________________________________,
制取乙炔的化学方程式是______________________________,
为避免反应太迅速,可采取的措施为___________________。
(2)乙炔通入酸性KMnO4溶液中观察到的现象是____________________,
乙炔发生了_________反应。
(3)乙炔通入溴的CCl4溶液中可观察到的现象是____________________,
乙炔发生了________反应。
(4)为了安全,点燃乙炔前应__________________,乙炔燃烧时的实验现象是______________________________________________________。
3.如图中的实验装置可用于制取乙炔。请填空:
调节水面高度以控制反应的发生和停止
CaC2+2H2O―→Ca(OH)2+C2H2↑
把水换成饱和食盐水
酸性KMnO4溶液褪色
氧化
溴的CCl4溶液褪色
加成
检验乙炔的纯度
火焰明亮并伴有浓烈的黑烟
【解析】(1)由题图可以看出A管通过橡胶软管与右侧相连,通过调节A管的高低可控制右管中的水是否与电石接触,从而控制反应的发生和停止。若反应太快,可把水换成饱和食盐水。(2)乙炔易被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色。(3)乙炔可与溴发生加成反应生成无色的溴代烃使溴的CCl4溶液褪色。(4)可燃性气体点燃前都应检验纯度。由于乙炔的含碳量较高,所以燃烧时火焰明亮并伴有浓烈的黑烟。
1.关于乙炔的说法错误的是( )
A.乙炔的键角为180°,是非极性分子
B.碳原子sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且互相垂直
C.碳碳三键中三条键能量大小相同,其键长是碳碳单键的
D.乙炔分子中既有极性键也有非极性键
当堂检测
C
【解析】乙炔为直线形分子,键角为180°,属于非极性分子,故A正确;碳原子形成乙炔时,一个2s轨道和一个2p轨道杂化成两个sp轨道,另外的两个2p轨道保持不变,其中一个sp轨道与氢原子的1s轨道头碰头重叠形成C—H σ键,另一个sp轨道则与另一个碳原子的sp轨道头碰头重叠形成C—C σ键,碳原子剩下的两个p轨道则肩并肩重叠形成两个C—C π键,且这两个π键相互垂直,故B正确;碳碳三键的三条键能量大小不同,键长大于碳碳单键的,故C错误;乙炔中C—H为极性共价键,碳碳三键属于非极性共价键,故D正确。
2.乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是( )
A.正四面体烷的二氯代物只有1种
B.乙炔生成乙烯基乙炔是加成反应
C.等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同
D. 与环辛四烯互为同分异构体
C
【解析】正四面体烷中每个C原子上只有1个H原子,且只有一种相邻位置,则正四面体烷的二氯代物只有1种,故A正确;乙炔生成乙烯基乙炔,发生碳碳三键的加成反应,故B正确;苯与乙烯基乙炔的最简式均为CH,所以等质量的苯与乙烯基乙炔完全燃烧时的耗氧量相同,故C错误; 与环辛四烯分子式都为C8H8,属于同分异构体,故D正确。
3.实验室制乙炔的实验中,下列说法错误的是( )
A.反应的原料之一——CaC2,俗称电石,是由焦炭、熟石灰在电炉中高温反应
制得
B.在实验中可用饱和食盐水代替纯水,有利于控制反应速率
C.该反应原理是CaC2+2H2O―→Ca(OH)2+HC≡CH↑
D.反应过程中会闻到难闻的气味是电石中含有的杂质造成的
A
【解析】焦炭固体与氧化钙固体在电炉中高温制得电石,反应为CaO+3C ==== CaC2+CO↑,故A错误;用饱和食盐水代替纯水能减缓反应速率,从而可以得到较平缓的乙炔气流,故B正确;CaC2与H2O反应生成Ca(OH)2和C2H2,故化学方程式为CaC2+2H2O―→Ca(OH)2+HC≡CH↑,故C正确;电石中含有磷化物和硫化物,与水反应生成臭鸡蛋气味的硫化氢气体和磷化氢气体,故D正确。
高温
4.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,下图所示是有关合成路线图。
已知反应:nCH2==CH—CH==CH2
催化剂
请完成下列各题:
(1)写出物质的结构简式A___________________,C____________________。
(2)写出反应的化学方程式
反应②_________________________________________________________;
反应③_________________________________________________________;
反应⑥________________________________________________________。
CH2==CHCl
CH≡C—CH==CH2
催化剂
nCH2==CHCl
催化剂
△
CH≡CH+HCN CH2==CH—CN
催化剂
△
CH≡C—CH==CH2+HCl
【解析】由合成路线图进行正推(由反应物―→生成物)和反推(由生成物―→反
应物)。如由 ,可推A为CH2==CHCl(氯乙烯),由A可推反应①为
CH≡CH+HCl CH2==CHCl。根据加成原理,可写出反应③为CH≡CH+HCN CH2==CHCN。
催化剂
△
催化剂
△
本节内容结束
