3.3 醛 酮课件(共31张PPT)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.3 醛 酮课件(共31张PPT)2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 16:38:40 | ||
图片预览








文档简介
第三章 烃的衍生物
第三节 醛 酮
【思考】在日常生活中我们都会有这样的疑问,为什么有的人喝酒“千杯万杯都不醉”,而有的人喝一点酒就面红耳赤,情绪激动甚至酩酊大醉?
新课导入
人的酒量大小,与酒精在人体内的代谢产物和过程有很大关系。乙醇进入人体内,首先在乙醇脱氢酶的作用下氧化为乙醛,然后又在乙醛脱氢酶的作用下将乙醛氧化为乙酸,并进一步转化为CO2和H2O。如果人体内这两种脱氢酶的含量都很大的话,酒精的代谢速度就很快。但如果人体内这两种脱氢酶的含量不够多, 例如缺少乙醛脱氢酶,饮酒后就会引起体内乙醛积累,导致血管扩张而脸红。
醛类通式:
饱和一元醛的通式为:
CmH2m+1CHO 或 CnH2nO(n≥1)
醛
烃基(或氢原子)与醛基直接相连的化合物。
羰基碳原子与两个烃基相连的化合物。
R—CHO
酮
酮类通式:
饱和一元酮的通式为:
CnH2nO(n≥3)
知识梳理
R—C—H
O
=
R—C—R?
O
=
饱和一元醛同分异构现象:
(1)碳链异构;
(2)与酮互为官能团异构。
【练习1】试写出C3H6O属于醛和酮的同分异构体
【练习2】C5H10O有几种醛的同分异构体?
—C4H9 有4种同分异构体
CH3—CH2—C—H
O
=
CH3—C—CH3
O
=
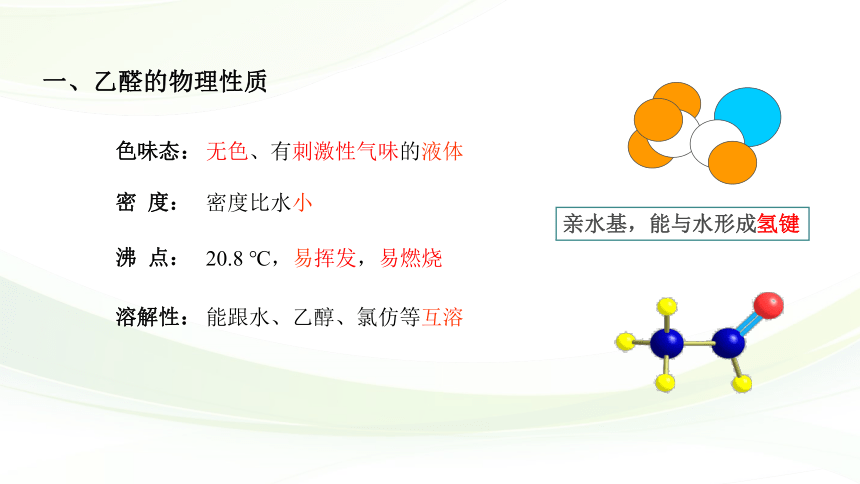
溶解性:
沸 点:
密 度:
无色、有刺激性气味的液体
密度比水小
能跟水、乙醇、氯仿等互溶
20.8 ℃,易挥发,易燃烧
一、乙醛的物理性质
亲水基,能与水形成氢键
色味态:
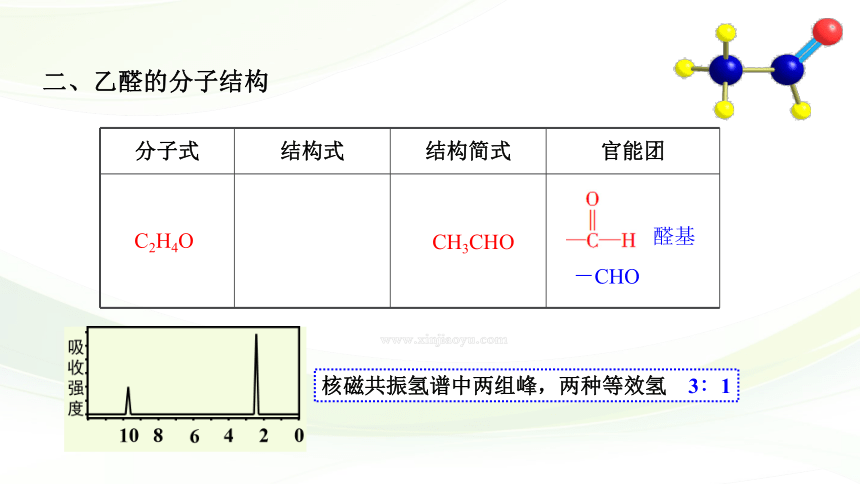
分子式
结构式
结构简式
官能团
C2H4O
CH3CHO
-CHO
核磁共振氢谱中两组峰,两种等效氢 3∶1
醛基
二、乙醛的分子结构
CH3—C—H
O
=
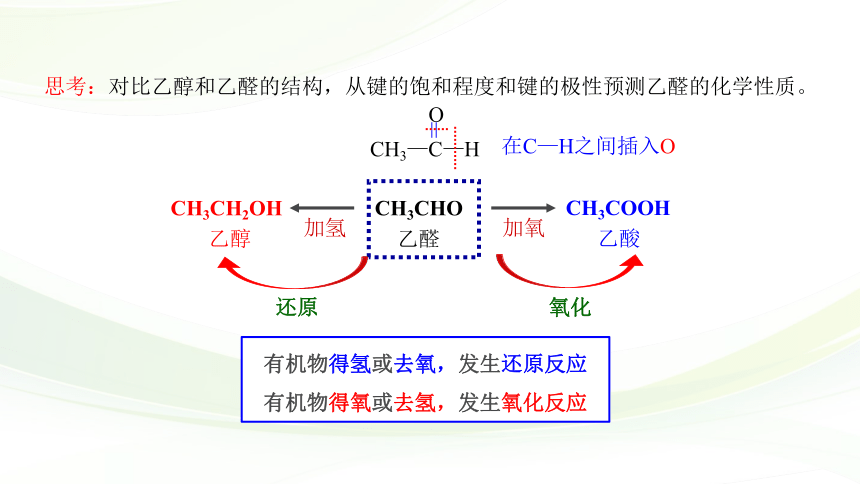
思考:对比乙醇和乙醛的结构,从键的饱和程度和键的极性预测乙醛的化学性质。
CH3CH2OH
CH3CHO
CH3COOH
乙醇
乙醛
乙酸
加氢
还原
加氧
氧化
在C—H之间插入O
有机物得氢或去氧,发生还原反应
有机物得氧或去氢,发生氧化反应
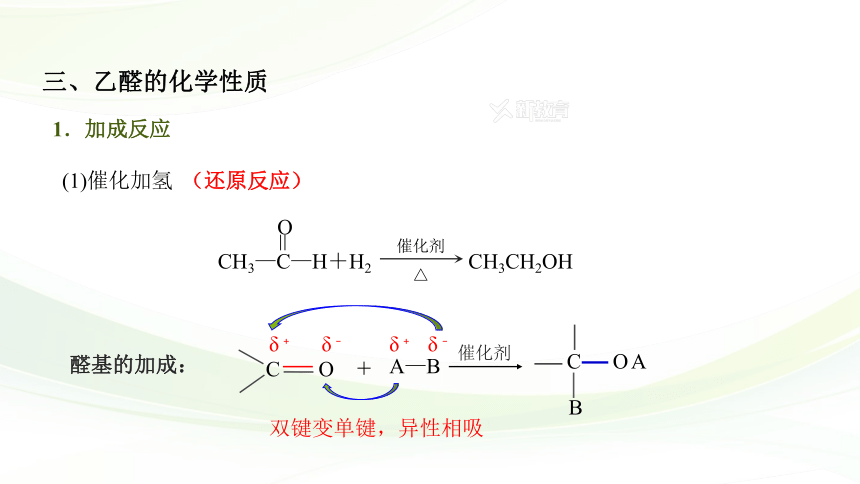
1.加成反应
(1)催化加氢
(还原反应)
双键变单键,异性相吸
醛基的加成:
三、乙醛的化学性质
CH3—C—H+H2 CH3CH2OH
O
=
催化剂
△
O
A
C
B
催化剂
+
C
O
δ﹢
δ﹣
A—B
δ﹢
δ﹣
讨论:溴能与碳碳双键发生加成反应,能否与醛基中的碳氧双键发生加成反应呢?
①醛和酮中的碳氧双键可与H2、HCN、NH3及氨的衍生物、醇发生加成反应。但不能和HX、X2、H2O发生加成反应。
②羧基 (—COOH) 和酯基(—COO—)中的碳氧双键不能与H2发生加成反应。
应用:醛与HCN加成,在有机合成中可以用来增长碳链。
2-羟基丙腈
CH3—C—H + H—CN →
O
=
δ﹣
δ﹢
δ﹢
δ﹣
—
OH
CH3—CH—CN
氰基
(2)与HCN加成
(2)催化氧化
乙醛在一定温度和催化剂作用下,能被氧气氧化为乙酸
乙醛能使酸性高锰酸钾溶液、酸性重铬酸钾溶液、溴水褪色,乙醛被氧化为乙酸
(3)被强氧化剂氧化
【思考】乙醛能与弱氧化剂反应吗?
注意:乙醛不能使
溴的四氯化碳溶液褪色
2.氧化反应
(1)可燃性
2CH3CHO +5O2 4CO2 + 4H2O
点燃
2CH3CHO + O2 2CH3COOH
催化剂
△
实验方案:在洁净的试管中加入1 mL 2% AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
【实验3-7】
现象:试管内壁上覆着一层光亮的银镜
2%AgNO3
2%
氨水
乙醛
水浴加热
银镜
(4)与银氨溶液的反应(银镜反应)
氢氧化二氨合银(络合物)(强电解质:完全电离)
银氨溶液的配制:
CH3CHO+ [Ag(NH3)2] OH
★ 产物巧记:一水、二银、三氨、乙酸铵 。
★ 定性、定量[ ] 分析醛基。
+2Ag↓
+CH3COONH4
2
(—CHO)~ 2 Ag↓
H2O
+ 3 NH3
弱氧化剂
较强还原性
AgNO3+NH3·H2O === AgOH↓+NH4NO3
AgOH + 2NH3·H2O===[Ag(NH3)2] OH +2H2O
△
CH3CHO+2Ag(NH3)2++ 2OH- H2O+2Ag↓+3NH3+CH3COO- +NH4+
?
△
应用:
①检验醛基,并测定醛基的个数
【牢记】1—CHO~2 [Ag(NH3)2]OH~ 1H2O~ 2Ag~ 3NH3
②工业制镜或热水瓶胆镀银
【课堂练习】完成下列化学方程式
+ [Ag(NH3)2]OH
△
COONH4
H2O+2Ag↓+3NH3+
2
实
验
注
意
事
项
(1)试管内壁应洁净,可先碱洗后水洗;
(2)须用新制的银氨溶液,氨水稍过量,滴至沉淀恰好溶解即可;
(3)水浴加热,加热时不能振荡或摇动试管;
(4)反应在碱性条件下进行;
(5)实验后用稀HNO3 浸泡试管,除去银镜。
实验方案:在试管里加入2 mL 10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
【实验3-8】
现象:生成砖红色沉淀
(5)与新制的Cu(OH)2悬浊液的反应(斐林反应)
+ H2O
+ CH3COOH
CH3CHO + Cu(OH)2
Cu2O↓
★ 检验—CHO,医学上常用此实验检查尿糖的含量。
+ NaOH
2
+ CH3COONa + 3 H2O
2
★ 定性、定量[ ] 分析醛基。
(—CHO)~ Cu2O↓
酸与碱会中和,Cu(OH)2 作为氧化剂,不能被中和,
(NaOH须过量),产物应为钠盐
CuSO4 + 2NaOH === Cu(OH)2↓ + Na2SO4
△
【课堂练习】完成下列化学方程式
COONa
+ Cu2O↓ + 3H2O
+ Cu(OH)2+NaOH
△
2
银镜反应与斐林反应的共同点:
醛类、HCOOH、HCOOR、葡萄糖、麦芽糖
含有—CHO的有机物:
①可用于鉴定—CHO的存在。
②均在碱性环境中进行。
③-CHO与[Ag(NH3)2]OH或 Cu(OH)2均以1∶2的比例反应。
④[Ag(NH3)2]OH或 Cu(OH)2均为弱氧化剂,能氧化乙醛,说明—CHO有较强的还原性。
练一练
某醛的结构简式为 CH2=CH-CHO。指出官能团并鉴别?
因为—CHO也能使溴水/KMnO4溶液褪色,所以必须先检验—CHO,将其转化后再检验C=C!
碳碳双键 醛基
溴水/KMnO4溶液 银氨溶液/新制Cu(OH)2
先加银氨溶液——产生银镜(检验醛基)
酸化后再加溴水——褪色(检验碳碳双键)
用Br2的CCl4溶液则不用考虑—CHO的干扰
结构式:
结构简式:HCHO
特殊性:分子中有两个醛基
O
‖
H—C—H
2.物理性质
无色、有强烈刺激性气味的气体(含氧衍生物唯一常温下呈气体的物质),易溶于水
质量分数是35%~45%的甲醛水溶液(又称福尔马林)具有杀菌、消毒性能,可用于防腐和生物标本制作,但是不能浸泡海鲜食品等。
3.用途
——最简单的醛
四、甲醛(又叫蚁醛)
1.分子式:CH2O
福尔马林浸泡的鱼标本
写出甲醛与下列物质反应的化学方程式
(1)与H2加成
(2)与O2催化氧化
(3)银镜反应
(4)与新制Cu(OH)2反应
HCHO+H2 CH3OH
催化剂
△
H—O—C—O—H
O
=
HCHO+O2
催化剂
(H2CO3)
HCHO+4[Ag(NH3)2]OH 2H2O+4Ag↓+6NH3+(NH4)2CO3
△
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
△
(2)苯甲醛在空气中久置,在容器内壁会出现苯甲酸的结晶,这是为什么?
(1)由丙醛如何得到1-丙醇或丙酸?
苯甲醛在空气中久置被氧化为苯甲酸
思考与讨论
—CHO
2 +O2 → 2
—COOH
1.概念:羰基与两个烃基相连的化合物
官能团:羰基
通式:
2.最简单的酮——丙酮
空间充填模型 球棍模型
五、酮
分子式
用途
沸点
结构简式
颜色状态
挥发性
溶解性
C3H6O
无色透明液体
56.2℃
易挥发
CH3CCH3
O
能与水、乙醇等互溶
CH3COCH3
具有令人愉快的气味
化学纤维、钢瓶储存乙炔等的溶剂,生产有机玻璃、农药和涂料等
(2)加成反应:能与H2、HCN、NH3、甲醇等发生加成反应
(酮的催化加氢生成醇是还原反应)
(1)氧化反应
①酮类通常情况不能被氧化,但大多数酮能在空气中燃烧。
②酮中的羰基直接与两个烃基相连,没有与羰基直接相连的氢原子,因此酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化。
可用于鉴别酮与醛
2-丙醇
3.酮的化学性质
?
醛
酮
官能团
醛基:
酮羰基:
官能团位置
碳链末端(最简单的醛是甲醛)
碳链中间(最简单的酮是丙酮)
结构通式
(R为烃基或氢原子)
(R、R′均为烃基)
联系
碳原子数相同的饱和一元脂肪醛和饱和一元脂肪酮互为同分异构体
醛和酮的区别与联系
归纳总结
{5940675A-B579-460E-94D1-54222C63F5DA}官能团
试剂
碳碳双键
碳碳三键
苯的
同系物
醇
酚
醛
溴水
酸性KMnO4溶液
√
结构条件:至少1H
使溴水、酸性KMnO4溶液褪色的有机物
加成
√
氧化
√
加成
√
氧化
×
√
氧化
×
√
氧化
√
取代
√
氧化
√
氧化
√
氧化
1.丙烯醛的结构简式为CH2═CHCHO,下列有关其性质的叙述不正确的是( )
A. 能使溴水褪色
B. 能与过量的氢气充分反应生成丙醛
C. 能发生银镜反应
D. 能被新制的氢氧化铜悬浊液氧化
B
课堂练习
2.下列有关银镜反应的说法正确的是( )
A.试管先用热烧碱溶液洗,然后用蒸馏水洗涤
B.向2%的稀氨水中滴入2%的硝酸银溶液,即可配得银氨溶液
C.可采用水浴加热,也可直接加热
D.可用浓盐酸洗去试管内产生的银镜
A
3.某同学探究乙醛的还原性时 ,取1 mol/L CuSO4溶液和0.5 mol/L NaOH溶液各
1 mL ,在一支洁将的试管内混合后,向其中又加入5 mL 40%的乙醛,结果无红色沉淀出现。实验失败原因可能是( )
A.未充分加热
B.加入乙醛太少
C.加入NaOH溶液的量不够
D.加入CuSO4溶液的量不够
A C
4.下列物质①乙酸、②苯、③聚乙烯、④苯酚、⑤2-丁炔、⑥甲醛、⑦邻二甲苯、⑧环己烯、⑨丙酮,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A. ③④⑤⑧ B. ④⑤⑦⑧⑨
C. ④⑤⑥⑧ D. ③④⑤⑦⑧
C
5.写出由乙二醇(CH2OHCH2OH)为原料制备乙二酸(HOOCCOOH)的化学方程式。
CH2OHCH2OH + O2
Cu
△
OHCCHO+2H2O
OHCCHO + O2
催化剂
△
HOOCCOOH
本节内容结束
第三节 醛 酮
【思考】在日常生活中我们都会有这样的疑问,为什么有的人喝酒“千杯万杯都不醉”,而有的人喝一点酒就面红耳赤,情绪激动甚至酩酊大醉?
新课导入
人的酒量大小,与酒精在人体内的代谢产物和过程有很大关系。乙醇进入人体内,首先在乙醇脱氢酶的作用下氧化为乙醛,然后又在乙醛脱氢酶的作用下将乙醛氧化为乙酸,并进一步转化为CO2和H2O。如果人体内这两种脱氢酶的含量都很大的话,酒精的代谢速度就很快。但如果人体内这两种脱氢酶的含量不够多, 例如缺少乙醛脱氢酶,饮酒后就会引起体内乙醛积累,导致血管扩张而脸红。
醛类通式:
饱和一元醛的通式为:
CmH2m+1CHO 或 CnH2nO(n≥1)
醛
烃基(或氢原子)与醛基直接相连的化合物。
羰基碳原子与两个烃基相连的化合物。
R—CHO
酮
酮类通式:
饱和一元酮的通式为:
CnH2nO(n≥3)
知识梳理
R—C—H
O
=
R—C—R?
O
=
饱和一元醛同分异构现象:
(1)碳链异构;
(2)与酮互为官能团异构。
【练习1】试写出C3H6O属于醛和酮的同分异构体
【练习2】C5H10O有几种醛的同分异构体?
—C4H9 有4种同分异构体
CH3—CH2—C—H
O
=
CH3—C—CH3
O
=
溶解性:
沸 点:
密 度:
无色、有刺激性气味的液体
密度比水小
能跟水、乙醇、氯仿等互溶
20.8 ℃,易挥发,易燃烧
一、乙醛的物理性质
亲水基,能与水形成氢键
色味态:
分子式
结构式
结构简式
官能团
C2H4O
CH3CHO
-CHO
核磁共振氢谱中两组峰,两种等效氢 3∶1
醛基
二、乙醛的分子结构
CH3—C—H
O
=
思考:对比乙醇和乙醛的结构,从键的饱和程度和键的极性预测乙醛的化学性质。
CH3CH2OH
CH3CHO
CH3COOH
乙醇
乙醛
乙酸
加氢
还原
加氧
氧化
在C—H之间插入O
有机物得氢或去氧,发生还原反应
有机物得氧或去氢,发生氧化反应
1.加成反应
(1)催化加氢
(还原反应)
双键变单键,异性相吸
醛基的加成:
三、乙醛的化学性质
CH3—C—H+H2 CH3CH2OH
O
=
催化剂
△
O
A
C
B
催化剂
+
C
O
δ﹢
δ﹣
A—B
δ﹢
δ﹣
讨论:溴能与碳碳双键发生加成反应,能否与醛基中的碳氧双键发生加成反应呢?
①醛和酮中的碳氧双键可与H2、HCN、NH3及氨的衍生物、醇发生加成反应。但不能和HX、X2、H2O发生加成反应。
②羧基 (—COOH) 和酯基(—COO—)中的碳氧双键不能与H2发生加成反应。
应用:醛与HCN加成,在有机合成中可以用来增长碳链。
2-羟基丙腈
CH3—C—H + H—CN →
O
=
δ﹣
δ﹢
δ﹢
δ﹣
—
OH
CH3—CH—CN
氰基
(2)与HCN加成
(2)催化氧化
乙醛在一定温度和催化剂作用下,能被氧气氧化为乙酸
乙醛能使酸性高锰酸钾溶液、酸性重铬酸钾溶液、溴水褪色,乙醛被氧化为乙酸
(3)被强氧化剂氧化
【思考】乙醛能与弱氧化剂反应吗?
注意:乙醛不能使
溴的四氯化碳溶液褪色
2.氧化反应
(1)可燃性
2CH3CHO +5O2 4CO2 + 4H2O
点燃
2CH3CHO + O2 2CH3COOH
催化剂
△
实验方案:在洁净的试管中加入1 mL 2% AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
【实验3-7】
现象:试管内壁上覆着一层光亮的银镜
2%AgNO3
2%
氨水
乙醛
水浴加热
银镜
(4)与银氨溶液的反应(银镜反应)
氢氧化二氨合银(络合物)(强电解质:完全电离)
银氨溶液的配制:
CH3CHO+ [Ag(NH3)2] OH
★ 产物巧记:一水、二银、三氨、乙酸铵 。
★ 定性、定量[ ] 分析醛基。
+2Ag↓
+CH3COONH4
2
(—CHO)~ 2 Ag↓
H2O
+ 3 NH3
弱氧化剂
较强还原性
AgNO3+NH3·H2O === AgOH↓+NH4NO3
AgOH + 2NH3·H2O===[Ag(NH3)2] OH +2H2O
△
CH3CHO+2Ag(NH3)2++ 2OH- H2O+2Ag↓+3NH3+CH3COO- +NH4+
?
△
应用:
①检验醛基,并测定醛基的个数
【牢记】1—CHO~2 [Ag(NH3)2]OH~ 1H2O~ 2Ag~ 3NH3
②工业制镜或热水瓶胆镀银
【课堂练习】完成下列化学方程式
+ [Ag(NH3)2]OH
△
COONH4
H2O+2Ag↓+3NH3+
2
实
验
注
意
事
项
(1)试管内壁应洁净,可先碱洗后水洗;
(2)须用新制的银氨溶液,氨水稍过量,滴至沉淀恰好溶解即可;
(3)水浴加热,加热时不能振荡或摇动试管;
(4)反应在碱性条件下进行;
(5)实验后用稀HNO3 浸泡试管,除去银镜。
实验方案:在试管里加入2 mL 10% NaOH溶液,加入5滴5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
【实验3-8】
现象:生成砖红色沉淀
(5)与新制的Cu(OH)2悬浊液的反应(斐林反应)
+ H2O
+ CH3COOH
CH3CHO + Cu(OH)2
Cu2O↓
★ 检验—CHO,医学上常用此实验检查尿糖的含量。
+ NaOH
2
+ CH3COONa + 3 H2O
2
★ 定性、定量[ ] 分析醛基。
(—CHO)~ Cu2O↓
酸与碱会中和,Cu(OH)2 作为氧化剂,不能被中和,
(NaOH须过量),产物应为钠盐
CuSO4 + 2NaOH === Cu(OH)2↓ + Na2SO4
△
【课堂练习】完成下列化学方程式
COONa
+ Cu2O↓ + 3H2O
+ Cu(OH)2+NaOH
△
2
银镜反应与斐林反应的共同点:
醛类、HCOOH、HCOOR、葡萄糖、麦芽糖
含有—CHO的有机物:
①可用于鉴定—CHO的存在。
②均在碱性环境中进行。
③-CHO与[Ag(NH3)2]OH或 Cu(OH)2均以1∶2的比例反应。
④[Ag(NH3)2]OH或 Cu(OH)2均为弱氧化剂,能氧化乙醛,说明—CHO有较强的还原性。
练一练
某醛的结构简式为 CH2=CH-CHO。指出官能团并鉴别?
因为—CHO也能使溴水/KMnO4溶液褪色,所以必须先检验—CHO,将其转化后再检验C=C!
碳碳双键 醛基
溴水/KMnO4溶液 银氨溶液/新制Cu(OH)2
先加银氨溶液——产生银镜(检验醛基)
酸化后再加溴水——褪色(检验碳碳双键)
用Br2的CCl4溶液则不用考虑—CHO的干扰
结构式:
结构简式:HCHO
特殊性:分子中有两个醛基
O
‖
H—C—H
2.物理性质
无色、有强烈刺激性气味的气体(含氧衍生物唯一常温下呈气体的物质),易溶于水
质量分数是35%~45%的甲醛水溶液(又称福尔马林)具有杀菌、消毒性能,可用于防腐和生物标本制作,但是不能浸泡海鲜食品等。
3.用途
——最简单的醛
四、甲醛(又叫蚁醛)
1.分子式:CH2O
福尔马林浸泡的鱼标本
写出甲醛与下列物质反应的化学方程式
(1)与H2加成
(2)与O2催化氧化
(3)银镜反应
(4)与新制Cu(OH)2反应
HCHO+H2 CH3OH
催化剂
△
H—O—C—O—H
O
=
HCHO+O2
催化剂
(H2CO3)
HCHO+4[Ag(NH3)2]OH 2H2O+4Ag↓+6NH3+(NH4)2CO3
△
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
△
(2)苯甲醛在空气中久置,在容器内壁会出现苯甲酸的结晶,这是为什么?
(1)由丙醛如何得到1-丙醇或丙酸?
苯甲醛在空气中久置被氧化为苯甲酸
思考与讨论
—CHO
2 +O2 → 2
—COOH
1.概念:羰基与两个烃基相连的化合物
官能团:羰基
通式:
2.最简单的酮——丙酮
空间充填模型 球棍模型
五、酮
分子式
用途
沸点
结构简式
颜色状态
挥发性
溶解性
C3H6O
无色透明液体
56.2℃
易挥发
CH3CCH3
O
能与水、乙醇等互溶
CH3COCH3
具有令人愉快的气味
化学纤维、钢瓶储存乙炔等的溶剂,生产有机玻璃、农药和涂料等
(2)加成反应:能与H2、HCN、NH3、甲醇等发生加成反应
(酮的催化加氢生成醇是还原反应)
(1)氧化反应
①酮类通常情况不能被氧化,但大多数酮能在空气中燃烧。
②酮中的羰基直接与两个烃基相连,没有与羰基直接相连的氢原子,因此酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化。
可用于鉴别酮与醛
2-丙醇
3.酮的化学性质
?
醛
酮
官能团
醛基:
酮羰基:
官能团位置
碳链末端(最简单的醛是甲醛)
碳链中间(最简单的酮是丙酮)
结构通式
(R为烃基或氢原子)
(R、R′均为烃基)
联系
碳原子数相同的饱和一元脂肪醛和饱和一元脂肪酮互为同分异构体
醛和酮的区别与联系
归纳总结
{5940675A-B579-460E-94D1-54222C63F5DA}官能团
试剂
碳碳双键
碳碳三键
苯的
同系物
醇
酚
醛
溴水
酸性KMnO4溶液
√
结构条件:至少1H
使溴水、酸性KMnO4溶液褪色的有机物
加成
√
氧化
√
加成
√
氧化
×
√
氧化
×
√
氧化
√
取代
√
氧化
√
氧化
√
氧化
1.丙烯醛的结构简式为CH2═CHCHO,下列有关其性质的叙述不正确的是( )
A. 能使溴水褪色
B. 能与过量的氢气充分反应生成丙醛
C. 能发生银镜反应
D. 能被新制的氢氧化铜悬浊液氧化
B
课堂练习
2.下列有关银镜反应的说法正确的是( )
A.试管先用热烧碱溶液洗,然后用蒸馏水洗涤
B.向2%的稀氨水中滴入2%的硝酸银溶液,即可配得银氨溶液
C.可采用水浴加热,也可直接加热
D.可用浓盐酸洗去试管内产生的银镜
A
3.某同学探究乙醛的还原性时 ,取1 mol/L CuSO4溶液和0.5 mol/L NaOH溶液各
1 mL ,在一支洁将的试管内混合后,向其中又加入5 mL 40%的乙醛,结果无红色沉淀出现。实验失败原因可能是( )
A.未充分加热
B.加入乙醛太少
C.加入NaOH溶液的量不够
D.加入CuSO4溶液的量不够
A C
4.下列物质①乙酸、②苯、③聚乙烯、④苯酚、⑤2-丁炔、⑥甲醛、⑦邻二甲苯、⑧环己烯、⑨丙酮,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A. ③④⑤⑧ B. ④⑤⑦⑧⑨
C. ④⑤⑥⑧ D. ③④⑤⑦⑧
C
5.写出由乙二醇(CH2OHCH2OH)为原料制备乙二酸(HOOCCOOH)的化学方程式。
CH2OHCH2OH + O2
Cu
△
OHCCHO+2H2O
OHCCHO + O2
催化剂
△
HOOCCOOH
本节内容结束
