4.1 糖类课件(共59张PPT)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 4.1 糖类课件(共59张PPT)2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 170.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 16:54:18 | ||
图片预览







文档简介
(共59张PPT)
第一节 糖类
第四章 生物大分子
1.认识常见糖类代表物的组成、结构和典型性质,进一步体会“结构决定性质”的学科观念。
2.了解葡萄糖的结构特点和主要性质,能通过实验探究认识葡萄糖的化学性质。深化对多官能团有机化合物中羟基和醛基性质的认识。
3.知道常见的二糖、多糖的性质及它们之间的相互关系。
4.能描述淀粉和纤维素的典型性质,认识淀粉和纤维素在人体内的重要生理功能。
5.知道糖类物质在食品加工和生物质能源等方面的应用。
学习目标
糖类是一类重要的有机化合物,在自然界中分布广泛,日常食用的蔗糖、粮食中的淀粉、植物茎叶中的纤维素、人体血液中的葡萄糖等均属于糖类。糖类在生命活动中起着重要作用,是生物体所需能量的主要来源,也是重要的能量储存物质,如植物体内的淀粉和动物体内的糖原。糖类还是很多生物体的结构成分,如植物细胞壁的主要成分纤维素。
生活中常见的糖类
葡萄糖
蔗糖
麦芽糖
淀粉
纤维素
甜味
无甜味
C6H12O6
C12H22O11
C12H22O11
(C6H10O5)n
(C6H10O5)n
一、糖类的组成和分类
阅读教材P100,思考并讨论:
1.糖类化合物的组成元素和组成特点?
2.糖类化合物按照什么标准进行分类?
1.糖类的组成
组成元素:碳、氢、氧
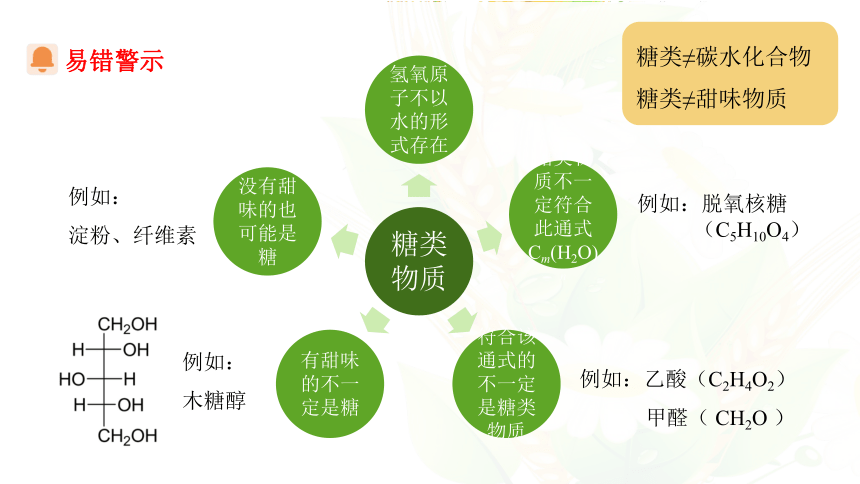
很多糖类分子中氢原子和氧原子数目比恰好为2∶1,组成可以用通式Cm(H2O)n 表示,故糖类也被称为碳水化合物。
易错警示
糖类≠碳水化合物
糖类≠甜味物质
例如:脱氧核糖
(C5H10O4)
例如:乙酸(C2H4O2)
甲醛( CH2O )
例如:
淀粉、纤维素
例如:
木糖醇
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
缩合一般指两个或更多反应物生成一个主要产物,并伴随着失去H2O等小分子的反应。
2.糖类的定义
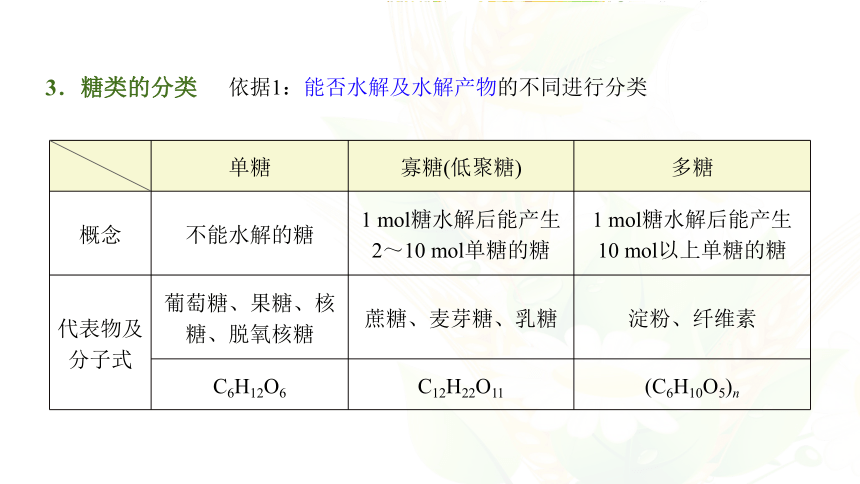
单糖 寡糖(低聚糖) 多糖
概念 不能水解的糖 1 mol糖水解后能产生 2~10 mol单糖的糖 1 mol糖水解后能产生
10 mol以上单糖的糖
代表物及 分子式 葡萄糖、果糖、核糖、脱氧核糖 蔗糖、麦芽糖、乳糖 淀粉、纤维素
C6H12O6 C12H22O11 (C6H10O5)n
依据1:能否水解及水解产物的不同进行分类
3.糖类的分类
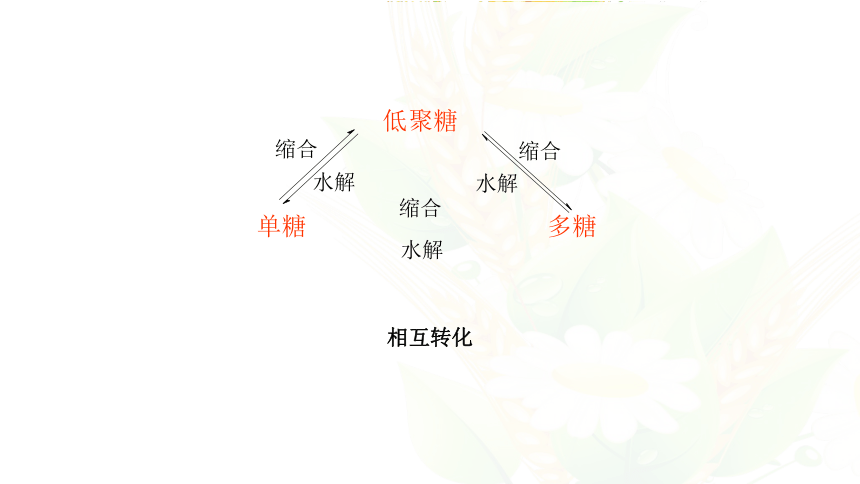
相互转化
低聚糖
单糖
多糖
水解
缩合
水解
缩合
水解
缩合
存在:葡萄糖是自然界中分布最广的单糖。存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
物理性质:葡萄糖是易溶于水的无色晶体,熔点为146 ℃,有甜味,但甜度不如蔗糖。
二、单糖
1.葡萄糖
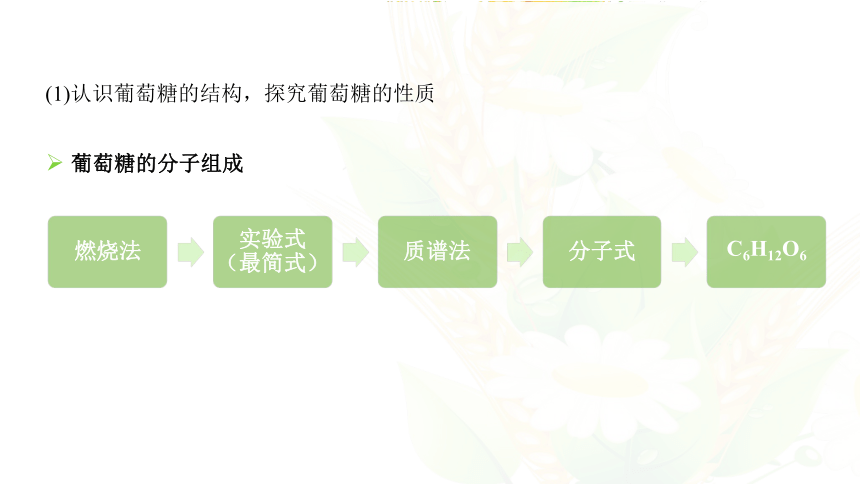
燃烧法
实验式(最简式)
质谱法
分子式
C6H12O6
(1)认识葡萄糖的结构,探究葡萄糖的性质
葡萄糖的分子组成
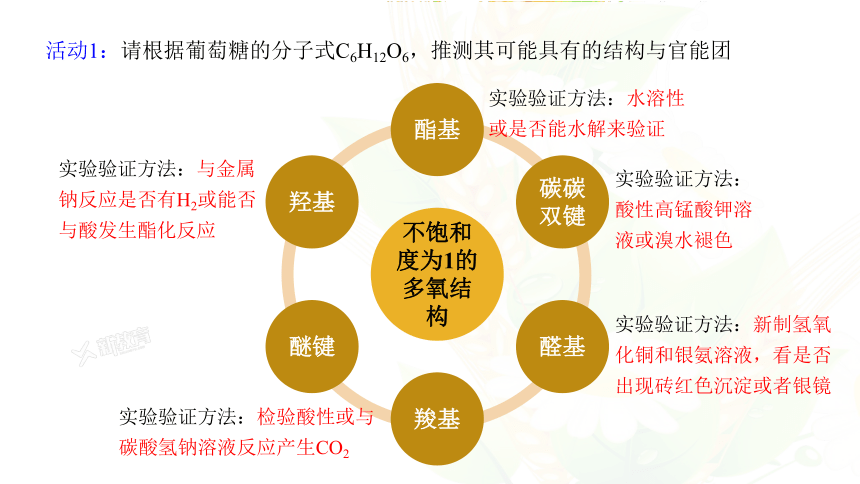
实验验证方法:酸性高锰酸钾溶液或溴水褪色
实验验证方法:新制氢氧化铜和银氨溶液,看是否出现砖红色沉淀或者银镜
实验验证方法:水溶性或是否能水解来验证
实验验证方法:与金属钠反应是否有H2或能否与酸发生酯化反应
实验验证方法:检验酸性或与碳酸氢钠溶液反应产生CO2
活动1:请根据葡萄糖的分子式C6H12O6,推测其可能具有的结构与官能团
思考:设计实验时官能团的验证顺序?
碳碳双键和醛基都可以使酸性高锰酸钾溶液或溴水褪色,所以应该先用新制氢氧化铜或银氨溶液检验醛基,再检验碳碳双键。
活动2:回顾必修第二册课本实验事实,确定葡萄糖分子的部分结构。
实验 操作
葡萄糖与银氨溶液反应 (1)在一支洁净的试管中配制约2 mL银氨溶液,加入l mL 10%葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
葡萄糖与新制氢氧化铜反应 (2)在另一支试管中加入2 mL 10% NaOH溶液,加入5滴5% CuSO4溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实验现象。
配制氢氧化铜
加入葡萄糖溶液
加热
砖红色沉淀
实验
葡萄糖和新制氢氧化铜反应
配制银氨溶液
滴加葡萄糖溶液
水浴加热
银镜
葡萄糖和银氨溶液反应
实验
葡萄糖具有醛基,有还原性
糖类的分类
依据2:能否对银氨溶液、氢氧化铜等弱氧化剂表现出还原性
还原性糖
非还原性糖
如:葡萄糖、果糖、麦芽糖
如:蔗糖、淀粉、纤维素
葡萄糖和新制的氢氧化铜常温混合,颜色加深,得到绛蓝色溶液
配制氢氧化铜
加入葡萄糖溶液
得到绛蓝色溶液
实验发现
实验过程 取五支试管,分别编号1-5,向五支试管中分别加入等量的新制氢氧化铜悬浊液,向2-5试管中,分别滴入5滴乙醇、乙二醇、丙三醇、葡萄糖,观察现象。
实验现象
实验结论
葡萄糖中含有多个羟基
补充信息1:多羟基有机化合物,与新制氢氧化铜作用可产生绛蓝色溶液
活动3:补充对比实验
依据以上实验现象,推测葡萄糖分子中,具有怎样的结构?
结论:葡萄糖为多羟基醛类有机化合物
如何设计实验确定葡萄糖分子中的羟基数目和连接方式?
可根据羟基性质进行定量分析
补充信息3:两个羟基连在同一个碳上不稳定
补充信息2:1 mol葡萄糖完全酯化,消耗的乙酸为5 mol,证明1个葡萄糖分子中有5个羟基
CHO
CH2OH
C
H
HO
C
OH
H
C
OH
H
C
OH
H
有机化合物
碳骨架 官能团
根据组成预测结构
总结
实验事实
验证
化学性质
寻找证据
预测
得出葡萄糖的结构简式
官能团 化学性质 实验事实
醛基
羟基
与活泼金属反应
可以发生氧化反应
和溴水反应
可以发生加成反应
和乙酸在一定的条件下生成五乙酸葡萄糖酯
可发生催化氧化,使酸性高锰酸钾溶液褪色
将葡萄糖加热至熔化,可以和一些活泼金属反应产生H2
和银氨溶液,新制氢氧化铜反应反应,催化氧化
使溴水褪色
和H2反应生成直链正己六醇
氧化反应
与酸发生酯化反应
取代反应、消去反应
与HX反应、分子内(间)脱水
活动4:依据葡萄糖的结构,预测它还可能具有哪些化学性质,还可以发生哪些化学反应。
① 银镜反应
②与新制Cu(OH)2悬浊液反应
醛基
加成反应
CH2OH(CHOH)4CHO+H2
CH2OH(CHOH)4CH2OH
氧化反应
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
Ni
③ 与高锰酸钾、溴水等强氧化剂反应
④催化加氢
医学用于检验尿糖
——结构决定性质
归纳总结:葡萄糖化学性质
羟基
⑥使高锰酸钾褪色
⑤ 与Na反应
⑦酯化反应
置换反应
氧化反应
取代反应
消去反应
⑧与HX反应
⑨分子间脱水
①食品和医药工业
C6H12O6 + 6O2 6CO2 + 6H2O
酶
葡萄糖是种重要的营养物质,易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维持生命活动所需要的能量。人生病不能正常饮食或低血糖时,医生一般会静脉注射葡萄糖水溶液。
(2)葡萄糖的应用
②工业上制镜
C6H12O6 2C2H5OH + 2CO2↑
酒化酶
③制酒工业
制酒工业
镀银工业
【资料卡片】糖尿病患者的糖代谢功能紊乱,其血液和尿液中的葡萄糖含量会超出正常范围。测定患者血液或尿液中的葡萄糖含量有助于判断病情,可使用根据葡萄糖特征反应原理制备的试纸进行测试。
分子式:
C6H12O6
结构简式:
多羟基酮
属于酮糖
和葡萄糖互为同分异构体
存在:在水果和蜂蜜中含量较高
物理性质:纯净的果糖为无色晶体,易溶于水,吸湿性强,比蔗糖甜度高
2.果糖
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。
它们都是含有5个碳原子的单糖——戊糖。均为醛糖,具有还原性。
3.核糖与脱氧核糖
人体摄入其他糖类(如蔗糖、麦芽糖、淀粉)在酶的催化作用下逐步水解,最终可生成葡萄糖。
淀粉
麦芽糖
葡萄糖
唾液淀粉酶
胰、肠淀粉酶
胰麦芽糖酶
肠麦芽糖酶
1.人体内的葡萄糖是从哪里来呢?
2. 某广告宣称新型糕点只含面粉、植物油和鸡蛋,不含糖,是糖尿病患者的理想食品,你认为这种说法对吗?
你知道吗
三、二糖及其化学性质
阅读教材P103-104,思考并讨论:
1.蔗糖、麦芽糖存在于哪些物质?
2.二糖有哪些化学性质?
存在于甘蔗(南方)和甜菜(北方)中。
平时食用的白糖、红糖都是蔗糖。
无色晶体,易溶于水,较难溶于乙醇,甜味仅次于果糖。
分子式 C12H22O11
摩尔质量g/mol 342.3
外观 无色晶体
熔点/ ℃ 186
1.蔗糖
发芽的小麦
白色晶体,易溶于水,有甜味,甜度约为蔗糖的。
饴糖就是麦芽糖的粗制品。
主要存在于发芽的谷粒和麦芽中。
分子式 C12H22O11
摩尔质量g/mol 342.3
外观 白色晶体
2.麦芽糖
资料显示:甘蔗汁中存在葡萄糖和果糖,这是因为蔗糖在蔗糖转化酶的作用下发生了水解反应。
蔗糖在酸或酶的作用下,水解生成葡萄糖和果糖,化学方程式为
麦芽糖的水解
蔗糖的水解反应
麦芽糖在酸或酶的作用下,水解生成葡萄糖,化学方程式为
蔗糖和麦芽糖属于同分异构体
课本P104——探究实验
【实验与记录】根据实验4-1中检验葡萄糖还原性的方法,自行设计实验方案进行检验。
【问题】葡萄糖属于还原糖,蔗糖和麦芽糖是否属于还原糖?
【讨论】
(1)根据实验结果判断蔗糖和麦芽糖是否属于还原糖。
(2)操作过程中有哪些需要注意的地方?
实验内容 预期现象 实验现象 结论
设计实验检验蔗糖和麦芽糖的还原性
【实验用品】
20%蔗糖溶液、 20%麦芽糖溶液、银氨溶液;
试管、烧杯、胶头滴管、玻璃棒、酒精灯、三脚架、石棉网、试管夹等。
实验 内容 实验操作 预期实验现象 实验现象 解释或结论
用银氨溶液检验蔗糖和麦芽糖是否有还原性 (1)取一支洁净的试管,加入2 mL银氨溶液,标记为2号试管; (2)向2号试管银氨溶液中加入1 mL蔗糖溶液,振荡; (3)将混合液平稳地放在60℃左右的热水浴中微热,观察实验现象。
(1)取一支洁净的试管,加入2 mL银氨溶液,标记为3号试管; (2)向3号试管银氨溶液中加入1 mL麦芽糖溶液,振荡; (3)将混合液平稳地放在60℃左右的热水浴中微热,观察实验现象。
实验 内容
实验 现象
实验 结论 蔗糖_______还原糖,麦芽糖_______还原糖
无明显现象
不属于
属于
【实验与记录】
用银氨溶液检验蔗糖和麦芽糖是否有还原性
试管内壁出现一层光亮银镜
实验 内容
实验 现象
实验 结论 蔗糖_______还原糖,麦芽糖_______还原糖
无明显现象
不属于
属于
【实验与记录】
用新制Cu(OH)2悬浊液检验蔗糖和麦芽糖是否有还原性
出现砖红色沉淀
讨论2:实验操作过程中有哪些需要注意的地方?
对比实验过程要注意控制变量:
实验过程中各种试剂的浓度、用量以及反应时间、反应温度等应尽可能相同。
蔗糖 麦芽糖
相似性
不 同 点
蔗糖和麦芽糖
①组成相同,分子式均为C12H22O11,互为同分异构体;
②都属于二糖,均能水解生成单糖。
水解产物
还原性
葡萄糖
葡萄糖和果糖
非还原糖
还原糖
不能发生银镜反应,也不能被新制的Cu(OH)2悬浊液氧化
能发生银镜反应,也能被新制的Cu(OH)2悬浊液氧化
化学性质
乳糖也是一种常见的二糖,主要存在于哺乳动物的乳汁中,可用于婴儿食品、糖果、药物等的生产。乳糖经发酵产生的乳酸是酸奶酸味的主要来源。部分人群由于肠道内缺乏乳糖酶导致乳糖消化吸收障碍,饮用牛奶后容易出现腹胀、腹泻等乳糖不耐受的症状。
3.乳糖
四、多糖及其化学性质
阅读教材P105-107,思考并讨论:
1.淀粉、纤维素存在于哪些物质?
2.多糖有哪些化学性质?
3. 淀粉和纤维素分子中所包含的葡萄糖单元数目,即n值不同,二者的组成与结构不同。
淀粉和纤维素的组成结构
1. 由大量_____________相互连接组成的,属于___________________。
葡萄糖单元
天然有机高分子
2. 淀粉的相对分子质量可达到几十万,纤维素可达到几百万。
淀粉和纤维素的分子式可以表示为_______________,
(C6H10O5)n
其中的葡萄糖单元中一般仍有_________,所以也可表示为_______________。
三个羟基
[C6H7O2(OH)3]n
二者不是同分异构体
存在:淀粉是绿色植物光合作用的产物,是植物储存营养物质的一种形式,在种子、块根和块茎中含量丰富,谷类和薯类含淀粉较多。
直链淀粉
支链淀粉
物理性质:白色粉末状物质,没有甜味,不溶于冷水,在热水中淀粉部分溶解,形成胶状的淀粉糊。
天然淀粉由直链淀粉和支链淀粉组成。支链淀粉含量很高的一些谷物,如糯米、糯玉米等有比较黏的口感。
1.淀粉
3. 由于其分子中葡萄糖单元醇羟基的存在,淀粉可以发生___________。
2. 淀粉______被银氨溶液和氢氧化铜等弱氧化剂氧化,属于_________。
化学性质
不能
非还原糖
酯化反应
4. 淀粉在酸或酶的作用下水解,生成一系列产物,最终生成葡萄糖。
1. 淀粉遇碘显______,利用该现象可检验淀粉的存在。
蓝色
特征反应
1. 淀粉是食物的一种重要成分。
2. 淀粉是重要的工业原料,以淀粉或淀粉水解生成的葡萄糖等为原料,经发酵可以得到多种产品,如燃料乙醇、白酒、食醋、味精,以及氨基酸、抗生素等药物。
3. 淀粉经酯化后可用于生产食品添加剂、表面活性剂和可降解塑料等。
用途
存在:纤维素存在于一些植物中(例如棉花、木材、麻中)。纤维素参与构成植物的细胞壁,是自然界分布最广泛的一种多糖。
物理性质:白色、没有甜味的具有纤维状结构的物质。不溶于水和一般的有机溶剂。
2.纤维素
化学性质
现象:出现砖红色沉淀
(1)纤维素的水解反应
在酸或酶的作用下水解,生成一系列产物,最终生成葡萄糖。
(2)纤维素不能被氢氧化铜等弱氧化剂氧化。
属于非还原糖。
(C6H10O5)n+ nH2O nC6H12O6
纤维素
葡萄糖
酸或酶
(3)其单糖单元中含有-OH,所以能与乙酸、硝酸等发生酯化反应。
纤维素的用途
1
2
6
4
3
5
棉和麻的纤维大量用于纺织工业。
木材、稻草、秸杆、蔗渣等用于造纸。
制造纤维素硝酸酯(硝酸纤维):极易燃烧。可用于生产火药、塑料和涂料等。
制造纤维素乙酸酯(醋酸纤维):不易燃烧,可用于生产塑料、过滤膜、胶片等。
制造黏胶纤维:其中的长纤维称人造丝,短纤维称人造棉,都可用于纺织工业。
食物中的纤维素有利于人体的消化。
用途
淀粉 纤维素
分子结构 分子通式 (C6H10O5)n
相对分子质量 可达到几十万 可达到几百万
分子结构关系
化学性质 共性
特性
淀粉和纤维素
都是由葡萄糖结构单元(C6H10O5)构成的天然有机高分子,但分子内葡萄糖结构单元数目不同,不是同分异构体。
无还原性
水解最终生成葡萄糖
遇碘变蓝
分子中含有醇羟基,能与醋酸、硝酸等发生酯化反应
3.多糖的知识拓展——甲壳质
甲壳质是由乙酰氨基葡萄糖相互结合形成的一种多糖,它是许多低等动物,特别是节肢动物外壳的重要成分,是一种来源丰富的可再生资源。
壳聚糖是甲壳质在碱溶液中脱去乙酰基,生成以氨基葡萄糖为单体的高聚物。可溶于酸溶液,具有良好的生物相容性和一定的抑菌作用。
1. 葡萄糖所不具有的性质是( )
A. 和H2发生加成反应
B. 和银氨溶液发生氧化反应
C. 和酸发生酯化反应
D. 和NaOH溶液反应
D
随堂练习
醛基
醛基
羟基
2.以下试剂不可以鉴别乙酸、葡萄糖溶液,这种试剂是( )
A.新制Cu(OH)2
B.Na2CO3溶液
C.石蕊试液
D.氢氧化钠溶液
D
蓝色絮状沉淀消失
砖红色沉淀
放出二氧化碳
不反应
变红
不变色
无明显现象
不反应
D
葡萄糖甜度比蔗糖低,果糖甜度比蔗糖高
3.有关葡萄糖与果糖的下列说法中,不正确的是( )
A.两者互为同分异构体
B.两者都易溶于水
C.两者都能发生酯化反应
D.葡萄糖比果糖要甜
Na2CO3溶液只能鉴别乙酸溶液,不能鉴别葡萄糖溶液和淀粉溶液;
Cu(OH)2悬浊液遇乙酸溶解,遇葡萄糖溶液加热有砖红色沉淀生成,遇淀粉溶液加热无现象,可以鉴别这三种物质;
NaOH溶液与乙酸能反应但无现象,与葡萄糖溶液、淀粉溶液不反应,无现象;
碘水遇淀粉显蓝色,加入乙酸或葡萄糖溶液中无明显现象。
B
4.只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液,这种试剂是( )
A.饱和Na2CO3溶液 B.Cu(OH)2悬浊液
C.烧碱溶液 D.碘水
5.关于淀粉与纤维素的下列说法,不正确的是( )
A.淀粉和纤维素都能在无机酸溶液中水解,其最终水解产物都是葡萄糖
B.两者实验式相同,通式相同,互为同分异构体
C.两者都属于糖类,与新制Cu(OH)2共热都不能出现砖红色沉淀
D.两者都属于高分子化合物,淀粉遇碘单质显蓝色,但纤维素却不能
B
本节内容结束
第一节 糖类
第四章 生物大分子
1.认识常见糖类代表物的组成、结构和典型性质,进一步体会“结构决定性质”的学科观念。
2.了解葡萄糖的结构特点和主要性质,能通过实验探究认识葡萄糖的化学性质。深化对多官能团有机化合物中羟基和醛基性质的认识。
3.知道常见的二糖、多糖的性质及它们之间的相互关系。
4.能描述淀粉和纤维素的典型性质,认识淀粉和纤维素在人体内的重要生理功能。
5.知道糖类物质在食品加工和生物质能源等方面的应用。
学习目标
糖类是一类重要的有机化合物,在自然界中分布广泛,日常食用的蔗糖、粮食中的淀粉、植物茎叶中的纤维素、人体血液中的葡萄糖等均属于糖类。糖类在生命活动中起着重要作用,是生物体所需能量的主要来源,也是重要的能量储存物质,如植物体内的淀粉和动物体内的糖原。糖类还是很多生物体的结构成分,如植物细胞壁的主要成分纤维素。
生活中常见的糖类
葡萄糖
蔗糖
麦芽糖
淀粉
纤维素
甜味
无甜味
C6H12O6
C12H22O11
C12H22O11
(C6H10O5)n
(C6H10O5)n
一、糖类的组成和分类
阅读教材P100,思考并讨论:
1.糖类化合物的组成元素和组成特点?
2.糖类化合物按照什么标准进行分类?
1.糖类的组成
组成元素:碳、氢、氧
很多糖类分子中氢原子和氧原子数目比恰好为2∶1,组成可以用通式Cm(H2O)n 表示,故糖类也被称为碳水化合物。
易错警示
糖类≠碳水化合物
糖类≠甜味物质
例如:脱氧核糖
(C5H10O4)
例如:乙酸(C2H4O2)
甲醛( CH2O )
例如:
淀粉、纤维素
例如:
木糖醇
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
缩合一般指两个或更多反应物生成一个主要产物,并伴随着失去H2O等小分子的反应。
2.糖类的定义
单糖 寡糖(低聚糖) 多糖
概念 不能水解的糖 1 mol糖水解后能产生 2~10 mol单糖的糖 1 mol糖水解后能产生
10 mol以上单糖的糖
代表物及 分子式 葡萄糖、果糖、核糖、脱氧核糖 蔗糖、麦芽糖、乳糖 淀粉、纤维素
C6H12O6 C12H22O11 (C6H10O5)n
依据1:能否水解及水解产物的不同进行分类
3.糖类的分类
相互转化
低聚糖
单糖
多糖
水解
缩合
水解
缩合
水解
缩合
存在:葡萄糖是自然界中分布最广的单糖。存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
物理性质:葡萄糖是易溶于水的无色晶体,熔点为146 ℃,有甜味,但甜度不如蔗糖。
二、单糖
1.葡萄糖
燃烧法
实验式(最简式)
质谱法
分子式
C6H12O6
(1)认识葡萄糖的结构,探究葡萄糖的性质
葡萄糖的分子组成
实验验证方法:酸性高锰酸钾溶液或溴水褪色
实验验证方法:新制氢氧化铜和银氨溶液,看是否出现砖红色沉淀或者银镜
实验验证方法:水溶性或是否能水解来验证
实验验证方法:与金属钠反应是否有H2或能否与酸发生酯化反应
实验验证方法:检验酸性或与碳酸氢钠溶液反应产生CO2
活动1:请根据葡萄糖的分子式C6H12O6,推测其可能具有的结构与官能团
思考:设计实验时官能团的验证顺序?
碳碳双键和醛基都可以使酸性高锰酸钾溶液或溴水褪色,所以应该先用新制氢氧化铜或银氨溶液检验醛基,再检验碳碳双键。
活动2:回顾必修第二册课本实验事实,确定葡萄糖分子的部分结构。
实验 操作
葡萄糖与银氨溶液反应 (1)在一支洁净的试管中配制约2 mL银氨溶液,加入l mL 10%葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
葡萄糖与新制氢氧化铜反应 (2)在另一支试管中加入2 mL 10% NaOH溶液,加入5滴5% CuSO4溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实验现象。
配制氢氧化铜
加入葡萄糖溶液
加热
砖红色沉淀
实验
葡萄糖和新制氢氧化铜反应
配制银氨溶液
滴加葡萄糖溶液
水浴加热
银镜
葡萄糖和银氨溶液反应
实验
葡萄糖具有醛基,有还原性
糖类的分类
依据2:能否对银氨溶液、氢氧化铜等弱氧化剂表现出还原性
还原性糖
非还原性糖
如:葡萄糖、果糖、麦芽糖
如:蔗糖、淀粉、纤维素
葡萄糖和新制的氢氧化铜常温混合,颜色加深,得到绛蓝色溶液
配制氢氧化铜
加入葡萄糖溶液
得到绛蓝色溶液
实验发现
实验过程 取五支试管,分别编号1-5,向五支试管中分别加入等量的新制氢氧化铜悬浊液,向2-5试管中,分别滴入5滴乙醇、乙二醇、丙三醇、葡萄糖,观察现象。
实验现象
实验结论
葡萄糖中含有多个羟基
补充信息1:多羟基有机化合物,与新制氢氧化铜作用可产生绛蓝色溶液
活动3:补充对比实验
依据以上实验现象,推测葡萄糖分子中,具有怎样的结构?
结论:葡萄糖为多羟基醛类有机化合物
如何设计实验确定葡萄糖分子中的羟基数目和连接方式?
可根据羟基性质进行定量分析
补充信息3:两个羟基连在同一个碳上不稳定
补充信息2:1 mol葡萄糖完全酯化,消耗的乙酸为5 mol,证明1个葡萄糖分子中有5个羟基
CHO
CH2OH
C
H
HO
C
OH
H
C
OH
H
C
OH
H
有机化合物
碳骨架 官能团
根据组成预测结构
总结
实验事实
验证
化学性质
寻找证据
预测
得出葡萄糖的结构简式
官能团 化学性质 实验事实
醛基
羟基
与活泼金属反应
可以发生氧化反应
和溴水反应
可以发生加成反应
和乙酸在一定的条件下生成五乙酸葡萄糖酯
可发生催化氧化,使酸性高锰酸钾溶液褪色
将葡萄糖加热至熔化,可以和一些活泼金属反应产生H2
和银氨溶液,新制氢氧化铜反应反应,催化氧化
使溴水褪色
和H2反应生成直链正己六醇
氧化反应
与酸发生酯化反应
取代反应、消去反应
与HX反应、分子内(间)脱水
活动4:依据葡萄糖的结构,预测它还可能具有哪些化学性质,还可以发生哪些化学反应。
① 银镜反应
②与新制Cu(OH)2悬浊液反应
醛基
加成反应
CH2OH(CHOH)4CHO+H2
CH2OH(CHOH)4CH2OH
氧化反应
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
Ni
③ 与高锰酸钾、溴水等强氧化剂反应
④催化加氢
医学用于检验尿糖
——结构决定性质
归纳总结:葡萄糖化学性质
羟基
⑥使高锰酸钾褪色
⑤ 与Na反应
⑦酯化反应
置换反应
氧化反应
取代反应
消去反应
⑧与HX反应
⑨分子间脱水
①食品和医药工业
C6H12O6 + 6O2 6CO2 + 6H2O
酶
葡萄糖是种重要的营养物质,易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维持生命活动所需要的能量。人生病不能正常饮食或低血糖时,医生一般会静脉注射葡萄糖水溶液。
(2)葡萄糖的应用
②工业上制镜
C6H12O6 2C2H5OH + 2CO2↑
酒化酶
③制酒工业
制酒工业
镀银工业
【资料卡片】糖尿病患者的糖代谢功能紊乱,其血液和尿液中的葡萄糖含量会超出正常范围。测定患者血液或尿液中的葡萄糖含量有助于判断病情,可使用根据葡萄糖特征反应原理制备的试纸进行测试。
分子式:
C6H12O6
结构简式:
多羟基酮
属于酮糖
和葡萄糖互为同分异构体
存在:在水果和蜂蜜中含量较高
物理性质:纯净的果糖为无色晶体,易溶于水,吸湿性强,比蔗糖甜度高
2.果糖
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。
它们都是含有5个碳原子的单糖——戊糖。均为醛糖,具有还原性。
3.核糖与脱氧核糖
人体摄入其他糖类(如蔗糖、麦芽糖、淀粉)在酶的催化作用下逐步水解,最终可生成葡萄糖。
淀粉
麦芽糖
葡萄糖
唾液淀粉酶
胰、肠淀粉酶
胰麦芽糖酶
肠麦芽糖酶
1.人体内的葡萄糖是从哪里来呢?
2. 某广告宣称新型糕点只含面粉、植物油和鸡蛋,不含糖,是糖尿病患者的理想食品,你认为这种说法对吗?
你知道吗
三、二糖及其化学性质
阅读教材P103-104,思考并讨论:
1.蔗糖、麦芽糖存在于哪些物质?
2.二糖有哪些化学性质?
存在于甘蔗(南方)和甜菜(北方)中。
平时食用的白糖、红糖都是蔗糖。
无色晶体,易溶于水,较难溶于乙醇,甜味仅次于果糖。
分子式 C12H22O11
摩尔质量g/mol 342.3
外观 无色晶体
熔点/ ℃ 186
1.蔗糖
发芽的小麦
白色晶体,易溶于水,有甜味,甜度约为蔗糖的。
饴糖就是麦芽糖的粗制品。
主要存在于发芽的谷粒和麦芽中。
分子式 C12H22O11
摩尔质量g/mol 342.3
外观 白色晶体
2.麦芽糖
资料显示:甘蔗汁中存在葡萄糖和果糖,这是因为蔗糖在蔗糖转化酶的作用下发生了水解反应。
蔗糖在酸或酶的作用下,水解生成葡萄糖和果糖,化学方程式为
麦芽糖的水解
蔗糖的水解反应
麦芽糖在酸或酶的作用下,水解生成葡萄糖,化学方程式为
蔗糖和麦芽糖属于同分异构体
课本P104——探究实验
【实验与记录】根据实验4-1中检验葡萄糖还原性的方法,自行设计实验方案进行检验。
【问题】葡萄糖属于还原糖,蔗糖和麦芽糖是否属于还原糖?
【讨论】
(1)根据实验结果判断蔗糖和麦芽糖是否属于还原糖。
(2)操作过程中有哪些需要注意的地方?
实验内容 预期现象 实验现象 结论
设计实验检验蔗糖和麦芽糖的还原性
【实验用品】
20%蔗糖溶液、 20%麦芽糖溶液、银氨溶液;
试管、烧杯、胶头滴管、玻璃棒、酒精灯、三脚架、石棉网、试管夹等。
实验 内容 实验操作 预期实验现象 实验现象 解释或结论
用银氨溶液检验蔗糖和麦芽糖是否有还原性 (1)取一支洁净的试管,加入2 mL银氨溶液,标记为2号试管; (2)向2号试管银氨溶液中加入1 mL蔗糖溶液,振荡; (3)将混合液平稳地放在60℃左右的热水浴中微热,观察实验现象。
(1)取一支洁净的试管,加入2 mL银氨溶液,标记为3号试管; (2)向3号试管银氨溶液中加入1 mL麦芽糖溶液,振荡; (3)将混合液平稳地放在60℃左右的热水浴中微热,观察实验现象。
实验 内容
实验 现象
实验 结论 蔗糖_______还原糖,麦芽糖_______还原糖
无明显现象
不属于
属于
【实验与记录】
用银氨溶液检验蔗糖和麦芽糖是否有还原性
试管内壁出现一层光亮银镜
实验 内容
实验 现象
实验 结论 蔗糖_______还原糖,麦芽糖_______还原糖
无明显现象
不属于
属于
【实验与记录】
用新制Cu(OH)2悬浊液检验蔗糖和麦芽糖是否有还原性
出现砖红色沉淀
讨论2:实验操作过程中有哪些需要注意的地方?
对比实验过程要注意控制变量:
实验过程中各种试剂的浓度、用量以及反应时间、反应温度等应尽可能相同。
蔗糖 麦芽糖
相似性
不 同 点
蔗糖和麦芽糖
①组成相同,分子式均为C12H22O11,互为同分异构体;
②都属于二糖,均能水解生成单糖。
水解产物
还原性
葡萄糖
葡萄糖和果糖
非还原糖
还原糖
不能发生银镜反应,也不能被新制的Cu(OH)2悬浊液氧化
能发生银镜反应,也能被新制的Cu(OH)2悬浊液氧化
化学性质
乳糖也是一种常见的二糖,主要存在于哺乳动物的乳汁中,可用于婴儿食品、糖果、药物等的生产。乳糖经发酵产生的乳酸是酸奶酸味的主要来源。部分人群由于肠道内缺乏乳糖酶导致乳糖消化吸收障碍,饮用牛奶后容易出现腹胀、腹泻等乳糖不耐受的症状。
3.乳糖
四、多糖及其化学性质
阅读教材P105-107,思考并讨论:
1.淀粉、纤维素存在于哪些物质?
2.多糖有哪些化学性质?
3. 淀粉和纤维素分子中所包含的葡萄糖单元数目,即n值不同,二者的组成与结构不同。
淀粉和纤维素的组成结构
1. 由大量_____________相互连接组成的,属于___________________。
葡萄糖单元
天然有机高分子
2. 淀粉的相对分子质量可达到几十万,纤维素可达到几百万。
淀粉和纤维素的分子式可以表示为_______________,
(C6H10O5)n
其中的葡萄糖单元中一般仍有_________,所以也可表示为_______________。
三个羟基
[C6H7O2(OH)3]n
二者不是同分异构体
存在:淀粉是绿色植物光合作用的产物,是植物储存营养物质的一种形式,在种子、块根和块茎中含量丰富,谷类和薯类含淀粉较多。
直链淀粉
支链淀粉
物理性质:白色粉末状物质,没有甜味,不溶于冷水,在热水中淀粉部分溶解,形成胶状的淀粉糊。
天然淀粉由直链淀粉和支链淀粉组成。支链淀粉含量很高的一些谷物,如糯米、糯玉米等有比较黏的口感。
1.淀粉
3. 由于其分子中葡萄糖单元醇羟基的存在,淀粉可以发生___________。
2. 淀粉______被银氨溶液和氢氧化铜等弱氧化剂氧化,属于_________。
化学性质
不能
非还原糖
酯化反应
4. 淀粉在酸或酶的作用下水解,生成一系列产物,最终生成葡萄糖。
1. 淀粉遇碘显______,利用该现象可检验淀粉的存在。
蓝色
特征反应
1. 淀粉是食物的一种重要成分。
2. 淀粉是重要的工业原料,以淀粉或淀粉水解生成的葡萄糖等为原料,经发酵可以得到多种产品,如燃料乙醇、白酒、食醋、味精,以及氨基酸、抗生素等药物。
3. 淀粉经酯化后可用于生产食品添加剂、表面活性剂和可降解塑料等。
用途
存在:纤维素存在于一些植物中(例如棉花、木材、麻中)。纤维素参与构成植物的细胞壁,是自然界分布最广泛的一种多糖。
物理性质:白色、没有甜味的具有纤维状结构的物质。不溶于水和一般的有机溶剂。
2.纤维素
化学性质
现象:出现砖红色沉淀
(1)纤维素的水解反应
在酸或酶的作用下水解,生成一系列产物,最终生成葡萄糖。
(2)纤维素不能被氢氧化铜等弱氧化剂氧化。
属于非还原糖。
(C6H10O5)n+ nH2O nC6H12O6
纤维素
葡萄糖
酸或酶
(3)其单糖单元中含有-OH,所以能与乙酸、硝酸等发生酯化反应。
纤维素的用途
1
2
6
4
3
5
棉和麻的纤维大量用于纺织工业。
木材、稻草、秸杆、蔗渣等用于造纸。
制造纤维素硝酸酯(硝酸纤维):极易燃烧。可用于生产火药、塑料和涂料等。
制造纤维素乙酸酯(醋酸纤维):不易燃烧,可用于生产塑料、过滤膜、胶片等。
制造黏胶纤维:其中的长纤维称人造丝,短纤维称人造棉,都可用于纺织工业。
食物中的纤维素有利于人体的消化。
用途
淀粉 纤维素
分子结构 分子通式 (C6H10O5)n
相对分子质量 可达到几十万 可达到几百万
分子结构关系
化学性质 共性
特性
淀粉和纤维素
都是由葡萄糖结构单元(C6H10O5)构成的天然有机高分子,但分子内葡萄糖结构单元数目不同,不是同分异构体。
无还原性
水解最终生成葡萄糖
遇碘变蓝
分子中含有醇羟基,能与醋酸、硝酸等发生酯化反应
3.多糖的知识拓展——甲壳质
甲壳质是由乙酰氨基葡萄糖相互结合形成的一种多糖,它是许多低等动物,特别是节肢动物外壳的重要成分,是一种来源丰富的可再生资源。
壳聚糖是甲壳质在碱溶液中脱去乙酰基,生成以氨基葡萄糖为单体的高聚物。可溶于酸溶液,具有良好的生物相容性和一定的抑菌作用。
1. 葡萄糖所不具有的性质是( )
A. 和H2发生加成反应
B. 和银氨溶液发生氧化反应
C. 和酸发生酯化反应
D. 和NaOH溶液反应
D
随堂练习
醛基
醛基
羟基
2.以下试剂不可以鉴别乙酸、葡萄糖溶液,这种试剂是( )
A.新制Cu(OH)2
B.Na2CO3溶液
C.石蕊试液
D.氢氧化钠溶液
D
蓝色絮状沉淀消失
砖红色沉淀
放出二氧化碳
不反应
变红
不变色
无明显现象
不反应
D
葡萄糖甜度比蔗糖低,果糖甜度比蔗糖高
3.有关葡萄糖与果糖的下列说法中,不正确的是( )
A.两者互为同分异构体
B.两者都易溶于水
C.两者都能发生酯化反应
D.葡萄糖比果糖要甜
Na2CO3溶液只能鉴别乙酸溶液,不能鉴别葡萄糖溶液和淀粉溶液;
Cu(OH)2悬浊液遇乙酸溶解,遇葡萄糖溶液加热有砖红色沉淀生成,遇淀粉溶液加热无现象,可以鉴别这三种物质;
NaOH溶液与乙酸能反应但无现象,与葡萄糖溶液、淀粉溶液不反应,无现象;
碘水遇淀粉显蓝色,加入乙酸或葡萄糖溶液中无明显现象。
B
4.只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液,这种试剂是( )
A.饱和Na2CO3溶液 B.Cu(OH)2悬浊液
C.烧碱溶液 D.碘水
5.关于淀粉与纤维素的下列说法,不正确的是( )
A.淀粉和纤维素都能在无机酸溶液中水解,其最终水解产物都是葡萄糖
B.两者实验式相同,通式相同,互为同分异构体
C.两者都属于糖类,与新制Cu(OH)2共热都不能出现砖红色沉淀
D.两者都属于高分子化合物,淀粉遇碘单质显蓝色,但纤维素却不能
B
本节内容结束
