2.2.1氯气的性质课件(27张)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.1氯气的性质课件(27张)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 44.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 18:07:18 | ||
图片预览





文档简介
(共27张PPT)
第1课时 氯气的性质
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
科学史话
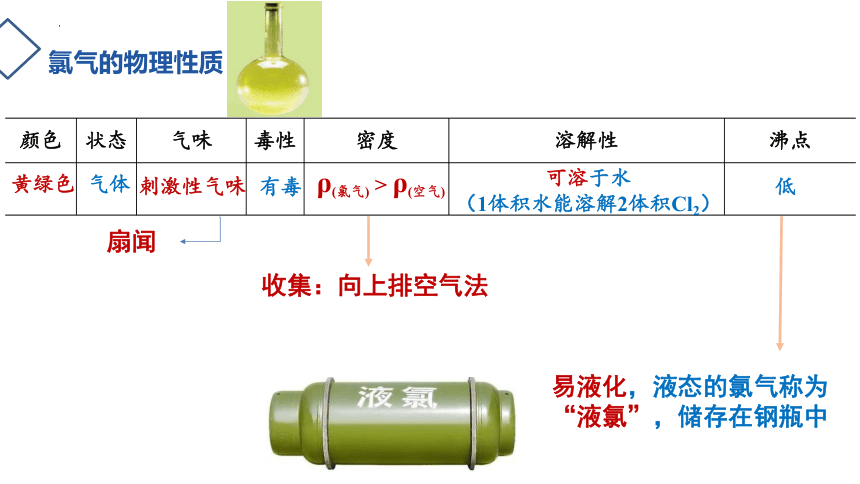
氯气的物理性质
颜色 状态 气味 毒性 密度 溶解性 沸点
黄绿色
可溶于水
(1体积水能溶解2体积Cl2)
气体
ρ(氯气) > ρ(空气)
有毒
低
刺激性气味
易液化,液态的氯气称为“液氯”,储存在钢瓶中
扇闻
收集:向上排空气法
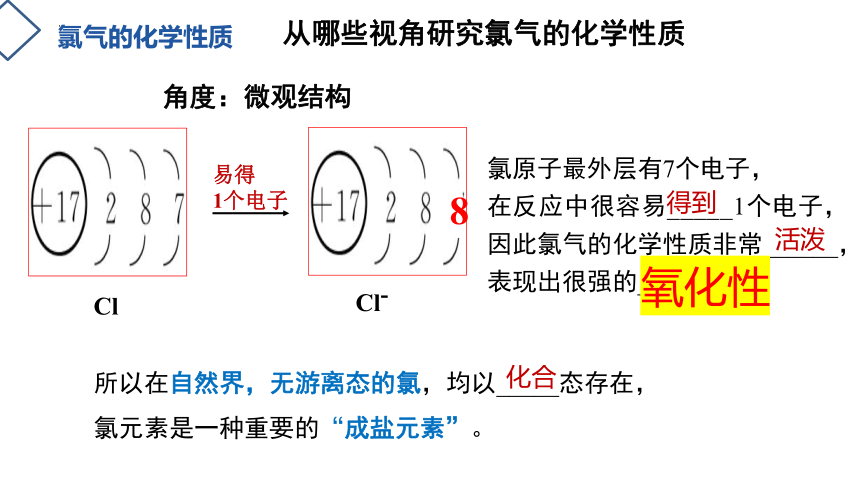
氯气的化学性质
从哪些视角研究氯气的化学性质
角度:微观结构
Cl
Cl-
易得
1个电子
氯原子最外层有7个电子,
在反应中很容易_____1个电子,因此氯气的化学性质非常______,表现出很强的________;
得到
活泼
氧化性
所以在自然界,无游离态的氯,均以_____态存在,
氯元素是一种重要的“成盐元素”。
化合
8
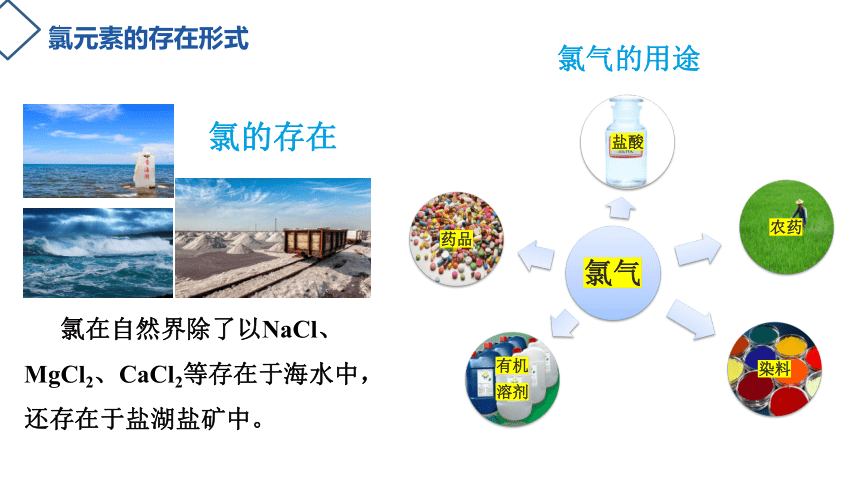
氯元素的存在形式
氯在自然界除了以NaCl、MgCl2、CaCl2等存在于海水中,还存在于盐湖盐矿中。
氯气的用途
氯的存在
课堂练习
[对点训练]1.下列关于氯气的叙述不正确的是 ( )
A.氯气是一种黄绿色气体 B.氯气是一种无刺激性气味的气体
C.氯气性质很稳定不与任何物质反应 D.氯气是密度很小的气体
[对点训练]2.可将氯气用软管通到田鼠洞中用于消灭田鼠,这是利用了氯气下列性质中的( )
①黄绿色 ②密度比空气大 ③有毒 ④易液化 ⑤溶于水
A.①② B.②③ C.①②③ D.③④⑤
BCD
B
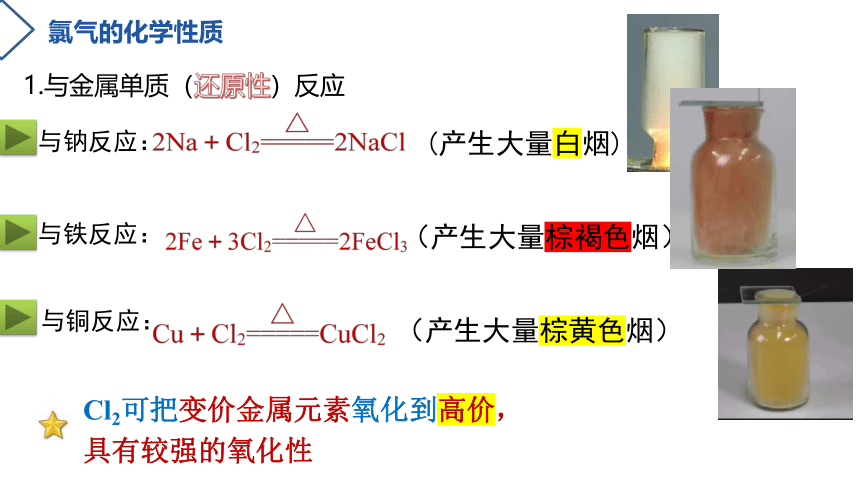
氯气的化学性质
1.与金属单质(还原性)反应
与钠反应:
(产生大量白烟)
与铁反应:
与铜反应:
(产生大量棕褐色烟)
(产生大量棕黄色烟)
Cl2可把变价金属元素氧化到高价,
具有较强的氧化性
氯气的化学性质
2.与非金属单质反应
与氢气反应:
氢气在氯气中安静地______,发出_______火焰。燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,观察到的现象是集气瓶口上方出现_____。
现象
燃烧
苍白色
白雾
(工业制盐酸)
光照
发生爆炸
课堂练习
燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
思考:通过H2在Cl2中燃烧,你对燃烧的条件及本质有了什么新的认识?
[对点训练]3.下列说法中,不正确的是( )。
A.燃烧一定伴有发光现象 B.燃烧一定是氧化还原反应
C.燃烧一定要有氧气参加 D.燃烧一定会放出热量
C
氯气的化学性质
氯气为什么会出现在游泳馆?
氯水会含有哪些物质?
氯气的化学性质
提出问题
氯水会含有哪些物质?氯气溶于水发生了什么变化?
①全部发生物理变化
②全部发生化学变化
③部分发生物理变化,部分发生化学变化
建立猜想
呈浅黄绿色
氯水中含有Cl2分子
猜想②不成立!
3、Cl2与H2O反应
氯气的化学性质
验证猜想
往氯水中加入稀硝酸酸化的AgNO3溶液,观察并记录实验现象
氯水中含有Cl-
猜想①不成立!
氧化还原反应原理
除了有Cl-生成,还有HClO生成
白色沉淀
3、Cl2与H2O反应
氯气的化学性质
①全部发生物理变化
提出问题
氯水会含有哪些物质?氯气溶于水发生了什么变化?
建立猜想
②全部发生化学变化
③部分发生物理变化,部分发生化学变化
验证猜想
氯水中含有Cl-
得出结论
Cl2+H2O === HCl+HClO(次氯酸)
+1
Cl2+H2O===H++Cl-+HClO
3、Cl2与H2O反应
氯气的化学性质
【思考探究】氯水中起漂白作用的是哪种物质?
HCl
Cl2
HClO
3、Cl2与H2O反应
【实验2-8】
氯水的漂白性(实验2-8)
实验操作 实验现象 实验结论
有色布条不褪色
干燥的Cl2不具有漂白性
有色布条褪色
新制氯水具有漂白性
有色鲜花变色
干燥的氯气能使鲜花褪色
氯气的化学性质
【思考探究】氯水中起漂白作用的是哪种物质?
HCl
Cl2
HClO
【现象】干燥的pH试纸不褪色;湿润的pH试纸褪色
【结论】干燥Cl2不具有漂白性,湿润Cl2具有漂白性
【总结】氯水中具有漂白性的物质是次氯酸HClO
氯水
3、Cl2与H2O反应
【实验2-8】
次氯酸(HClO)的性质
(1)强氧化性
漂白、杀菌消毒
自来水厂常用氯气消毒杀菌,氯气溶于水后生成的次氯酸有强氧化性,能杀死自来水的病菌,起到消毒作用
(2)弱酸性
酸性弱于H2CO3
(3)不稳定性
2HClO 2HCl + O2 ↑
光照
【思考】新制氯水与久置氯水有区别吗?
HClO H+ + ClO-
分析 比较
液氯、新制氯水、久置氯水
液氯 新制氯水 久置氯水
所属物质类别
颜色
成分(微粒)
性质
纯净物
黄绿色
浅黄绿色
无色
混合物
混合物
盐酸
Cl2
Cl2、H2O、HClO、
H+ 、 Cl-、 ClO-、OH-(少量)
H2O、H+ 、
Cl-、OH-(少量)
氧化性
强氧化性、酸性、漂白性
酸性
新型消毒剂:氯气可用于自来水杀菌消毒,但因与水中的有机物反应生成有机氯化物对人体有害,所以,国家规定了饮用水中余氯含量的标准;并开始使用 等新的自来水消毒剂。从中你能得到什么启示?
ClO2、O3
课堂练习
[对点训练]4.氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是 ( )
A.新制氯水呈淡黄绿色,是因为氯水中溶解了未反应的Cl2
B.新制氯水滴入硝酸银溶液中产生白色沉淀是因为氯水中有Cl-
C.久置氯水酸性将增强
D.新制氯水能使有色布条褪色是因为Cl2具有漂白性
[对点训练]5.下列有关实验现象的描述中正确的是 ( )
A.氯气可使湿润的红色布条褪色,所以氯气具有漂白性
B.钠在氯气中燃烧,产生白烟
C.铜丝在氯气中燃烧,产生蓝色的烟
D.红热的铁丝在氯气中剧烈燃烧,产生黑色的烟
D
B
根据氯气与水的反应原理,推测氯气与NaOH能否发生反应 若反应,其产物是什么
Cl2 + H2O == HCl + HClO
HCl + NaOH == NaCl + H2O
HClO+ NaOH == NaClO + H2O
Cl2 + 2 NaOH == NaCl + NaClO + H2O
(次氯酸钠)
氯气的化学性质
4.与碱的反应:
①与NaOH溶液反应
Cl2+2NaOH = NaCl+NaClO+H2O
(工业上制取漂白液原理)
Cl2+2OH- = Cl-+ClO-+H2O
②与石灰乳Ca(OH)2反应
2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
(工业上制取漂白粉原理)
2Cl2+Ca(OH)2 = Ca2++Cl-+ClO-+H2O
84消毒液的有效成分
氯气的尾气处理
漂白液 漂白粉 漂粉精
主要成分
有效成分
漂白粉 作用原理 久置空气中失效的原因 氯气的化学性质
强酸制弱酸
H2CO3>HClO
NaCl、NaClO
NaClO
Ca(ClO)2 、CaCl2
Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
Ca(ClO)2 +H2O + CO2 === CaCO3 ↓+ 2HClO
与空气中CO2、H2O反应,转成HClO,HClO分解失效
Ca(ClO)2 +H2O + CO2 === CaCO3 ↓+ 2HClO
2HClO = 2HCl + O2 ↑
光照
思考与讨论
2HCl + NaClO == NaCl + Cl2↑+H2O
不能将洁厕灵和84消毒液混合使用
主要成分HCl
主要成分NaClO
能将洁厕灵和84消毒液混合使用吗?
2H+ + Cl- + ClO- == Cl2↑+H2O
Cl2有毒,打开门窗通风。
课堂练习
[对点训练]1、I.NaClO是“84”消毒液的有效成分。请回答下列问题:
(1)NaClO中Cl元素的化合价是________。
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:_______________ 。(已知酸性:)
(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是____________________ 。
Ⅱ.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中被氧化和未被氧化的NH3分子的个数比为______________。
(2)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是___________。
+1
ClO- +H2O + CO2 === HCO3- + HClO
ClO- +2H+ + Cl- === Cl2 ↑+ H2O
1:3
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
课堂练习
[对点训练]2、下列说法中正确的是 ( )
A.漂白粉是纯净物,84消毒液是混合物,两者都可以长期保存
B.漂白粉中含有次氯酸,所以漂白粉能使有机色质褪色
C.工业上将氯气通入澄清石灰水中制取漂白粉
D.漂白粉在空气中容易失效的原因是Ca(ClO)2不稳定
D
总结 提升
氯气
(Cl2)
化学性质
用途
制漂白液、漂白粉、漂粉精
可将变价金属元素氧化到高价
Cl2与金属单质反应
Cl2与H2O反应
Cl2与碱反应
物理性质
Cl2与非金属单质反应
Cl2 +H2O === HCl + HClO
次氯酸
(HClO)
强氧化性、弱酸性、不稳定性
性质
自来水消毒、制盐酸、漂白剂、制备药物……
新制氯水的性质
总结 提升
第1课时 氯气的性质
第二章 海水中的重要元素——钠和氯
第二节 氯及其化合物
科学史话
氯气的物理性质
颜色 状态 气味 毒性 密度 溶解性 沸点
黄绿色
可溶于水
(1体积水能溶解2体积Cl2)
气体
ρ(氯气) > ρ(空气)
有毒
低
刺激性气味
易液化,液态的氯气称为“液氯”,储存在钢瓶中
扇闻
收集:向上排空气法
氯气的化学性质
从哪些视角研究氯气的化学性质
角度:微观结构
Cl
Cl-
易得
1个电子
氯原子最外层有7个电子,
在反应中很容易_____1个电子,因此氯气的化学性质非常______,表现出很强的________;
得到
活泼
氧化性
所以在自然界,无游离态的氯,均以_____态存在,
氯元素是一种重要的“成盐元素”。
化合
8
氯元素的存在形式
氯在自然界除了以NaCl、MgCl2、CaCl2等存在于海水中,还存在于盐湖盐矿中。
氯气的用途
氯的存在
课堂练习
[对点训练]1.下列关于氯气的叙述不正确的是 ( )
A.氯气是一种黄绿色气体 B.氯气是一种无刺激性气味的气体
C.氯气性质很稳定不与任何物质反应 D.氯气是密度很小的气体
[对点训练]2.可将氯气用软管通到田鼠洞中用于消灭田鼠,这是利用了氯气下列性质中的( )
①黄绿色 ②密度比空气大 ③有毒 ④易液化 ⑤溶于水
A.①② B.②③ C.①②③ D.③④⑤
BCD
B
氯气的化学性质
1.与金属单质(还原性)反应
与钠反应:
(产生大量白烟)
与铁反应:
与铜反应:
(产生大量棕褐色烟)
(产生大量棕黄色烟)
Cl2可把变价金属元素氧化到高价,
具有较强的氧化性
氯气的化学性质
2.与非金属单质反应
与氢气反应:
氢气在氯气中安静地______,发出_______火焰。燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,观察到的现象是集气瓶口上方出现_____。
现象
燃烧
苍白色
白雾
(工业制盐酸)
光照
发生爆炸
课堂练习
燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。
思考:通过H2在Cl2中燃烧,你对燃烧的条件及本质有了什么新的认识?
[对点训练]3.下列说法中,不正确的是( )。
A.燃烧一定伴有发光现象 B.燃烧一定是氧化还原反应
C.燃烧一定要有氧气参加 D.燃烧一定会放出热量
C
氯气的化学性质
氯气为什么会出现在游泳馆?
氯水会含有哪些物质?
氯气的化学性质
提出问题
氯水会含有哪些物质?氯气溶于水发生了什么变化?
①全部发生物理变化
②全部发生化学变化
③部分发生物理变化,部分发生化学变化
建立猜想
呈浅黄绿色
氯水中含有Cl2分子
猜想②不成立!
3、Cl2与H2O反应
氯气的化学性质
验证猜想
往氯水中加入稀硝酸酸化的AgNO3溶液,观察并记录实验现象
氯水中含有Cl-
猜想①不成立!
氧化还原反应原理
除了有Cl-生成,还有HClO生成
白色沉淀
3、Cl2与H2O反应
氯气的化学性质
①全部发生物理变化
提出问题
氯水会含有哪些物质?氯气溶于水发生了什么变化?
建立猜想
②全部发生化学变化
③部分发生物理变化,部分发生化学变化
验证猜想
氯水中含有Cl-
得出结论
Cl2+H2O === HCl+HClO(次氯酸)
+1
Cl2+H2O===H++Cl-+HClO
3、Cl2与H2O反应
氯气的化学性质
【思考探究】氯水中起漂白作用的是哪种物质?
HCl
Cl2
HClO
3、Cl2与H2O反应
【实验2-8】
氯水的漂白性(实验2-8)
实验操作 实验现象 实验结论
有色布条不褪色
干燥的Cl2不具有漂白性
有色布条褪色
新制氯水具有漂白性
有色鲜花变色
干燥的氯气能使鲜花褪色
氯气的化学性质
【思考探究】氯水中起漂白作用的是哪种物质?
HCl
Cl2
HClO
【现象】干燥的pH试纸不褪色;湿润的pH试纸褪色
【结论】干燥Cl2不具有漂白性,湿润Cl2具有漂白性
【总结】氯水中具有漂白性的物质是次氯酸HClO
氯水
3、Cl2与H2O反应
【实验2-8】
次氯酸(HClO)的性质
(1)强氧化性
漂白、杀菌消毒
自来水厂常用氯气消毒杀菌,氯气溶于水后生成的次氯酸有强氧化性,能杀死自来水的病菌,起到消毒作用
(2)弱酸性
酸性弱于H2CO3
(3)不稳定性
2HClO 2HCl + O2 ↑
光照
【思考】新制氯水与久置氯水有区别吗?
HClO H+ + ClO-
分析 比较
液氯、新制氯水、久置氯水
液氯 新制氯水 久置氯水
所属物质类别
颜色
成分(微粒)
性质
纯净物
黄绿色
浅黄绿色
无色
混合物
混合物
盐酸
Cl2
Cl2、H2O、HClO、
H+ 、 Cl-、 ClO-、OH-(少量)
H2O、H+ 、
Cl-、OH-(少量)
氧化性
强氧化性、酸性、漂白性
酸性
新型消毒剂:氯气可用于自来水杀菌消毒,但因与水中的有机物反应生成有机氯化物对人体有害,所以,国家规定了饮用水中余氯含量的标准;并开始使用 等新的自来水消毒剂。从中你能得到什么启示?
ClO2、O3
课堂练习
[对点训练]4.氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是 ( )
A.新制氯水呈淡黄绿色,是因为氯水中溶解了未反应的Cl2
B.新制氯水滴入硝酸银溶液中产生白色沉淀是因为氯水中有Cl-
C.久置氯水酸性将增强
D.新制氯水能使有色布条褪色是因为Cl2具有漂白性
[对点训练]5.下列有关实验现象的描述中正确的是 ( )
A.氯气可使湿润的红色布条褪色,所以氯气具有漂白性
B.钠在氯气中燃烧,产生白烟
C.铜丝在氯气中燃烧,产生蓝色的烟
D.红热的铁丝在氯气中剧烈燃烧,产生黑色的烟
D
B
根据氯气与水的反应原理,推测氯气与NaOH能否发生反应 若反应,其产物是什么
Cl2 + H2O == HCl + HClO
HCl + NaOH == NaCl + H2O
HClO+ NaOH == NaClO + H2O
Cl2 + 2 NaOH == NaCl + NaClO + H2O
(次氯酸钠)
氯气的化学性质
4.与碱的反应:
①与NaOH溶液反应
Cl2+2NaOH = NaCl+NaClO+H2O
(工业上制取漂白液原理)
Cl2+2OH- = Cl-+ClO-+H2O
②与石灰乳Ca(OH)2反应
2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
(工业上制取漂白粉原理)
2Cl2+Ca(OH)2 = Ca2++Cl-+ClO-+H2O
84消毒液的有效成分
氯气的尾气处理
漂白液 漂白粉 漂粉精
主要成分
有效成分
漂白粉 作用原理 久置空气中失效的原因 氯气的化学性质
强酸制弱酸
H2CO3>HClO
NaCl、NaClO
NaClO
Ca(ClO)2 、CaCl2
Ca(ClO)2
Ca(ClO)2
Ca(ClO)2
Ca(ClO)2 +H2O + CO2 === CaCO3 ↓+ 2HClO
与空气中CO2、H2O反应,转成HClO,HClO分解失效
Ca(ClO)2 +H2O + CO2 === CaCO3 ↓+ 2HClO
2HClO = 2HCl + O2 ↑
光照
思考与讨论
2HCl + NaClO == NaCl + Cl2↑+H2O
不能将洁厕灵和84消毒液混合使用
主要成分HCl
主要成分NaClO
能将洁厕灵和84消毒液混合使用吗?
2H+ + Cl- + ClO- == Cl2↑+H2O
Cl2有毒,打开门窗通风。
课堂练习
[对点训练]1、I.NaClO是“84”消毒液的有效成分。请回答下列问题:
(1)NaClO中Cl元素的化合价是________。
(2)浸泡衣物时加入“84”消毒液,在空气中放置一段时间后漂白效果更好,结合离子方程式解释原因:_______________ 。(已知酸性:)
(3)若将“84”消毒液与洁厕灵(主要成分是HCl)混合使用,会产生黄绿色的有毒气体,其反应的离子方程式是____________________ 。
Ⅱ.Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知,化工厂可用浓氨水来检验Cl2是否泄漏。该反应中被氧化和未被氧化的NH3分子的个数比为______________。
(2)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是___________。
+1
ClO- +H2O + CO2 === HCO3- + HClO
ClO- +2H+ + Cl- === Cl2 ↑+ H2O
1:3
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
课堂练习
[对点训练]2、下列说法中正确的是 ( )
A.漂白粉是纯净物,84消毒液是混合物,两者都可以长期保存
B.漂白粉中含有次氯酸,所以漂白粉能使有机色质褪色
C.工业上将氯气通入澄清石灰水中制取漂白粉
D.漂白粉在空气中容易失效的原因是Ca(ClO)2不稳定
D
总结 提升
氯气
(Cl2)
化学性质
用途
制漂白液、漂白粉、漂粉精
可将变价金属元素氧化到高价
Cl2与金属单质反应
Cl2与H2O反应
Cl2与碱反应
物理性质
Cl2与非金属单质反应
Cl2 +H2O === HCl + HClO
次氯酸
(HClO)
强氧化性、弱酸性、不稳定性
性质
自来水消毒、制盐酸、漂白剂、制备药物……
新制氯水的性质
总结 提升
