第30讲 化学反应的热效应(基础课)(共82张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第30讲 化学反应的热效应(基础课)(共82张PPT)-2024届高考化学一轮复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 00:00:00 | ||
图片预览









文档简介
(共82张PPT)
第30讲 化学反应的热效应(基础课)
第四部分 化学反应原理
第六章 化学反应与能量
1.了解化学反应中能量转化的原因及常见的能量转化形式。 2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 3.了解热化学方程式的含义,能正确书写热化学方程式。 4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 5.了解焓变(ΔH)与反应热的含义。了解活化能的概念。 6.了解有关燃烧热、中和反应反应热的计算,了解中和反应反应热的测定。 7.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。
知识点一 焓变 热化学方程式
必备知识梳理
关键能力训练
01
断裂
形成
物质
能量
热量
2.反应热和焓变
(1)反应热:在等温条件下,化学反应体系向环境______或从环境______的热量。
(2)焓变:在等压条件下化学反应的热效应,其符号为______,单位是__________(或kJ·mol-1)。
释放
吸收
ΔH
kJ/mol
等压条件下,反应中的能量变化全部转化为热能时,焓变(ΔH)等于反应热。
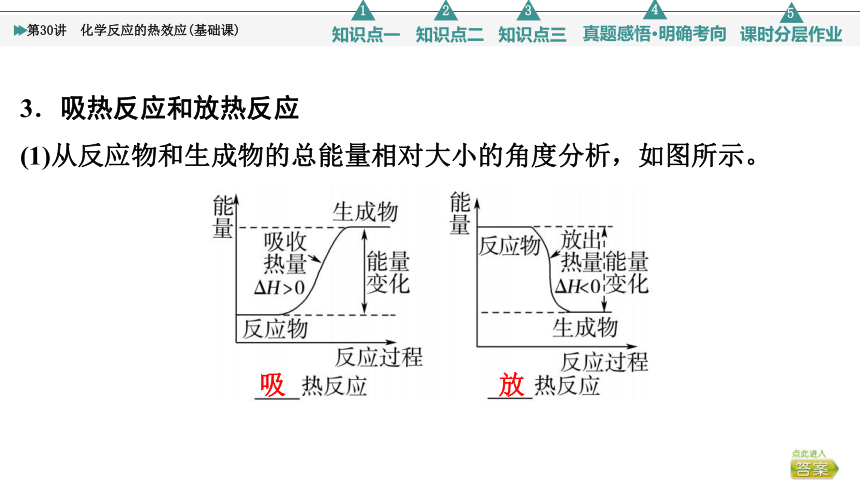
3.吸热反应和放热反应
(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
吸
放
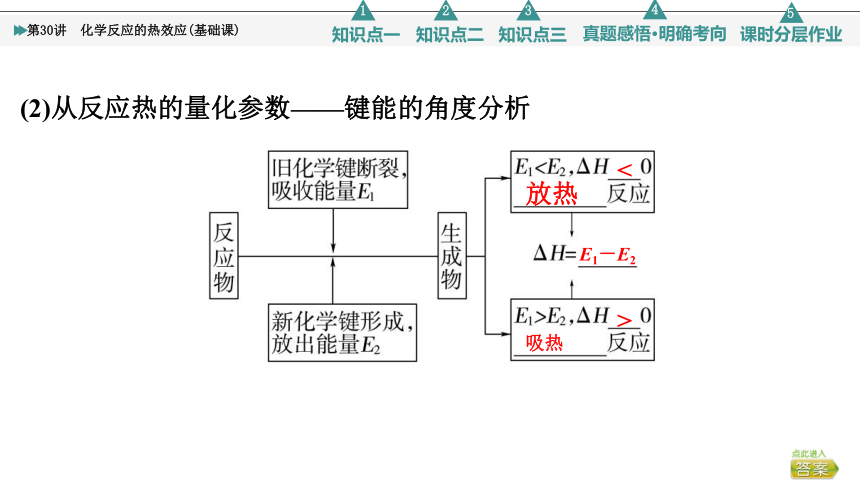
(2)从反应热的量化参数——键能的角度分析
<
放热
E1-E2
>
吸热
放热反应可以看成反应物所具有的化学能转化为热能释放出来;吸热反应可以看成热能转化为化学能被生成物储存起来。
[识记] 常见的放热反应与吸热反应
放热反应:①可燃物的燃烧,②酸碱中和反应,③大多数化合反应,④金属跟水或酸的置换反应,⑤物质的缓慢氧化,⑥铝热反应。
吸热反应:①大多数分解反应,②盐类的水解反应,③Ba(OH)2·8H2O与NH4Cl反应,④碳和水蒸气、C和CO2的反应,⑤NaHCO3与盐酸的反应。
4.热化学方程式
(1)定义:表明反应所释放或吸收的热量的化学方程式,叫做热化学方程式。
(2)意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1表示在25 ℃、101 kPa条件下,__________________________________________________
_____________________________。
2 mol 气态H2和1 mol 气态O2反应生成2 mol液态水时,放出571.6 kJ 的热量
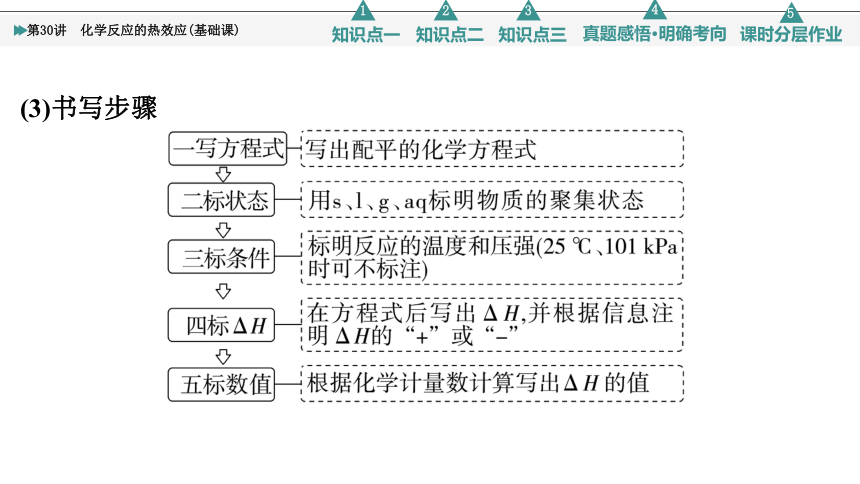
(3)书写步骤
(4)注意事项
①热化学方程式不标“↑”“↓”,但必须用s、l、g、aq等标出物质的聚集状态。而在书写同素异形体转化的热化学方程式时,由于不同单质可能用同一元素符号表示(如金刚石与石墨都用C表示),除了注明状态外,还要注明名称。
②热化学方程式的化学计量数只表示物质的量,其ΔH必须与化学方程式及物质的聚集状态相对应。
③ΔH表示完全反应时的热量变化,与反应条件及反应是否可逆无关。
5.活化能与催化剂
图中:E1为______________,E2为逆反应活化能,使用催化剂时的正反应活化能为_____,反应热为__________。
正反应活化能
E3
E1-E2
①活化能又称能垒。
②活化能与温度无关,与使用的催化剂有关。
③催化剂不改变焓变(ΔH)。
1.判断正误(正确的打“√”,错误的打“×”)
(1)需加热进行的反应均为吸热反应,其焓变ΔH>0。( )
(2)任何化学反应都伴随着能量变化,有能量变化的过程均为化学变化。( )
(3)C(s,石墨)===C(s,金刚石) ΔH>0,金刚石比石墨稳定。( )
(4)H2(g)+ O2(g)===H2O(l) ΔH1,H2(g)+ O2(g)===H2O(g) ΔH2,则ΔH1=ΔH2。( )
(5)对同一反应,使用催化剂可以改变反应的活化能和焓变。( )
(6)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同。( )
[答案] (1) (2)× (3)× (4)× (5)× (6)√
2.根据信息书写热化学方程式。
(1)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_______________________。
(2)在一定条件下,将1 mol N2和3 mol H2充入一密闭容器中发生反应生成氨气,达到平衡时N2的转化率为25%,放出Q kJ的热量,N2与H2反应的热化学方程式为________________________________。
(3)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_________________。
[答案] (1)AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ·mol-1
(2)N2(g)+3H2(g) 2NH3(g) ΔH=-4Q kJ·mol-1
(3)NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ·mol-1
能量关系图分析
1.(2022·南京模拟)某反应使用催化剂后,其反应过程中能量变化如图所示,下列说法错误的是( )
A.总反应为放热反应
B.使用催化剂后,活化能不变
C.反应①是吸热反应,反应②是放热反应
D.ΔH=ΔH1+ΔH2
B [由题图可知,反应①是吸热反应,反应②是放热反应,总反应是放热反应,且ΔH=ΔH1+ΔH2,A、C、D项正确;催化剂能降低反应的活化能,B项错误。]
2.分析图像书写热化学方程式。
(1)图甲表示氧族元素中的氧、硫、硒、碲在生成1 mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:_______________。
(2)图乙表示一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)相对能量的大小。
①D是_______________________(填离子符号)。
②B―→A+C反应的热化学方程式为____________(用离子符号表示)。
[答案] (1)H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·mol-1
利用键能确定焓变(ΔH)
3.(2022·浙江6月选考,T18)标准状况下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/ (kJ· mol-1) 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-1。下列说法不正确的是( )
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOOD.H2O(g)+O(g)===H2O2(g) ΔH=-143 kJ·mol-1
C [根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·
mol-1,A正确;O2的键能为249 kJ·mol-1×2=498 kJ·mol-1,而H2O2中氧氧单键的键能为214 kJ·mol-1,则O2的键能大于H2O2中氧氧单键的键能的两倍,B正确;HOO===HO+O,解离其中氧氧单键需要的能量为249 kJ·mol-1+39 kJ·mol-1-10 kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,C错误;H2O(g)+O(g)===H2O2(g)的ΔH=-136 kJ·mol-1-249 kJ·mol-1-(-242 kJ·mol-1)=-143
kJ·mol-1,D正确。]
4.化学反应的ΔH等于反应物的总键能与生成物的总键能之差。
化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C
键能/ (kJ· mol-1) 460 360 436 431 176 347
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=______ kJ·mol-1。
[解析] ΔH=4E(Si—Cl)+2E(H—H)-2E(Si—Si)-4E(H—Cl)=(4×360+2×436-2×176-4×431) kJ·mol-1=+236 kJ·mol-1。
[答案] +236
ΔH的基本计算
(1)ΔH=E(生成物)-E(反应物)。
(2)ΔH=反应物断键吸收的能量-生成物成键放出的能量。
(3)ΔH=正反应活化能-逆反应活化能
注意:常见物质(1 mol)中化学键数目
物质(化学键) CO2 (C===O) CH4 (C—H) P4 (P—P) SiO2 (Si—O) 石 墨 金刚 石 S8 (S—S) Si
化学键 数目(NA) 2 4 6 4 1.5 2 8 2
知识点二 燃烧热与中和反应热 能源
02
必备知识梳理
关键能力训练
1.燃烧热
(1)概念:在101 kPa时,_________纯物质完全燃烧生成__________时所放出的能量,其单位为_____________,指定产物一般指稳定的氧化物。
(2)表示:已知H2的燃烧热为285.8 kJ·mol-1,则H2燃烧热的热化学方程式为____________________________________________________。
(3)元素燃烧生成的指定产物:C→__________、H→__________、S→__________、N→________等。
1 mol
指定产物
kJ·mol-1
CO2(g)
H2O(l)
SO2(g)
N2(g)
①燃烧热有两种表示方法,如C的燃烧热为393.5 kJ·mol-1,也可表示为C的燃烧热ΔH为-393.5 kJ·mol-1。
②“焓变、ΔH与反应热”描述时一定指明“+”“-”和“kJ·mol-1”。
2.中和反应反应热的实验测定
中和反应反应热的热化学离子方程式为________________________________________________________。
(1)实验装置
(2)实验步骤
①绝热装置组装→②量取一定体积酸、碱稀溶液→③测反应前酸、碱液温度→④混合酸、碱液测反应时最高温度→⑤重复2~3次实验→⑥求平均温度差(t终-t始)→⑦计算中和反应反应热ΔH。
(3)数据处理
c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1。
(4)注意事项
①碎泡沫塑料(或纸条)及泡沫塑料板的作用是保温、隔热,减少热量损失。
②为保证酸、碱完全中和,常采用碱稍稍过量(0.5 mol·L-1 HCl、0.55 mol·L-1 NaOH溶液等体积混合)。
③实验时不能用铜丝搅拌代替玻璃搅拌器的理由是铜丝导热性好,比用玻璃搅拌器误差大。
④若用弱酸或弱碱反应,中和反应反应热小于57.3 kJ·mol-1,其ΔH>-57.3 kJ·mol-1。
3.能源
(1)分类
不可再生
可再生
(2)科学开发利用能源的措施
①提高能源的利用率
科学控制燃烧反应,使燃料充分燃烧:一是保证燃烧时有适当过量的空气,如鼓入空气、增大O2浓度等;二是保证_____________________
_________,如将固体粉碎成粉末,使液体喷射成雾状等。
②开发新的能源
开发资源丰富、可以再生、对环境无污染的新能源等。
燃料与空气有足够大的
接触面积
判断正误(正确的打“√”,错误的打“×”)
(1)已知H2(g)+ O2(g)===H2O(g) ΔH=-a kJ·mol-1,则H2的燃烧热为a kJ·mol-1。( )
(2)已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量。( )
(3)煤的液化或气化可以提高能源利用率,减少污染气体的排放。( )
(4)天然气、水能、风能、氢能、生物质能均属于可再生的新能源。( )
(5)天然气、风能属于一次能源,水煤气、电能属于二次能源。( )
(6)已知S(s)的燃烧热为a kJ·mol-1,则S(s)燃烧的热化学方程式为S(s)+
O2(g)===SO3(g) ΔH=-a kJ·mol-1。( )
[答案] (1)× (2)× (3)√ (4)× (5)√ (6)×
1.一些烷烃的燃烧热如下表:
化合物 燃烧热/ (kJ·mol-1) 化合物 燃烧热/
(kJ·mol-1)
甲烷 890.3 正丁烷 2 878.0
乙烷 1 560.8 异丁烷 2 869.6
丙烷 2 221.5 2 甲基丁烷 3 531.3
下列说法正确的是( )
A.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3 531.3 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
C [表示乙烷燃烧的热化学方程式中,H2O应为液态,且该反应的ΔH=-3 121.6 kJ·mol-1,A错误;由表中燃烧热数据可知,1 mol正丁烷、异丁烷分别完全燃烧时,正丁烷放出的热量多,说明等量的两种物质,正丁烷具有的能量高于异丁烷,则异丁烷更稳定,B错误;2 甲基丁烷的稳定性强于正戊烷,由于2 甲基丁烷的燃烧热为3 531.3 kJ·mol-1,故正戊烷的燃烧热大于3 531.3 kJ·mol-1,C正确;由表中数据分析可知,相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,D错误。]
2. (2022·唐山月考)在如图所示的量热计中,将100 mL 0.50 mol·L-1 CH3COOH溶液与100 mL 0.55 mol·L-1 NaOH溶液混合,温度从25.0 ℃升高到27.7 ℃。下列说法错误的是( )
A.若量热计的保温瓶绝热效果不好,则所测ΔH偏大
B.搅拌器一般选用导热性差的玻璃搅拌器
C.若选用同浓度同体积的盐酸,则溶液温度将升高至不超过27.7 ℃
D.分多次把NaOH溶液倒入CH3COOH溶液混合,所测ΔH偏大
C [若用盐酸代替CH3COOH,反应放出的热量多,最高温度将高于27.7 ℃,C错误。]
知识点三 盖斯定律及其应用
03
必备知识梳理
关键能力训练
1.盖斯定律
(1)内容
对于一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。即:在一定条件下,化学反应的反应热只与反应体系的____________有关,而与__________无关。
始态和终态
反应途径
(2)意义:间接计算一些难以测定的反应的反应热或很难反应的反应
热。如确定C―→CO的ΔH时可以通过盖斯定律设计 ,ΔH=______________。
ΔH1-ΔH2
(3)应用
aΔH2
-ΔH2
ΔH1+ΔH2
利用盖斯定律计算反应热的方法
1.已知:反应Ⅰ:2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
反应Ⅱ:2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)===2NO2(g)+ O2(g)的ΔH=________ kJ·mol-1。
[答案] +53.1
[解析] 将所给反应依次编号为①、②、③,根据盖斯定律,(①+②+③)×2可得4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=[(+83 kJ·mol-1)+(-20 kJ·mol-1)+(-121 kJ·mol-1)]×2=-116 kJ·mol-1。
[答案] -116
3.(2022·潍坊模拟)在H2还原SiCl4和SiHCl3混合物得到纯硅,该过程发生的主要反应为
ⅰ.SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH1=a kJ·mol-1
ⅱ.SiHCl3(g)+H2(g)===Si(s)+3HCl(g) ΔH2=b kJ·mol-1
还知2SiHCl3(g)===SiCl4(g)+SiH2Cl2(g) ΔH3=48 kJ·mol-1
请写出H2(g)还原SiCl4(g)生成SiH2Cl2(g)的热化学方程式为____________________________________________________。
[解析] 根据盖斯定律目标反应:SiCl4(g)+2H2(g)===SiH2Cl2(g)+2HCl(g)的ΔH=2(ΔH1-ΔH2)+ΔH3=(2a-2b+48) kJ·mol-1。
[答案] SiCl4(g)+2H2(g)===SiH2Cl2(g)+2HCl(g) ΔH=(2a-2b+48) kJ·mol-1
4.(2021·河北选择性考试,T16节选)大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为_____________。
物质 H2(g) C(石墨,s) C6H6(l)
燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
[答案] 3H2(g)+6C(石墨,s)===C6H6(l) ΔH=+49.1 kJ·mol-1
真题感悟·明确考向
04
1.(2022·精选真题)(1)(海南等级考)已知:电解液态水制备1 mol O2(g),电解反应的ΔH=+572 kJ·mol-1。由此计算H2(g)的燃烧热(焓)ΔH=________kJ·mol-1。
(2)(河北选择性考试)298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为___________________________________________________。
1
3
2
4
(3)(全国乙卷)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1 036 kJ·mol-1
②4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH2=+94 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ·mol-1
计算H2S热分解反应④2H2S(g)===S2(g)+2H2(g)的ΔH4=________ kJ·mol-1。
1
3
2
4
1
3
2
4
[答案] (1)-286 (2)H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1 (3)+170
1
3
2
4
2.(2022·广东选择性考试,T19节选)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为_______________________(列式表示)。
1
3
2
4
[解析] 设反应过程中第一步的产物为M,第二步的产物为N,则X→M ΔH1=(E1-E2),M→N ΔH2=ΔH,N→Y ΔH3=(E3-E4),根据盖斯定律可知,X(g)→Y(g)的焓变为ΔH1+ΔH2+ΔH3=(E1-E2)+ΔH+(E3-E4)。
[答案] (E1-E2)+ΔH+(E3-E4)
1
3
2
4
3.(2021·真题精选)(1)(湖北选择性考试)丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):C3H8(g)===C3H6(g)+H2(g) ΔH1=+125 kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+ O2(g)===C3H6(g)+H2O(g) ΔH2=-118 kJ·mol-1
已知键能:E(C—H)=416 kJ·mol-1,E(H—H)=436 kJ·mol-1,由此计算生成1 mol 碳碳π键放出的能量为________ kJ。
1
3
2
4
(2)(湖南选择性考试)氨热分解法制氢气
相关化学键的键能数据如下:
1
3
2
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946.0 436.0 390.8
在一定温度下,利用催化剂将NH3分解为N2和H2。
反应2NH3(g) N2(g)+3H2(g) ΔH=________kJ·mol-1。
4
1
3
2
(3)(辽宁选择性考试)苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
4
1
3
2
已知:Ⅲ.2H2(g)+O2(g)===2H2O(l) ΔH3
4
1
3
2
[解析] (1)反应Ⅰ中断裂2 mol C—H键、形成1 mol碳碳π键和1 mol H—H键,即416 kJ·mol-1×2-436 kJ·mol-1-E(碳碳π键)=+125 kJ·mol-1,解得:E(碳碳π键)=271 kJ·mol-1,所以形成1 mol 碳碳π键放出的能量为271 kJ。
(2)ΔH=反应物键能总和-生成物键能总和,根据热化学方程式以及表格中数据可得ΔH=390.8 kJ·mol-1×3×2-(946.0 kJ·mol-1+436.0 kJ·mol-1×3)=+90.8 kJ·mol-1。
4
1
3
2
4
1
3
2
4
4.(2020·浙江7月选考,T27)100 mL 0.200 mol·L-1 CuSO4溶液与1.95 g锌粉在量热计中充分反应。测得反应前温度为20.1 ℃,反应后最高温度为30.1 ℃。
已知:反应前后,溶液的比热容均近似为4.18 J·g-1·℃-1、溶液的密度均近似为1.00 g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量Q=________________J。
2
3
4
1
2
3
1
(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=____________
kJ·mol-1(列式计算)。
4
2
3
1
4
2
3
1
[答案] (1)4.18×103
4
谢谢观看 THANK YOU!
第30讲 化学反应的热效应(基础课)
第四部分 化学反应原理
第六章 化学反应与能量
1.了解化学反应中能量转化的原因及常见的能量转化形式。 2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 3.了解热化学方程式的含义,能正确书写热化学方程式。 4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 5.了解焓变(ΔH)与反应热的含义。了解活化能的概念。 6.了解有关燃烧热、中和反应反应热的计算,了解中和反应反应热的测定。 7.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。
知识点一 焓变 热化学方程式
必备知识梳理
关键能力训练
01
断裂
形成
物质
能量
热量
2.反应热和焓变
(1)反应热:在等温条件下,化学反应体系向环境______或从环境______的热量。
(2)焓变:在等压条件下化学反应的热效应,其符号为______,单位是__________(或kJ·mol-1)。
释放
吸收
ΔH
kJ/mol
等压条件下,反应中的能量变化全部转化为热能时,焓变(ΔH)等于反应热。
3.吸热反应和放热反应
(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
吸
放
(2)从反应热的量化参数——键能的角度分析
<
放热
E1-E2
>
吸热
放热反应可以看成反应物所具有的化学能转化为热能释放出来;吸热反应可以看成热能转化为化学能被生成物储存起来。
[识记] 常见的放热反应与吸热反应
放热反应:①可燃物的燃烧,②酸碱中和反应,③大多数化合反应,④金属跟水或酸的置换反应,⑤物质的缓慢氧化,⑥铝热反应。
吸热反应:①大多数分解反应,②盐类的水解反应,③Ba(OH)2·8H2O与NH4Cl反应,④碳和水蒸气、C和CO2的反应,⑤NaHCO3与盐酸的反应。
4.热化学方程式
(1)定义:表明反应所释放或吸收的热量的化学方程式,叫做热化学方程式。
(2)意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1表示在25 ℃、101 kPa条件下,__________________________________________________
_____________________________。
2 mol 气态H2和1 mol 气态O2反应生成2 mol液态水时,放出571.6 kJ 的热量
(3)书写步骤
(4)注意事项
①热化学方程式不标“↑”“↓”,但必须用s、l、g、aq等标出物质的聚集状态。而在书写同素异形体转化的热化学方程式时,由于不同单质可能用同一元素符号表示(如金刚石与石墨都用C表示),除了注明状态外,还要注明名称。
②热化学方程式的化学计量数只表示物质的量,其ΔH必须与化学方程式及物质的聚集状态相对应。
③ΔH表示完全反应时的热量变化,与反应条件及反应是否可逆无关。
5.活化能与催化剂
图中:E1为______________,E2为逆反应活化能,使用催化剂时的正反应活化能为_____,反应热为__________。
正反应活化能
E3
E1-E2
①活化能又称能垒。
②活化能与温度无关,与使用的催化剂有关。
③催化剂不改变焓变(ΔH)。
1.判断正误(正确的打“√”,错误的打“×”)
(1)需加热进行的反应均为吸热反应,其焓变ΔH>0。( )
(2)任何化学反应都伴随着能量变化,有能量变化的过程均为化学变化。( )
(3)C(s,石墨)===C(s,金刚石) ΔH>0,金刚石比石墨稳定。( )
(4)H2(g)+ O2(g)===H2O(l) ΔH1,H2(g)+ O2(g)===H2O(g) ΔH2,则ΔH1=ΔH2。( )
(5)对同一反应,使用催化剂可以改变反应的活化能和焓变。( )
(6)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同。( )
[答案] (1) (2)× (3)× (4)× (5)× (6)√
2.根据信息书写热化学方程式。
(1)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_______________________。
(2)在一定条件下,将1 mol N2和3 mol H2充入一密闭容器中发生反应生成氨气,达到平衡时N2的转化率为25%,放出Q kJ的热量,N2与H2反应的热化学方程式为________________________________。
(3)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是_________________。
[答案] (1)AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ·mol-1
(2)N2(g)+3H2(g) 2NH3(g) ΔH=-4Q kJ·mol-1
(3)NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ·mol-1
能量关系图分析
1.(2022·南京模拟)某反应使用催化剂后,其反应过程中能量变化如图所示,下列说法错误的是( )
A.总反应为放热反应
B.使用催化剂后,活化能不变
C.反应①是吸热反应,反应②是放热反应
D.ΔH=ΔH1+ΔH2
B [由题图可知,反应①是吸热反应,反应②是放热反应,总反应是放热反应,且ΔH=ΔH1+ΔH2,A、C、D项正确;催化剂能降低反应的活化能,B项错误。]
2.分析图像书写热化学方程式。
(1)图甲表示氧族元素中的氧、硫、硒、碲在生成1 mol气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:_______________。
(2)图乙表示一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)相对能量的大小。
①D是_______________________(填离子符号)。
②B―→A+C反应的热化学方程式为____________(用离子符号表示)。
[答案] (1)H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·mol-1
利用键能确定焓变(ΔH)
3.(2022·浙江6月选考,T18)标准状况下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/ (kJ· mol-1) 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-1。下列说法不正确的是( )
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOO
C [根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·
mol-1,A正确;O2的键能为249 kJ·mol-1×2=498 kJ·mol-1,而H2O2中氧氧单键的键能为214 kJ·mol-1,则O2的键能大于H2O2中氧氧单键的键能的两倍,B正确;HOO===HO+O,解离其中氧氧单键需要的能量为249 kJ·mol-1+39 kJ·mol-1-10 kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,C错误;H2O(g)+O(g)===H2O2(g)的ΔH=-136 kJ·mol-1-249 kJ·mol-1-(-242 kJ·mol-1)=-143
kJ·mol-1,D正确。]
4.化学反应的ΔH等于反应物的总键能与生成物的总键能之差。
化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C
键能/ (kJ· mol-1) 460 360 436 431 176 347
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=______ kJ·mol-1。
[解析] ΔH=4E(Si—Cl)+2E(H—H)-2E(Si—Si)-4E(H—Cl)=(4×360+2×436-2×176-4×431) kJ·mol-1=+236 kJ·mol-1。
[答案] +236
ΔH的基本计算
(1)ΔH=E(生成物)-E(反应物)。
(2)ΔH=反应物断键吸收的能量-生成物成键放出的能量。
(3)ΔH=正反应活化能-逆反应活化能
注意:常见物质(1 mol)中化学键数目
物质(化学键) CO2 (C===O) CH4 (C—H) P4 (P—P) SiO2 (Si—O) 石 墨 金刚 石 S8 (S—S) Si
化学键 数目(NA) 2 4 6 4 1.5 2 8 2
知识点二 燃烧热与中和反应热 能源
02
必备知识梳理
关键能力训练
1.燃烧热
(1)概念:在101 kPa时,_________纯物质完全燃烧生成__________时所放出的能量,其单位为_____________,指定产物一般指稳定的氧化物。
(2)表示:已知H2的燃烧热为285.8 kJ·mol-1,则H2燃烧热的热化学方程式为____________________________________________________。
(3)元素燃烧生成的指定产物:C→__________、H→__________、S→__________、N→________等。
1 mol
指定产物
kJ·mol-1
CO2(g)
H2O(l)
SO2(g)
N2(g)
①燃烧热有两种表示方法,如C的燃烧热为393.5 kJ·mol-1,也可表示为C的燃烧热ΔH为-393.5 kJ·mol-1。
②“焓变、ΔH与反应热”描述时一定指明“+”“-”和“kJ·mol-1”。
2.中和反应反应热的实验测定
中和反应反应热的热化学离子方程式为________________________________________________________。
(1)实验装置
(2)实验步骤
①绝热装置组装→②量取一定体积酸、碱稀溶液→③测反应前酸、碱液温度→④混合酸、碱液测反应时最高温度→⑤重复2~3次实验→⑥求平均温度差(t终-t始)→⑦计算中和反应反应热ΔH。
(3)数据处理
c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1。
(4)注意事项
①碎泡沫塑料(或纸条)及泡沫塑料板的作用是保温、隔热,减少热量损失。
②为保证酸、碱完全中和,常采用碱稍稍过量(0.5 mol·L-1 HCl、0.55 mol·L-1 NaOH溶液等体积混合)。
③实验时不能用铜丝搅拌代替玻璃搅拌器的理由是铜丝导热性好,比用玻璃搅拌器误差大。
④若用弱酸或弱碱反应,中和反应反应热小于57.3 kJ·mol-1,其ΔH>-57.3 kJ·mol-1。
3.能源
(1)分类
不可再生
可再生
(2)科学开发利用能源的措施
①提高能源的利用率
科学控制燃烧反应,使燃料充分燃烧:一是保证燃烧时有适当过量的空气,如鼓入空气、增大O2浓度等;二是保证_____________________
_________,如将固体粉碎成粉末,使液体喷射成雾状等。
②开发新的能源
开发资源丰富、可以再生、对环境无污染的新能源等。
燃料与空气有足够大的
接触面积
判断正误(正确的打“√”,错误的打“×”)
(1)已知H2(g)+ O2(g)===H2O(g) ΔH=-a kJ·mol-1,则H2的燃烧热为a kJ·mol-1。( )
(2)已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量。( )
(3)煤的液化或气化可以提高能源利用率,减少污染气体的排放。( )
(4)天然气、水能、风能、氢能、生物质能均属于可再生的新能源。( )
(5)天然气、风能属于一次能源,水煤气、电能属于二次能源。( )
(6)已知S(s)的燃烧热为a kJ·mol-1,则S(s)燃烧的热化学方程式为S(s)+
O2(g)===SO3(g) ΔH=-a kJ·mol-1。( )
[答案] (1)× (2)× (3)√ (4)× (5)√ (6)×
1.一些烷烃的燃烧热如下表:
化合物 燃烧热/ (kJ·mol-1) 化合物 燃烧热/
(kJ·mol-1)
甲烷 890.3 正丁烷 2 878.0
乙烷 1 560.8 异丁烷 2 869.6
丙烷 2 221.5 2 甲基丁烷 3 531.3
下列说法正确的是( )
A.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3 531.3 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
C [表示乙烷燃烧的热化学方程式中,H2O应为液态,且该反应的ΔH=-3 121.6 kJ·mol-1,A错误;由表中燃烧热数据可知,1 mol正丁烷、异丁烷分别完全燃烧时,正丁烷放出的热量多,说明等量的两种物质,正丁烷具有的能量高于异丁烷,则异丁烷更稳定,B错误;2 甲基丁烷的稳定性强于正戊烷,由于2 甲基丁烷的燃烧热为3 531.3 kJ·mol-1,故正戊烷的燃烧热大于3 531.3 kJ·mol-1,C正确;由表中数据分析可知,相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,D错误。]
2. (2022·唐山月考)在如图所示的量热计中,将100 mL 0.50 mol·L-1 CH3COOH溶液与100 mL 0.55 mol·L-1 NaOH溶液混合,温度从25.0 ℃升高到27.7 ℃。下列说法错误的是( )
A.若量热计的保温瓶绝热效果不好,则所测ΔH偏大
B.搅拌器一般选用导热性差的玻璃搅拌器
C.若选用同浓度同体积的盐酸,则溶液温度将升高至不超过27.7 ℃
D.分多次把NaOH溶液倒入CH3COOH溶液混合,所测ΔH偏大
C [若用盐酸代替CH3COOH,反应放出的热量多,最高温度将高于27.7 ℃,C错误。]
知识点三 盖斯定律及其应用
03
必备知识梳理
关键能力训练
1.盖斯定律
(1)内容
对于一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。即:在一定条件下,化学反应的反应热只与反应体系的____________有关,而与__________无关。
始态和终态
反应途径
(2)意义:间接计算一些难以测定的反应的反应热或很难反应的反应
热。如确定C―→CO的ΔH时可以通过盖斯定律设计 ,ΔH=______________。
ΔH1-ΔH2
(3)应用
aΔH2
-ΔH2
ΔH1+ΔH2
利用盖斯定律计算反应热的方法
1.已知:反应Ⅰ:2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
反应Ⅱ:2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)===2NO2(g)+ O2(g)的ΔH=________ kJ·mol-1。
[答案] +53.1
[解析] 将所给反应依次编号为①、②、③,根据盖斯定律,(①+②+③)×2可得4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=[(+83 kJ·mol-1)+(-20 kJ·mol-1)+(-121 kJ·mol-1)]×2=-116 kJ·mol-1。
[答案] -116
3.(2022·潍坊模拟)在H2还原SiCl4和SiHCl3混合物得到纯硅,该过程发生的主要反应为
ⅰ.SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH1=a kJ·mol-1
ⅱ.SiHCl3(g)+H2(g)===Si(s)+3HCl(g) ΔH2=b kJ·mol-1
还知2SiHCl3(g)===SiCl4(g)+SiH2Cl2(g) ΔH3=48 kJ·mol-1
请写出H2(g)还原SiCl4(g)生成SiH2Cl2(g)的热化学方程式为____________________________________________________。
[解析] 根据盖斯定律目标反应:SiCl4(g)+2H2(g)===SiH2Cl2(g)+2HCl(g)的ΔH=2(ΔH1-ΔH2)+ΔH3=(2a-2b+48) kJ·mol-1。
[答案] SiCl4(g)+2H2(g)===SiH2Cl2(g)+2HCl(g) ΔH=(2a-2b+48) kJ·mol-1
4.(2021·河北选择性考试,T16节选)大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为_____________。
物质 H2(g) C(石墨,s) C6H6(l)
燃烧热ΔH/ (kJ·mol-1) -285.8 -393.5 -3 267.5
[答案] 3H2(g)+6C(石墨,s)===C6H6(l) ΔH=+49.1 kJ·mol-1
真题感悟·明确考向
04
1.(2022·精选真题)(1)(海南等级考)已知:电解液态水制备1 mol O2(g),电解反应的ΔH=+572 kJ·mol-1。由此计算H2(g)的燃烧热(焓)ΔH=________kJ·mol-1。
(2)(河北选择性考试)298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为___________________________________________________。
1
3
2
4
(3)(全国乙卷)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g) ΔH1=-1 036 kJ·mol-1
②4H2S(g)+2SO2(g)===3S2(g)+4H2O(g) ΔH2=+94 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ·mol-1
计算H2S热分解反应④2H2S(g)===S2(g)+2H2(g)的ΔH4=________ kJ·mol-1。
1
3
2
4
1
3
2
4
[答案] (1)-286 (2)H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1 (3)+170
1
3
2
4
2.(2022·广东选择性考试,T19节选)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为_______________________(列式表示)。
1
3
2
4
[解析] 设反应过程中第一步的产物为M,第二步的产物为N,则X→M ΔH1=(E1-E2),M→N ΔH2=ΔH,N→Y ΔH3=(E3-E4),根据盖斯定律可知,X(g)→Y(g)的焓变为ΔH1+ΔH2+ΔH3=(E1-E2)+ΔH+(E3-E4)。
[答案] (E1-E2)+ΔH+(E3-E4)
1
3
2
4
3.(2021·真题精选)(1)(湖北选择性考试)丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):C3H8(g)===C3H6(g)+H2(g) ΔH1=+125 kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+ O2(g)===C3H6(g)+H2O(g) ΔH2=-118 kJ·mol-1
已知键能:E(C—H)=416 kJ·mol-1,E(H—H)=436 kJ·mol-1,由此计算生成1 mol 碳碳π键放出的能量为________ kJ。
1
3
2
4
(2)(湖南选择性考试)氨热分解法制氢气
相关化学键的键能数据如下:
1
3
2
化学键 N≡N H—H N—H
键能E/(kJ·mol-1) 946.0 436.0 390.8
在一定温度下,利用催化剂将NH3分解为N2和H2。
反应2NH3(g) N2(g)+3H2(g) ΔH=________kJ·mol-1。
4
1
3
2
(3)(辽宁选择性考试)苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
4
1
3
2
已知:Ⅲ.2H2(g)+O2(g)===2H2O(l) ΔH3
4
1
3
2
[解析] (1)反应Ⅰ中断裂2 mol C—H键、形成1 mol碳碳π键和1 mol H—H键,即416 kJ·mol-1×2-436 kJ·mol-1-E(碳碳π键)=+125 kJ·mol-1,解得:E(碳碳π键)=271 kJ·mol-1,所以形成1 mol 碳碳π键放出的能量为271 kJ。
(2)ΔH=反应物键能总和-生成物键能总和,根据热化学方程式以及表格中数据可得ΔH=390.8 kJ·mol-1×3×2-(946.0 kJ·mol-1+436.0 kJ·mol-1×3)=+90.8 kJ·mol-1。
4
1
3
2
4
1
3
2
4
4.(2020·浙江7月选考,T27)100 mL 0.200 mol·L-1 CuSO4溶液与1.95 g锌粉在量热计中充分反应。测得反应前温度为20.1 ℃,反应后最高温度为30.1 ℃。
已知:反应前后,溶液的比热容均近似为4.18 J·g-1·℃-1、溶液的密度均近似为1.00 g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量Q=________________J。
2
3
4
1
2
3
1
(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=____________
kJ·mol-1(列式计算)。
4
2
3
1
4
2
3
1
[答案] (1)4.18×103
4
谢谢观看 THANK YOU!
同课章节目录
