第34讲 电解池 金属的腐蚀与防护(基础课)(共90张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第34讲 电解池 金属的腐蚀与防护(基础课)(共90张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 20:15:20 | ||
图片预览











文档简介
(共90张PPT)
第34讲 电解池 金属的腐蚀与防护(基础课)
第四部分 化学反应原理
第六章 化学反应与能量
1.理解电解池的构成、工作原理及应用,能书写电极反应式和总反应方程式。 2.了解电解原理在氯碱工业、精炼铜、电镀、电冶金等方面的应用。 3.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。
知识点一 电解原理及其规律
必备知识梳理
关键能力训练
01
1.电解
使______通过电解质溶液(或熔融电解质)而在阴极、阳极引起______________的过程。
电流
氧化还原反应
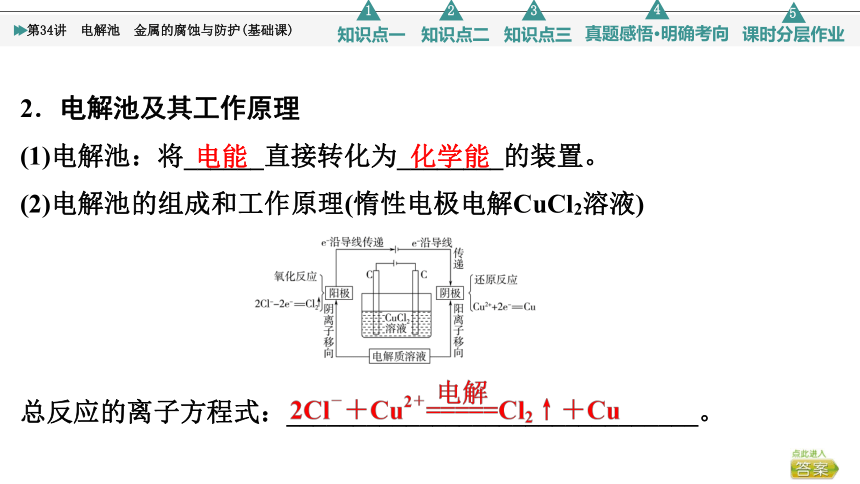
2.电解池及其工作原理
(1)电解池:将______直接转化为________的装置。
(2)电解池的组成和工作原理(惰性电极电解CuCl2溶液)
总反应的离子方程式:_______________________________。
电能
化学能
(3)放电顺序(一般情况下)
①阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
②阳极:__________>S2->I->Br->Cl->OH->含氧酸根离子>F-。
活性电极
①活性电极指的是除去Au、Pt以外的金属电极,惰性电极指的是Pt、Au、C电极,不参与电极反应。
②阴极材料若为金属电极,一般是为增强导电性,但不参与反应。
3.以惰性电极电解水溶液的有关规律
(1)电解水型——含氧酸、强碱、活泼金属含氧酸盐
①阴极反应式为_________________________,阳极反应式为__________________________________,
总方程式为2H2O 2H2↑+O2↑。
②电解质浓度变____,pH可能变大、变小或不变,可加_______复原。
4H++4e-===2H2↑
4OH--4e-===2H2O+O2↑
大
H2O
(2)电解电解质型——无氧酸(如HCl),不活泼金属无氧酸盐(如CuCl2),电解质浓度变____,加电解质本身复原。
(3)放H2生碱型——活泼金属的无氧酸盐(如NaCl)
①阴极反应式为____________________________,阳极反应式为__________________,总方程式为_______________________________
_______________。
②溶液pH变____,加_______复原。
小
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
+2OH-
大
HCl
(4)放O2生酸型——不活泼金属的含氧酸盐(如CuSO4)
①阴极反应式为_________________________,阳极反应式为________________________________,总方程式为___________________________________。
②溶液pH变____,加_____________________________复原。
2Cu2++4e-===2Cu
2H2O-4e-===O2↑+4H+
小
CuO(金属氧化物)或CuCO3
水电离出的H+或OH-放电,一般电极反应式为2H2O+2e-===H2↑+2OH-或2H2O-4e-===O2↑+4H+。
1.判断正误(正确的打“√”,错误的打“×”)
(1)电解质溶液的导电过程就是电解质溶液被电解的过程。( )
(2)某些不能自发进行的氧化还原反应,通过电解可以实现。( )
(3)电解池中的电子流向:电源负极→阴极→电解质溶液→阳极→电源正极。( )
(4)用Cu作电极电解CuSO4溶液的阳极反应为2H2O-4e-===O2↑+4H+。( )
(5)用惰性电极电解NaCl和NaBr的混合液,阳极上的放电顺序为Br-、Cl-、OH-。( )
[答案] (1)√ (2)√ (3)× (4)× (5)√
2.按要求书写电极反应式和总反应方程式:
(1)用惰性电极电解MgCl2溶液
阳极反应式:_______________________;
阴极反应式:_______________________;
总反应离子方程式:_________________。
(2)用惰性电极电解AgNO3溶液
阴极反应式:____________________________
阳极反应式:____________________________
总反应离子方程式:______________________。
(3)某水溶液中含有等物质的量浓度的Cu(NO3)2和NaCl,以惰性电极对该溶液进行电解,分阶段写出电解反应的离子方程式:
___________________________________________________________、
___________________________________________________________、
___________________________________________________________。
1.用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一项是( )
选项 X极 实验前U形 管中液体 通电后现 象及结论 恢复原溶液
所加物质
A 正极 Na2SO4溶液 U形管两端滴入酚酞后,a管中呈红色 H2O
B 正极 AgNO3溶液 a管中电极反应式是4OH--4e-===O2↑+2H2O AgOH
C 负极 CuCl2溶液 b管中有气体逸出 CuCl2
D 负极 NaOH溶液 溶液pH降低 H2O
C [A项,a管电极附近生成H+,呈酸性,错误;B项,AgNO3溶液电解可用Ag2O复原,错误;D项,电解水使c(NaOH)增大,pH增大,错误。]
2.采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )
A.阳极反应为2H2O-4e-===4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
D [根据题给电解装置图可知,电解池右侧O2参加反应生成H2O2,a极为阳极,b极为阴极。 电解时,阳极的电极反应式为2H2O-4e-===4H++O2↑,阴极的电极反应式为4H++2O2+4e-===2H2O2,A正确;根据电极反应式及得失电子守恒可知,阳极生成的H+通过质子交换膜进入阴极区最终转化为H2O2,阳极区H+的物质的量浓度不发生变化,pH不变,B、C正确;设电解时转移电子为4 mol,则阳极生成1 mol O2,阴极消耗2 mol O2,D错误。]
3. (2022·武汉模拟)如图所示,在一定电压下用惰性电极电解由等物质的量浓度的FeCl2、HCl组成的混合溶液。已知在此电压下,阴、阳离子根据放电能力顺序,都可能在阳极放电,下列分析正确的是( )
A.C1电极上的电极反应式为2H2O+2e-===2OH-+H2↑
B.C1电极处溶液首先变黄色
C.C2电极上可依次发生的电极反应为Fe2+-e-===Fe3+、
2Cl--2e-===Cl2↑
D.当C1电极上有2 g物质生成时,就会有2NA个
电子通过溶液发生转移(NA表示阿伏加德罗常数的值)
C [C1电极与电源的负极相连,作阴极,溶液中的H+在阴极放电,电极反应式为2H++2e-===H2↑,A错误;C1电极上H+放电生成H2,C2电极与电源的正极相连,作阳极,Fe2+的还原性强于Cl-,则依次发生的电极反应为Fe2+-e-===Fe3+、2Cl--2e-===Cl2↑,故C2电极处溶液首先变黄色,B错误,C正确;电子只能通过导线传递,不能通过溶液传递,D错误。]
知识点二 电解原理的应用
02
必备知识梳理
关键能力训练
1.电解饱和食盐水——氯碱工业
(1)电极反应
阳极:__________________________(______反应)。
阴极:__________________________________(______反应)。
检验阳极产物的方法:用湿润的淀粉 KI试纸靠近阳极附近,若试纸变蓝,证明生成了Cl2。
电解时向食盐水中加酚酞,____极附近溶液变红,说明该电极附近产生的物质为_________。
2Cl--2e-===Cl2↑
氧化
2H2O+2e-===H2↑+2OH-
还原
阴
NaOH
(2)电解饱和食盐水的化学方程式和离子方程式
①2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
②______________________________________。
(3)阳离子交换膜法电解饱和食盐水示意图
①阳离子交换膜的作用
阻止________进入阳极室与Cl2发生反应:________________________
_____________________,阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
OH-
2NaOH+Cl2===NaCl+
NaClO+H2O
②a、b、c、d加入或取出的物质分别是________________、_______________、____________、_______________;X、Y分别是______、_____。
精制饱和食盐水
稀NaOH溶液
稀的食盐水
浓NaOH溶液
Cl2
H2
2.电镀和电解精炼铜
电镀(Fe表 面镀Cu) 电解精炼铜
阳 极 电极材料 镀层金属铜 ______(含Zn、Fe、Ni、Ag、Au等杂质)
电极反应 _______________________ _______________________、
Fe-2e-===Fe2+、
Ni-2e-===Ni2+、
Cu-2e-===Cu2+(主要)
粗铜
Cu-2e-===Cu2+
Zn-2e-===Zn2+
阴 极 电极材料 ____________ ______
电极反应 _______________________ 电解质溶液 含________的盐溶液 注:电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成________ 待镀金属铁
纯铜
Cu2++2e-===Cu
Cu2+
阳极泥
3.电冶金——活泼金属的冶炼方法
(1)电解熔融氯化钠得到钠
2Cl--2e-===Cl2↑
2Na++2e-===2Na
(2)电解熔融Al2O3制Al
电极反应:
阳极:___________________________
阴极:__________________________
冰晶石的作用是作Al2O3的助熔剂。
6O2--12e-===3O2↑
4Al3++12e-===4Al
4.电解在有机合成中的应用
以丙烯腈合成己二腈为例,两极反应式如下:
2CH2===CHCN+2H++2e-===NC(CH2)4CN
电解原理的一般应用
1. 利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
D [氯碱工业中阳极是Cl-放电生成Cl2,A错误;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,溶液中Cu2+浓度变小,B错误;铁片上镀铜时,阴极应该是铁片,阳极是纯铜,C错误。]
2.(2022·石家庄模拟)金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量相等
C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中有Cu和Pt
D [电解时,阳极Zn、Fe、Ni失去电子,发生氧化反应,A项错误;因氧化性Ni2+>Fe2+>Zn2+,故阴极反应式为Ni2++2e-===Ni,可见,阳极质量减少是因为Zn、Fe、Ni溶解,而阴极质量增加是因为Ni析出,B项错误;电解后溶液中的阳离子除Fe2+和Zn2+外,还有Ni2+和H+,C项错误。]
电解原理在实际中的创新应用
3.(2022·济南模拟)在直流电源作用下,双极膜中间层中的H2O解离为H+和OH-,利用双极膜电解池产生的强氧化性羟基自由基(·OH)处理含苯酚废水和含SO2的烟气的工作原理如图所示。下列说法错误的是( )
A.N电极为阴极,发生还原反应
B.阴极电极反应式为O2+2e-+2H+===2·OH
C.每处理9.4 g苯酚,理论上有2.8 mol H+透过膜a
D.若·OH只与苯酚和SO2反应,则参加反应的苯酚和SO2物质的量之比为1∶14
AC [M极上O2得电子生成羟基自由基(·OH),电极反应为O2+2e-+2H+===2·OH,则M极为阴极,连接电源的负极,膜b允许H+透过进入阴极区,M极上产生的羟基自由基将苯酚氧化成CO2;N极为阳极,其电极反应为OH--e-===·OH,则膜a允许OH-透过进入阳极区,N极上产生的羟基自由基将SO2氧化为硫酸根离子。N为阳极发生氧化反应,A错误;1 mol 苯酚转化为CO2,失去28 mol电子,则每处理9.4 g(0.1 mol)苯酚,理论上有2.8 mol H+透过膜b,C项错误。]
4.(2022·海淀区模拟)电解制备H2O2,装置示意图如图所示。
(1)a极的电极反应式为________________________________________。
(2)通过管道将b极产生的气体送至a极,目的是___________________。
(3)pH过高时H2O2会分解。但电解一段时间后,a极附近溶液的pH基本不变,原因是______________________________________________。
[答案] (1)O2+2H2O+2e-===H2O2+2OH- (2)将b极产生的氧气循环利用,用于制备H2O2 (3)反应转移2 mol电子时,即阴极产生2 mol OH-的同时,阳极反应产生2 mol H+并通过质子交换膜移至阴极室,与OH-发生中和反应
5.如图所示是电解法合成氨反应装置示意图。
则b极为________(填“阴”或“阳”)极,a极的电极反应式为__________________________,电解装置中质子交换膜的作用为_____________________________________________________________
____________________;
若b极产生的O2在一定条件下的体积为336 L,a极中通入相同条件下N2的总体积为672 L,则N2的转化率为________%(保留两位有效数字)。
[解析] b极上H2O转化为O2,发生氧化反应,则b极为阳极;a极上N2转化为NH3,发生还原反应,则a极为阴极,其电极反应式为N2+6e-+6H+===2NH3;质子交换膜只允许H+通过,电解过程中a极上消耗H+,b极上生成H+,因此质子交换膜的作用是为质子的迁移和输送提供通道,并阻隔阴阳极产物接触;b极的电极反应式为2H2O-4e-===O2↑+4H+,根据各电极上通过电量相等,可得关系式:2N2~3O2,则相同条件下,生成的O2和消耗的N2的体积比为3∶2,因此若b极产生O2 336 L,则a极消耗N2 224 L,而通入的N2为672 L,因此N2的转化率为 ×100%≈33%。
[答案] 阳 N2+6e-+6H+===2NH3 质子交换膜为质子的迁移和输送提供通道,并阻隔阴阳极产物接触 33
知识点三 金属的腐蚀与防护
03
必备知识梳理
关键能力训练
1.金属的腐蚀及分类
(1)金属腐蚀:金属或合金与周围的气体或液体发生__________反应而引起损耗的现象。其本质是M-ne-===Mn+。
氧化还原
(2)分类
①化学腐蚀:金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应而引起的腐蚀。如钢材在高温下容易被氧化,表面生成由FeO、Fe2O3、Fe3O4组成的一层氧化物。
②电化学腐蚀:当不纯的金属与电解质溶液接触时会发生________反应,__________的金属发生氧化反应而被腐蚀。比化学腐蚀更普遍、速率更快。
原电池
比较活泼
2.电化学腐蚀的分类
以钢铁腐蚀为例进行分析
类型 析氢腐蚀 吸氧腐蚀
条件 水膜____性较____(pH≤_____),如NH4Cl溶液 水膜酸性很____或呈____性,如NaCl溶液
酸
强
4.3
弱
中
电极材料及反应 负 极 Fe:_______________________ 正 极 C:_____________________ C:________________________________
Fe-2e-===Fe2+
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
总反 应式 _______________________ ________________________________
联系 __________更普遍 Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
吸氧腐蚀
铁锈的主要成分为Fe2O3·xH2O,其形成过程所涉及的反应为4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O。
3.电化学腐蚀的实验探究(如图所示)
(1)若棉团浸有NH4Cl溶液,铁钉发生______腐蚀,正极反应式为________________________,右侧试管中现象是____________。
(2)若棉团浸有NaCl溶液,铁钉发生______腐蚀,正极反应式为________________________________,右侧试管中现象是________________。
析氢
2H++2e-===H2↑
有气泡冒出
吸氧
O2+4e-+2H2O===4OH-
导管内液面上升
4.金属的防护
(1)改变金属材料的组成。在金属中添加其他金属或非金属可以制成性能优异的合金。
(2)在金属表面覆盖保护层
①在钢铁制品的表面喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等。
②用电镀等方法在钢铁表面镀上一层Zn、Sn、Cr、Ni等金属,如白铁皮(镀Zn)、马口铁(镀Sn)。
③用化学方法在钢铁部件表面进行发蓝处理(生成一层致密的Fe3O4薄膜)。
④利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化。
(3)电化学保护法
①牺牲阳极法—________原理
a.______:比被保护金属活泼的金属;
b. ______:被保护的金属设备。
原电池
负极
正极
②外加电流法—______原理
通电后,调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流________________,从而得到保护。
a.______:被保护的金属设备;
b.______:惰性金属。
电解
降至零或接近零
阴极
阳极
(4)实验探究
为验证牺牲阳极法,如图所示:
①Fe作____极,电极反应式为________________________。
②Zn作负极,电极反应式为_______________________。
正
2H++2e-===H2↑
Zn-2e-===Zn2+
③Fe电极附近滴加K3[Fe(CN)6]溶液,溶液中是否有蓝色沉淀生成?____,说明_____被保护。
④若将Zn改为Cu,则Fe电极附近滴加K3[Fe(CN)6]溶液,现象为____________________,说明_____被保护。此现象的离子方程式为________________________________________________________。
否
Fe
溶液中生成蓝色沉淀
Cu
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓
判断正误(正确的打“√”,错误的打“×”)
(1)纯银器表面变黑和钢铁表面生锈腐蚀原理一样。( )
(2)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物。( )
(3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+。( )
(4)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用。( )
(5)为了保护船体,在船体表面嵌入锌块,利用了牺牲阳极保护法。( )
[答案] (1)× (2)× (3)× (4)× (5)√
金属的腐蚀与防护
1.下列与金属腐蚀有关的说法正确的是( )
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁输水管的腐蚀,镁块相当于原电池的正极
C [浓硫酸从环境中吸收水分,使铁钉周围的空气比较干燥,因此铁钉不易腐蚀,A项错误;Fe、Cu与酸化的3% NaCl溶液构成原电池,Fe作负极,发生失去电子的氧化反应,有Fe2+生成,因此滴加少量K3[Fe(CN)6]溶液,有蓝色沉淀出现,B项错误;燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀,C项正确;用牺牲镁块的方法来防止地下钢铁输水管的腐蚀,镁块相当于原电池的负极,D项错误。]
2. (2022·佛山模拟)如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法不正确的是( )
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-===4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
C [AB段作原电池正极,BC段为原电池负极。BC段电极反应为Fe-2e-===Fe2+,AB段电极反应为O2+2H2O+4e-===4OH-,BC段溶解而被腐蚀,AB段形成铁锈。C项不正确。]
3. 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应为Zn2++2e-===Zn
D.通电时为外加电流法,断电时为牺牲阳极法
C [断电时,锌作负极,反应式为Zn-2e-===Zn2+,保护铁不被腐蚀,C项错误。]
4.如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为________(填序号)。
[解析] ②③④是原电池,⑤⑥是电解池,金属被腐蚀由快到慢的顺序:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
[答案] ⑤④②①③⑥
(1)判断析氢腐蚀与吸氧腐蚀的依据:对于金属活动顺序表氢元素前的金属,酸性发生析氢腐蚀,中性或碱性发生吸氧腐蚀;对于氢元素后的金属只能发生吸氧腐蚀。
(2)对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
金属的腐蚀与防护实验探究
5.(2022·武汉模拟)验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① ② ③
在Fe表面生成蓝色沉淀 试管内无明显变化 试管内生成蓝色沉淀
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
D [②中Zn作负极,发生氧化反应生成Zn2+,Fe作正极被保护,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,试管内无明显变化。但③中没有Zn保护Fe,Fe在酸性环境中发生析氢腐蚀,Fe作负极被氧化生成Fe2+,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,生成蓝色沉淀,对比②③可知Zn保护了Fe,A项正确;①与②的区别在于前者是将铁氰化钾溶液直接滴入烧杯中,而后者是在取出的少量Fe附近的溶液中滴加铁氰化钾溶液,①中出现了蓝色沉淀,说明有Fe2+生成。对比分析可知,可能是铁氰化钾氧化Fe生成了Fe2+,B项正确;通过上述分析可知,验证Zn保护Fe时不能用①的方法,C项正确;若将Zn换成Cu,铁氰化钾仍会将Fe氧化为Fe2+,在铁的表面同样会生成蓝色沉淀,所以无法判断Fe2+是不是负极产物,即无法判断Fe与Cu的活泼性,D项错误。]
6. 利用如图装置,可以模拟铁的电化学防护,减缓铁的腐蚀。
(1)若开关K置于N处,则X应为____________________,该电化学防护法为__________________________。
(2)若开关K置于M处,则X应为____________________________,该电化学防护法称为________________________。
[答案] (1)碳棒或Pt等惰性电极 外加电流法
(2)比铁活泼的金属如Zn等 牺牲阳极法
真题感悟·明确考向
04
1.(2022·广东选择性考试,T10)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中( )
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
1
3
2
4
C [阴极发生得电子的还原反应,Mg在阳极失电子生成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据得失电子守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。]
1
3
2
4
2.(2022·北京等级考,T4)利用下图装置进行铁上电镀铜的实验探究。
1
3
2
4
序号 电解质溶液 实验现象
① 0.1 mol/L CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol/L CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
下列说法不正确的是( )
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+===Fe2++H2↑、Fe+Cu2+===Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)
减少,Cu2++4NH3 [Cu(NH3)4]2+平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)
比①中溶液的小,Cu缓慢析出,镀层更致密
1
3
2
4
C [C项,阴极析出Cu,阳极溶解Cu,析出和溶解的Cu的量相同,②中c(Cu2+)不变,C错误。]
1
3
2
4
3.(2022·海南等级考,T9)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如下。
下列有关说法正确的是( )
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
1
3
2
4
A [由图可知,N2→NH3,发生还原反应,b为阴极,a为阳极。]
1
3
2
4
2
3
4
1
A.a为电源负极
B.溶液中Q的物质的量保持不变
C.CO2在M极被还原
D.分离出的CO2从出口2排出
2
3
4
1
5
2
3
4
1
谢谢观看 THANK YOU!
第34讲 电解池 金属的腐蚀与防护(基础课)
第四部分 化学反应原理
第六章 化学反应与能量
1.理解电解池的构成、工作原理及应用,能书写电极反应式和总反应方程式。 2.了解电解原理在氯碱工业、精炼铜、电镀、电冶金等方面的应用。 3.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。
知识点一 电解原理及其规律
必备知识梳理
关键能力训练
01
1.电解
使______通过电解质溶液(或熔融电解质)而在阴极、阳极引起______________的过程。
电流
氧化还原反应
2.电解池及其工作原理
(1)电解池:将______直接转化为________的装置。
(2)电解池的组成和工作原理(惰性电极电解CuCl2溶液)
总反应的离子方程式:_______________________________。
电能
化学能
(3)放电顺序(一般情况下)
①阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
②阳极:__________>S2->I->Br->Cl->OH->含氧酸根离子>F-。
活性电极
①活性电极指的是除去Au、Pt以外的金属电极,惰性电极指的是Pt、Au、C电极,不参与电极反应。
②阴极材料若为金属电极,一般是为增强导电性,但不参与反应。
3.以惰性电极电解水溶液的有关规律
(1)电解水型——含氧酸、强碱、活泼金属含氧酸盐
①阴极反应式为_________________________,阳极反应式为__________________________________,
总方程式为2H2O 2H2↑+O2↑。
②电解质浓度变____,pH可能变大、变小或不变,可加_______复原。
4H++4e-===2H2↑
4OH--4e-===2H2O+O2↑
大
H2O
(2)电解电解质型——无氧酸(如HCl),不活泼金属无氧酸盐(如CuCl2),电解质浓度变____,加电解质本身复原。
(3)放H2生碱型——活泼金属的无氧酸盐(如NaCl)
①阴极反应式为____________________________,阳极反应式为__________________,总方程式为_______________________________
_______________。
②溶液pH变____,加_______复原。
小
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
+2OH-
大
HCl
(4)放O2生酸型——不活泼金属的含氧酸盐(如CuSO4)
①阴极反应式为_________________________,阳极反应式为________________________________,总方程式为___________________________________。
②溶液pH变____,加_____________________________复原。
2Cu2++4e-===2Cu
2H2O-4e-===O2↑+4H+
小
CuO(金属氧化物)或CuCO3
水电离出的H+或OH-放电,一般电极反应式为2H2O+2e-===H2↑+2OH-或2H2O-4e-===O2↑+4H+。
1.判断正误(正确的打“√”,错误的打“×”)
(1)电解质溶液的导电过程就是电解质溶液被电解的过程。( )
(2)某些不能自发进行的氧化还原反应,通过电解可以实现。( )
(3)电解池中的电子流向:电源负极→阴极→电解质溶液→阳极→电源正极。( )
(4)用Cu作电极电解CuSO4溶液的阳极反应为2H2O-4e-===O2↑+4H+。( )
(5)用惰性电极电解NaCl和NaBr的混合液,阳极上的放电顺序为Br-、Cl-、OH-。( )
[答案] (1)√ (2)√ (3)× (4)× (5)√
2.按要求书写电极反应式和总反应方程式:
(1)用惰性电极电解MgCl2溶液
阳极反应式:_______________________;
阴极反应式:_______________________;
总反应离子方程式:_________________。
(2)用惰性电极电解AgNO3溶液
阴极反应式:____________________________
阳极反应式:____________________________
总反应离子方程式:______________________。
(3)某水溶液中含有等物质的量浓度的Cu(NO3)2和NaCl,以惰性电极对该溶液进行电解,分阶段写出电解反应的离子方程式:
___________________________________________________________、
___________________________________________________________、
___________________________________________________________。
1.用如图所示装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中各项所列对应关系均正确的一项是( )
选项 X极 实验前U形 管中液体 通电后现 象及结论 恢复原溶液
所加物质
A 正极 Na2SO4溶液 U形管两端滴入酚酞后,a管中呈红色 H2O
B 正极 AgNO3溶液 a管中电极反应式是4OH--4e-===O2↑+2H2O AgOH
C 负极 CuCl2溶液 b管中有气体逸出 CuCl2
D 负极 NaOH溶液 溶液pH降低 H2O
C [A项,a管电极附近生成H+,呈酸性,错误;B项,AgNO3溶液电解可用Ag2O复原,错误;D项,电解水使c(NaOH)增大,pH增大,错误。]
2.采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )
A.阳极反应为2H2O-4e-===4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
D [根据题给电解装置图可知,电解池右侧O2参加反应生成H2O2,a极为阳极,b极为阴极。 电解时,阳极的电极反应式为2H2O-4e-===4H++O2↑,阴极的电极反应式为4H++2O2+4e-===2H2O2,A正确;根据电极反应式及得失电子守恒可知,阳极生成的H+通过质子交换膜进入阴极区最终转化为H2O2,阳极区H+的物质的量浓度不发生变化,pH不变,B、C正确;设电解时转移电子为4 mol,则阳极生成1 mol O2,阴极消耗2 mol O2,D错误。]
3. (2022·武汉模拟)如图所示,在一定电压下用惰性电极电解由等物质的量浓度的FeCl2、HCl组成的混合溶液。已知在此电压下,阴、阳离子根据放电能力顺序,都可能在阳极放电,下列分析正确的是( )
A.C1电极上的电极反应式为2H2O+2e-===2OH-+H2↑
B.C1电极处溶液首先变黄色
C.C2电极上可依次发生的电极反应为Fe2+-e-===Fe3+、
2Cl--2e-===Cl2↑
D.当C1电极上有2 g物质生成时,就会有2NA个
电子通过溶液发生转移(NA表示阿伏加德罗常数的值)
C [C1电极与电源的负极相连,作阴极,溶液中的H+在阴极放电,电极反应式为2H++2e-===H2↑,A错误;C1电极上H+放电生成H2,C2电极与电源的正极相连,作阳极,Fe2+的还原性强于Cl-,则依次发生的电极反应为Fe2+-e-===Fe3+、2Cl--2e-===Cl2↑,故C2电极处溶液首先变黄色,B错误,C正确;电子只能通过导线传递,不能通过溶液传递,D错误。]
知识点二 电解原理的应用
02
必备知识梳理
关键能力训练
1.电解饱和食盐水——氯碱工业
(1)电极反应
阳极:__________________________(______反应)。
阴极:__________________________________(______反应)。
检验阳极产物的方法:用湿润的淀粉 KI试纸靠近阳极附近,若试纸变蓝,证明生成了Cl2。
电解时向食盐水中加酚酞,____极附近溶液变红,说明该电极附近产生的物质为_________。
2Cl--2e-===Cl2↑
氧化
2H2O+2e-===H2↑+2OH-
还原
阴
NaOH
(2)电解饱和食盐水的化学方程式和离子方程式
①2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
②______________________________________。
(3)阳离子交换膜法电解饱和食盐水示意图
①阳离子交换膜的作用
阻止________进入阳极室与Cl2发生反应:________________________
_____________________,阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
OH-
2NaOH+Cl2===NaCl+
NaClO+H2O
②a、b、c、d加入或取出的物质分别是________________、_______________、____________、_______________;X、Y分别是______、_____。
精制饱和食盐水
稀NaOH溶液
稀的食盐水
浓NaOH溶液
Cl2
H2
2.电镀和电解精炼铜
电镀(Fe表 面镀Cu) 电解精炼铜
阳 极 电极材料 镀层金属铜 ______(含Zn、Fe、Ni、Ag、Au等杂质)
电极反应 _______________________ _______________________、
Fe-2e-===Fe2+、
Ni-2e-===Ni2+、
Cu-2e-===Cu2+(主要)
粗铜
Cu-2e-===Cu2+
Zn-2e-===Zn2+
阴 极 电极材料 ____________ ______
电极反应 _______________________ 电解质溶液 含________的盐溶液 注:电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成________ 待镀金属铁
纯铜
Cu2++2e-===Cu
Cu2+
阳极泥
3.电冶金——活泼金属的冶炼方法
(1)电解熔融氯化钠得到钠
2Cl--2e-===Cl2↑
2Na++2e-===2Na
(2)电解熔融Al2O3制Al
电极反应:
阳极:___________________________
阴极:__________________________
冰晶石的作用是作Al2O3的助熔剂。
6O2--12e-===3O2↑
4Al3++12e-===4Al
4.电解在有机合成中的应用
以丙烯腈合成己二腈为例,两极反应式如下:
2CH2===CHCN+2H++2e-===NC(CH2)4CN
电解原理的一般应用
1. 利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
D [氯碱工业中阳极是Cl-放电生成Cl2,A错误;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,溶液中Cu2+浓度变小,B错误;铁片上镀铜时,阴极应该是铁片,阳极是纯铜,C错误。]
2.(2022·石家庄模拟)金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+
B.电解过程中,阳极质量的减少量与阴极质量的增加量相等
C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中有Cu和Pt
D [电解时,阳极Zn、Fe、Ni失去电子,发生氧化反应,A项错误;因氧化性Ni2+>Fe2+>Zn2+,故阴极反应式为Ni2++2e-===Ni,可见,阳极质量减少是因为Zn、Fe、Ni溶解,而阴极质量增加是因为Ni析出,B项错误;电解后溶液中的阳离子除Fe2+和Zn2+外,还有Ni2+和H+,C项错误。]
电解原理在实际中的创新应用
3.(2022·济南模拟)在直流电源作用下,双极膜中间层中的H2O解离为H+和OH-,利用双极膜电解池产生的强氧化性羟基自由基(·OH)处理含苯酚废水和含SO2的烟气的工作原理如图所示。下列说法错误的是( )
A.N电极为阴极,发生还原反应
B.阴极电极反应式为O2+2e-+2H+===2·OH
C.每处理9.4 g苯酚,理论上有2.8 mol H+透过膜a
D.若·OH只与苯酚和SO2反应,则参加反应的苯酚和SO2物质的量之比为1∶14
AC [M极上O2得电子生成羟基自由基(·OH),电极反应为O2+2e-+2H+===2·OH,则M极为阴极,连接电源的负极,膜b允许H+透过进入阴极区,M极上产生的羟基自由基将苯酚氧化成CO2;N极为阳极,其电极反应为OH--e-===·OH,则膜a允许OH-透过进入阳极区,N极上产生的羟基自由基将SO2氧化为硫酸根离子。N为阳极发生氧化反应,A错误;1 mol 苯酚转化为CO2,失去28 mol电子,则每处理9.4 g(0.1 mol)苯酚,理论上有2.8 mol H+透过膜b,C项错误。]
4.(2022·海淀区模拟)电解制备H2O2,装置示意图如图所示。
(1)a极的电极反应式为________________________________________。
(2)通过管道将b极产生的气体送至a极,目的是___________________。
(3)pH过高时H2O2会分解。但电解一段时间后,a极附近溶液的pH基本不变,原因是______________________________________________。
[答案] (1)O2+2H2O+2e-===H2O2+2OH- (2)将b极产生的氧气循环利用,用于制备H2O2 (3)反应转移2 mol电子时,即阴极产生2 mol OH-的同时,阳极反应产生2 mol H+并通过质子交换膜移至阴极室,与OH-发生中和反应
5.如图所示是电解法合成氨反应装置示意图。
则b极为________(填“阴”或“阳”)极,a极的电极反应式为__________________________,电解装置中质子交换膜的作用为_____________________________________________________________
____________________;
若b极产生的O2在一定条件下的体积为336 L,a极中通入相同条件下N2的总体积为672 L,则N2的转化率为________%(保留两位有效数字)。
[解析] b极上H2O转化为O2,发生氧化反应,则b极为阳极;a极上N2转化为NH3,发生还原反应,则a极为阴极,其电极反应式为N2+6e-+6H+===2NH3;质子交换膜只允许H+通过,电解过程中a极上消耗H+,b极上生成H+,因此质子交换膜的作用是为质子的迁移和输送提供通道,并阻隔阴阳极产物接触;b极的电极反应式为2H2O-4e-===O2↑+4H+,根据各电极上通过电量相等,可得关系式:2N2~3O2,则相同条件下,生成的O2和消耗的N2的体积比为3∶2,因此若b极产生O2 336 L,则a极消耗N2 224 L,而通入的N2为672 L,因此N2的转化率为 ×100%≈33%。
[答案] 阳 N2+6e-+6H+===2NH3 质子交换膜为质子的迁移和输送提供通道,并阻隔阴阳极产物接触 33
知识点三 金属的腐蚀与防护
03
必备知识梳理
关键能力训练
1.金属的腐蚀及分类
(1)金属腐蚀:金属或合金与周围的气体或液体发生__________反应而引起损耗的现象。其本质是M-ne-===Mn+。
氧化还原
(2)分类
①化学腐蚀:金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应而引起的腐蚀。如钢材在高温下容易被氧化,表面生成由FeO、Fe2O3、Fe3O4组成的一层氧化物。
②电化学腐蚀:当不纯的金属与电解质溶液接触时会发生________反应,__________的金属发生氧化反应而被腐蚀。比化学腐蚀更普遍、速率更快。
原电池
比较活泼
2.电化学腐蚀的分类
以钢铁腐蚀为例进行分析
类型 析氢腐蚀 吸氧腐蚀
条件 水膜____性较____(pH≤_____),如NH4Cl溶液 水膜酸性很____或呈____性,如NaCl溶液
酸
强
4.3
弱
中
电极材料及反应 负 极 Fe:_______________________ 正 极 C:_____________________ C:________________________________
Fe-2e-===Fe2+
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
总反 应式 _______________________ ________________________________
联系 __________更普遍 Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
吸氧腐蚀
铁锈的主要成分为Fe2O3·xH2O,其形成过程所涉及的反应为4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O。
3.电化学腐蚀的实验探究(如图所示)
(1)若棉团浸有NH4Cl溶液,铁钉发生______腐蚀,正极反应式为________________________,右侧试管中现象是____________。
(2)若棉团浸有NaCl溶液,铁钉发生______腐蚀,正极反应式为________________________________,右侧试管中现象是________________。
析氢
2H++2e-===H2↑
有气泡冒出
吸氧
O2+4e-+2H2O===4OH-
导管内液面上升
4.金属的防护
(1)改变金属材料的组成。在金属中添加其他金属或非金属可以制成性能优异的合金。
(2)在金属表面覆盖保护层
①在钢铁制品的表面喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等。
②用电镀等方法在钢铁表面镀上一层Zn、Sn、Cr、Ni等金属,如白铁皮(镀Zn)、马口铁(镀Sn)。
③用化学方法在钢铁部件表面进行发蓝处理(生成一层致密的Fe3O4薄膜)。
④利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化。
(3)电化学保护法
①牺牲阳极法—________原理
a.______:比被保护金属活泼的金属;
b. ______:被保护的金属设备。
原电池
负极
正极
②外加电流法—______原理
通电后,调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流________________,从而得到保护。
a.______:被保护的金属设备;
b.______:惰性金属。
电解
降至零或接近零
阴极
阳极
(4)实验探究
为验证牺牲阳极法,如图所示:
①Fe作____极,电极反应式为________________________。
②Zn作负极,电极反应式为_______________________。
正
2H++2e-===H2↑
Zn-2e-===Zn2+
③Fe电极附近滴加K3[Fe(CN)6]溶液,溶液中是否有蓝色沉淀生成?____,说明_____被保护。
④若将Zn改为Cu,则Fe电极附近滴加K3[Fe(CN)6]溶液,现象为____________________,说明_____被保护。此现象的离子方程式为________________________________________________________。
否
Fe
溶液中生成蓝色沉淀
Cu
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓
判断正误(正确的打“√”,错误的打“×”)
(1)纯银器表面变黑和钢铁表面生锈腐蚀原理一样。( )
(2)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物。( )
(3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+。( )
(4)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用。( )
(5)为了保护船体,在船体表面嵌入锌块,利用了牺牲阳极保护法。( )
[答案] (1)× (2)× (3)× (4)× (5)√
金属的腐蚀与防护
1.下列与金属腐蚀有关的说法正确的是( )
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁输水管的腐蚀,镁块相当于原电池的正极
C [浓硫酸从环境中吸收水分,使铁钉周围的空气比较干燥,因此铁钉不易腐蚀,A项错误;Fe、Cu与酸化的3% NaCl溶液构成原电池,Fe作负极,发生失去电子的氧化反应,有Fe2+生成,因此滴加少量K3[Fe(CN)6]溶液,有蓝色沉淀出现,B项错误;燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀,C项正确;用牺牲镁块的方法来防止地下钢铁输水管的腐蚀,镁块相当于原电池的负极,D项错误。]
2. (2022·佛山模拟)如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法不正确的是( )
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-===4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
C [AB段作原电池正极,BC段为原电池负极。BC段电极反应为Fe-2e-===Fe2+,AB段电极反应为O2+2H2O+4e-===4OH-,BC段溶解而被腐蚀,AB段形成铁锈。C项不正确。]
3. 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应为Zn2++2e-===Zn
D.通电时为外加电流法,断电时为牺牲阳极法
C [断电时,锌作负极,反应式为Zn-2e-===Zn2+,保护铁不被腐蚀,C项错误。]
4.如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为________(填序号)。
[解析] ②③④是原电池,⑤⑥是电解池,金属被腐蚀由快到慢的顺序:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
[答案] ⑤④②①③⑥
(1)判断析氢腐蚀与吸氧腐蚀的依据:对于金属活动顺序表氢元素前的金属,酸性发生析氢腐蚀,中性或碱性发生吸氧腐蚀;对于氢元素后的金属只能发生吸氧腐蚀。
(2)对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
金属的腐蚀与防护实验探究
5.(2022·武汉模拟)验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① ② ③
在Fe表面生成蓝色沉淀 试管内无明显变化 试管内生成蓝色沉淀
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
D [②中Zn作负极,发生氧化反应生成Zn2+,Fe作正极被保护,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,试管内无明显变化。但③中没有Zn保护Fe,Fe在酸性环境中发生析氢腐蚀,Fe作负极被氧化生成Fe2+,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,生成蓝色沉淀,对比②③可知Zn保护了Fe,A项正确;①与②的区别在于前者是将铁氰化钾溶液直接滴入烧杯中,而后者是在取出的少量Fe附近的溶液中滴加铁氰化钾溶液,①中出现了蓝色沉淀,说明有Fe2+生成。对比分析可知,可能是铁氰化钾氧化Fe生成了Fe2+,B项正确;通过上述分析可知,验证Zn保护Fe时不能用①的方法,C项正确;若将Zn换成Cu,铁氰化钾仍会将Fe氧化为Fe2+,在铁的表面同样会生成蓝色沉淀,所以无法判断Fe2+是不是负极产物,即无法判断Fe与Cu的活泼性,D项错误。]
6. 利用如图装置,可以模拟铁的电化学防护,减缓铁的腐蚀。
(1)若开关K置于N处,则X应为____________________,该电化学防护法为__________________________。
(2)若开关K置于M处,则X应为____________________________,该电化学防护法称为________________________。
[答案] (1)碳棒或Pt等惰性电极 外加电流法
(2)比铁活泼的金属如Zn等 牺牲阳极法
真题感悟·明确考向
04
1.(2022·广东选择性考试,T10)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中( )
A.阴极发生的反应为Mg-2e-===Mg2+
B.阴极上Al被氧化
C.在电解槽底部产生含Cu的阳极泥
D.阳极和阴极的质量变化相等
1
3
2
4
C [阴极发生得电子的还原反应,Mg在阳极失电子生成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据得失电子守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。]
1
3
2
4
2.(2022·北京等级考,T4)利用下图装置进行铁上电镀铜的实验探究。
1
3
2
4
序号 电解质溶液 实验现象
① 0.1 mol/L CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol/L CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
下列说法不正确的是( )
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+===Fe2++H2↑、Fe+Cu2+===Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)
减少,Cu2++4NH3 [Cu(NH3)4]2+平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)
比①中溶液的小,Cu缓慢析出,镀层更致密
1
3
2
4
C [C项,阴极析出Cu,阳极溶解Cu,析出和溶解的Cu的量相同,②中c(Cu2+)不变,C错误。]
1
3
2
4
3.(2022·海南等级考,T9)一种采用H2O(g)和N2(g)为原料制备NH3(g)的装置示意图如下。
下列有关说法正确的是( )
A.在b电极上,N2被还原
B.金属Ag可作为a电极的材料
C.改变工作电源电压,反应速率不变
D.电解过程中,固体氧化物电解质中O2-不断减少
1
3
2
4
A [由图可知,N2→NH3,发生还原反应,b为阴极,a为阳极。]
1
3
2
4
2
3
4
1
A.a为电源负极
B.溶液中Q的物质的量保持不变
C.CO2在M极被还原
D.分离出的CO2从出口2排出
2
3
4
1
5
2
3
4
1
谢谢观看 THANK YOU!
同课章节目录
