第33讲 新型化学电源的分类突破(能力课)(共42张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第33讲 新型化学电源的分类突破(能力课)(共42张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 20:20:30 | ||
图片预览










文档简介
(共42张PPT)
第33讲 新型化学电源的分类突破
(能力课)
第四部分 化学反应原理
第六章 化学反应与能量
1.了解新型燃料电池和二次电池的电极判断、电极反应、电子和离子的移动方向等。 2.了解协同电池和浓度差电池的原理及有关反应式书写等。
考点一 新型燃料电池与二次电池
核心知能突破
关键能力训练
01
1.新型燃料电池——微生物燃料电池
微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。在负极室厌氧环境下,有机物在微生物作用下分解并释放出电子和质子,电子依靠合适的电子传递介体在生物组分和负极之间进行有效传递,并通过外电路传递到正极形成电流,而质子通过质子交换膜传递到正极,氧化剂(一般为氧气)在正极得到电子被还原再与质子结合成水。
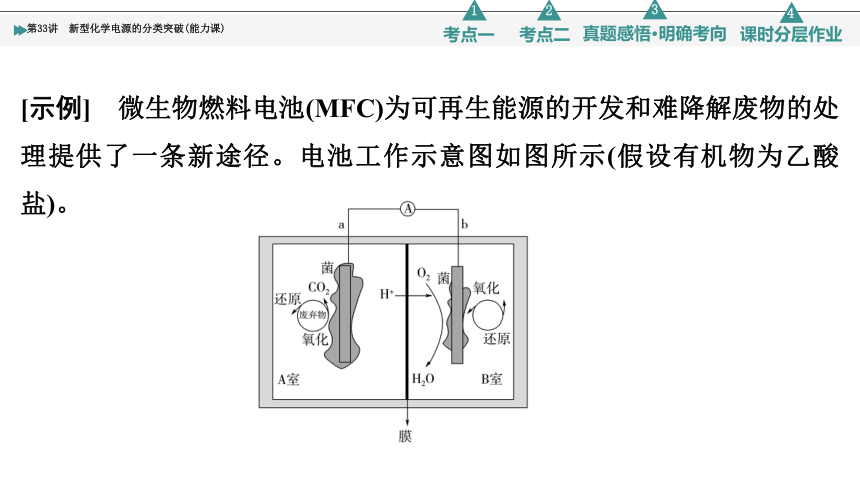
[示例] 微生物燃料电池(MFC)为可再生能源的开发和难降解废物的处理提供了一条新途径。电池工作示意图如图所示(假设有机物为乙酸盐)。
①a极为负极:CH3COO--8e-+2H2O===2CO2↑+7H+
②b极为正极:O2+4H++4e-===2H2O
③总反应为CH3COO-+2O2+H+===2CO2↑+2H2O
2.新型二次电池
[示例] 如图是一种最新研制的聚合物锂电池,a极为含有Li、Co、Ni、Mn、O等元素组成的混盐,电解质为一种能传导Li+的高分子复合材料,b极为镶嵌金属锂的石墨烯材料,反应原理为LixC6+Li3-xNiCoMnO6 C6+Li3NiCoMnO6。
①放电
b为负极:LixC6-xe-===xLi++C6;
a为正极:Li3-xNiCoMnO6+xe-+xLi+===Li3NiCoMnO6。
②充电
b为阴极:xLi++C6+xe-===LixC6,
a为阳极:Li3NiCoMnO6-xe-===Li3-xNiCoMnO6+xLi+。
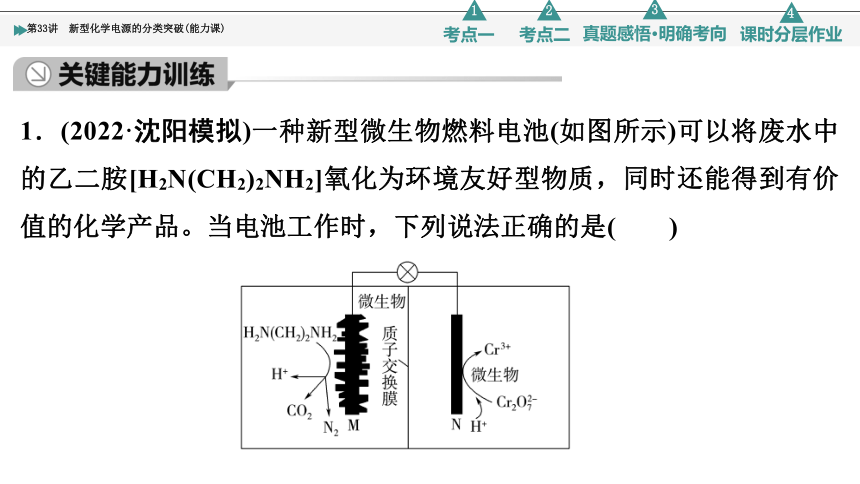
1.(2022·沈阳模拟)一种新型微生物燃料电池(如图所示)可以将废水中的乙二胺[H2N(CH2)2NH2]氧化为环境友好型物质,同时还能得到有价值的化学产品。当电池工作时,下列说法正确的是( )
A.M极电势高于N极电势
B.电池工作一段时间后,正极区溶液的pH减小
C.M极的电极反应式:H2N(CH2)2NH2+4H2O-16e-===2CO2↑+N2↑+16H+
D.理论上,当有90 g H2N(CH2)2NH2参加反应时,得到4 mol Cr3+
C [由装置图可知,N极上发生还原反应,则N极为正极,M极为负极,故N极电势高于M极电势,A项错误;正极反应式为Cr2O +14H++6e-===2Cr3++7H2O,当转移6 mol电子时,有6 mol H+通过质子交换膜从负极区进入正极区,但正极区反应消耗14 mol H+,故正极区H+浓度降低,即pH增大,B项错误;M极是负极,H2N(CH2)2NH2发生氧化反应,电极反应式为H2N(CH2)2NH2+4H2O-16e-===2CO2↑+N2↑+16H+,C项正确;90 g H2N(CH2)2NH2的物质的量为1.5 mol,根据转移电子数相等可得关系式:3H2N(CH2)2NH2~48e-~16Cr3+,故理论上应得到8 mol Cr3+,D项错误。]
2.(2022·济南模拟)钠 硫电池作为一种新型化学电源,具有体积小、容量大、寿命长、效率高等重要优点,其结构与工作原理如图所示。下列说法正确的是( )
A.β Al2O3作用为隔膜,只允许阳离子通过
B.放电过程中,B极的电极反应式:xS+2e-+2Na+===Na2Sx
C.线路Ⅰ是充电过程中粒子移动的方向
D.充电过程中,外电路中流过0.01 mol 电子,负极材料增重0.23 g
BD [由图可知,β Al2O3不是隔膜,是固体电解质,起导电作用,A错误;放电过程中,B极作正极得电子,电极反应式为xS+2e-+2Na+===Na2Sx,B正确;充电过程中,Na+移向阴极,即线路Ⅱ是充电过程中粒子移动的方向,C错误;充电过程中,外电路中流过0.01 mol电子,有0.01 mol钠离子转化成钠单质,所以负极材料增重0.23 g,D正确。]
3.(2022·邢台模拟)复旦大学研究团队研究PTO和PTO 2H之间的可逆转化;二氧化锰在石墨毡上可逆的沉积和溶解,储存、释放电解液中的水合氢离子;设计出能在-70℃工作的电池,该电池放电时的总反应为PTO 2H+MnO2+2H3O+===PTO+Mn2++4H2O。下列说法错误的是( )
B.放电时,H3O+移向b电极
C.充电时,阳极反应为Mn2+-2e-+6H2O===MnO2+4H3O+
D.充电时,电路中通过1 mol e-,阳极附近电解质溶液质量减少19 g
D [根据放电时总反应,PTO 2H发生氧化反应,则放电时a电极为负极,电极反应为PTO 2H-2e-+2H2O===PTO+2H3O+,A项正确;放电时,H3O+移向正极(b电极),B项正确;充电时阳极反应与放电时正极反应互逆,故充电时阳极上Mn2+发生氧化反应,转化为MnO2,电极反应为Mn2+-2e-+6H2O===MnO2+4H3O+,C项正确;根据阳极反应,电路中通过1 mol e-,阳极析出0.5 mol MnO2,有1 mol H3O+从阳极向阴极移动,故阳极附近电解质溶液质量减少87 g·mol-1×0.5 mol+19 g·mol-1×1 mol=62.5 g,D项错误。]
考点二 协同电池与浓差电池
02
核心知能突破
关键能力训练
1.协同电池
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
(1)协同电池反应是以具有“电子传递”功能的物质为媒质(催化剂),对反应基质进行间接氧化或还原,从而得到目的产物的反应。
(2)原理:媒质也称为“电对”或“介对”,其首先在电极表面失去(或得到)电子,形成氧化态(或还原态),在电解溶液中进一步氧化(或还原)反应基质,最终生成目的产物。其原理如下所示:
2.浓差电池
浓差电池是利用物质的浓度差产生电势差的一种装置。常见的有两电极材料相同,两池电解质溶质相同浓度不同的浓差电池。
[示例]
①a极:Ag-e-===Ag+(负极);
b极:Ag++e-===Ag(正极)。
②NO 通过交换膜移向a极。
1.(2022·长寿区模拟)我国科学家设计的一种甲酸(HCOOH)燃料电池如图所示(半透膜只允许K+、H+通过),下列说法错误的是( )
A.物质A可以是硫酸氢钾
B.左侧电极为电池负极,HCOO-发生氧化反应生成HCO
C.该燃料电池的总反应为2HCOOH+O2+2OH-===2HCO+2H2O
D.右侧每消耗11.2 L O2(标准状况),
左侧有1 mol K+通过半透膜移向右侧
2.(2022·石家庄模拟)由相同金属电极及其不同浓度的盐溶液组成的电池,称浓差电池,电子由溶液浓度较小的一极经外电路流向浓度较大的一极。如图所示装置中,X电极与Y电极初始质量相等。进行实验时,先闭合K2,断开K1,一段时间后,再断开K2,闭合K1,即可形成浓差电池,电流表指针偏转。下列不正确的是( )
A.充电前,该电池两电极存在电势差
B.放电时,右池中的NO 通过离子交换膜移向左池
C.充电时,当外电路通过0.1 mol电子时,两电极的质量差为21.6 g
D.放电时,电极Y为电池的正极
A [充电前,两电极附近的AgNO3浓度相同,不会产生电势差,充电后,左池Ag+减小,右池Ag+增多,NO 移向右池,使右池的AgNO3浓度大,产生电势差,A错,B、C、D正确。]
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·全国甲卷,T10)一种水性电解液Zn MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH) 存在]。电池放电时,下列叙述错误的是( )
1
3
2
4
1
3
2
4
A [MnO2电极为正极,Zn电极为负极,电池放电时,电解质溶液中阴离子向负极移动,阳离子向正极移动,A项错误;Ⅰ区中的SO 通过隔膜向Ⅱ区迁移,B项正确;MnO2电极为正极,电极反应式为MnO2+2e-+4H+===Mn2++2H2O,C项正确;根据正负两极的电极反应式可得电池总反应,D项正确。]
1
3
2
4
2.(2022·广东选择性考试,T16)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
1
3
2
4
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
1
3
2
4
C [由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时电极反应和充电时相反,则由放电时电极a的反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+可知,NaCl溶液的pH不变,故B错误;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g/mol×2 mol=46 g,故D错误。]
1
3
2
4
3.(2021·福建选择性考试,T9)催化剂TAPP Mn(Ⅱ)的应用,使Li CO2电池的研究取得了新的进展。Li CO2电池结构和该催化剂作用下正极反应可能的历程如图所示。
下列说法错误的是( )
A.Li CO2电池可使用有机电解液
B.充电时,Li+由正极向负极迁移
C.放电时,正极反应为3CO2+4Li++4e-===2Li2CO3+C
D.*LiCO2、*CO、*LiC2O3和C都是正极反应的中间产物
1
3
2
4
D [Li是活泼金属,能与水发生反应,因此不能采用水溶液作为电解质,应使用有机电解液,故A正确;充电时原电池的负极与电源负极相连作阴极,原电池的正极与电源正极相连作阳极,阳离子由阳极向阴极移动,则Li+由正极向负极迁移,故B正确;由装置可知,该原电池的正极为二氧化碳得电子生成C单质,电极反应式为3CO2+4Li++4e-===2Li2CO3+C,故C正确;由正极的反应历程图示可知,C为最终的产物,不是中间产物,故D错误。]
1
3
2
4
4.(2020·全国Ⅰ卷,T12)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
2
3
4
1
D [充电时,正极(接电源正极,作阳极)反应为2H2O-4e-===O2↑+4H+,c(H+)增大,c(OH-)减小,D错误。]
2
3
4
1
利用微生物燃料电池处理某废水的工作原理如图所示。
(1)该电池的正极为________(填“a”或“b”),a电极反应式为__________________________________________________________________________________________。
(2)b极反应式为_____________________________。
(3)当电路中有0.6 mol e-转移时,通过质子交换膜的H+数目为________。
[解析] 根据工作原理图可知a为负极,b为正极。
[答案] (1)b H2S+4H2O-8e-===SO +10H+
(2)O2+4H++4e-===2H2O (3)3.612×1023
谢谢观看 THANK YOU!
第33讲 新型化学电源的分类突破
(能力课)
第四部分 化学反应原理
第六章 化学反应与能量
1.了解新型燃料电池和二次电池的电极判断、电极反应、电子和离子的移动方向等。 2.了解协同电池和浓度差电池的原理及有关反应式书写等。
考点一 新型燃料电池与二次电池
核心知能突破
关键能力训练
01
1.新型燃料电池——微生物燃料电池
微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。在负极室厌氧环境下,有机物在微生物作用下分解并释放出电子和质子,电子依靠合适的电子传递介体在生物组分和负极之间进行有效传递,并通过外电路传递到正极形成电流,而质子通过质子交换膜传递到正极,氧化剂(一般为氧气)在正极得到电子被还原再与质子结合成水。
[示例] 微生物燃料电池(MFC)为可再生能源的开发和难降解废物的处理提供了一条新途径。电池工作示意图如图所示(假设有机物为乙酸盐)。
①a极为负极:CH3COO--8e-+2H2O===2CO2↑+7H+
②b极为正极:O2+4H++4e-===2H2O
③总反应为CH3COO-+2O2+H+===2CO2↑+2H2O
2.新型二次电池
[示例] 如图是一种最新研制的聚合物锂电池,a极为含有Li、Co、Ni、Mn、O等元素组成的混盐,电解质为一种能传导Li+的高分子复合材料,b极为镶嵌金属锂的石墨烯材料,反应原理为LixC6+Li3-xNiCoMnO6 C6+Li3NiCoMnO6。
①放电
b为负极:LixC6-xe-===xLi++C6;
a为正极:Li3-xNiCoMnO6+xe-+xLi+===Li3NiCoMnO6。
②充电
b为阴极:xLi++C6+xe-===LixC6,
a为阳极:Li3NiCoMnO6-xe-===Li3-xNiCoMnO6+xLi+。
1.(2022·沈阳模拟)一种新型微生物燃料电池(如图所示)可以将废水中的乙二胺[H2N(CH2)2NH2]氧化为环境友好型物质,同时还能得到有价值的化学产品。当电池工作时,下列说法正确的是( )
A.M极电势高于N极电势
B.电池工作一段时间后,正极区溶液的pH减小
C.M极的电极反应式:H2N(CH2)2NH2+4H2O-16e-===2CO2↑+N2↑+16H+
D.理论上,当有90 g H2N(CH2)2NH2参加反应时,得到4 mol Cr3+
C [由装置图可知,N极上发生还原反应,则N极为正极,M极为负极,故N极电势高于M极电势,A项错误;正极反应式为Cr2O +14H++6e-===2Cr3++7H2O,当转移6 mol电子时,有6 mol H+通过质子交换膜从负极区进入正极区,但正极区反应消耗14 mol H+,故正极区H+浓度降低,即pH增大,B项错误;M极是负极,H2N(CH2)2NH2发生氧化反应,电极反应式为H2N(CH2)2NH2+4H2O-16e-===2CO2↑+N2↑+16H+,C项正确;90 g H2N(CH2)2NH2的物质的量为1.5 mol,根据转移电子数相等可得关系式:3H2N(CH2)2NH2~48e-~16Cr3+,故理论上应得到8 mol Cr3+,D项错误。]
2.(2022·济南模拟)钠 硫电池作为一种新型化学电源,具有体积小、容量大、寿命长、效率高等重要优点,其结构与工作原理如图所示。下列说法正确的是( )
A.β Al2O3作用为隔膜,只允许阳离子通过
B.放电过程中,B极的电极反应式:xS+2e-+2Na+===Na2Sx
C.线路Ⅰ是充电过程中粒子移动的方向
D.充电过程中,外电路中流过0.01 mol 电子,负极材料增重0.23 g
BD [由图可知,β Al2O3不是隔膜,是固体电解质,起导电作用,A错误;放电过程中,B极作正极得电子,电极反应式为xS+2e-+2Na+===Na2Sx,B正确;充电过程中,Na+移向阴极,即线路Ⅱ是充电过程中粒子移动的方向,C错误;充电过程中,外电路中流过0.01 mol电子,有0.01 mol钠离子转化成钠单质,所以负极材料增重0.23 g,D正确。]
3.(2022·邢台模拟)复旦大学研究团队研究PTO和PTO 2H之间的可逆转化;二氧化锰在石墨毡上可逆的沉积和溶解,储存、释放电解液中的水合氢离子;设计出能在-70℃工作的电池,该电池放电时的总反应为PTO 2H+MnO2+2H3O+===PTO+Mn2++4H2O。下列说法错误的是( )
B.放电时,H3O+移向b电极
C.充电时,阳极反应为Mn2+-2e-+6H2O===MnO2+4H3O+
D.充电时,电路中通过1 mol e-,阳极附近电解质溶液质量减少19 g
D [根据放电时总反应,PTO 2H发生氧化反应,则放电时a电极为负极,电极反应为PTO 2H-2e-+2H2O===PTO+2H3O+,A项正确;放电时,H3O+移向正极(b电极),B项正确;充电时阳极反应与放电时正极反应互逆,故充电时阳极上Mn2+发生氧化反应,转化为MnO2,电极反应为Mn2+-2e-+6H2O===MnO2+4H3O+,C项正确;根据阳极反应,电路中通过1 mol e-,阳极析出0.5 mol MnO2,有1 mol H3O+从阳极向阴极移动,故阳极附近电解质溶液质量减少87 g·mol-1×0.5 mol+19 g·mol-1×1 mol=62.5 g,D项错误。]
考点二 协同电池与浓差电池
02
核心知能突破
关键能力训练
1.协同电池
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
(1)协同电池反应是以具有“电子传递”功能的物质为媒质(催化剂),对反应基质进行间接氧化或还原,从而得到目的产物的反应。
(2)原理:媒质也称为“电对”或“介对”,其首先在电极表面失去(或得到)电子,形成氧化态(或还原态),在电解溶液中进一步氧化(或还原)反应基质,最终生成目的产物。其原理如下所示:
2.浓差电池
浓差电池是利用物质的浓度差产生电势差的一种装置。常见的有两电极材料相同,两池电解质溶质相同浓度不同的浓差电池。
[示例]
①a极:Ag-e-===Ag+(负极);
b极:Ag++e-===Ag(正极)。
②NO 通过交换膜移向a极。
1.(2022·长寿区模拟)我国科学家设计的一种甲酸(HCOOH)燃料电池如图所示(半透膜只允许K+、H+通过),下列说法错误的是( )
A.物质A可以是硫酸氢钾
B.左侧电极为电池负极,HCOO-发生氧化反应生成HCO
C.该燃料电池的总反应为2HCOOH+O2+2OH-===2HCO+2H2O
D.右侧每消耗11.2 L O2(标准状况),
左侧有1 mol K+通过半透膜移向右侧
2.(2022·石家庄模拟)由相同金属电极及其不同浓度的盐溶液组成的电池,称浓差电池,电子由溶液浓度较小的一极经外电路流向浓度较大的一极。如图所示装置中,X电极与Y电极初始质量相等。进行实验时,先闭合K2,断开K1,一段时间后,再断开K2,闭合K1,即可形成浓差电池,电流表指针偏转。下列不正确的是( )
A.充电前,该电池两电极存在电势差
B.放电时,右池中的NO 通过离子交换膜移向左池
C.充电时,当外电路通过0.1 mol电子时,两电极的质量差为21.6 g
D.放电时,电极Y为电池的正极
A [充电前,两电极附近的AgNO3浓度相同,不会产生电势差,充电后,左池Ag+减小,右池Ag+增多,NO 移向右池,使右池的AgNO3浓度大,产生电势差,A错,B、C、D正确。]
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·全国甲卷,T10)一种水性电解液Zn MnO2离子选择双隔膜电池如图所示[KOH溶液中,Zn2+以Zn(OH) 存在]。电池放电时,下列叙述错误的是( )
1
3
2
4
1
3
2
4
A [MnO2电极为正极,Zn电极为负极,电池放电时,电解质溶液中阴离子向负极移动,阳离子向正极移动,A项错误;Ⅰ区中的SO 通过隔膜向Ⅱ区迁移,B项正确;MnO2电极为正极,电极反应式为MnO2+2e-+4H+===Mn2++2H2O,C项正确;根据正负两极的电极反应式可得电池总反应,D项正确。]
1
3
2
4
2.(2022·广东选择性考试,T16)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为:NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
1
3
2
4
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
1
3
2
4
C [由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时电极反应和充电时相反,则由放电时电极a的反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+可知,NaCl溶液的pH不变,故B错误;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g/mol×2 mol=46 g,故D错误。]
1
3
2
4
3.(2021·福建选择性考试,T9)催化剂TAPP Mn(Ⅱ)的应用,使Li CO2电池的研究取得了新的进展。Li CO2电池结构和该催化剂作用下正极反应可能的历程如图所示。
下列说法错误的是( )
A.Li CO2电池可使用有机电解液
B.充电时,Li+由正极向负极迁移
C.放电时,正极反应为3CO2+4Li++4e-===2Li2CO3+C
D.*LiCO2、*CO、*LiC2O3和C都是正极反应的中间产物
1
3
2
4
D [Li是活泼金属,能与水发生反应,因此不能采用水溶液作为电解质,应使用有机电解液,故A正确;充电时原电池的负极与电源负极相连作阴极,原电池的正极与电源正极相连作阳极,阳离子由阳极向阴极移动,则Li+由正极向负极迁移,故B正确;由装置可知,该原电池的正极为二氧化碳得电子生成C单质,电极反应式为3CO2+4Li++4e-===2Li2CO3+C,故C正确;由正极的反应历程图示可知,C为最终的产物,不是中间产物,故D错误。]
1
3
2
4
4.(2020·全国Ⅰ卷,T12)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
2
3
4
1
D [充电时,正极(接电源正极,作阳极)反应为2H2O-4e-===O2↑+4H+,c(H+)增大,c(OH-)减小,D错误。]
2
3
4
1
利用微生物燃料电池处理某废水的工作原理如图所示。
(1)该电池的正极为________(填“a”或“b”),a电极反应式为__________________________________________________________________________________________。
(2)b极反应式为_____________________________。
(3)当电路中有0.6 mol e-转移时,通过质子交换膜的H+数目为________。
[解析] 根据工作原理图可知a为负极,b为正极。
[答案] (1)b H2S+4H2O-8e-===SO +10H+
(2)O2+4H++4e-===2H2O (3)3.612×1023
谢谢观看 THANK YOU!
同课章节目录
