第35讲 多池串联与“隔膜”电化学装置(能力课)(共52张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第35讲 多池串联与“隔膜”电化学装置(能力课)(共52张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 20:23:45 | ||
图片预览







文档简介
(共52张PPT)
第35讲 多池串联与“隔膜”电化学装置(能力课)
第四部分 化学反应原理
第六章 化学反应与能量
1.了解多电池串联装置的工作原理与分析。 2.了解含隔膜的电化学装置的原理及应用。
考点一 多池串联的电化学装置分析
核心知能突破
关键能力训练
01
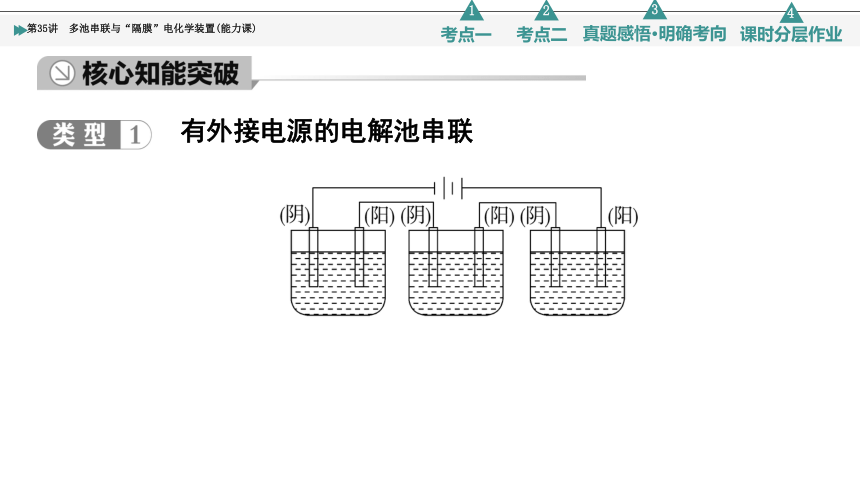
有外接电源的电解池串联
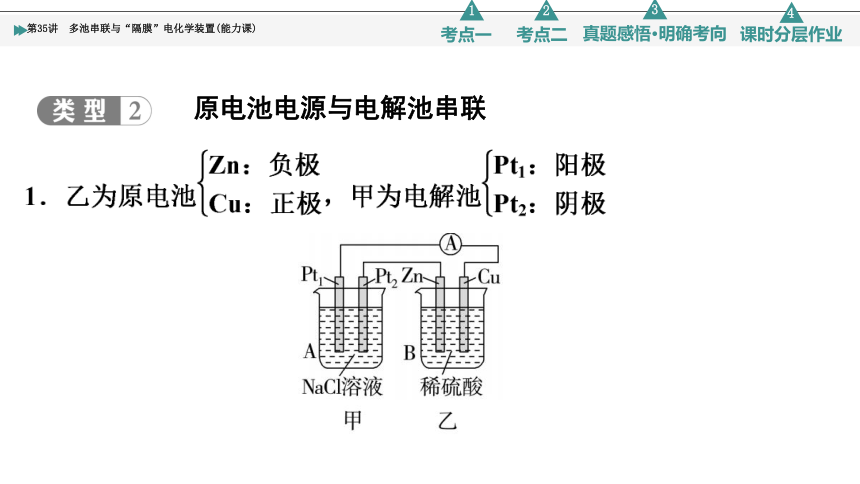
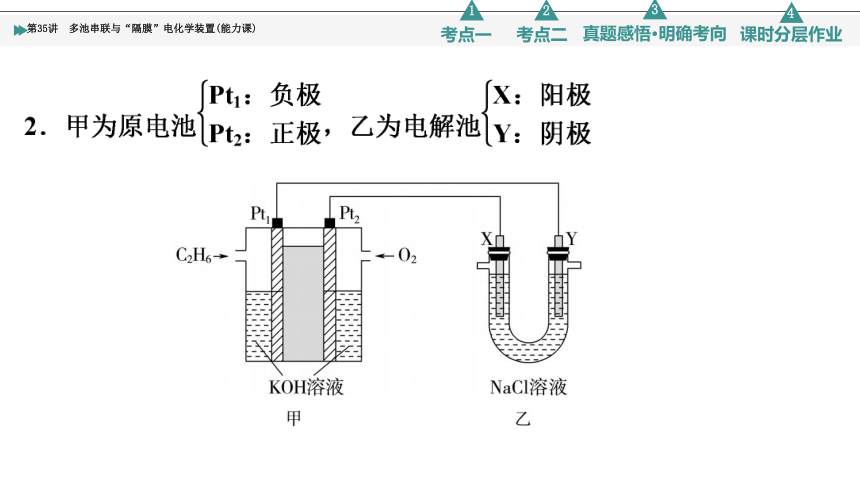
原电池电源与电解池串联
有外接电源的电解池串联
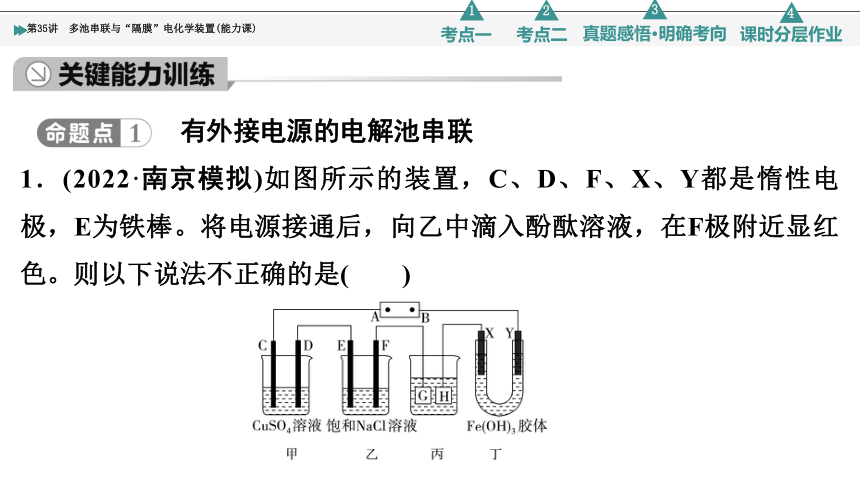
1.(2022·南京模拟)如图所示的装置,C、D、F、X、Y都是惰性电极,E为铁棒。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是( )
A.电源B极是负极
B.欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液
C.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶2
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
C [电解滴入酚酞的饱和氯化钠溶液时,阴极上氢离子放电,导致阴极附近显碱性,所以阴极附近溶液显红色,在F极附近显红色,所以F极是阴极,则B极是负极,A正确;电镀时,镀层金属作阳极,镀件作阴极,电解质溶液中金属阳离子和阳极材料是相同元素,所以欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液,B正确;电解硫酸铜溶液时,E为阳极且Fe作电极,故发生的反应为Fe-2e-===Fe2+,无单质生成,C错误;电解池工作时,溶液中阴离子向阳极移动,阳离子向阴极移动,装置丁中,X极是阳极,Y极是阴极,Y极附近红褐色变深,说明氢氧化铁胶粒向阴极移动,由此证明氢氧化铁胶粒带正电荷,D正确。]
原电池与电解池的串联分析
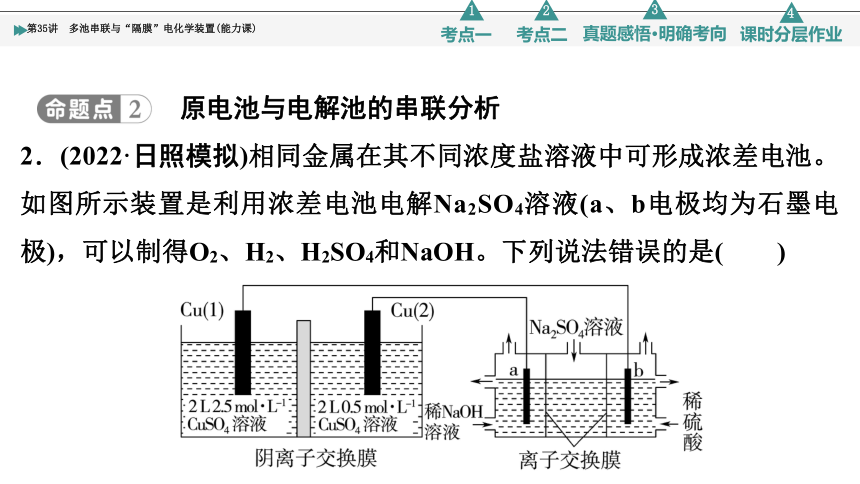
2.(2022·日照模拟)相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法错误的是( )
A.a为电解池的阴极
B.电池放电过程中,Cu(2)电极上的电极反应为Cu-2e-===Cu2+
C.当电路中转移2 mol电子时,1 mol SO 通过离子交换膜向右移动
D.电池从开始工作到停止放电,电解池理论上可制得120 g NaOH
D [电池放电过程中,Cu(2)的电极反应为Cu-2e-===Cu2+,Cu(1)的电极反应为Cu2++2e-===Cu,反应前原电池左边硫酸铜物质的量为5 mol,右边硫酸铜物质的量为1 mol,电池停止放电时,左右两侧硫酸铜物质的量均为3 mol,因此右侧有2 mol 铜离子生成,转移4 mol 电子,根据阴极反应式可知,转移2 mol电子时得到2 mol NaOH即80 g,因此电池从开始工作到停止放电,电解池理论上可制得160 g NaOH,D错误。]
3.用C3H8、O2和熔融Na2CO3组成的燃料电池作电源,电解饱和的K2S溶液和2 mol·L-1 AgNO3溶液制备某些单质,盐桥中充有饱和的KNO3溶液。下列说法错误的是( )
C [熔融盐电池是燃料电池的一种,左边装置中石墨1电极上进气a生成“x+y”,y再到石墨2处参与反应,则石墨1电极上进的气体为C3H8,发生氧化反应生成CO2和H2O,石墨1为负极,石墨2为正极,石墨3为阳极,石墨4为阴极。盐桥作为电解池的内部结构,NO应移向阳极,即石墨3电极处,C错误。]
考点二 含隔膜的电化学装置分析
02
核心知能突破
关键能力训练
1.隔膜的分类
隔膜(又叫离子交换膜)由特殊高分子材料制成。离子交换膜分四类:
(1)阳离子交换膜,简称阳膜,只允许阳离子通过,即允许H+和其他阳离子通过,不允许阴离子通过。
(2)阴离子交换膜,简称阴膜,只允许阴离子通过,不允许阳离子通过。
(3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。
(4)双极膜,又称双极性膜,是特种离子交换膜,它是由一张阳膜和一张阴膜复合制成的阴、阳复合膜。该膜的特点是在直流电场的作用下,阴、阳膜复合层间的H2O解离成H+和OH-分别通过阴、阳膜,作为H+和OH-的离子源。
2.隔膜的作用
(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。
(2)能选择性地通过离子,起到平衡电荷、形成闭合回路的作用。
3.离子通过隔膜的定量关系
(1)通过隔膜的离子带的电荷数等于电路中电子转移数。
(2)离子迁移:依据电荷守恒,通过隔膜的离子数不一定相等。
双极膜在电渗析中应用广泛,它由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2O解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。如图为NaBr溶液的电渗析装置示意图。下列说法正确的是( )
A.出口2的产物为HBr溶液
B.出口5的产物为稀硫酸
C.Br-可从盐室最终进入阳极液中
D.当阳极产生1 mol气体时,通过阴离子交换膜的Br-为4 mol
[思路点拨]
原理图分析如下:
[答案] D
含离子交换膜电化学装置题的解题步骤
[说明] 原电池中阴(阳)离子通过阴(阳)离子交换膜移向负(正)极,电解池中阴(阳)离子通过阴(阳)离子交换膜移向阳(阴)极。
单膜电化学装置
1.(2022·日照模拟)一种利用烃(CxHy)来消除氮氧化物污染的工作原理如图所示,装置中电极均为惰性电极,两侧电解质溶液为同浓度的盐酸。下列说法错误的是( )
A.通入NO2的电极为正极,发生还原反应
B.若使用的烃为C2H6,该电极反应为C2H6+4H2O-14e-===2CO2+14H+
C.装置中转移0.4 mol电子时,有0.4NA个H+通过质子交换膜
D.装置工作一段时间后,两侧电极室中溶液的pH不变
D [根据电极的物质转化得:左电极为正极,反应式为2NO2+8e-+8H+===N2↑+4H2O,右电极为负极,若使用的烃为C2H6,电极反应为C2H6+4H2O-14e-===2CO2+14H+。左侧生成水,c(HCl)变小,pH变大,D错误。]
2.(2022·邯郸模拟)微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如图所示[其中电源为(CH3)2NNH2-KOH-O2清洁燃料电池]。下列说法正确的是( )
A.氢离子可通过离子交换膜自右室移向左室
B.温度越高,产甲烷效率越高
C.电源放电过程中会产生N2
D.a电极反应为CH3COO--6e-+2H2O===2CO2↑+7H+
C [根据a电极上CH3COO-转化为CO2,C元素化合价升高,发生氧化反应,知a电极为阳极,则b电极为阴极,氢离子通过离子交换膜由阳极室(左室)进入阴极室(右室),A项错误;该装置中有产电菌、产甲烷菌参与,温度过高,微生物的蛋白质变性,产甲烷效率降低,B项错误;根据电源为(CH3)2NNH2-KOH-O2清洁燃料电池,知其放电过程中产生N2,C项正确;a电极反应为CH3COO--8e-+2H2O===2CO2↑+7H+,D项错误。]
多膜电化学装置
3.(2022·大连模拟)一种三室微生物燃料电池污水净化系统的原理如图所示,图中含酚废水中的有机物可用C6H5OH表示。
下列说法不正确的是( )
A.右室电极为该电池的正极
B.右室电极附近溶液的pH增大
C.左侧离子交换膜为阳离子交换膜
D.左室电极反应式可表示为C6H5OH+11H2O-28e-===6CO2↑+28H+
C [根据图示可知左电极为负极,反应式为C6H5OH+11H2O-28e-===6CO2↑+28H+,右电极为正极,反应式为2NO +10e-+6H2O===N2↑+12OH-。左侧溶液中H+增多,Cl-通过交换膜移向左侧,左侧离子交换膜为阴离子交换膜,C错误。]
4.我国光伏发电并网装机容量突破3亿千瓦。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是( )
A.光伏并网发电装置中N型半导体为正极
B.c为阳离子交换膜,d、e均为阴离子交换膜
C.保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率
D.制备182 g四甲基氢氧化铵,两极共产生33.6 L气体(标准状况)
D [根据第三个池中浓度变化得出,钠离子从第四池通过e膜,氯离子从第二池通过d膜,电解池中阳离子向阴极移动,阴离子向阳极移动,则a为阴极,电极反应式为2(CH3)4N++2H2O+2e-===2(CH3)4NOH+H2↑,b为阳极,电极反应式为4OH--4e-===O2↑+2H2O,a与N型半导体相连,b与P型半导体相连,所以N型半导体为负极,P型半导体为正极。由分析可知,N型半导体为负极,A错误;Na+离子通过e膜,Cl-通过d膜,(CH3)4N+通过c膜,所以c、e膜为阳离子交换膜,d膜为阴离子交换膜,B错误;温度过高,四甲基氯化铵会分解,四甲基氯化铵浓度降低,不能加快合成四甲基氢氧化铵的速率,C错误。]
5.(2022·沈阳模拟)利用双极膜电解制备磷酸和氢氧化钠的原理如图所示。已知双极膜是一种复合膜,在直流电作用下,中间界面内水解离为H+和OH-,并实现其定向通过。下列说法正确的是( )
A.若用铅酸蓄电池为电源,则X极与Pb电极相连
B.双极膜中a为H+,b为OH-
C.当电路中通过4 mol电子时,电极Y上产生2 mol气体
D.M膜为阴离子交换膜,N膜为阳离子交换膜
CD [由图可知,与直流电源正极相连的电极X为电解池的阳极,Y为阴极,电解池工作时阴离子向阳极迁移,阳离子向阴极迁移,则双极膜中水解离出的离子a为氢氧根离子、b为氢离子,M膜为阴离子交换膜、N膜为阳离子交换膜,原料室中磷酸二氢根离子通过M膜进入产品室1,与双极膜产生的氢离子反应生成磷酸,N膜为阳离子交换膜,原料室中钠离子通过N膜进入产品室2得到氢氧化钠。电极X为电解池的阳极,若用铅酸蓄电池为电源,X极与二氧化铅电极相连,A错误,B错误,D正确;由上述分析可知,Y为阴极,电极反应式为2H++2e-===H2↑,由电极反应式可知电路中通过4 mol 电子时,电极Y上产生氢气的物质的量为4 mol× =2 mol,C正确。]
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·山东等级考,T13)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )
1
3
2
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为LiCoO2+2H2O+e-===Li++Co2++4OH-
D.若甲室Co2+减少200 mg,乙室Co2+增加300 mg,则此时已进行过溶液转移
1
3
2
BD [电池工作时, 甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,Co2+在另一个电极上得到电子,被还原产生Co单质,CH3COO--8e-+2H2O===2CO2↑+7H+,H+移向甲室,c(H+)变大,pH减小,A错误;乙室电极反应式为8LiCoO2+32H++8e-===8Li++8Co2++16H2O,右侧装置中细菌电极(负极)的电极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,每转移8个e-,乙室消耗32个H+,而负极反应仅产生7个H+,因此电池工作一段时间后,乙室应补充盐酸,B正确;电解质溶液为酸性,不可能大量存在OH-,
1
3
2
1
3
2
2.(2021·广东选择性考试,T16)钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
1
3
2
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 mol Co,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
1
3
2
D [石墨电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,H+通过阳离子交换膜由Ⅰ室进入Ⅱ室,右侧Co电极为阴极,电极反应式为Co2++2e-===Co,Cl-通过阴离子交换膜由Ⅲ室进入Ⅱ室,与H+结合生成盐酸。由上述分析知,Ⅰ室中H2O放电使硫酸浓度增大,Ⅱ室中生成盐酸,故Ⅰ室和Ⅱ室溶液的pH均减小,A错误;生成1 mol Co时,转移2 mol电子,Ⅰ室有0.5 mol (即16 g)O2逸出,有2 mol(即2 g)H+通过阳离子交换膜进入Ⅱ室,则Ⅰ室溶液质量理论上减少18 g,B错误;移除两交换膜后,石墨电极上的电极反应为2Cl--2e-===Cl2↑,C错误;根据上述分析可知,电解时生成了O2、Co、H+,则电解总反应为2Co2++2H2O 2Co+O2↑+4H+,D正确。]
1
3
2
3.(2021·全国甲卷,T13)乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
1
3
2
1
3
2
1
3
2
D [由题图可知,在铅电极乙二酸变成乙醛酸是去氧的过程,发生还原反应,则铅电极是电解装置的阴极,石墨电极是电解装置的阳极发生氧化反应,反应为2Br--2e-===Br2。由上述分析可知,Br-起到还原剂的作用,A错误;阳极上的反应式为2Br--2e-===Br2,B错误;制得2 mol乙醛酸,实际上是左、右两侧各制得1 mol乙醛酸,共转移2 mol电子,故理论上外电路中迁移的电子数为2 mol,C错误;电解装置中,阳离子移向阴极(即铅电极),D正确。]
氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
(1)B膜最佳应选择________交换膜(填具体离子符号)。
(2)阳极的电极反应式是_______________________________________。
(3)少量的I-因浓度差通过BPM膜,若撤去A膜,其缺点是_____________________________________________________________________________________________________________________。
[答案] (1)Na+ (2)2H2O-4e-===O2↑+4H+
(3)I-会在阳极放电,沉积在阳极表面,损伤阳极板
谢谢观看 THANK YOU!
第35讲 多池串联与“隔膜”电化学装置(能力课)
第四部分 化学反应原理
第六章 化学反应与能量
1.了解多电池串联装置的工作原理与分析。 2.了解含隔膜的电化学装置的原理及应用。
考点一 多池串联的电化学装置分析
核心知能突破
关键能力训练
01
有外接电源的电解池串联
原电池电源与电解池串联
有外接电源的电解池串联
1.(2022·南京模拟)如图所示的装置,C、D、F、X、Y都是惰性电极,E为铁棒。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是( )
A.电源B极是负极
B.欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液
C.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶2
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
C [电解滴入酚酞的饱和氯化钠溶液时,阴极上氢离子放电,导致阴极附近显碱性,所以阴极附近溶液显红色,在F极附近显红色,所以F极是阴极,则B极是负极,A正确;电镀时,镀层金属作阳极,镀件作阴极,电解质溶液中金属阳离子和阳极材料是相同元素,所以欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液,B正确;电解硫酸铜溶液时,E为阳极且Fe作电极,故发生的反应为Fe-2e-===Fe2+,无单质生成,C错误;电解池工作时,溶液中阴离子向阳极移动,阳离子向阴极移动,装置丁中,X极是阳极,Y极是阴极,Y极附近红褐色变深,说明氢氧化铁胶粒向阴极移动,由此证明氢氧化铁胶粒带正电荷,D正确。]
原电池与电解池的串联分析
2.(2022·日照模拟)相同金属在其不同浓度盐溶液中可形成浓差电池。如图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法错误的是( )
A.a为电解池的阴极
B.电池放电过程中,Cu(2)电极上的电极反应为Cu-2e-===Cu2+
C.当电路中转移2 mol电子时,1 mol SO 通过离子交换膜向右移动
D.电池从开始工作到停止放电,电解池理论上可制得120 g NaOH
D [电池放电过程中,Cu(2)的电极反应为Cu-2e-===Cu2+,Cu(1)的电极反应为Cu2++2e-===Cu,反应前原电池左边硫酸铜物质的量为5 mol,右边硫酸铜物质的量为1 mol,电池停止放电时,左右两侧硫酸铜物质的量均为3 mol,因此右侧有2 mol 铜离子生成,转移4 mol 电子,根据阴极反应式可知,转移2 mol电子时得到2 mol NaOH即80 g,因此电池从开始工作到停止放电,电解池理论上可制得160 g NaOH,D错误。]
3.用C3H8、O2和熔融Na2CO3组成的燃料电池作电源,电解饱和的K2S溶液和2 mol·L-1 AgNO3溶液制备某些单质,盐桥中充有饱和的KNO3溶液。下列说法错误的是( )
C [熔融盐电池是燃料电池的一种,左边装置中石墨1电极上进气a生成“x+y”,y再到石墨2处参与反应,则石墨1电极上进的气体为C3H8,发生氧化反应生成CO2和H2O,石墨1为负极,石墨2为正极,石墨3为阳极,石墨4为阴极。盐桥作为电解池的内部结构,NO应移向阳极,即石墨3电极处,C错误。]
考点二 含隔膜的电化学装置分析
02
核心知能突破
关键能力训练
1.隔膜的分类
隔膜(又叫离子交换膜)由特殊高分子材料制成。离子交换膜分四类:
(1)阳离子交换膜,简称阳膜,只允许阳离子通过,即允许H+和其他阳离子通过,不允许阴离子通过。
(2)阴离子交换膜,简称阴膜,只允许阴离子通过,不允许阳离子通过。
(3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。
(4)双极膜,又称双极性膜,是特种离子交换膜,它是由一张阳膜和一张阴膜复合制成的阴、阳复合膜。该膜的特点是在直流电场的作用下,阴、阳膜复合层间的H2O解离成H+和OH-分别通过阴、阳膜,作为H+和OH-的离子源。
2.隔膜的作用
(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。
(2)能选择性地通过离子,起到平衡电荷、形成闭合回路的作用。
3.离子通过隔膜的定量关系
(1)通过隔膜的离子带的电荷数等于电路中电子转移数。
(2)离子迁移:依据电荷守恒,通过隔膜的离子数不一定相等。
双极膜在电渗析中应用广泛,它由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2O解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。如图为NaBr溶液的电渗析装置示意图。下列说法正确的是( )
A.出口2的产物为HBr溶液
B.出口5的产物为稀硫酸
C.Br-可从盐室最终进入阳极液中
D.当阳极产生1 mol气体时,通过阴离子交换膜的Br-为4 mol
[思路点拨]
原理图分析如下:
[答案] D
含离子交换膜电化学装置题的解题步骤
[说明] 原电池中阴(阳)离子通过阴(阳)离子交换膜移向负(正)极,电解池中阴(阳)离子通过阴(阳)离子交换膜移向阳(阴)极。
单膜电化学装置
1.(2022·日照模拟)一种利用烃(CxHy)来消除氮氧化物污染的工作原理如图所示,装置中电极均为惰性电极,两侧电解质溶液为同浓度的盐酸。下列说法错误的是( )
A.通入NO2的电极为正极,发生还原反应
B.若使用的烃为C2H6,该电极反应为C2H6+4H2O-14e-===2CO2+14H+
C.装置中转移0.4 mol电子时,有0.4NA个H+通过质子交换膜
D.装置工作一段时间后,两侧电极室中溶液的pH不变
D [根据电极的物质转化得:左电极为正极,反应式为2NO2+8e-+8H+===N2↑+4H2O,右电极为负极,若使用的烃为C2H6,电极反应为C2H6+4H2O-14e-===2CO2+14H+。左侧生成水,c(HCl)变小,pH变大,D错误。]
2.(2022·邯郸模拟)微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如图所示[其中电源为(CH3)2NNH2-KOH-O2清洁燃料电池]。下列说法正确的是( )
A.氢离子可通过离子交换膜自右室移向左室
B.温度越高,产甲烷效率越高
C.电源放电过程中会产生N2
D.a电极反应为CH3COO--6e-+2H2O===2CO2↑+7H+
C [根据a电极上CH3COO-转化为CO2,C元素化合价升高,发生氧化反应,知a电极为阳极,则b电极为阴极,氢离子通过离子交换膜由阳极室(左室)进入阴极室(右室),A项错误;该装置中有产电菌、产甲烷菌参与,温度过高,微生物的蛋白质变性,产甲烷效率降低,B项错误;根据电源为(CH3)2NNH2-KOH-O2清洁燃料电池,知其放电过程中产生N2,C项正确;a电极反应为CH3COO--8e-+2H2O===2CO2↑+7H+,D项错误。]
多膜电化学装置
3.(2022·大连模拟)一种三室微生物燃料电池污水净化系统的原理如图所示,图中含酚废水中的有机物可用C6H5OH表示。
下列说法不正确的是( )
A.右室电极为该电池的正极
B.右室电极附近溶液的pH增大
C.左侧离子交换膜为阳离子交换膜
D.左室电极反应式可表示为C6H5OH+11H2O-28e-===6CO2↑+28H+
C [根据图示可知左电极为负极,反应式为C6H5OH+11H2O-28e-===6CO2↑+28H+,右电极为正极,反应式为2NO +10e-+6H2O===N2↑+12OH-。左侧溶液中H+增多,Cl-通过交换膜移向左侧,左侧离子交换膜为阴离子交换膜,C错误。]
4.我国光伏发电并网装机容量突破3亿千瓦。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是( )
A.光伏并网发电装置中N型半导体为正极
B.c为阳离子交换膜,d、e均为阴离子交换膜
C.保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率
D.制备182 g四甲基氢氧化铵,两极共产生33.6 L气体(标准状况)
D [根据第三个池中浓度变化得出,钠离子从第四池通过e膜,氯离子从第二池通过d膜,电解池中阳离子向阴极移动,阴离子向阳极移动,则a为阴极,电极反应式为2(CH3)4N++2H2O+2e-===2(CH3)4NOH+H2↑,b为阳极,电极反应式为4OH--4e-===O2↑+2H2O,a与N型半导体相连,b与P型半导体相连,所以N型半导体为负极,P型半导体为正极。由分析可知,N型半导体为负极,A错误;Na+离子通过e膜,Cl-通过d膜,(CH3)4N+通过c膜,所以c、e膜为阳离子交换膜,d膜为阴离子交换膜,B错误;温度过高,四甲基氯化铵会分解,四甲基氯化铵浓度降低,不能加快合成四甲基氢氧化铵的速率,C错误。]
5.(2022·沈阳模拟)利用双极膜电解制备磷酸和氢氧化钠的原理如图所示。已知双极膜是一种复合膜,在直流电作用下,中间界面内水解离为H+和OH-,并实现其定向通过。下列说法正确的是( )
A.若用铅酸蓄电池为电源,则X极与Pb电极相连
B.双极膜中a为H+,b为OH-
C.当电路中通过4 mol电子时,电极Y上产生2 mol气体
D.M膜为阴离子交换膜,N膜为阳离子交换膜
CD [由图可知,与直流电源正极相连的电极X为电解池的阳极,Y为阴极,电解池工作时阴离子向阳极迁移,阳离子向阴极迁移,则双极膜中水解离出的离子a为氢氧根离子、b为氢离子,M膜为阴离子交换膜、N膜为阳离子交换膜,原料室中磷酸二氢根离子通过M膜进入产品室1,与双极膜产生的氢离子反应生成磷酸,N膜为阳离子交换膜,原料室中钠离子通过N膜进入产品室2得到氢氧化钠。电极X为电解池的阳极,若用铅酸蓄电池为电源,X极与二氧化铅电极相连,A错误,B错误,D正确;由上述分析可知,Y为阴极,电极反应式为2H++2e-===H2↑,由电极反应式可知电路中通过4 mol 电子时,电极Y上产生氢气的物质的量为4 mol× =2 mol,C正确。]
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·山东等级考,T13)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )
1
3
2
A.装置工作时,甲室溶液pH逐渐增大
B.装置工作一段时间后,乙室应补充盐酸
C.乙室电极反应式为LiCoO2+2H2O+e-===Li++Co2++4OH-
D.若甲室Co2+减少200 mg,乙室Co2+增加300 mg,则此时已进行过溶液转移
1
3
2
BD [电池工作时, 甲室中细菌上乙酸盐的阴离子失去电子被氧化为CO2气体,Co2+在另一个电极上得到电子,被还原产生Co单质,CH3COO--8e-+2H2O===2CO2↑+7H+,H+移向甲室,c(H+)变大,pH减小,A错误;乙室电极反应式为8LiCoO2+32H++8e-===8Li++8Co2++16H2O,右侧装置中细菌电极(负极)的电极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,每转移8个e-,乙室消耗32个H+,而负极反应仅产生7个H+,因此电池工作一段时间后,乙室应补充盐酸,B正确;电解质溶液为酸性,不可能大量存在OH-,
1
3
2
1
3
2
2.(2021·广东选择性考试,T16)钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
1
3
2
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 mol Co,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
1
3
2
D [石墨电极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,H+通过阳离子交换膜由Ⅰ室进入Ⅱ室,右侧Co电极为阴极,电极反应式为Co2++2e-===Co,Cl-通过阴离子交换膜由Ⅲ室进入Ⅱ室,与H+结合生成盐酸。由上述分析知,Ⅰ室中H2O放电使硫酸浓度增大,Ⅱ室中生成盐酸,故Ⅰ室和Ⅱ室溶液的pH均减小,A错误;生成1 mol Co时,转移2 mol电子,Ⅰ室有0.5 mol (即16 g)O2逸出,有2 mol(即2 g)H+通过阳离子交换膜进入Ⅱ室,则Ⅰ室溶液质量理论上减少18 g,B错误;移除两交换膜后,石墨电极上的电极反应为2Cl--2e-===Cl2↑,C错误;根据上述分析可知,电解时生成了O2、Co、H+,则电解总反应为2Co2++2H2O 2Co+O2↑+4H+,D正确。]
1
3
2
3.(2021·全国甲卷,T13)乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )
1
3
2
1
3
2
1
3
2
D [由题图可知,在铅电极乙二酸变成乙醛酸是去氧的过程,发生还原反应,则铅电极是电解装置的阴极,石墨电极是电解装置的阳极发生氧化反应,反应为2Br--2e-===Br2。由上述分析可知,Br-起到还原剂的作用,A错误;阳极上的反应式为2Br--2e-===Br2,B错误;制得2 mol乙醛酸,实际上是左、右两侧各制得1 mol乙醛酸,共转移2 mol电子,故理论上外电路中迁移的电子数为2 mol,C错误;电解装置中,阳离子移向阴极(即铅电极),D正确。]
氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
(1)B膜最佳应选择________交换膜(填具体离子符号)。
(2)阳极的电极反应式是_______________________________________。
(3)少量的I-因浓度差通过BPM膜,若撤去A膜,其缺点是_____________________________________________________________________________________________________________________。
[答案] (1)Na+ (2)2H2O-4e-===O2↑+4H+
(3)I-会在阳极放电,沉积在阳极表面,损伤阳极板
谢谢观看 THANK YOU!
同课章节目录
