第36讲 微点突破13 反应机理(或历程)的分析(共19张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第36讲 微点突破13 反应机理(或历程)的分析(共19张PPT)-2024届高考化学一轮复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
微点突破13 反应机理(或历程)的
分析
第四部分 化学反应原理
第七章 化学反应速率与化学平衡
微点精讲
01
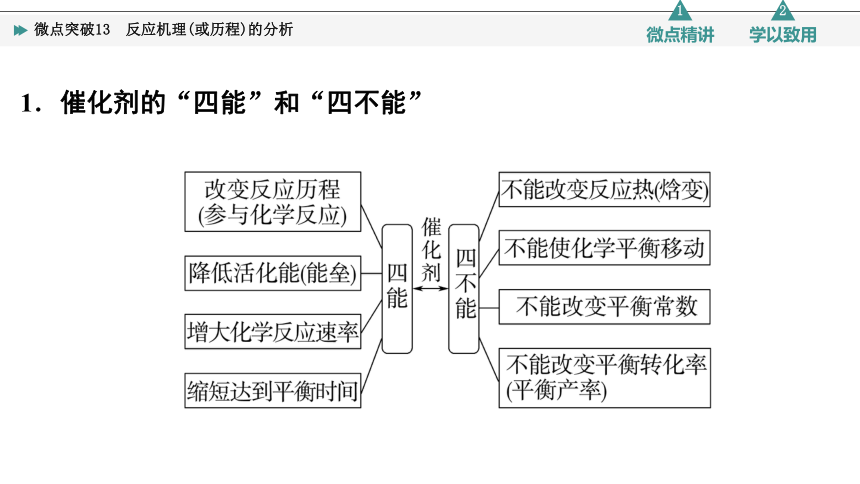
1.催化剂的“四能”和“四不能”
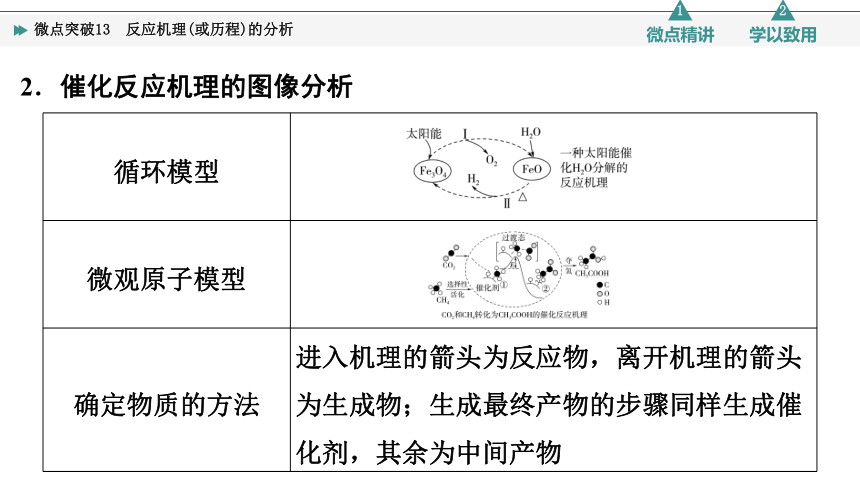
2.催化反应机理的图像分析
循环模型
微观原子模型
确定物质的方法 进入机理的箭头为反应物,离开机理的箭头为生成物;生成最终产物的步骤同样生成催化剂,其余为中间产物
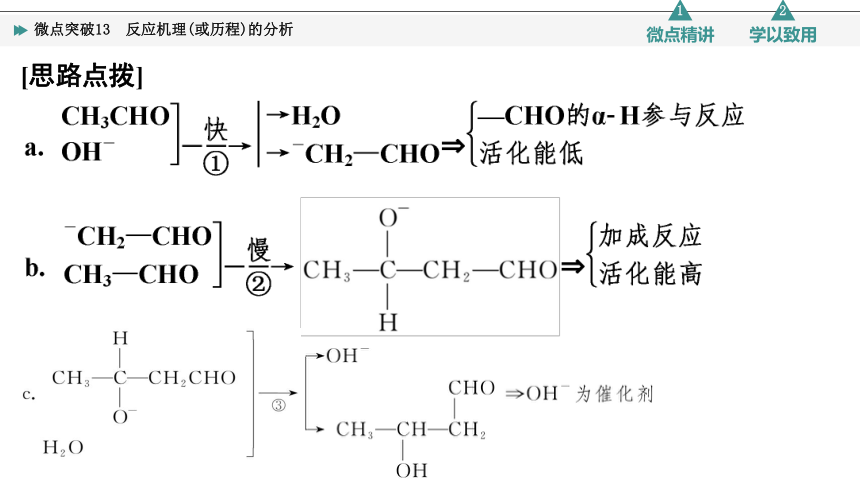
(2022·青岛模拟)稀碱条件,乙醛合成CH3CH===CHCHO(巴豆醛)的反应历程如图。下列说法正确的是( )
A.苯甲醛也能发生类似反应
B.反应①的活化能大于反应②的活化能
C.反应中,OH-、H2O均为反应催化剂
D.由上述历程可知醛基α H的酸性强于醇羟基
[思路点拨]
D [由乙醛合成巴豆醛的反应机理可知,该过程先发生α H与OH-的反应,再发生加成反应,苯甲醛无α H,不能发生类似反应,A错误;反应①较快,反应②较慢,反应越慢活化能越大,B错误;由图中可知,OH-为反应的催化剂,H2O为反应的中间产物,C错误;由上述历程可知,CH3CHO分子中的α H可与稀碱中的OH-反应,而醇无法发生类似反应,故可知醛基α H的酸性强于醇羟基,D正确。]
催化反应机理思维模式
(1)分析反应目的:分清反应物与目标产物。
(2)寻找各步反应的反应物和生成物。
(3)综合分析所有反应历程,确定总反应的反应物(只反应不生成)、生成物(只生成不反应)及中间产物(既生成又消耗)、循环物质或催化剂(既反应又生成)等。
学以致用
02
1.(2022·菏泽模拟)铑的配合物离子可催化甲醇的羰基化反应,反应机理如图所示,下列说法错误的是( )
A.总反应的原子利用率达到100%,符合绿色化学的理念
B.反应过程中只有阳离子(Ⅰ)为催化剂
C.反应过程中涉及取代反应
D.若其他条件不变,加入碘乙烷和乙醇,可以制得CH3CH2COOH
B [由反应机理可知,总反应为CO+CH3OH―→CH3COOH,原子利用率达到100%,符合绿色化学的理念,A正确;结合反应机理可知,阳离子(Ⅰ)、CH3I作为催化剂,B错误;过程⑤的反应为CH3COI+CH3OH―→CH3I+CH3COOH,此反应为取代反应,C正确;若其他条件不变,将CH3I换为碘乙烷,将甲醇换成乙醇,过程⑤发生的反应为CH3CH2COI+CH3CH2OH―→CH3CH2I+CH3CH2COOH,可以制得CH3CH2COOH,D正确。]
2.(2022·长沙模拟)二氧化碳甲烷化可以缓解能源危机。CO2在催化剂的作用下与H2制备甲烷的反应机理如图所示。
下列说法错误的是( )
C [H2―→2H·为断键,吸热,催化剂不能改变的吸热与放热,C项错误。]
3.(2022·深圳模拟)气相离子催化剂(Fe+、Co+、Mn+等)具有优良的催化效果。其中,在Fe+催化下乙烷氧化反应的机理如图所示(图中 为副反应)。下列说法正确的是( )
A.FeO+、N2均为反应中间体
B.X既含极性共价键也含非极性共价键
C.该机理涉及的反应均为氧化还原反应
D.每生成1 mol CH3CHO,消耗N2O的物质的量大于2 mol
D [由反应机理图可知,FeO+为反应中间体,N2为产物,A项错误;X为H2O,只含极性共价键,B项错误;[(C2H5)Fe(OH)]+转化为[(C2H4)Fe]+和H2O的反应没有元素的化合价发生变化,不是氧化还原反应,C项错误;不考虑副反应,发生的总反应为2N2O+C2H6―→2N2+CH3CHO+H2O,此时生成1 mol CH3CHO,消耗2 mol N2O,但因为有副反应发生,所以消耗的N2O的物质的量大于2 mol,D项正确。]
谢谢观看 THANK YOU!
微点突破13 反应机理(或历程)的
分析
第四部分 化学反应原理
第七章 化学反应速率与化学平衡
微点精讲
01
1.催化剂的“四能”和“四不能”
2.催化反应机理的图像分析
循环模型
微观原子模型
确定物质的方法 进入机理的箭头为反应物,离开机理的箭头为生成物;生成最终产物的步骤同样生成催化剂,其余为中间产物
(2022·青岛模拟)稀碱条件,乙醛合成CH3CH===CHCHO(巴豆醛)的反应历程如图。下列说法正确的是( )
A.苯甲醛也能发生类似反应
B.反应①的活化能大于反应②的活化能
C.反应中,OH-、H2O均为反应催化剂
D.由上述历程可知醛基α H的酸性强于醇羟基
[思路点拨]
D [由乙醛合成巴豆醛的反应机理可知,该过程先发生α H与OH-的反应,再发生加成反应,苯甲醛无α H,不能发生类似反应,A错误;反应①较快,反应②较慢,反应越慢活化能越大,B错误;由图中可知,OH-为反应的催化剂,H2O为反应的中间产物,C错误;由上述历程可知,CH3CHO分子中的α H可与稀碱中的OH-反应,而醇无法发生类似反应,故可知醛基α H的酸性强于醇羟基,D正确。]
催化反应机理思维模式
(1)分析反应目的:分清反应物与目标产物。
(2)寻找各步反应的反应物和生成物。
(3)综合分析所有反应历程,确定总反应的反应物(只反应不生成)、生成物(只生成不反应)及中间产物(既生成又消耗)、循环物质或催化剂(既反应又生成)等。
学以致用
02
1.(2022·菏泽模拟)铑的配合物离子可催化甲醇的羰基化反应,反应机理如图所示,下列说法错误的是( )
A.总反应的原子利用率达到100%,符合绿色化学的理念
B.反应过程中只有阳离子(Ⅰ)为催化剂
C.反应过程中涉及取代反应
D.若其他条件不变,加入碘乙烷和乙醇,可以制得CH3CH2COOH
B [由反应机理可知,总反应为CO+CH3OH―→CH3COOH,原子利用率达到100%,符合绿色化学的理念,A正确;结合反应机理可知,阳离子(Ⅰ)、CH3I作为催化剂,B错误;过程⑤的反应为CH3COI+CH3OH―→CH3I+CH3COOH,此反应为取代反应,C正确;若其他条件不变,将CH3I换为碘乙烷,将甲醇换成乙醇,过程⑤发生的反应为CH3CH2COI+CH3CH2OH―→CH3CH2I+CH3CH2COOH,可以制得CH3CH2COOH,D正确。]
2.(2022·长沙模拟)二氧化碳甲烷化可以缓解能源危机。CO2在催化剂的作用下与H2制备甲烷的反应机理如图所示。
下列说法错误的是( )
C [H2―→2H·为断键,吸热,催化剂不能改变的吸热与放热,C项错误。]
3.(2022·深圳模拟)气相离子催化剂(Fe+、Co+、Mn+等)具有优良的催化效果。其中,在Fe+催化下乙烷氧化反应的机理如图所示(图中 为副反应)。下列说法正确的是( )
A.FeO+、N2均为反应中间体
B.X既含极性共价键也含非极性共价键
C.该机理涉及的反应均为氧化还原反应
D.每生成1 mol CH3CHO,消耗N2O的物质的量大于2 mol
D [由反应机理图可知,FeO+为反应中间体,N2为产物,A项错误;X为H2O,只含极性共价键,B项错误;[(C2H5)Fe(OH)]+转化为[(C2H4)Fe]+和H2O的反应没有元素的化合价发生变化,不是氧化还原反应,C项错误;不考虑副反应,发生的总反应为2N2O+C2H6―→2N2+CH3CHO+H2O,此时生成1 mol CH3CHO,消耗2 mol N2O,但因为有副反应发生,所以消耗的N2O的物质的量大于2 mol,D项正确。]
谢谢观看 THANK YOU!
同课章节目录
