第39讲 化学平衡移动 化学反应方向(基础课)(共78张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第39讲 化学平衡移动 化学反应方向(基础课)(共78张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-02 22:09:11 | ||
图片预览











文档简介
(共78张PPT)
第39讲 化学平衡移动 化学反应方向(基础课)
第四部分 化学反应原理
第七章 化学反应速率与化学平衡
1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。 2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。 3.了解化学反应的方向判断。
知识点一 化学平衡移动
必备知识梳理
关键能力训练
01
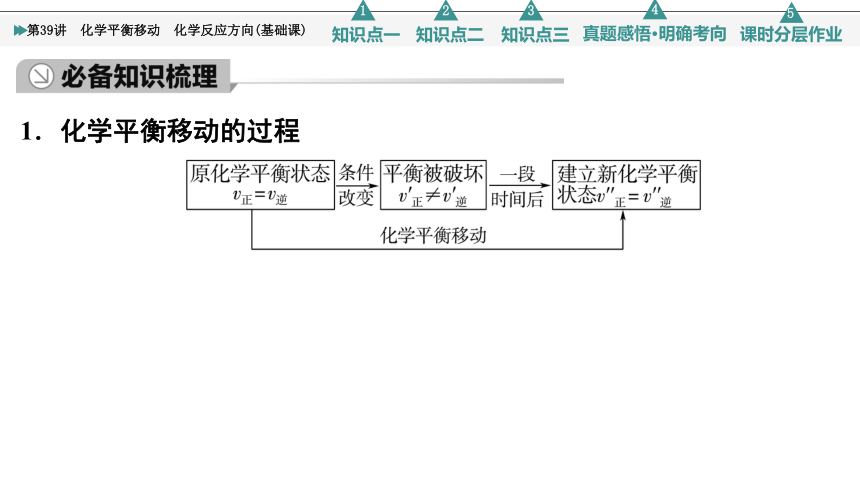
1.化学平衡移动的过程
2.化学平衡移动与化学反应速率的关系
(1)v正>v逆:平衡向____________移动。
(2)v正=v逆:反应达到平衡状态,________平衡移动。
(3)v正即:哪方向速率大,平衡就向哪方向移动。
正反应方向
不发生
逆反应方向
3.影响化学平衡的外界因素
(1)浓度对平衡的影响
①其他条件不变时,增大反应物浓度,平衡向________方向移动;同理,减小反应物浓度,平衡向________方向移动。
②根据浓度商(Q)和平衡常数判断平衡移动
a.当Q=K时,反应处于平衡状态;
b.当Q>K时,平衡向________方向移动;
c.当Q正反应
逆反应
逆反应
正反应
③应用:工业生产中,适当增大廉价反应物的浓度,使平衡向正反应方向移动,提高价格较高原料的转化率,从而降低成本。
(2)压强对平衡的影响
其他条件不变时,增大压强,会使平衡向气体体积______的方向移动;减小压强,会使平衡向气体体积______的方向移动。
减小
增大
①改变压强,对于反应前后气体体积不变的反应,平衡不移动,v正、v逆同倍数改变。
②平衡混合物中都是固体或液体时,改变压强,平衡不移动。
③恒温恒容条件通“惰性气体”,各组分浓度不变,v正、v逆不变,平衡不移动;恒温恒压通“惰性气体”,各组分浓度同倍数减小(相当于减压),平衡向气体体积增大的方向移动。
(3)温度对平衡的影响
其他条件不变时,升高温度,平衡向______方向移动;降低温度,平衡向______方向移动。
吸热
放热
①任何可逆反应均有能量变化,改变温度一定发生平衡移动。
②催化剂能改变正、逆反应的活化能,同倍数改变v正、v逆,对平衡移动无影响,只能改变到达平衡的时间。
4.勒夏特列原理
如果改变影响化学平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够______________的方向移动。如反应N2(g)+3H2(g) 2NH3(g)在一定温度下达到平衡时c(N2)=a mol·L-1,压强为p,在恒温下,将容器容积缩小一半,达到平衡时,c′(N2)____2a mol·L-1,p′____2p。
减弱这种改变
<
<
①勒夏特列原理仅适用于判断平衡移动方向,不适用于改变条件平衡不发生移动的情况。
②化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变。
5.影响化学平衡移动因素的v t图像分析
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g) 2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
(1)加催化剂对反应速率影响的图像是____(填字母,下同),平衡____移动。
(2)升高温度对反应速率影响的图像是____,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是____,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是____,平衡向________方向移动。
C
不
A
逆反应
D
逆反应
B
正反应
1.判断正误(正确的打“√”,错误的打“×”)
(1)改变条件,v正、v逆均变化时平衡一定移动。( )
(2)在密闭容器加入任一反应物,平衡一定移动。( )
(3)升高温度,平衡向正反应方向移动,v正增大,v逆减小。( )
(4)平衡向正反应方向移动,生成物的浓度一定增大。( )
(5)平衡向正反应方向移动,反应物的转化率一定增大。( )
[答案] (1)× (2)× (3)× (4)× (5)×
2.在一定温度下,容积不变的容器中发生C(s)+H2O(g) CO(g)+H2(g),改变一个条件,填表
改变条件 平衡移 动方向 v正、v逆 变化 平衡转化率
α(H2O)
①加入C(s)
②通入H2O(g)
③增大压强
④使用催化剂
⑤充入Ne气
[答案] ①不移动 不变 不变 ②正向 v正增大,v逆逐渐增大 减小 ③逆向 均增大 减小 ④不移动 均增大 不变 ⑤不移动 不变 不变
化学平衡移动与转化率的判断
1.在恒容密闭容器中,反应2SO2(g)+O2(g) 2SO3(g) ΔH<0达到平衡后,采用下列措施,既能增大逆反应速率又能使平衡向正反应方向移动的是( )
A.通入一定量O2 B.增大容器容积
C.移去部分SO3(g) D.降低体系的温度
[答案] A
2.在一个密闭容器中充入a mol A和b mol B,发生反应aA(g)+bB(g)
cC(g)+dD(g) ΔH>0,一段时间后达到平衡,测得各物质的浓度。
(1)若体积不变,仅增加c(A),A的转化率将________(填“增大”“减小”或“不变”,下同),B的转化率将________,达到新平衡时,c(A)将________,c(C)将________。
(2)体积不变,再充入a mol A和b mol B,则平衡________移动,达到新平衡时,c(A)将______,c(C)将________。
①若a+b=c+d,则A的转化率将________;
②若a+b>c+d,则A的转化率将________;
③若a+b(3)升高温度,平衡________移动,达到新平衡时,c(A)将________,c(C)将________,A的转化率将________。
[答案] (1)减小 增大 增大 增大 (2)正向 增大 增大 ①不变 ②增大 ③减小 (3)正向 减小 增大 增大
3.一定温度下,1 L密闭容器中发生A(g)+2B(g) C(g),平衡时A、B、C的浓度分别为1 mol/L、2 mol/L和1.5 mol/L,在温度不变的条件下,再充入1 mol A、1 mol B和1 mol C,此时平衡移动方向为________(填“向右”“向左”或“不移动”)。
[答案] 向右
4.在一密闭容器中,反应aA(g)+bB(s) cC(g)+dD(g)达到平衡后,保持温度不变,将容器缩小为原来的一半,当达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是 ( )
A.平衡向逆反应方向移动
B.aC.物质A的转化率增大
D.物质A和C的浓度都增大,且增大的倍数相同
C [容器缩小为原来的一半,若平衡不移动,则A的浓度应变为原来的2倍;因达到新的平衡时,A的浓度是原来的1.6倍,说明平衡正向移动,C的浓度比原来的2倍还多,A的转化率增大。]
平衡转化率变化的判断方法
(1)改变温度或压强,若平衡正向移动,转化率增大。
(2)两种或多种反应物的反应,增大某一反应物的浓度,其他反应物的转化率增大,而自身的转化率减小。
(3)恒温恒容条件下,对于可逆的分解反应aA(g) bB(g)+cC(g),A分解反应建立平衡后,增大A的浓度,平衡正向移动。当a=b+c时,α(A)不变,φ(A)不变;a>b+c时,α(A)增大,φ(A)减小;a 根据平衡移动比较平衡状态
5.将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g) ΔH<0。改变某个条件并维持新条件直至达到平衡状态,下表中关于新平衡与原平衡的比较正确的是( )
选项 改变的条件 新平衡与原平衡比较
A 升高温度 X的转化率变小
B 增大压强 X的浓度变小
C 充入一定量Y Y的转化率增大
D 使用适当催化剂 X的体积分数变小
[答案] A
6.一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),其正反应放热。图1、图2表示起始时容器甲、丙的体积都是V,容器乙、丁的体积都是 ;向容器甲、丙内都充入2a mol SO2和a mol O2并保持恒温;向容器乙、丁内都充入a mol SO2和0.5a mol O2并保持绝热(即与外界无热量交换),在一定温度时开始反应。
请完成下列问题:
(1)图1达平衡,α(SO2):甲________(填“>”“<”或“=”,下同)乙,K:K甲________K乙。
(2)图2达平衡,α(SO2):丙________丁,c(SO2):丙________丁。
(3)甲、丙达平衡,α(SO2):甲________丙,SO2体积分数:甲________丙。
[解析] (1)甲、乙相比,平衡时,乙中温度高,正向程度小,乙中α(SO2)较小。(2)丙、丁相比,平衡时,丁中温度高,正向程度小,丁中α(SO2)较小,c(SO2)较大。(3)甲、丙相比,平衡时甲中压强大,甲中α(SO2)较大。
[答案] (1)> > (2)> < (3)> <
(1)构建恒温恒容平衡思维模式
新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)
新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。
知识点二 工业合成氨与反应条件的调控
02
必备知识梳理
关键能力训练
1.工业合成氨的条件控制
(1)反应原理:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
(2)根据反应特点可选择的条件
①增大合成氨反应速率的措施有:__________、__________、____________________和____________。
②提高平衡混合气中NH3含量的措施有:__________、__________和____________________。
升高温度
增大压强
增大N2、H2的浓度
使用催化剂
降低温度
增大压强
增大N2、H2的浓度
(3)反应条件的控制
①压强:10~30 MPa。压强越大,转化率越大,但对____________的要求高,需要的______也越大。
②温度:400~500 ℃。温度要适宜,既要保证反应有较快的速率,又要使反应物的转化率不能太低,并且该反应的催化剂在该温度下______最大。
材料、设备
动力
活性
③催化剂:使用催化剂可提高反应的速率。
④浓度:迅速冷却使_______液化,降低c(NH3),平衡向____移动。
⑤循环操作:将分离出NH3的原料气循环使用,提高原料的利用率。
NH3
右
2.化学反应调控的一般原则
条件 原则
从化学反应 速率分析 既不能过快,又不能太慢
从化学平衡 移动分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
条件 原则
从原料的利 用率分析 ①增大易得廉价原料浓度,提高难得高价原料的利用率,从而降低生产成本
②循环操作
从实际生产 能力分析 如设备承受高温、高压能力等
从催化剂的使 用活性分析 注意催化剂的活性对温度的要求
1.在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为[Cu(NH3)2]++CO+NH3 [Cu(NH3)3CO]+ ΔH<0。
(1)铜氨液吸收CO适宜的生产条件是____________。
(2)吸收CO后的铜氨液经过适当处理又可再生,恢复其吸收CO的能力,可供循环使用。铜氨液再生适宜的生产条件是______________。
[答案] (1)低温、高压 (2)高温、低压
2.CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是_______________________________。
[答案] < 在1.3×104 kPa下,CO的转化率较高,再增大压强CO转化率提高不大,同时生产成本增加,得不偿失
3.“丁烯裂解法”是一种重要的丙烯生产法,在生产过程中会有生成乙烯的副反应发生。反应如下:
测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(T)和压强(p)变化的趋势分别如图甲和图乙所示:
(1)平衡体系中的C3H6(g)和C2H4(g)的质量比是工业生产C3H6(g)时选择反应条件的重要依据之一,从产物的纯度考虑,该数值越高越好,据图甲和图乙判断,反应条件应选择______(填序号)。
A.300 ℃、0.1 Mpa B.700 ℃、0.1 MPa
C.300 ℃、0.5 MPa D.700 ℃、0.5 MPa
(2)有研究者结合图甲数据并综合考虑各种因素,认为450 ℃的反应温度比300 ℃或700 ℃更合适,从反应原理角度分析其理由可能是___________________________________________________________________________________________________________。
[解析] (1)由图甲可知,300 ℃时C2H4(g)的质量分数接近于0,而温度升高,C2H4(g)的质量分数增大,故选择300 ℃;由图乙可知,压强增大,C2H4(g)的质量分数减小,C3H6(g)的质量分数增大,故选0.5 MPa,因此控制反应条件为300 ℃、0.5 MPa。(2)温度越低,反应速率越慢,由图甲可知,300 ℃时反应速率慢;温度升高,C2H4(g)的质量分数增大,700 ℃的副反应的转化率大于丁烯转化成丙烯的转化率。而450 ℃时,C3H6(g)的质量分数达最大值,且C2H4(g)的质量分数在10%左右,产物中C3H6(g)的含量较高,故450 ℃更合适。
[答案] (1)C (2)300 ℃反应速率慢,700 ℃副反应的转化率大于丁烯转化成丙烯的转化率
知识点三 化学反应的方向
03
必备知识梳理
关键能力训练
1.自发过程(自发反应)
(1)定义:一定条件下不需要外界作用就能进行的过程(或反应)称为自发过程(或自发反应)。
(2)特点
①大多数______反应(ΔH____0)可以自发进行。
②大多数混乱度______的反应(熵变ΔS____0)可以自发进行。
放热
<
增大
>
自发反应(过程)指的是在一定条件下有自发进行的倾向而不一定发生,如燃烧反应是自发反应,但在常温下不一定燃烧。
2.熵与熵变
(1)熵:描述体系__________的物理量,符号为S。熵值越大,体系________越大。
(2)熵变:ΔS=S(生成物)-S(反应物)。
(3)常见的熵增过程
①同一种物质由固态到液态再到气态:S(s)②反应后气体物质的量______的反应。
③固体参加生成气体的反应,如C(s)+H2O(g) CO(g)+H2(g)。
混乱程度
混乱度
增加
3.化学反应方向的判定
(1)判定依据
<
>
>0
=0
<0
(2)一般规律
①ΔH____0、ΔS____0,任何温度下都能自发进行。
②ΔH____0、ΔS____0,任何温度下都不能自发进行。
③ΔH和ΔS的作用相反,且相差不大时,______对反应的方向起决定性作用。当ΔH<0、ΔS<0时,______下反应能自发进行;当ΔH>0、ΔS>0时,______下反应能自发进行。
<
>
>
<
温度
低温
高温
1.已知:ΔG=ΔH—TΔS,当ΔG<0,反应能自发进行,ΔG>0反应不能自发进行。下列说法中正确的是( )
A.非自发反应在任何条件下都不能发生
B.熵增加且放热的反应一定是自发反应
C.自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应
D.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
B [A.非自发反应在一定条件下也能发生,如碳酸钙的分解反应在常温下不能自发进行,在高温下就可以自发进行,错误;B.熵增加且放热的反应,ΔS>0、ΔH<0,则ΔG=ΔH-TΔS<0,反应一定能自发进行,正确;C.反应能否自发进行,由熵变、焓变和反应温度共同决定,所以熵增加、熵减小或熵不变的反应都可能自发进行,错误;D.根据上述分析可知,反应能否自发进行,由熵变、焓变和反应温度共同决定,所以放热反应或吸热反应都可能自发进行,错误。]
2.回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)===2CO(g)+O2(g),该反应的ΔH________0,ΔS________0(填“>”“<”或“=”),在低温下,该反应________(填“能”或“不能”)自发进行。
(2)超声速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO 2CO2+N2。若反应在常温下能够自发进行,则反应的ΔH______(填“>”“<”或“=”)0。
(3)已知在100 kPa、298 K时石灰石分解反应
CaCO3(s)===CaO(s)+CO2(g)的ΔH>0,ΔS>0。
①常温下,该反应________(填“能”或“不能”)自发进行。
②据本题反应数据分析,温度________(填“能”或“不能”)成为反应进行方向的决定因素。
(4)已知CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是________。
(5)某吸热反应能自发进行,则该反应的ΔS________(填“>”或“<”)0。
[解析] (1)由于CO在O2中燃烧生成CO2为放热反应,则二氧化碳分解生成CO和O2的反应为吸热反应,ΔH>0,根据化学方程式可知,反应后气体的化学计量数之和增加,ΔS>0,故低温下ΔG=ΔH-TΔS>0,反应不能自发进行。(2)ΔG=ΔH-TΔS<0时反应自发进行,通过化学方程式可知常温下ΔS<0,常温下反应能够自发进行,则ΔH<0。(3)①根据ΔG=ΔH-TΔS<0时反应自发进行,已知ΔH>0,ΔS>0,则常温下不能自发进行;②该反应的ΔH>0、ΔS>0,高温条件下能使ΔG=ΔH-TΔS<0,而常温条件下ΔG=ΔH-TΔS>0,则该反应中温度能成为决定反应进行方向的因素。(4)该反应的ΔS>0、ΔH>0,则高温时ΔG=ΔH-TΔS<0,反应能自发进行。(5)已知某吸热反应能自发进行,即ΔG=ΔH-TΔS<0,ΔH>0,则ΔS>0。
[答案] (1)> > 不能 (2)< (3)①不能 ②能 (4)高温 (5)>
真题感悟·明确考向
04
1.(2022·河北选择性考试,节选)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
1
3
2
4
下列操作中,能提高CH4(g)平衡转化率的是________(填标号)。
A.增加CH4(g)用量
B.恒温恒压下通入惰性气体
C.移除CO(g)
D.加入催化剂
1
3
2
4
[解析] A项,增加CH4(g)用量,α(CH4)减小,错误;B项,恒温恒压通入惰性气体,相当于减压,反应Ⅰ正向移动,α(CH4)增大,正确;C项,移除CO(g),反应Ⅰ正向移动,α(CH4)增大,正确;D项,加入催化剂,不影响平衡,α(CH4)不变,错误。
[答案] BC
1
3
2
4
2.(2022·全国甲卷,T28节选)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH1=172 kJ·mol-1,Kp1=1.0×10-2
(ⅱ)碳氯化:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g)
ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
1
3
2
4
(1)反应2C(s)+O2(g)===2CO(g)的ΔH为________kJ·mol-1,Kp=________Pa。
(2)碳氯化的反应趋势远大于直接氯化,其原因是__________________。
(3)对于碳氯化反应:增大压强,平衡________移动(填“向左”“向右”或“不”);温度升高,平衡转化率________(填“变大”“变小”或“不变”) 。
1
3
2
4
1
3
2
4
[答案] (1)-223 1.2×1014 (2)碳氯化反应气体分子数增加,ΔH小于0,是熵增、放热的反应,熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变且是吸热过程 (3)向左 变小
1
3
2
4
3.(2022·辽宁选择性考试,节选)已知合成氨反应为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,ΔS=-200 J·K-1·mol-1。
(1)合成氨反应在常温下________(填“能”或“不能”)自发。
(2)________温(填“高”或“低”,下同)有利于提高反应速率,________温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400~500 ℃。
1
3
2
4
[解析] (1)ΔG=ΔH-TΔS=-92.4 kJ·mol-1-298 K×(-200 J·K-1·mol-1)×10-3 kJ·J-1=-32.8 kJ·mol-1<0。
[答案] (1)能 (2)高 低
1
3
2
4
2
3
4
1
4.(2021·广东选择性考试,T19节选)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
2
3
4
1
(1)根据盖斯定律,反应a的ΔH1=______________(写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有________。
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
2
3
4
1
[解析] (1)由题给反应方程式可知,反应a可由反应c-d或反应b+c-e得到,故根据盖斯定律,ΔH1=ΔH3-ΔH4或ΔH1=ΔH2+ΔH3-ΔH5。(2)增大CO2的浓度,反应a、b的正反应速率增加;增大CH4的浓度,反应a、c的正反应速率增加,A正确。由于C(s)是固体,移去部分C(s),平衡不移动,B错误。催化剂只能改变反应速率,不影响化学平衡移动,则不能提高CH4的平衡转化率,C错误。降低反应温度,正、逆反应速率均减小,D正确。
[答案] (1)ΔH3-ΔH4(或ΔH2+ΔH3-ΔH5) (2)AD
2
3
4
1
谢谢观看 THANK YOU!
第39讲 化学平衡移动 化学反应方向(基础课)
第四部分 化学反应原理
第七章 化学反应速率与化学平衡
1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。 2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。 3.了解化学反应的方向判断。
知识点一 化学平衡移动
必备知识梳理
关键能力训练
01
1.化学平衡移动的过程
2.化学平衡移动与化学反应速率的关系
(1)v正>v逆:平衡向____________移动。
(2)v正=v逆:反应达到平衡状态,________平衡移动。
(3)v正
正反应方向
不发生
逆反应方向
3.影响化学平衡的外界因素
(1)浓度对平衡的影响
①其他条件不变时,增大反应物浓度,平衡向________方向移动;同理,减小反应物浓度,平衡向________方向移动。
②根据浓度商(Q)和平衡常数判断平衡移动
a.当Q=K时,反应处于平衡状态;
b.当Q>K时,平衡向________方向移动;
c.当Q
逆反应
逆反应
正反应
③应用:工业生产中,适当增大廉价反应物的浓度,使平衡向正反应方向移动,提高价格较高原料的转化率,从而降低成本。
(2)压强对平衡的影响
其他条件不变时,增大压强,会使平衡向气体体积______的方向移动;减小压强,会使平衡向气体体积______的方向移动。
减小
增大
①改变压强,对于反应前后气体体积不变的反应,平衡不移动,v正、v逆同倍数改变。
②平衡混合物中都是固体或液体时,改变压强,平衡不移动。
③恒温恒容条件通“惰性气体”,各组分浓度不变,v正、v逆不变,平衡不移动;恒温恒压通“惰性气体”,各组分浓度同倍数减小(相当于减压),平衡向气体体积增大的方向移动。
(3)温度对平衡的影响
其他条件不变时,升高温度,平衡向______方向移动;降低温度,平衡向______方向移动。
吸热
放热
①任何可逆反应均有能量变化,改变温度一定发生平衡移动。
②催化剂能改变正、逆反应的活化能,同倍数改变v正、v逆,对平衡移动无影响,只能改变到达平衡的时间。
4.勒夏特列原理
如果改变影响化学平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够______________的方向移动。如反应N2(g)+3H2(g) 2NH3(g)在一定温度下达到平衡时c(N2)=a mol·L-1,压强为p,在恒温下,将容器容积缩小一半,达到平衡时,c′(N2)____2a mol·L-1,p′____2p。
减弱这种改变
<
<
①勒夏特列原理仅适用于判断平衡移动方向,不适用于改变条件平衡不发生移动的情况。
②化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变。
5.影响化学平衡移动因素的v t图像分析
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g) 2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
(1)加催化剂对反应速率影响的图像是____(填字母,下同),平衡____移动。
(2)升高温度对反应速率影响的图像是____,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是____,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是____,平衡向________方向移动。
C
不
A
逆反应
D
逆反应
B
正反应
1.判断正误(正确的打“√”,错误的打“×”)
(1)改变条件,v正、v逆均变化时平衡一定移动。( )
(2)在密闭容器加入任一反应物,平衡一定移动。( )
(3)升高温度,平衡向正反应方向移动,v正增大,v逆减小。( )
(4)平衡向正反应方向移动,生成物的浓度一定增大。( )
(5)平衡向正反应方向移动,反应物的转化率一定增大。( )
[答案] (1)× (2)× (3)× (4)× (5)×
2.在一定温度下,容积不变的容器中发生C(s)+H2O(g) CO(g)+H2(g),改变一个条件,填表
改变条件 平衡移 动方向 v正、v逆 变化 平衡转化率
α(H2O)
①加入C(s)
②通入H2O(g)
③增大压强
④使用催化剂
⑤充入Ne气
[答案] ①不移动 不变 不变 ②正向 v正增大,v逆逐渐增大 减小 ③逆向 均增大 减小 ④不移动 均增大 不变 ⑤不移动 不变 不变
化学平衡移动与转化率的判断
1.在恒容密闭容器中,反应2SO2(g)+O2(g) 2SO3(g) ΔH<0达到平衡后,采用下列措施,既能增大逆反应速率又能使平衡向正反应方向移动的是( )
A.通入一定量O2 B.增大容器容积
C.移去部分SO3(g) D.降低体系的温度
[答案] A
2.在一个密闭容器中充入a mol A和b mol B,发生反应aA(g)+bB(g)
cC(g)+dD(g) ΔH>0,一段时间后达到平衡,测得各物质的浓度。
(1)若体积不变,仅增加c(A),A的转化率将________(填“增大”“减小”或“不变”,下同),B的转化率将________,达到新平衡时,c(A)将________,c(C)将________。
(2)体积不变,再充入a mol A和b mol B,则平衡________移动,达到新平衡时,c(A)将______,c(C)将________。
①若a+b=c+d,则A的转化率将________;
②若a+b>c+d,则A的转化率将________;
③若a+b
[答案] (1)减小 增大 增大 增大 (2)正向 增大 增大 ①不变 ②增大 ③减小 (3)正向 减小 增大 增大
3.一定温度下,1 L密闭容器中发生A(g)+2B(g) C(g),平衡时A、B、C的浓度分别为1 mol/L、2 mol/L和1.5 mol/L,在温度不变的条件下,再充入1 mol A、1 mol B和1 mol C,此时平衡移动方向为________(填“向右”“向左”或“不移动”)。
[答案] 向右
4.在一密闭容器中,反应aA(g)+bB(s) cC(g)+dD(g)达到平衡后,保持温度不变,将容器缩小为原来的一半,当达到新的平衡时,A的浓度是原来的1.6倍,则下列说法正确的是 ( )
A.平衡向逆反应方向移动
B.a
D.物质A和C的浓度都增大,且增大的倍数相同
C [容器缩小为原来的一半,若平衡不移动,则A的浓度应变为原来的2倍;因达到新的平衡时,A的浓度是原来的1.6倍,说明平衡正向移动,C的浓度比原来的2倍还多,A的转化率增大。]
平衡转化率变化的判断方法
(1)改变温度或压强,若平衡正向移动,转化率增大。
(2)两种或多种反应物的反应,增大某一反应物的浓度,其他反应物的转化率增大,而自身的转化率减小。
(3)恒温恒容条件下,对于可逆的分解反应aA(g) bB(g)+cC(g),A分解反应建立平衡后,增大A的浓度,平衡正向移动。当a=b+c时,α(A)不变,φ(A)不变;a>b+c时,α(A)增大,φ(A)减小;a
5.将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g) ΔH<0。改变某个条件并维持新条件直至达到平衡状态,下表中关于新平衡与原平衡的比较正确的是( )
选项 改变的条件 新平衡与原平衡比较
A 升高温度 X的转化率变小
B 增大压强 X的浓度变小
C 充入一定量Y Y的转化率增大
D 使用适当催化剂 X的体积分数变小
[答案] A
6.一定条件下存在反应:2SO2(g)+O2(g) 2SO3(g),其正反应放热。图1、图2表示起始时容器甲、丙的体积都是V,容器乙、丁的体积都是 ;向容器甲、丙内都充入2a mol SO2和a mol O2并保持恒温;向容器乙、丁内都充入a mol SO2和0.5a mol O2并保持绝热(即与外界无热量交换),在一定温度时开始反应。
请完成下列问题:
(1)图1达平衡,α(SO2):甲________(填“>”“<”或“=”,下同)乙,K:K甲________K乙。
(2)图2达平衡,α(SO2):丙________丁,c(SO2):丙________丁。
(3)甲、丙达平衡,α(SO2):甲________丙,SO2体积分数:甲________丙。
[解析] (1)甲、乙相比,平衡时,乙中温度高,正向程度小,乙中α(SO2)较小。(2)丙、丁相比,平衡时,丁中温度高,正向程度小,丁中α(SO2)较小,c(SO2)较大。(3)甲、丙相比,平衡时甲中压强大,甲中α(SO2)较大。
[答案] (1)> > (2)> < (3)> <
(1)构建恒温恒容平衡思维模式
新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)
新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。
知识点二 工业合成氨与反应条件的调控
02
必备知识梳理
关键能力训练
1.工业合成氨的条件控制
(1)反应原理:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
(2)根据反应特点可选择的条件
①增大合成氨反应速率的措施有:__________、__________、____________________和____________。
②提高平衡混合气中NH3含量的措施有:__________、__________和____________________。
升高温度
增大压强
增大N2、H2的浓度
使用催化剂
降低温度
增大压强
增大N2、H2的浓度
(3)反应条件的控制
①压强:10~30 MPa。压强越大,转化率越大,但对____________的要求高,需要的______也越大。
②温度:400~500 ℃。温度要适宜,既要保证反应有较快的速率,又要使反应物的转化率不能太低,并且该反应的催化剂在该温度下______最大。
材料、设备
动力
活性
③催化剂:使用催化剂可提高反应的速率。
④浓度:迅速冷却使_______液化,降低c(NH3),平衡向____移动。
⑤循环操作:将分离出NH3的原料气循环使用,提高原料的利用率。
NH3
右
2.化学反应调控的一般原则
条件 原则
从化学反应 速率分析 既不能过快,又不能太慢
从化学平衡 移动分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
条件 原则
从原料的利 用率分析 ①增大易得廉价原料浓度,提高难得高价原料的利用率,从而降低生产成本
②循环操作
从实际生产 能力分析 如设备承受高温、高压能力等
从催化剂的使 用活性分析 注意催化剂的活性对温度的要求
1.在合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前需经过铜氨液处理,目的是除去其中的CO,其反应为[Cu(NH3)2]++CO+NH3 [Cu(NH3)3CO]+ ΔH<0。
(1)铜氨液吸收CO适宜的生产条件是____________。
(2)吸收CO后的铜氨液经过适当处理又可再生,恢复其吸收CO的能力,可供循环使用。铜氨液再生适宜的生产条件是______________。
[答案] (1)低温、高压 (2)高温、低压
2.CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是_______________________________。
[答案] < 在1.3×104 kPa下,CO的转化率较高,再增大压强CO转化率提高不大,同时生产成本增加,得不偿失
3.“丁烯裂解法”是一种重要的丙烯生产法,在生产过程中会有生成乙烯的副反应发生。反应如下:
测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(T)和压强(p)变化的趋势分别如图甲和图乙所示:
(1)平衡体系中的C3H6(g)和C2H4(g)的质量比是工业生产C3H6(g)时选择反应条件的重要依据之一,从产物的纯度考虑,该数值越高越好,据图甲和图乙判断,反应条件应选择______(填序号)。
A.300 ℃、0.1 Mpa B.700 ℃、0.1 MPa
C.300 ℃、0.5 MPa D.700 ℃、0.5 MPa
(2)有研究者结合图甲数据并综合考虑各种因素,认为450 ℃的反应温度比300 ℃或700 ℃更合适,从反应原理角度分析其理由可能是___________________________________________________________________________________________________________。
[解析] (1)由图甲可知,300 ℃时C2H4(g)的质量分数接近于0,而温度升高,C2H4(g)的质量分数增大,故选择300 ℃;由图乙可知,压强增大,C2H4(g)的质量分数减小,C3H6(g)的质量分数增大,故选0.5 MPa,因此控制反应条件为300 ℃、0.5 MPa。(2)温度越低,反应速率越慢,由图甲可知,300 ℃时反应速率慢;温度升高,C2H4(g)的质量分数增大,700 ℃的副反应的转化率大于丁烯转化成丙烯的转化率。而450 ℃时,C3H6(g)的质量分数达最大值,且C2H4(g)的质量分数在10%左右,产物中C3H6(g)的含量较高,故450 ℃更合适。
[答案] (1)C (2)300 ℃反应速率慢,700 ℃副反应的转化率大于丁烯转化成丙烯的转化率
知识点三 化学反应的方向
03
必备知识梳理
关键能力训练
1.自发过程(自发反应)
(1)定义:一定条件下不需要外界作用就能进行的过程(或反应)称为自发过程(或自发反应)。
(2)特点
①大多数______反应(ΔH____0)可以自发进行。
②大多数混乱度______的反应(熵变ΔS____0)可以自发进行。
放热
<
增大
>
自发反应(过程)指的是在一定条件下有自发进行的倾向而不一定发生,如燃烧反应是自发反应,但在常温下不一定燃烧。
2.熵与熵变
(1)熵:描述体系__________的物理量,符号为S。熵值越大,体系________越大。
(2)熵变:ΔS=S(生成物)-S(反应物)。
(3)常见的熵增过程
①同一种物质由固态到液态再到气态:S(s)
③固体参加生成气体的反应,如C(s)+H2O(g) CO(g)+H2(g)。
混乱程度
混乱度
增加
3.化学反应方向的判定
(1)判定依据
<
>
>0
=0
<0
(2)一般规律
①ΔH____0、ΔS____0,任何温度下都能自发进行。
②ΔH____0、ΔS____0,任何温度下都不能自发进行。
③ΔH和ΔS的作用相反,且相差不大时,______对反应的方向起决定性作用。当ΔH<0、ΔS<0时,______下反应能自发进行;当ΔH>0、ΔS>0时,______下反应能自发进行。
<
>
>
<
温度
低温
高温
1.已知:ΔG=ΔH—TΔS,当ΔG<0,反应能自发进行,ΔG>0反应不能自发进行。下列说法中正确的是( )
A.非自发反应在任何条件下都不能发生
B.熵增加且放热的反应一定是自发反应
C.自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应
D.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
B [A.非自发反应在一定条件下也能发生,如碳酸钙的分解反应在常温下不能自发进行,在高温下就可以自发进行,错误;B.熵增加且放热的反应,ΔS>0、ΔH<0,则ΔG=ΔH-TΔS<0,反应一定能自发进行,正确;C.反应能否自发进行,由熵变、焓变和反应温度共同决定,所以熵增加、熵减小或熵不变的反应都可能自发进行,错误;D.根据上述分析可知,反应能否自发进行,由熵变、焓变和反应温度共同决定,所以放热反应或吸热反应都可能自发进行,错误。]
2.回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)===2CO(g)+O2(g),该反应的ΔH________0,ΔS________0(填“>”“<”或“=”),在低温下,该反应________(填“能”或“不能”)自发进行。
(2)超声速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO 2CO2+N2。若反应在常温下能够自发进行,则反应的ΔH______(填“>”“<”或“=”)0。
(3)已知在100 kPa、298 K时石灰石分解反应
CaCO3(s)===CaO(s)+CO2(g)的ΔH>0,ΔS>0。
①常温下,该反应________(填“能”或“不能”)自发进行。
②据本题反应数据分析,温度________(填“能”或“不能”)成为反应进行方向的决定因素。
(4)已知CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是________。
(5)某吸热反应能自发进行,则该反应的ΔS________(填“>”或“<”)0。
[解析] (1)由于CO在O2中燃烧生成CO2为放热反应,则二氧化碳分解生成CO和O2的反应为吸热反应,ΔH>0,根据化学方程式可知,反应后气体的化学计量数之和增加,ΔS>0,故低温下ΔG=ΔH-TΔS>0,反应不能自发进行。(2)ΔG=ΔH-TΔS<0时反应自发进行,通过化学方程式可知常温下ΔS<0,常温下反应能够自发进行,则ΔH<0。(3)①根据ΔG=ΔH-TΔS<0时反应自发进行,已知ΔH>0,ΔS>0,则常温下不能自发进行;②该反应的ΔH>0、ΔS>0,高温条件下能使ΔG=ΔH-TΔS<0,而常温条件下ΔG=ΔH-TΔS>0,则该反应中温度能成为决定反应进行方向的因素。(4)该反应的ΔS>0、ΔH>0,则高温时ΔG=ΔH-TΔS<0,反应能自发进行。(5)已知某吸热反应能自发进行,即ΔG=ΔH-TΔS<0,ΔH>0,则ΔS>0。
[答案] (1)> > 不能 (2)< (3)①不能 ②能 (4)高温 (5)>
真题感悟·明确考向
04
1.(2022·河北选择性考试,节选)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
1
3
2
4
下列操作中,能提高CH4(g)平衡转化率的是________(填标号)。
A.增加CH4(g)用量
B.恒温恒压下通入惰性气体
C.移除CO(g)
D.加入催化剂
1
3
2
4
[解析] A项,增加CH4(g)用量,α(CH4)减小,错误;B项,恒温恒压通入惰性气体,相当于减压,反应Ⅰ正向移动,α(CH4)增大,正确;C项,移除CO(g),反应Ⅰ正向移动,α(CH4)增大,正确;D项,加入催化剂,不影响平衡,α(CH4)不变,错误。
[答案] BC
1
3
2
4
2.(2022·全国甲卷,T28节选)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH1=172 kJ·mol-1,Kp1=1.0×10-2
(ⅱ)碳氯化:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g)
ΔH2=-51 kJ·mol-1,Kp2=1.2×1012Pa
1
3
2
4
(1)反应2C(s)+O2(g)===2CO(g)的ΔH为________kJ·mol-1,Kp=________Pa。
(2)碳氯化的反应趋势远大于直接氯化,其原因是__________________。
(3)对于碳氯化反应:增大压强,平衡________移动(填“向左”“向右”或“不”);温度升高,平衡转化率________(填“变大”“变小”或“不变”) 。
1
3
2
4
1
3
2
4
[答案] (1)-223 1.2×1014 (2)碳氯化反应气体分子数增加,ΔH小于0,是熵增、放热的反应,熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变且是吸热过程 (3)向左 变小
1
3
2
4
3.(2022·辽宁选择性考试,节选)已知合成氨反应为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,ΔS=-200 J·K-1·mol-1。
(1)合成氨反应在常温下________(填“能”或“不能”)自发。
(2)________温(填“高”或“低”,下同)有利于提高反应速率,________温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400~500 ℃。
1
3
2
4
[解析] (1)ΔG=ΔH-TΔS=-92.4 kJ·mol-1-298 K×(-200 J·K-1·mol-1)×10-3 kJ·J-1=-32.8 kJ·mol-1<0。
[答案] (1)能 (2)高 低
1
3
2
4
2
3
4
1
4.(2021·广东选择性考试,T19节选)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
2
3
4
1
(1)根据盖斯定律,反应a的ΔH1=______________(写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有________。
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
2
3
4
1
[解析] (1)由题给反应方程式可知,反应a可由反应c-d或反应b+c-e得到,故根据盖斯定律,ΔH1=ΔH3-ΔH4或ΔH1=ΔH2+ΔH3-ΔH5。(2)增大CO2的浓度,反应a、b的正反应速率增加;增大CH4的浓度,反应a、c的正反应速率增加,A正确。由于C(s)是固体,移去部分C(s),平衡不移动,B错误。催化剂只能改变反应速率,不影响化学平衡移动,则不能提高CH4的平衡转化率,C错误。降低反应温度,正、逆反应速率均减小,D正确。
[答案] (1)ΔH3-ΔH4(或ΔH2+ΔH3-ΔH5) (2)AD
2
3
4
1
谢谢观看 THANK YOU!
同课章节目录
