1.1物质的分类及变化(含解析)同步练习2023——2024学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1物质的分类及变化(含解析)同步练习2023——2024学年高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 10:31:39 | ||
图片预览



文档简介
1.1物质的分类及变化同步练习
姓名()班级()学号()
一、选择题
1.下列关于分散系的说法正确的是
A.烟、云、雾都是胶体
B.氢氧化铁胶体属于纯净物
C.稀氯化铁溶液具有丁达尔效应
D.过滤可分离氢氧化铁胶体和氯化铁溶液
2.金属及其化合物转化关系是化学学习的重要内容之一、下列各组物质的转化关系中不全部是通过一步反应完成的是
A.
B.
C.
D.
3.“PM2.5”是指大气中直径小于或等于 2.5μm(1μm=10-6m)的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是
A.PM2.5在空气中形成的分散系为胶体
B.云、雾、烟属于胶体,能产生丁达尔效应
C.实施绿化工程,可以有效地防治PM2.5污染
D.PM2.5表面积大能吸附大量的有毒、有害物质
4.下列物质间的转化不能一步完成的是
A.
B.
C.
D.
5.分类是学习化学的一种重要方法,下表中物质分类组合完全正确的是
选项 强酸 弱酸 酸性氧化物 碱 盐
A 硝酸 熟石灰 NaCl
B 硫酸 冰醋酸 碱式碳酸铜
C 盐酸 亚硫酸 氨水 小苏打
D
A.A B.B C.C D.D
6.科学家制得一种新型分子。关于和的下列说法不正确的是
A.互为同素异形体 B.均属于纯净物
C.化学性质均相同 D.都属于单质
7.许多食品包装袋中常有一个小纸袋,纸袋内盛白色固体物质,标有“干燥剂”字样,白色固体的主要成分为生石灰(CaO),下列说法正确的是
A.生石灰常用于建筑材料
B.常温下,CaCO3可分解成CaO和CO2
C.CaO中钙元素与氧元素的质量之比为1:1
D.相同质量的块状生石灰比粉末状生石灰的干燥效果好
8.魔术“水”变红(如图),杯子中事先涂有酚酞溶液,然后加入“水”,则加入的“水”是
A.NaOH溶液 B.HNO3溶液 C.H2O D.NaCl溶液
9.下列物质在给定条件下的转化均能一步实现的是
A. B.
C. D.
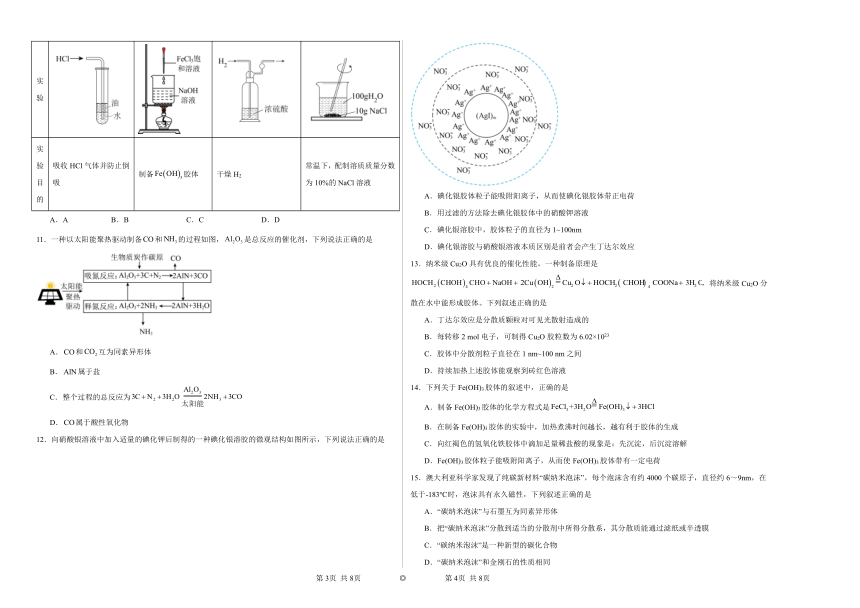
10.化学是一门以实验为基础的学科,如图所示的实验装置或操作能达到实验目的的是
选项 A B C D
实验
实验目的 吸收HCl气体并防止倒吸 制备胶体 干燥H2 常温下,配制溶质质量分数为10%的NaCl溶液
A.A B.B C.C D.D
11.一种以太阳能聚热驱动制备和的过程如图,是总反应的催化剂,下列说法正确的是
A.和互为同素异形体
B.属于盐
C.整个过程的总反应为
D.属于酸性氧化物
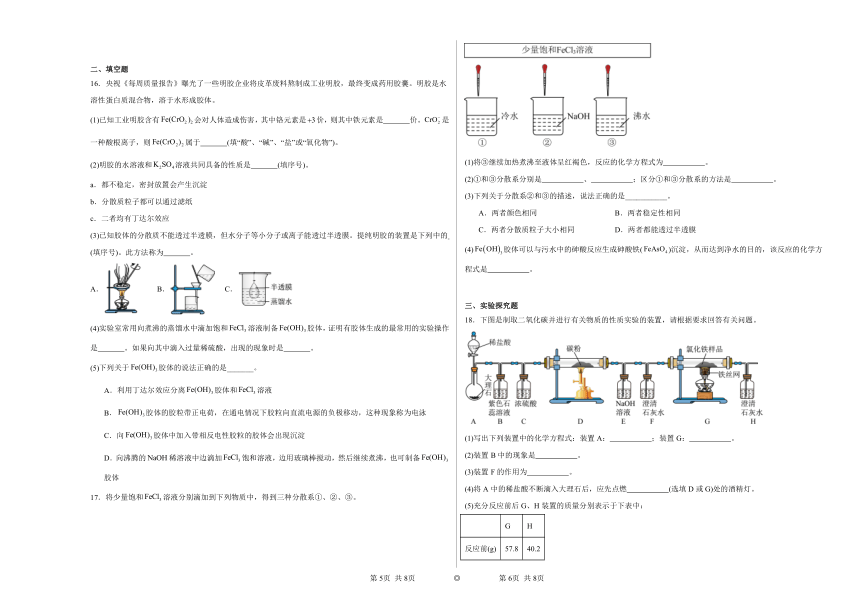
12.向硝酸银溶液中加入适量的碘化钾后制得的一种碘化银溶胶的微观结构如图所示,下列说法正确的是
A.碘化银胶体粒子能吸附阳离子,从而使碘化银胶体带正电荷
B.用过滤的方法除去碘化银胶体中的硝酸钾溶液
C.碘化银溶胶中,胶体粒子的直径为1~100nm
D.碘化银溶胶与硝酸银溶液本质区别是前者会产生丁达尔效应
13.纳米级Cu2O具有优良的催化性能。一种制备原理是,将纳米级Cu2O分散在水中能形成胶体。下列叙述正确的是
A.丁达尔效应是分散质颗粒对可见光散射造成的
B.每转移2 mol电子,可制得Cu2O胶粒数为6.02×1023
C.胶体中分散剂粒子直径在1 nm~100 nm之间
D.持续加热上述胶体能观察到砖红色溶液
14.下列关于Fe(OH)3胶体的叙述中,正确的是
A.制备Fe(OH)3胶体的化学方程式是
B.在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C.向红褐色的氢氧化铁胶体中滴加足量稀盐酸的现象是:先沉淀,后沉淀溶解
D.Fe(OH)3胶体粒子能吸附阳离子,从而使Fe(OH)3胶体带有一定电荷
15.澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6~9nm,在低于-183℃时,泡沫具有永久磁性,下列叙述正确的是
A.“碳纳米泡沫”与石墨互为同素异形体
B.把“碳纳米泡沫”分散到适当的分散剂中所得分散系,其分散质能通过滤纸或半透膜
C.“碳纳米泡沫”是一种新型的碳化合物
D.“碳纳米泡沫”和金刚石的性质相同
二、填空题
16.央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知工业明胶含有会对人体造成伤害,其中铬元素是价,则其中铁元素是 价。是一种酸根离子,则属于 (填“酸”、“碱”、“盐”或“氧化物”)。
(2)明胶的水溶液和溶液共同具备的性质是 (填序号)。
a.都不稳定,密封放置会产生沉淀
b.分散质粒子都可以通过滤纸
c.二者均有丁达尔效应
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的 (填序号)。此方法称为 。
A. B. C.
(4)实验室常用向煮沸的蒸馏水中滴加饱和溶液制备胶体,证明有胶体生成的最常用的实验操作是 。如果向其中滴入过量稀硫酸,出现的现象时是 。
(5)下列关于胶体的说法正确的是_______。
A.利用丁达尔效应分离胶体和溶液
B.胶体的胶粒带正电荷,在通电情况下胶粒向直流电源的负极移动,这种现象称为电泳
C.向胶体中加入带相反电性胶粒的胶体会出现沉淀
D.向沸腾的稀溶液中边滴加饱和溶液,边用玻璃棒搅动,然后继续煮沸,也可制备胶体
17.将少量饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
(1)将③继续加热煮沸至液体呈红褐色,反应的化学方程式为 。
(2)①和③分散系分别是 、 ;区分①和③分散系的方法是 。
(3)下列关于分散系②和③的描述,说法正确的是___________。
A.两者颜色相同 B.两者稳定性相同
C.两者分散质粒子大小相同 D.两者都能透过半透膜
(4)胶体可以与污水中的砷酸反应生成砷酸铁()沉淀,从而达到净水的目的,该反应的化学方程式是 。
三、实验探究题
18.下图是制取二氧化碳并进行有关物质的性质实验的装置,请根据要求回答有关问题。
(1)写出下列装置中的化学方程式:装置A: ;装置G: 。
(2)装置B中的现象是 。
(3)装置F的作用为 。
(4)将A中的稀盐酸不断滴入大理石后,应先点燃 (选填D或G)处的酒精灯。
(5)充分反应前后G、H装置的质量分别表示于下表中:
G H
反应前(g) 57.8 40.2
反应后(g) 55.4 44.6
则样品中氧化铁的质量为 g。
(6)该装置有一处明显的不足,请给出改进的具体措施 。
19.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向饱和氯化铁溶液中加入少量的NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是 (填“甲”“乙”或“丙”)。该同学想证明Fe(OH)3胶体已经制备成功,他可以利用 (最简单的方法)进行鉴别。
(2)制备氢氧化铁胶体的化学方程式为 。
(3)在胶体中加入电解质溶液或带有相反电荷的胶体粒子能使胶体粒子沉淀出来。丁同学利用制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的液体颜色逐渐变深,这表明Fe(OH)3胶体微粒带 (带“正”或“负”)电荷。
②实验证明,物质的凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚力越大。向Fe(OH)3胶体加入下列物质时,其凝聚能力最强的为
A. NaCl B. FeCl3 C.K2SO4 D.Na3PO4
(4)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯Fe(OH)3胶体的装置是可用下列中的 (填选项)。
A. B. C.
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.烟、云、雾都是气胶体,A正确;
B.氢氧化铁胶体属于混合物,B错误;
C.稀氯化铁溶液分散质半径小于1纳米不具有丁达尔效应,C错误;
D.过滤可分离出沉淀和溶液,氢氧化铁胶体和氯化铁溶液分离用半透膜,D错误;
故选A。
2.B
【详解】A.NaOH→Na2CO3→NaCl中反应方程式分别为:2NaOH+CO2=Na2CO3 +H2O、Na2CO3+CaCl2=CaCO3↓+2NaCl,所以能一步实现,故A不符合题意;
B.中,CuO与水不反应,不能一步生成Cu(OH)2,故B符合题意;
C.中反应方程式分别为:Mg+2HCl=MgCl2+H2↑、MgCl2+2NaOH=2NaCl+Mg(OH)2↓、Mg(OH)2+H2SO4=MgSO4+2H2O,能一步实现,故C不符合题意;
D.中反应方程式分别是Fe(NO3)3+3NaOH=Fe(OH)3↓+3NaNO3、2Fe(OH)3Fe2O3+3H2O,能一步实现,故D不符合题意。
答案选B。
3.A
【详解】A.PM2.5的颗粒直径可能大于100nm,在空气中形成的分散系不一定是胶体,A错误;
B.云、雾、烟都是胶体,能产生丁达尔效应,B正确;
C.实施绿化工程,有利于减少水土流失等问题,可有效地防治PM2.5污染,C正确;
D.PM2.5表面积较大,能吸附大量的有毒、有害物质,D正确;
故答案选A。
4.C
【详解】A.都能一步完成,A正确;
B.都能一步完成,B正确;
C.过程中,不能一步完成,C错误;
D.都能一步完成,D正确;
故选C。
5.A
【详解】A.硝酸为强酸,为弱酸,为酸性氧化物,熟石灰为,属于碱,NaCl属于盐,A正确;
B.为碱性氧化物,属于有机物,B错误;
C.盐酸为的水溶液,为混合物,显酸性但是不属于酸,氨水为混合物,显碱性但不属于碱,C错误;
D.在水溶液中能电离出氢离子为盐,但不属于酸,属于酸式盐,不属于酸性氧化物,D错误;
故选A。
6.C
【详解】A.同素异形体是指同种元素形成的性质不同的单质,和互为同素异形体,A正确;
B.和都是单质,都属于纯净物,B正确;
C.和的结构不同,则化学性质也不相同,C错误;
D.和都是由O原子形成的单质,D正确;
故选C。
7.A
【详解】A.生石灰在建筑领域中有着广泛的应用。它被用作建筑材料的关键成分,如水泥、石灰浆和石灰砂浆,故A正确;
B.CaCO3在高温下可分解成CaO和CO2,故B错误;
C.CaO中钙元素与氧元素的质量之比为20:16=5:4,故C错误;
D.粉末状生石灰比表面积大,与介质接触面积大,干燥效果更好,故D错误;
故选A。
8.A
【详解】A.酚酞溶液遇到碱溶液变红,则水可以是NaOH溶液,A正确;
B.酸遇到酚酞不变色,则水不可以是HNO3溶液,B错误;
C.酚酞溶液加水不变色,C错误;
D.氯化钠溶液为中性,遇到酚酞溶液不变色,则水不可以是NaCl溶液,D错误;
故选A。
9.A
【详解】A.铁与硫酸铜溶液反应生成铜,铜加热条件下与氧气生成氧化铜,A正确;
B.,B错误;
C.溶液与不反应,C错误;
D.,D错误。
故选A。
10.C
【详解】A.油不能隔绝气体与水,图中不能防止倒吸,A错误;
B.NaOH溶液与FeCl3反应生成沉淀,应向沸水中滴加饱和FeCl3溶液制备胶体,B错误;
C.浓硫酸具有吸水性,且不与H2反应,可干燥H2,C正确;
D.常温下,配制溶质质量分数为10%的NaCl溶液,根据溶质质量分数=×100%,应向90g水中加入10gNaCl固体,D错误;
故选C。
11.C
【详解】A. 同素异形体为同种元素形成的不同种单质,CO与CO2为化合物,A错误;
B. 盐是由金属离子或者铵根离子与酸根离子形成的化合物,故氮化铝不是盐类,B错误;
C. 将吸氮反应与释氮反应的方程式相加得到总方程式,其中Al2O3为催化剂,AlN为中间产物:,C正确;
D. CO属于不成盐氧化物,D错误;
答案选C。
12.C
【详解】A.碘化银胶体粒子能吸附阳离子,从而使碘化银胶粒带正电荷,碘化银胶体不带电荷,故A错误;
B.胶体粒子能透过滤纸,不能用过滤的方法除去碘化银胶体中的硝酸钾溶液,应该用渗析的方法除去碘化银胶体中的硝酸钾溶液,故B错误;
C.根据胶体的定义,碘化银溶胶中,胶体粒子的直径为1~100nm,故C正确;
D.碘化银溶胶与硝酸银溶液本质区别是分散质粒子直径不同,故D错误;
选C。
13.A
【详解】A.丁达尔效应是胶体中分散质颗粒对可见光散射造成的,可利用丁达尔效应区分溶液和胶体,A正确;
B.每转移2 mol电子,可制得1molCu2O,但Cu2O胶粒是由许许多多个Cu2O构成,所以生成Cu2O胶粒数小于6.02×1023,B不正确;
C.胶体中,分散质粒子直径在1 nm~100 nm之间,分散剂通常为水,其粒子直径小于1nm,C不正确;
D.胶体长时间受热会产生凝聚,所以持续加热上述胶体能观察到有砖红色沉淀生成,D不正确;
故选A。
14.C
【详解】A.制备Fe(OH)3胶体的化学方程式是,故A错误;
B.在制备Fe(OH)3胶体的实验中,加热煮沸时间过长,胶体发生聚沉产生沉淀,故B错误;
C.向红褐色的氢氧化铁胶体中滴加足量稀盐酸,先胶体聚沉,后氢氧化铁与盐酸反应生成氯化铁和水,沉淀又溶解,故C正确;
D.Fe(OH)3胶体粒子能吸附阳离子,从而使Fe(OH)3胶体粒子带有一定电荷,胶体为电中性,胶体不带电,故D错误;
选C。
15.A
【详解】A.“碳纳米泡沫”只含有一种元素,属于碳单质,与石墨互为同素异形体,A正确;
B.“碳纳米泡沫”每个泡沫含有约4000个碳原子,直径约6到9nm,分散到适当的溶剂中形成胶体,其分散质能通过滤纸不能通过半透膜,B错误;
C.“碳纳米泡沫”只含有一种元素,属于碳单质,不是化合物,C错误;
D.“碳纳米泡沫”在低于-183℃时,泡沫具有永久磁性,金刚石没有磁性,二者性质不同,D错误;
故选A。
16.(1) 盐
(2)b
(3) C 渗析
(4) 让一束可见光通过制得的分散系,从侧面观察到一条光亮的“通路”,说明制得的是胶体 先生成红褐色沉淀,后逐渐溶解,变为黄色溶液
(5)BC
【详解】(1)中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价;是一种酸根离子,则是由亚铁离子和组成的盐。
(2)a.溶液很稳定,a项错误;
b.胶体和溶液中的分散质粒子都能透过滤纸,b项正确;
c.胶体具有丁达尔效应而溶液没有,c项错误;
故答案为b。
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜,可以是使用渗析的方法提纯,装置为C;
(4)光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达尔效应;故证明有胶体生成的最常用的实验操作是让一束可见光通过制得的分散系,从侧面观察到一条光亮的“通路”,说明制得的是胶体。如果向其中滴入过量稀硫酸,会首先使得胶体发生聚沉,出现红褐色沉淀,沉淀又和稀硫酸反应生成硫酸铁溶液,故出现的现象时是先生成红褐色沉淀,后逐渐溶解,变为黄色溶液;
(5)A.胶体具有丁达尔效应而溶液没有,利用丁达尔效应区分胶体和溶液,但是不能分离,分离两者需要使用渗析,错误;
B.异种电荷相互吸引,胶体的胶粒带正电荷,在通电情况下胶粒向直流电源的负极移动,这种现象称为电泳,正确;
C.向胶体中加入带相反电性胶粒,破坏了胶体的稳定,使得胶体会出现沉淀,正确;
D.向沸腾的稀溶液中边滴加饱和溶液,边用玻璃棒搅动,然后继续煮沸,会得到氢氧化铁沉淀,不可制备胶体;制取红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色;错误;
故选BC。
17.(1)
(2) 溶液 胶体 使用一束光线照射,然后观察现象
(3)A
(4)
【详解】(1)制取红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色;;
(2)胶体是分散质粒子大小在 1nm~100nm 的分散系;溶液是分散质粒子大小于1nm的分散系;浊液是分散质粒子大于100nm的分散系;①和③分散系分别是溶液、胶体;光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达尔效应;区分①和③分散系的方法是使用一束光线照射,然后观察现象;
(3)②为氢氧化钠和氯化铁生成氢氧化铁红褐色沉淀,得到浊液;③得到氢氧化铁胶体;
A.两者颜色相同,均为红褐色,A正确;
B.浊液与胶体稳定性不同,B错误;
C.胶体和浊液本质区别是分散质的颗粒大小不同,C错误;
D.胶体能透过半透膜、而浊液不能,D错误;
故选A。
(4)胶体可以与污水中的砷酸反应生成砷酸铁()沉淀,同时生成水,该反应的化学方程式是。
18.(1) CaCO3+2HCl=CaCl2+H2O+CO2↑ 3CO+ Fe2O3 2Fe + 3CO2
(2)紫色变红色
(3)检验二氧化碳是否被除净
(4)D
(5)8
(6)把H中的澄清石灰水换成氢氧化钡溶液,并添加尾气处理装置(点燃或气囊收集CO)
【分析】A中产生二氧化碳,B检验二氧化碳和水反应生成碳酸,C干燥二氧化碳,D中生产CO其他,E吸收未反应的二氧化碳,F检验二氧化碳是否被除净;G中CO还原氧化铁,H检验二氧化碳的生成;
【详解】(1)A中大理石与和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;G中高温下一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+ Fe2O3 2Fe + 3CO2;
(2)二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊试液变红,因此实验过程中装置B中的现象是液体由紫色变红色;
(3)二氧化碳能使澄清的石灰水变浑浊,可用澄清的石灰水来检验二氧化碳的存在,为排除二氧化碳对G装置中反应产物检验的干扰,装置F的作用是检验二氧化碳是否被除净;
(4)在实验中为防止爆炸,先通入一氧化碳排净装置内的空气,所以应该先点燃D处的酒精灯;
(5)根据化学方程式为3CO+ Fe2O3 2Fe + 3CO2可知,G装置内固体减少的质量即为氧化铁中氧元素的质量,即:57.8g﹣55.4g=2.4g。
设:氧化铁的质量为x,则有: =2.4g, x=8g。
(6)由(5)数据可知,8g氧化铁充分反应生成CO2为,而H中增重4.4g,则G中生成的二氧化碳未被完全吸收,可能是石灰水浓度太低引起的,且反应中有有毒气体CO,故该装置的缺陷是不能完全吸收二氧化碳、又没有尾气处理装置,该装置改进的具体措施为:把H中的澄清石灰水换成氢氧化钡溶液(以充分吸收二氧化碳),并添加尾气处理装置(点燃或气囊收集CO)。
19.(1) 丙 丁达尔效应
(2)
(3) 正 D
(4)C
【详解】(1)Fe(OH)3胶体制备的方法为:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热;可用丁达尔效应鉴别胶体已制备成功;
(2)制备氢氧化铁胶体为FeCl3与H2O反应生成Fe(OH)3胶体和HCl,化学方程式为;
(3)①电泳实验,阴极附近的液体颜色逐渐变深,说明阴极吸引了Fe(OH)3胶体微粒,则Fe(OH)3胶体微粒带正电荷;②物质的凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚力越大,所带的负电荷数最大,故选D;
(4)胶体的分散质可以透过滤纸,不可以透过半透膜,提纯Fe(OH)3胶体可以用半透膜装置,让杂质小分子透过半透膜,胶体分散质留下来,起到提纯作用。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、选择题
1.下列关于分散系的说法正确的是
A.烟、云、雾都是胶体
B.氢氧化铁胶体属于纯净物
C.稀氯化铁溶液具有丁达尔效应
D.过滤可分离氢氧化铁胶体和氯化铁溶液
2.金属及其化合物转化关系是化学学习的重要内容之一、下列各组物质的转化关系中不全部是通过一步反应完成的是
A.
B.
C.
D.
3.“PM2.5”是指大气中直径小于或等于 2.5μm(1μm=10-6m)的细小颗粒物,也称为可入肺颗粒物。下列有关说法中错误的是
A.PM2.5在空气中形成的分散系为胶体
B.云、雾、烟属于胶体,能产生丁达尔效应
C.实施绿化工程,可以有效地防治PM2.5污染
D.PM2.5表面积大能吸附大量的有毒、有害物质
4.下列物质间的转化不能一步完成的是
A.
B.
C.
D.
5.分类是学习化学的一种重要方法,下表中物质分类组合完全正确的是
选项 强酸 弱酸 酸性氧化物 碱 盐
A 硝酸 熟石灰 NaCl
B 硫酸 冰醋酸 碱式碳酸铜
C 盐酸 亚硫酸 氨水 小苏打
D
A.A B.B C.C D.D
6.科学家制得一种新型分子。关于和的下列说法不正确的是
A.互为同素异形体 B.均属于纯净物
C.化学性质均相同 D.都属于单质
7.许多食品包装袋中常有一个小纸袋,纸袋内盛白色固体物质,标有“干燥剂”字样,白色固体的主要成分为生石灰(CaO),下列说法正确的是
A.生石灰常用于建筑材料
B.常温下,CaCO3可分解成CaO和CO2
C.CaO中钙元素与氧元素的质量之比为1:1
D.相同质量的块状生石灰比粉末状生石灰的干燥效果好
8.魔术“水”变红(如图),杯子中事先涂有酚酞溶液,然后加入“水”,则加入的“水”是
A.NaOH溶液 B.HNO3溶液 C.H2O D.NaCl溶液
9.下列物质在给定条件下的转化均能一步实现的是
A. B.
C. D.
10.化学是一门以实验为基础的学科,如图所示的实验装置或操作能达到实验目的的是
选项 A B C D
实验
实验目的 吸收HCl气体并防止倒吸 制备胶体 干燥H2 常温下,配制溶质质量分数为10%的NaCl溶液
A.A B.B C.C D.D
11.一种以太阳能聚热驱动制备和的过程如图,是总反应的催化剂,下列说法正确的是
A.和互为同素异形体
B.属于盐
C.整个过程的总反应为
D.属于酸性氧化物
12.向硝酸银溶液中加入适量的碘化钾后制得的一种碘化银溶胶的微观结构如图所示,下列说法正确的是
A.碘化银胶体粒子能吸附阳离子,从而使碘化银胶体带正电荷
B.用过滤的方法除去碘化银胶体中的硝酸钾溶液
C.碘化银溶胶中,胶体粒子的直径为1~100nm
D.碘化银溶胶与硝酸银溶液本质区别是前者会产生丁达尔效应
13.纳米级Cu2O具有优良的催化性能。一种制备原理是,将纳米级Cu2O分散在水中能形成胶体。下列叙述正确的是
A.丁达尔效应是分散质颗粒对可见光散射造成的
B.每转移2 mol电子,可制得Cu2O胶粒数为6.02×1023
C.胶体中分散剂粒子直径在1 nm~100 nm之间
D.持续加热上述胶体能观察到砖红色溶液
14.下列关于Fe(OH)3胶体的叙述中,正确的是
A.制备Fe(OH)3胶体的化学方程式是
B.在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C.向红褐色的氢氧化铁胶体中滴加足量稀盐酸的现象是:先沉淀,后沉淀溶解
D.Fe(OH)3胶体粒子能吸附阳离子,从而使Fe(OH)3胶体带有一定电荷
15.澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6~9nm,在低于-183℃时,泡沫具有永久磁性,下列叙述正确的是
A.“碳纳米泡沫”与石墨互为同素异形体
B.把“碳纳米泡沫”分散到适当的分散剂中所得分散系,其分散质能通过滤纸或半透膜
C.“碳纳米泡沫”是一种新型的碳化合物
D.“碳纳米泡沫”和金刚石的性质相同
二、填空题
16.央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知工业明胶含有会对人体造成伤害,其中铬元素是价,则其中铁元素是 价。是一种酸根离子,则属于 (填“酸”、“碱”、“盐”或“氧化物”)。
(2)明胶的水溶液和溶液共同具备的性质是 (填序号)。
a.都不稳定,密封放置会产生沉淀
b.分散质粒子都可以通过滤纸
c.二者均有丁达尔效应
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的 (填序号)。此方法称为 。
A. B. C.
(4)实验室常用向煮沸的蒸馏水中滴加饱和溶液制备胶体,证明有胶体生成的最常用的实验操作是 。如果向其中滴入过量稀硫酸,出现的现象时是 。
(5)下列关于胶体的说法正确的是_______。
A.利用丁达尔效应分离胶体和溶液
B.胶体的胶粒带正电荷,在通电情况下胶粒向直流电源的负极移动,这种现象称为电泳
C.向胶体中加入带相反电性胶粒的胶体会出现沉淀
D.向沸腾的稀溶液中边滴加饱和溶液,边用玻璃棒搅动,然后继续煮沸,也可制备胶体
17.将少量饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
(1)将③继续加热煮沸至液体呈红褐色,反应的化学方程式为 。
(2)①和③分散系分别是 、 ;区分①和③分散系的方法是 。
(3)下列关于分散系②和③的描述,说法正确的是___________。
A.两者颜色相同 B.两者稳定性相同
C.两者分散质粒子大小相同 D.两者都能透过半透膜
(4)胶体可以与污水中的砷酸反应生成砷酸铁()沉淀,从而达到净水的目的,该反应的化学方程式是 。
三、实验探究题
18.下图是制取二氧化碳并进行有关物质的性质实验的装置,请根据要求回答有关问题。
(1)写出下列装置中的化学方程式:装置A: ;装置G: 。
(2)装置B中的现象是 。
(3)装置F的作用为 。
(4)将A中的稀盐酸不断滴入大理石后,应先点燃 (选填D或G)处的酒精灯。
(5)充分反应前后G、H装置的质量分别表示于下表中:
G H
反应前(g) 57.8 40.2
反应后(g) 55.4 44.6
则样品中氧化铁的质量为 g。
(6)该装置有一处明显的不足,请给出改进的具体措施 。
19.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向饱和氯化铁溶液中加入少量的NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是 (填“甲”“乙”或“丙”)。该同学想证明Fe(OH)3胶体已经制备成功,他可以利用 (最简单的方法)进行鉴别。
(2)制备氢氧化铁胶体的化学方程式为 。
(3)在胶体中加入电解质溶液或带有相反电荷的胶体粒子能使胶体粒子沉淀出来。丁同学利用制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的液体颜色逐渐变深,这表明Fe(OH)3胶体微粒带 (带“正”或“负”)电荷。
②实验证明,物质的凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚力越大。向Fe(OH)3胶体加入下列物质时,其凝聚能力最强的为
A. NaCl B. FeCl3 C.K2SO4 D.Na3PO4
(4)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯Fe(OH)3胶体的装置是可用下列中的 (填选项)。
A. B. C.
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.烟、云、雾都是气胶体,A正确;
B.氢氧化铁胶体属于混合物,B错误;
C.稀氯化铁溶液分散质半径小于1纳米不具有丁达尔效应,C错误;
D.过滤可分离出沉淀和溶液,氢氧化铁胶体和氯化铁溶液分离用半透膜,D错误;
故选A。
2.B
【详解】A.NaOH→Na2CO3→NaCl中反应方程式分别为:2NaOH+CO2=Na2CO3 +H2O、Na2CO3+CaCl2=CaCO3↓+2NaCl,所以能一步实现,故A不符合题意;
B.中,CuO与水不反应,不能一步生成Cu(OH)2,故B符合题意;
C.中反应方程式分别为:Mg+2HCl=MgCl2+H2↑、MgCl2+2NaOH=2NaCl+Mg(OH)2↓、Mg(OH)2+H2SO4=MgSO4+2H2O,能一步实现,故C不符合题意;
D.中反应方程式分别是Fe(NO3)3+3NaOH=Fe(OH)3↓+3NaNO3、2Fe(OH)3Fe2O3+3H2O,能一步实现,故D不符合题意。
答案选B。
3.A
【详解】A.PM2.5的颗粒直径可能大于100nm,在空气中形成的分散系不一定是胶体,A错误;
B.云、雾、烟都是胶体,能产生丁达尔效应,B正确;
C.实施绿化工程,有利于减少水土流失等问题,可有效地防治PM2.5污染,C正确;
D.PM2.5表面积较大,能吸附大量的有毒、有害物质,D正确;
故答案选A。
4.C
【详解】A.都能一步完成,A正确;
B.都能一步完成,B正确;
C.过程中,不能一步完成,C错误;
D.都能一步完成,D正确;
故选C。
5.A
【详解】A.硝酸为强酸,为弱酸,为酸性氧化物,熟石灰为,属于碱,NaCl属于盐,A正确;
B.为碱性氧化物,属于有机物,B错误;
C.盐酸为的水溶液,为混合物,显酸性但是不属于酸,氨水为混合物,显碱性但不属于碱,C错误;
D.在水溶液中能电离出氢离子为盐,但不属于酸,属于酸式盐,不属于酸性氧化物,D错误;
故选A。
6.C
【详解】A.同素异形体是指同种元素形成的性质不同的单质,和互为同素异形体,A正确;
B.和都是单质,都属于纯净物,B正确;
C.和的结构不同,则化学性质也不相同,C错误;
D.和都是由O原子形成的单质,D正确;
故选C。
7.A
【详解】A.生石灰在建筑领域中有着广泛的应用。它被用作建筑材料的关键成分,如水泥、石灰浆和石灰砂浆,故A正确;
B.CaCO3在高温下可分解成CaO和CO2,故B错误;
C.CaO中钙元素与氧元素的质量之比为20:16=5:4,故C错误;
D.粉末状生石灰比表面积大,与介质接触面积大,干燥效果更好,故D错误;
故选A。
8.A
【详解】A.酚酞溶液遇到碱溶液变红,则水可以是NaOH溶液,A正确;
B.酸遇到酚酞不变色,则水不可以是HNO3溶液,B错误;
C.酚酞溶液加水不变色,C错误;
D.氯化钠溶液为中性,遇到酚酞溶液不变色,则水不可以是NaCl溶液,D错误;
故选A。
9.A
【详解】A.铁与硫酸铜溶液反应生成铜,铜加热条件下与氧气生成氧化铜,A正确;
B.,B错误;
C.溶液与不反应,C错误;
D.,D错误。
故选A。
10.C
【详解】A.油不能隔绝气体与水,图中不能防止倒吸,A错误;
B.NaOH溶液与FeCl3反应生成沉淀,应向沸水中滴加饱和FeCl3溶液制备胶体,B错误;
C.浓硫酸具有吸水性,且不与H2反应,可干燥H2,C正确;
D.常温下,配制溶质质量分数为10%的NaCl溶液,根据溶质质量分数=×100%,应向90g水中加入10gNaCl固体,D错误;
故选C。
11.C
【详解】A. 同素异形体为同种元素形成的不同种单质,CO与CO2为化合物,A错误;
B. 盐是由金属离子或者铵根离子与酸根离子形成的化合物,故氮化铝不是盐类,B错误;
C. 将吸氮反应与释氮反应的方程式相加得到总方程式,其中Al2O3为催化剂,AlN为中间产物:,C正确;
D. CO属于不成盐氧化物,D错误;
答案选C。
12.C
【详解】A.碘化银胶体粒子能吸附阳离子,从而使碘化银胶粒带正电荷,碘化银胶体不带电荷,故A错误;
B.胶体粒子能透过滤纸,不能用过滤的方法除去碘化银胶体中的硝酸钾溶液,应该用渗析的方法除去碘化银胶体中的硝酸钾溶液,故B错误;
C.根据胶体的定义,碘化银溶胶中,胶体粒子的直径为1~100nm,故C正确;
D.碘化银溶胶与硝酸银溶液本质区别是分散质粒子直径不同,故D错误;
选C。
13.A
【详解】A.丁达尔效应是胶体中分散质颗粒对可见光散射造成的,可利用丁达尔效应区分溶液和胶体,A正确;
B.每转移2 mol电子,可制得1molCu2O,但Cu2O胶粒是由许许多多个Cu2O构成,所以生成Cu2O胶粒数小于6.02×1023,B不正确;
C.胶体中,分散质粒子直径在1 nm~100 nm之间,分散剂通常为水,其粒子直径小于1nm,C不正确;
D.胶体长时间受热会产生凝聚,所以持续加热上述胶体能观察到有砖红色沉淀生成,D不正确;
故选A。
14.C
【详解】A.制备Fe(OH)3胶体的化学方程式是,故A错误;
B.在制备Fe(OH)3胶体的实验中,加热煮沸时间过长,胶体发生聚沉产生沉淀,故B错误;
C.向红褐色的氢氧化铁胶体中滴加足量稀盐酸,先胶体聚沉,后氢氧化铁与盐酸反应生成氯化铁和水,沉淀又溶解,故C正确;
D.Fe(OH)3胶体粒子能吸附阳离子,从而使Fe(OH)3胶体粒子带有一定电荷,胶体为电中性,胶体不带电,故D错误;
选C。
15.A
【详解】A.“碳纳米泡沫”只含有一种元素,属于碳单质,与石墨互为同素异形体,A正确;
B.“碳纳米泡沫”每个泡沫含有约4000个碳原子,直径约6到9nm,分散到适当的溶剂中形成胶体,其分散质能通过滤纸不能通过半透膜,B错误;
C.“碳纳米泡沫”只含有一种元素,属于碳单质,不是化合物,C错误;
D.“碳纳米泡沫”在低于-183℃时,泡沫具有永久磁性,金刚石没有磁性,二者性质不同,D错误;
故选A。
16.(1) 盐
(2)b
(3) C 渗析
(4) 让一束可见光通过制得的分散系,从侧面观察到一条光亮的“通路”,说明制得的是胶体 先生成红褐色沉淀,后逐渐溶解,变为黄色溶液
(5)BC
【详解】(1)中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价;是一种酸根离子,则是由亚铁离子和组成的盐。
(2)a.溶液很稳定,a项错误;
b.胶体和溶液中的分散质粒子都能透过滤纸,b项正确;
c.胶体具有丁达尔效应而溶液没有,c项错误;
故答案为b。
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜,可以是使用渗析的方法提纯,装置为C;
(4)光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达尔效应;故证明有胶体生成的最常用的实验操作是让一束可见光通过制得的分散系,从侧面观察到一条光亮的“通路”,说明制得的是胶体。如果向其中滴入过量稀硫酸,会首先使得胶体发生聚沉,出现红褐色沉淀,沉淀又和稀硫酸反应生成硫酸铁溶液,故出现的现象时是先生成红褐色沉淀,后逐渐溶解,变为黄色溶液;
(5)A.胶体具有丁达尔效应而溶液没有,利用丁达尔效应区分胶体和溶液,但是不能分离,分离两者需要使用渗析,错误;
B.异种电荷相互吸引,胶体的胶粒带正电荷,在通电情况下胶粒向直流电源的负极移动,这种现象称为电泳,正确;
C.向胶体中加入带相反电性胶粒,破坏了胶体的稳定,使得胶体会出现沉淀,正确;
D.向沸腾的稀溶液中边滴加饱和溶液,边用玻璃棒搅动,然后继续煮沸,会得到氢氧化铁沉淀,不可制备胶体;制取红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色;错误;
故选BC。
17.(1)
(2) 溶液 胶体 使用一束光线照射,然后观察现象
(3)A
(4)
【详解】(1)制取红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色;;
(2)胶体是分散质粒子大小在 1nm~100nm 的分散系;溶液是分散质粒子大小于1nm的分散系;浊液是分散质粒子大于100nm的分散系;①和③分散系分别是溶液、胶体;光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达尔效应;区分①和③分散系的方法是使用一束光线照射,然后观察现象;
(3)②为氢氧化钠和氯化铁生成氢氧化铁红褐色沉淀,得到浊液;③得到氢氧化铁胶体;
A.两者颜色相同,均为红褐色,A正确;
B.浊液与胶体稳定性不同,B错误;
C.胶体和浊液本质区别是分散质的颗粒大小不同,C错误;
D.胶体能透过半透膜、而浊液不能,D错误;
故选A。
(4)胶体可以与污水中的砷酸反应生成砷酸铁()沉淀,同时生成水,该反应的化学方程式是。
18.(1) CaCO3+2HCl=CaCl2+H2O+CO2↑ 3CO+ Fe2O3 2Fe + 3CO2
(2)紫色变红色
(3)检验二氧化碳是否被除净
(4)D
(5)8
(6)把H中的澄清石灰水换成氢氧化钡溶液,并添加尾气处理装置(点燃或气囊收集CO)
【分析】A中产生二氧化碳,B检验二氧化碳和水反应生成碳酸,C干燥二氧化碳,D中生产CO其他,E吸收未反应的二氧化碳,F检验二氧化碳是否被除净;G中CO还原氧化铁,H检验二氧化碳的生成;
【详解】(1)A中大理石与和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;G中高温下一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+ Fe2O3 2Fe + 3CO2;
(2)二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊试液变红,因此实验过程中装置B中的现象是液体由紫色变红色;
(3)二氧化碳能使澄清的石灰水变浑浊,可用澄清的石灰水来检验二氧化碳的存在,为排除二氧化碳对G装置中反应产物检验的干扰,装置F的作用是检验二氧化碳是否被除净;
(4)在实验中为防止爆炸,先通入一氧化碳排净装置内的空气,所以应该先点燃D处的酒精灯;
(5)根据化学方程式为3CO+ Fe2O3 2Fe + 3CO2可知,G装置内固体减少的质量即为氧化铁中氧元素的质量,即:57.8g﹣55.4g=2.4g。
设:氧化铁的质量为x,则有: =2.4g, x=8g。
(6)由(5)数据可知,8g氧化铁充分反应生成CO2为,而H中增重4.4g,则G中生成的二氧化碳未被完全吸收,可能是石灰水浓度太低引起的,且反应中有有毒气体CO,故该装置的缺陷是不能完全吸收二氧化碳、又没有尾气处理装置,该装置改进的具体措施为:把H中的澄清石灰水换成氢氧化钡溶液(以充分吸收二氧化碳),并添加尾气处理装置(点燃或气囊收集CO)。
19.(1) 丙 丁达尔效应
(2)
(3) 正 D
(4)C
【详解】(1)Fe(OH)3胶体制备的方法为:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热;可用丁达尔效应鉴别胶体已制备成功;
(2)制备氢氧化铁胶体为FeCl3与H2O反应生成Fe(OH)3胶体和HCl,化学方程式为;
(3)①电泳实验,阴极附近的液体颜色逐渐变深,说明阴极吸引了Fe(OH)3胶体微粒,则Fe(OH)3胶体微粒带正电荷;②物质的凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚力越大,所带的负电荷数最大,故选D;
(4)胶体的分散质可以透过滤纸,不可以透过半透膜,提纯Fe(OH)3胶体可以用半透膜装置,让杂质小分子透过半透膜,胶体分散质留下来,起到提纯作用。
答案第1页,共2页
答案第1页,共2页
