第三章 铁 金属材料 测试题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章 铁 金属材料 测试题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 453.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 13:40:40 | ||
图片预览



文档简介
第三章 铁金属材料 测试题
一、选择题
1.富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法错误的是
A.若加盐酸时有气体产生,不能证明脱氧剂未变质
B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质
C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质
D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已变质
2.下列物质不属于合金的是
A.不锈钢 B.金刚石 C.硬铝 D.特种钢
3.实验室配制FeSO4溶液时,为了保证得到较纯的FeSO4溶液,可往溶液中加入
A.铜粉 B.氯水 C.溴水 D.铁粉
4.在地壳中含量排第一的金属元素是
A.铁 B.氧 C.硅 D.铝
5.化学与生活息息相关,下列说法不正确的是
A.常温下,铝制品耐腐蚀是因为铝不活泼
B.金属钠可用于制造高压钠灯,常用作路灯
C.小苏打可作食品膨松剂
D.节假日里燃放的烟花利用了一些金属的焰色反应
6.部分被氧化的合金样品(氧化产物为)共5.76g,经如下处理:
下列说法不正确的是
A.滤液A中的阳离子为
B.样品中氧原子的物质的量为0.02mol
C.溶解样品的过程中消耗硫酸的总物质的量为0.04mol
D.
7.下列离子方程式书写正确的是:
A.常温下,铝遇到浓硝酸:
B.少量通入NaClO溶液中:
C.向溶液中加入过量NaOH溶液并加热:
D.向溶液中加溶液至中性:
8.下列物质对应的化学式不正确的是
A.重晶石: B.芒硝:
C.金刚砂: D.刚玉:
9.下列说法不正确的是
A.实验未用完的钠不可放回原试剂瓶,以免引起污染
B.硫酸亚铁溶液保存时需加入少量铁粉
C.次氯酸不稳定,难以保存,常制成具有漂白作用的次氯酸盐
D.氯水保存在棕色细口瓶中,置于阴凉干燥处
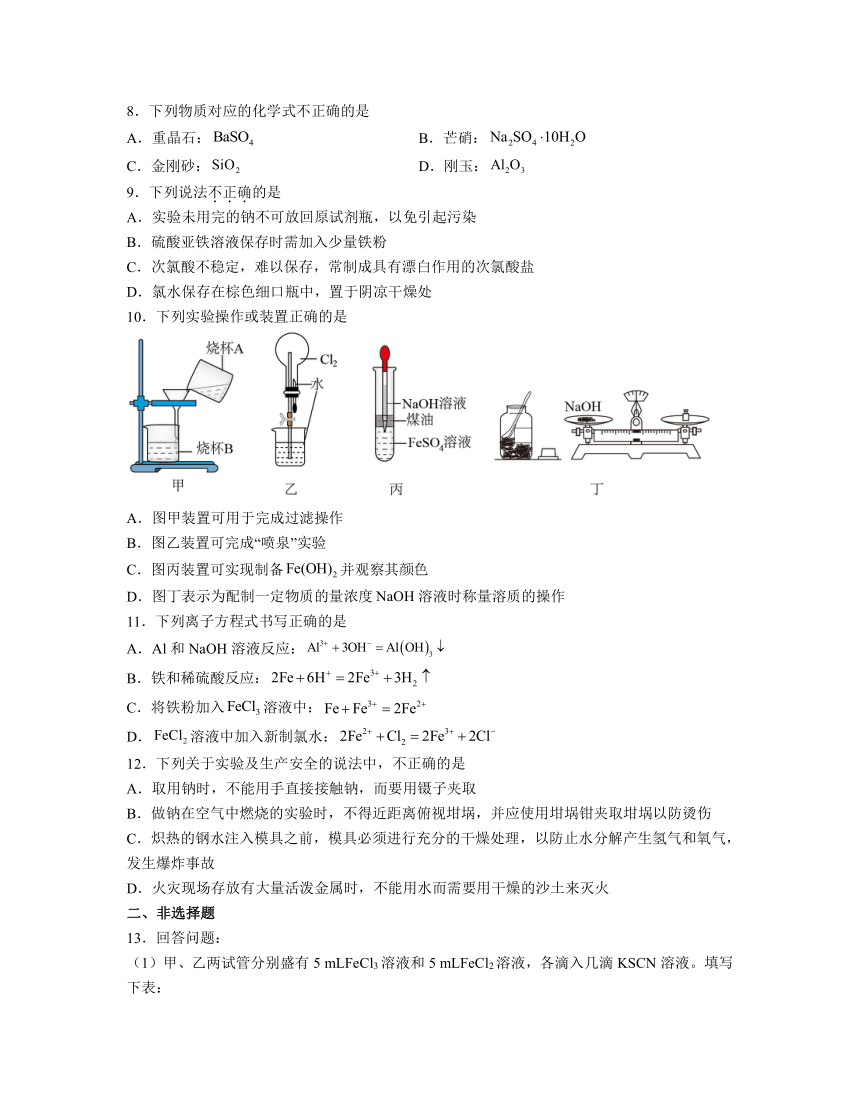
10.下列实验操作或装置正确的是
A.图甲装置可用于完成过滤操作
B.图乙装置可完成“喷泉”实验
C.图丙装置可实现制备并观察其颜色
D.图丁表示为配制一定物质的量浓度溶液时称量溶质的操作
11.下列离子方程式书写正确的是
A.Al和NaOH溶液反应:
B.铁和稀硫酸反应:
C.将铁粉加入溶液中:
D.溶液中加入新制氯水:
12.下列关于实验及生产安全的说法中,不正确的是
A.取用钠时,不能用手直接接触钠,而要用镊子夹取
B.做钠在空气中燃烧的实验时,不得近距离俯视坩埚,并应使用坩埚钳夹取坩埚以防烫伤
C.炽热的钢水注入模具之前,模具必须进行充分的干燥处理,以防止水分解产生氢气和氧气,发生爆炸事故
D.火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火
二、非选择题
13.回答问题:
(1)甲、乙两试管分别盛有5 mLFeCl3溶液和5 mLFeCl2溶液,各滴入几滴KSCN溶液。填写下表:
试 样 滴入KSCN溶液后的现象 两试管里产生不同的现象有何用途
甲试管(FeCl3)
乙试管(FeCl2)
(2)在盛有3 mLFeCl3溶液的试管中加入少量铁粉,若充分反应后没有固体物剩余。该试管的溶液中存在什么金属阳离子?如何进一步得到肯定答案?
14.铁及其化合物之间的转化关系如图所示。
回答下列问题:
(1)反应①的离子方程式为 。
(2)完成反应②还需加入 (填“氧化剂”或“还原剂”)。
(3)完成反应③还需用到的试剂为 (填化学式),检验的试剂为 。
(4)向溶液中加入溶液的现象为 。
15.在化学学习中,了解知识的发展历程,可以促进我们正确理解科学本质
(1)十八世纪,化学家发现某些金属与酸反应能生成一种气体,该气体被称为“会制造水的物质”,写出该气体燃烧制造水的化学方程式:
(2)俄国化学家贝开托夫于1865年发表了金属活动性顺序;某同学将铝片放入氯化铜溶液中,发现有红色固体和无色气体生成
①写出生成红色固体的化学方程式: .
②利用温度传感器和传感器监测实验过程中的相关数据(如图所示).
说明该过程 (“放热”或“吸热”),溶液的酸性 (“增强”或“减弱”);推测铝与溶液中的反应生成无色气体是 (填物质化学式)
16.向13.6g铁和氧化铁的化合物中,加入稀硫酸,固体完全溶解,且放出(标准状况),向反应后的溶液中滴入溶液,无明显现象,继续向溶液中逐滴滴加溶液,一段时间后生成白色沉淀,当生成沉淀的质量恰好达到最大时,共消耗2mol/L的溶液。试计算:
(1)原硫酸的物质的量浓度
(2)原混合物中铁和氧化铁的物质的量之比为
17.某磁黄铁矿的主要成分是FeXS(S为-2价), 磁黄铁矿中既含有二价铁又含有三价铁。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应,生成2.4g硫单质、 0.5molFeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。
回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+ (二价铁) 与Fe3+ (三价铁)的物质的量之比为 。
(2)该磁黄铁矿FeXS中,x= (保留 2位有效数字)
18.i.完成该化学方程式:KClO3+HCl(浓) →KCl+ ClO2↑+ Cl2↑+H2O 。
ii.用2.7g铝和过量200mL浓度为2mol/L的盐酸反应,回答下列问题:
(1)反应消耗 mol HCl;
(2)在标准状况下产生的气体体积为 升;
(3)溶液中生成物的物质的量浓度为 。(假设反应后溶液体积不变)
19.A、B、C、D都是中学化学中常见物质。其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去)。根据题意回答下列问题:
(1)若A、B、C的焰色反应均为黄色,C为食品工业中的一种应用广泛的疏松剂,D的过度排放会造成温室效应。
①A的化学式: ,B的俗名: 。
②反应II的离子方程式是 。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是 。
②反应III的离子方程式是 。
③设计实验方案检验B中阳离子 。
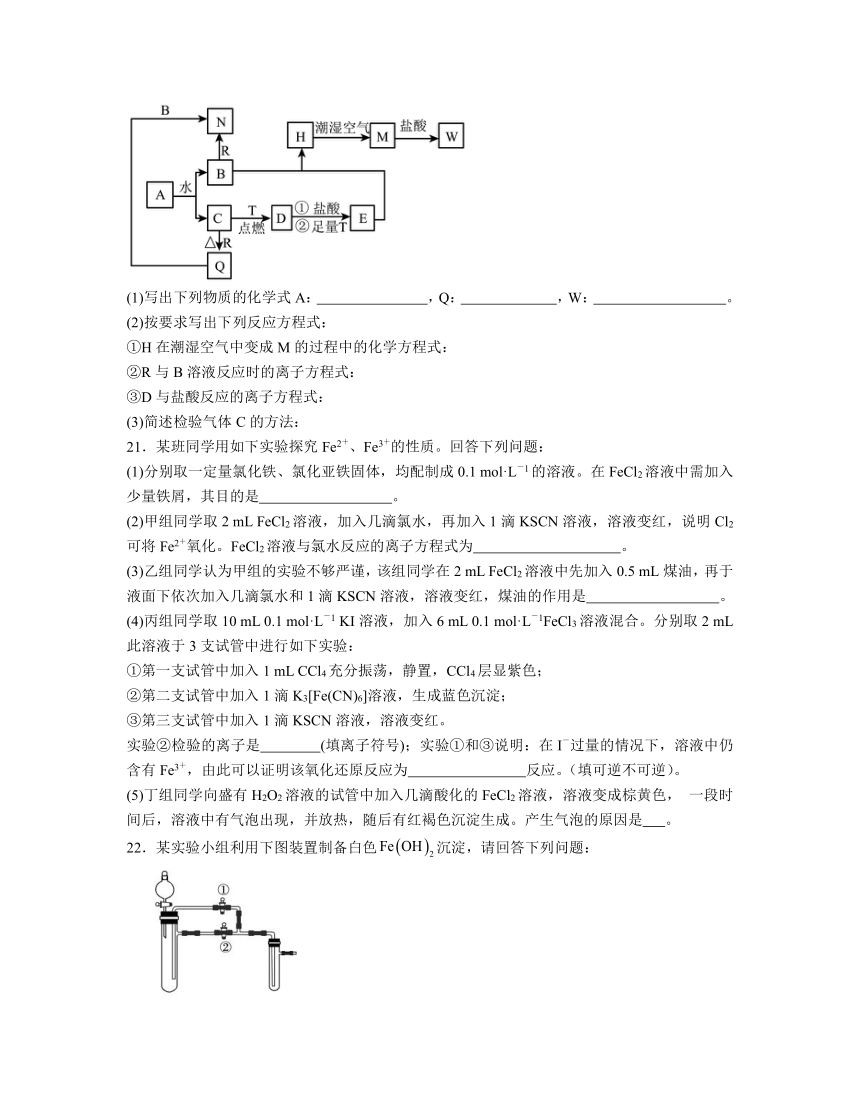
20.已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
(1)写出下列物质的化学式A: ,Q: ,W: 。
(2)按要求写出下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:
②R与B溶液反应时的离子方程式:
③D与盐酸反应的离子方程式:
(3)简述检验气体C的方法:
21.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡,静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为 反应。(填可逆不可逆)。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色, 一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 。
22.某实验小组利用下图装置制备白色沉淀,请回答下列问题:
(1)分液漏斗、大具支试管、小具支试管分别盛装的物质是 、 、 (填编号)。
A.还原铁粉 B.浓硫酸 C.稀硫酸 D.氢氧化钠溶液
(2)制备操作:实验过程中产生的气体从 (填“开关①”或“开关②”)导出,赶出装置中的氧气;待氧气全部赶尽后,再关闭 (填“开关①”或“开关②”),打开 (填“开关①”或“开关②”),得到沉淀。
(3)待保护气体失去作用后,白色沉淀会转化为灰绿色,最终变成红褐色,该化学方程式为 。
(4)研究发现被氧气氧化的反应速率与大小有关,室温下其他条件相同时,为3的氧化速率 (填“大于”、“等于”或“小于”)为11的氧化速率。
【参考答案】
一、选择题
1.B
解析:A.若加盐酸时有气体产生,说明样品中还有铁粉,不能证明脱氧剂未变质,可能部分变质,A正确;
B.若滴加KSCN溶液,无明显变化,说明加入盐酸后的溶液中没有Fe3+,这可能是发生了Fe+2Fe3+=3Fe2+,再滴加氯水显血红色,故不能证明脱氧剂未变质,B错误;
C.若滴加KSCN溶液,溶液显血红色,说明加入盐酸后的溶液中含有Fe3+,所以证明脱氧剂已变质,C正确;
D.若加入铜粉充分反应后,溶液呈蓝色,说明加入盐酸后的溶液中含有Fe3+,发生Cu+2Fe3+=Cu2++2Fe2+,证明脱氧剂已变质,D正确;
故选B。
2.B
解析:A.不锈钢是铁合金,A不符合题意;
B.金刚石为碳单质,不是合金,B符合题意;
C.硬铝是铝合金,C不符合题意;
D.特种钢是铁合金,D不符合题意;
故选B。
3.D
【分析】FeSO4溶液能被氧化为Fe2(SO4)3而变质。
解析:A.铜与三价铁反应能生成铜离子,使FeSO4溶液含有杂质,故A不符合题意;
B.氯水具有强氧化性,使二价铁氧化为三价铁而变质,故B不符合题意;
C.溴水具有强氧化性,使二价铁氧化为三价铁而变质,故C不符合题意;
D.铁粉与三价铁反应能生成二价铁,可防止亚铁离子被氧化而变质,能得到较纯的FeSO4溶液,故D符合题意;
故答案为D。
4.D
解析:地壳中含量最多的前五种元素:氧、硅、铝、铁、钙,汉字中带金字旁(汞合金)除外的属于金属元素,所以地壳中含量排第一的金属元素是铝。
答案选D。
5.A
解析:A.常温下,铝制品耐腐蚀是因为铝与空气中氧气反应,表面生成一层致密的氧化铝薄膜,阻止铝与氧气继续反应,A错误;
B.金属钠可用于制造高压钠灯,发黄光,常用作路灯,B正确;
C.碳酸氢钠受热易分解放出二氧化碳气体,可作食品膨松剂,C正确;
D.节假日里燃放的烟花利用了一些金属的焰色反应,比如钠的焰色反应为黄色,D正确;
答案选A。
6.A
【分析】部分被氧化的合金样品(氧化产物为)共5.76g,与足量稀硫酸反应,先是金属氧化物和硫酸反应生成硫酸铁、硫酸铜,硫酸铁与铁反应生成硫酸亚铁,硫酸铜与铁反应生成铜和硫酸亚铁,剩余的铁与稀硫酸反应生成氢气和硫酸亚铁,因此滤渣是铜单质,滤液加入足量氢氧化钠溶液得到氢氧化亚铁沉淀,过滤,在空气中充分灼烧得到氧化铁3.2g。
解析:A. 铁离子的氧化性大于氢离子的氧化性,由于样品中铁和稀硫酸反应生成了氢气,则说明溶液中没有铁离子,故A错误;
B. 滤渣3.2g是铜的质量,最后得到固体3.2g是氧化铁的质量,则铁元素的质量为,则金属总质量为5.44g,样品中氧原子的质量为5.76g 5.44g=0.32g,则氧原子的物质的量为0.02mol,故C正确;
C. 最后得到固体3.2g是氧化铁的质量,则样品中铁的物质的量为,反应后溶液中的溶质为硫酸和硫酸亚铁,根据质量守恒分析,消耗的硫酸物质的量等于生成的硫酸亚铁的物质的量,则溶解样品的过程中消耗硫酸的总物质的量为0.04mol,故C正确;
D. 利用质量守恒分析消耗的硫酸的氢一部分变为了氢气,一部分和氧化物反应变为了水,根据氧化物中氧的物质的量为0.02mol,则生成水物质的量为0.02mol,则生成氢气的物质的量为0.04mol 0.02mol=0.02mol,则标准状况下体积为0.448L即,故D正确。
综上所述,答案为A。
7.D
解析:A.常温下,铝遇到浓硝酸发生钝化,选项A错误;
B.少量通入NaClO溶液中,反应生成氯化钠和硫酸,反应的离子方程式为:,选项B错误;
C.向溶液中加入过量NaOH溶液并加热,反应生成碳酸钠、氨气和水,反应的离子方程式为:,选项C错误;
D.向溶液中加溶液至中性,反应生成硫酸钠、硫酸钡和水,反应的离子方程式为:,选项D正确;
答案选D。
8.C
解析:A.重晶石的化学式为,故A正确;
B.芒硝是硫酸钠的结晶水合物,化学式为:,故B正确;
C.金刚砂,学名碳化硅,分子式为:SiC,故C错误;
D.刚玉的化学组成为,故D正确;
故选C。
9.A
解析:A.钠为活泼金属,能与空气中的氧气、水反应引发安全事故,因此实验未用完的钠可放回原试剂瓶,故A错误;
B.亚铁离子易被氧化为铁离子,硫酸亚铁溶液保存时需加入少量铁粉防止亚铁离子被氧化,故B正确;
C.次氯酸不稳定受热或见光易分解,难以保存,常制成具有漂白作用的次氯酸盐,故C正确;
D.次氯酸不稳定受热或见光易分解,因此氯水保存在棕色细口瓶中,置于阴凉干燥处,故D正确;
故选A。
10.C
解析:A.过滤时需要用玻璃棒引流,不能直接倾倒,图甲装置中过滤时没有用玻璃棒引流,A错误;
B.氯气在水中溶解度较小,不能完成“喷泉”实验,B错误;
C.因为氢氧化亚铁极易被氧化,故制取氢氧化亚铁时应隔绝空气进行,煤油起到隔绝空气的作用,C正确;
D.称量NaOH时,应将NaOH固体放入小烧杯中,以防止NaOH受潮附在纸上或仪器上,D错误;
故选C。
11.D
解析:A.Al和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为,A错误;
B.铁和稀硫酸反应生成亚铁离子,离子反应为,B错误;
C.离子方程式电荷不守恒,应为,C错误;
D.溶液中加入新制氯水离子方程式为,D正确;
故选D。
12.C
解析:A.钠为活泼金属,取用钠时,不能用手直接接触钠,而要用镊子夹取,故A正确;
B.做钠在空气中燃烧的实验时,不得近距离俯视坩埚以防被伤,并应使用坩埚钳夹取坩埚以防烫伤,故B正确;
C.炽热的钢水注入模具之前,模具必须进行充分的干燥处理,以防止铁和水高温反应生成四氧化三铁和氢气,故C错误;
D.活泼金属可能会和水反应,火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火,故D正确;
故选C。
二、非选择题
13.(1)溶液变成红色;溶液没有变色;常用KSCN溶液检验Fe3+的存在。
(2)答:若铁粉不足,反应后溶液里存在的金属离子可能是Fe2+和Fe3+,若铁粉恰好与Fe3+完全反应,则反应后溶液中的金属离子是Fe2+。
取少量反应后的溶液于另一试管中,滴入几滴KSCN溶液,观察溶液是否变红,若变红说明是Fe2+和Fe3+,若不变色,则说明是Fe2+。
解析:(1)FeCl3溶液中加入KSCN溶液,两者反应生成血红色的Fe(SCN)3溶液,FeCl2溶液中加入KSCN溶液,溶液不变色,根据这一现象可以检验溶液中是否有Fe3+的存在,所以故为:溶液变成红色;溶液没有变色;常用KSCN溶液检验Fe3+的存在;
(2)在FeCl3溶液中加入铁粉,发生Fe+2FeCl3=3FeCl2,所以溶液中一定有Fe2+,若Fe粉过量,溶液中金属阳离子只有Fe2+,若没有固体剩余,可能是Fe粉不足,溶液中除Fe2+外,还有Fe3+,另一种可能是恰好反应,此时溶液中只有Fe2+,所以正确答案是:若铁粉不足,反应后溶液里存在的金属离子可能是Fe2+和Fe3+,若铁粉恰好与Fe3+完全反应,则反应后溶液中的金属离子是Fe2+;如果要进一步确定是否有Fe3+,可以取少量反应后的溶液于另一试管中,滴入几滴KSCN溶液,观察溶液是否变红,若变红说明是Fe2+和Fe3+,若不变色,则说明是Fe2+,故为:取少量反应后的溶液于另一试管中,滴入几滴KSCN溶液,观察溶液是否变红,若变红说明是Fe2+和Fe3+,若不变色,则说明是Fe2+。
14.(1)
(2)氧化剂
(3) 溶液
(4)产生白色沉淀,迅速变成灰绿色,最后变成红褐色
解析:(1)反应①是铁与盐酸反应生成氯化亚铁和氢气,离子方程式为:。
(2)反应②是FeCl2转化为FeCl3,铁元素化合价升高,被氧化,需要加入氧化剂才能实现。
(3)反应③是Fe转化为FeCl3,是铁与氯气加热化合生成氯化铁,故需要加入Cl2;遇到KSCN溶液变成血红色,所以检验的试剂为KSCN溶液。
(4)向溶液中加入溶液发生的反应是Fe2++2OH-=Fe(OH)2↓, 氢氧化亚铁是白色沉淀,且极其不稳定,在空气中遇到氧气,迅速变成灰绿色,最后变成红褐色的Fe(OH)3,所以现象是:产生白色沉淀,迅速变成灰绿色,最后变成红褐色。
15.(1)
(2) 2Al+3CuCl2=2AlCl3+3Cu 放热 增强 H2
解析:(1)活泼金属和酸反应生成氢气,氢气和氧气点燃生成水,;
(2)①铝的活动性大于铜,将铝片放入氯化铜溶液中,反应生成铜、氯化铝,化学方程式:2Al+3CuCl2=2AlCl3+3Cu;
②由图1可知,反应后温度升高,则反应放热;由图2可知,pH减小,溶液酸性增强;铝和溶液中氢离子反应生成氢气,故为H2。
16.5mol/L 2:1
解析:(1)根据题给信息可知,向反应后的溶液中滴入溶液,无明显现象,说明溶液中不存在铁离子;铁和氧化铁与硫酸反应后溶液中溶质为硫酸亚铁、硫酸,加入氢氧化钠溶液后,使亚铁离子全部转化为氢氧化亚铁,反应后的溶液溶质只有硫酸钠,根据硫酸根离子守恒可知:n(H2SO4)=n(Na2SO4),根据钠离子守恒可以知道,n(Na2SO4)=n(NaOH)= ×2mol/L×0.25L=0.25mol,所以原硫酸溶液的物质的量浓度为 c(H2SO4)= =2.5mol/L;
(2)铁和硫酸反应方程式:Fe+H2SO4=FeSO4+H2↑,固体加入酸后放出(标准状况),氢气的量为0.05mol,根据方程式反应关系可知,消耗铁的量为0.05mol,质量为m1(Fe)= 0.05mol×56g/mol=2.8g;设氧化铁为mg,反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,根据关系Fe2O3~ Fe2(SO4)3可知,160g:1mol=mg:xmol,x=mol;所以n(Fe3+)= mol;铁离子能够与铁反应生成亚铁离子,方程式为:2Fe3++Fe=3Fe2+,根据2Fe3+~Fe关系可知:2mol:56g=:yg,y= g,则消耗的m2(Fe)=g;故m1(Fe)+ m2(Fe)+m(Fe2O3)=13.6g;2.8++m=13.6,计算出m=8g,故m(Fe2O3)=8g;则m(Fe)=13.6-8=5.6g,故铁和氧化铁的物质的量之比为: =2:1。
17.(1)7:3 (2)0.87
解析:(1)n(S)=2.4g÷32g/mol=0.075mol,根据转移电子守恒得n(Fe3+)==0.15mol,则n(Fe2+)=0.5mol-0.15mol=0.35mol,该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量的比0.35:0.15=7:3;
(2)根据氢原子、氯原子守恒得n(H2S)=n(HCl)=n(FeCl2)=0.5mol,FexS中n(S)=0.075mol+0.5mol=0.575mol,n(Fe)=0.5mol,所以n(Fe):n(S)=0.5mol:0.575mol≈0.87,即x=0.87。
18. 2KClO3+4HCl(浓) =2KCl+ 2ClO2↑+ Cl2↑+2H2O 0.3 3.36 0.5mol/L
解析:i.根据同种元素发生氧化还原反应(归中反应)时,化合价变化规律“只靠拢不交叉”分析可知,反应中KClO3中+5价Cl,降低到ClO2中+4价的氯,HCl中的-1价氯,升高到氯气中0价的氯,还有部分-1价氯没有变价;根据化合价升降总数相等,原子守恒,得到配平后的方程式为:2KClO3+4HCl(浓) =2KCl+ 2ClO2↑+ Cl2↑+2H2O;
故答案为:2KClO3+4HCl(浓) =2KCl+ 2ClO2↑+ Cl2↑+2H2O;
ⅱ.2.7g铝的物质的量为0.1mol,根据化学方程式2Al+6HCl =2AlCl3+ 3H2↑,求得消耗的氯化氢为0.3mol,产生的氢气为0.15mol,生成氯化铝为0.1mol,则:
(1)反应消耗0.3mol HCl;
(2)在标准状况下产生的氢气体积为0.15mol×22.4L/mol=3.36L;
(3)溶液中氯化铝的物质的量浓度为0.1mol/0.2L=0.5mol/L;
故本题答案为:0.3;3.36;0.5mol/L。
【点睛】根据化学方程式求算未知量时要注意:(1)化学方程式所表示的是纯净物之间的关系,因此不纯物质必须换算成纯净物的量再进行计算. (2)在所列比例式中,同一物质上下单位要一致,不同物质左右要对应,此为易错点。
19.(1) NaOH 纯碱(或苏打) CO+CO2+H2O=2HCO
(2) Fe+2Fe3+=3Fe2+ Cl2+2Fe2+=2Cl-+2Fe3+ 取少量B的溶液于试管中,向其中滴加KSCN溶液,若出现血红色,说明B中的阳离子是Fe3+
解析:若A、B、C的焰色反应均为黄色,均含有Na元素, D的过度排放会造成温室效应,D为CO2,A能与二氧化碳反应生成B,B能与二氧化碳反应生成C,C为厨房中的用品,则C为NaHCO3,B为碳酸钠,且A与C反应得到B,则A为NaOH。若A、D均为单质,D元素的一种红棕色氧化物常用作颜料,为Fe2O3,则D为Fe,且A为气体,由转化关系可知A具有强氧化性,将Fe氧化为高价态,可推知A为Cl2、B为FeCl3、C为FeCl2。
(1)由上述分析可知,A的化学式为NaOH,B为碳酸钠,俗名纯碱或苏打;②反应II的离子方程式是:;
(2)反应II的离子方程式是Fe+2Fe3+=3Fe2+;②反应III的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+;③B中含有阳离子为Fe3+,检验方法是:取少量B的溶液于试管中,向其中滴加KSCN溶液,若出现血红色,说明B中的阳离子是Fe3+。
20.Na2O2 Al2O3 FeCl3 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Fe3O4+8H+= Fe3++2Fe2++4H2O 用带火星的木条伸入收集满该气体的集气瓶瓶口,若木条复燃,则气体是氧气
【分析】H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体,则H为氢氧化亚铁,金属T为Fe;氢氧化亚铁与潮湿的空气反应生成氢氧化铁,M为氢氧化铁;氢氧化铁与盐酸反应生成氯化铁,则W为氯化铁;A为淡黄色固体,则A为过氧化钠,B为氢氧化钠,C为氧气;D为四氧化三铁;可以和氢氧化钠反应的金属为Al;氧气与铝反应生成氧化铝,则Q为氧化铝、N为偏铝酸钠。
解析:(1)分析可知,A为过氧化钠,化学式为Na2O2;Q为氧化铝,化学式为Al2O3;W为氯化铁,化学式为FeCl3;
(2) ①H(氢氧化亚铁)在潮湿空气中变成M(氢氧化铁)的过程中为氢氧化亚铁与氧气、水反应生成氢氧化铁,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②R与B溶液反应为Al与NaOH反应生成偏铝酸钠和氢气,离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③D与盐酸反应为四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,离子方程式为Fe3O4+8H+= Fe3++2Fe2++4H2O;
(3)通常用带火星的木条靠近盛有该气体的集气瓶,若木条复燃,则为氧气。
21. 防止氯化亚铁被氧化 2Fe2++Cl2=2Fe3++2Cl- 隔绝空气(排除氧气对实验的影响) Fe2+ 可逆 反应生成的Fe3+催化了H2O2的分解
【分析】(1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁;
(3)煤油不溶于水,密度比水小,浮在液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,是亚铁离子检验的特征反应现象,第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用。
解析:(1)FeCl2易被空气中的氧气氧化,而铁和氯化铁可反应生成氯化亚铁,则在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;
故答案为防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为2Fe2++Cl2=2Fe3++2Cl-;
(3)FeCl2易被空气中的氧气氧化,煤油不溶于水,密度比水小,浮于液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
故答案为隔绝空气(排除氧气对实验的影响);
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子检验的特征反应现象,实验②检验的离子是Fe2+,①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色,说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:2Fe3++2I =I2+2Fe2+,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
故答案为Fe2+;可逆;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用,产生气泡的原因是反应生成的Fe3+催化了H2O2的分解;
故答案为反应生成的Fe3+催化了H2O2的分解。
22.(1) C A D
(2)开关② 开关② 开关①
(3)
(4)小于
解析:根据制备物质的性质判断,实验操作,将氧气排除,利用气压差将液体混合更能保持物质的纯净度,不能被氧气氧化,根据物质的性质判断反应类型,利用化合价的升降配平 氧化还原反应。
(1)根据装置制取氢氧化亚铁判断,需要的试剂有氢氧化钠,铁和稀硫酸,铁先跟稀硫酸发生反应生成硫酸亚铁,硫酸亚铁再与氢氧化钠发生反应生成氢氧化亚铁,液体装在分液漏斗,硫酸亚铁和氢氧化钠反应混合需要利用气压差,故大大具支试管铁,使其产生氢气,利用氢气将产生的硫酸亚铁压至小小具支试管中的氢氧化钠中,故答案为:C、A、D。
(2)根据导管的长度判断,导管插入溶液中
(3)红褐色沉淀是氢氧化铁,根据化合价的升降守恒配平得方程式为:;
(4)再碱性条件更容易生成氢氧化铁,导致离子浓度减小,更容易反应,反应速率更快,故答案为:小于
一、选择题
1.富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法错误的是
A.若加盐酸时有气体产生,不能证明脱氧剂未变质
B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质
C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质
D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已变质
2.下列物质不属于合金的是
A.不锈钢 B.金刚石 C.硬铝 D.特种钢
3.实验室配制FeSO4溶液时,为了保证得到较纯的FeSO4溶液,可往溶液中加入
A.铜粉 B.氯水 C.溴水 D.铁粉
4.在地壳中含量排第一的金属元素是
A.铁 B.氧 C.硅 D.铝
5.化学与生活息息相关,下列说法不正确的是
A.常温下,铝制品耐腐蚀是因为铝不活泼
B.金属钠可用于制造高压钠灯,常用作路灯
C.小苏打可作食品膨松剂
D.节假日里燃放的烟花利用了一些金属的焰色反应
6.部分被氧化的合金样品(氧化产物为)共5.76g,经如下处理:
下列说法不正确的是
A.滤液A中的阳离子为
B.样品中氧原子的物质的量为0.02mol
C.溶解样品的过程中消耗硫酸的总物质的量为0.04mol
D.
7.下列离子方程式书写正确的是:
A.常温下,铝遇到浓硝酸:
B.少量通入NaClO溶液中:
C.向溶液中加入过量NaOH溶液并加热:
D.向溶液中加溶液至中性:
8.下列物质对应的化学式不正确的是
A.重晶石: B.芒硝:
C.金刚砂: D.刚玉:
9.下列说法不正确的是
A.实验未用完的钠不可放回原试剂瓶,以免引起污染
B.硫酸亚铁溶液保存时需加入少量铁粉
C.次氯酸不稳定,难以保存,常制成具有漂白作用的次氯酸盐
D.氯水保存在棕色细口瓶中,置于阴凉干燥处
10.下列实验操作或装置正确的是
A.图甲装置可用于完成过滤操作
B.图乙装置可完成“喷泉”实验
C.图丙装置可实现制备并观察其颜色
D.图丁表示为配制一定物质的量浓度溶液时称量溶质的操作
11.下列离子方程式书写正确的是
A.Al和NaOH溶液反应:
B.铁和稀硫酸反应:
C.将铁粉加入溶液中:
D.溶液中加入新制氯水:
12.下列关于实验及生产安全的说法中,不正确的是
A.取用钠时,不能用手直接接触钠,而要用镊子夹取
B.做钠在空气中燃烧的实验时,不得近距离俯视坩埚,并应使用坩埚钳夹取坩埚以防烫伤
C.炽热的钢水注入模具之前,模具必须进行充分的干燥处理,以防止水分解产生氢气和氧气,发生爆炸事故
D.火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火
二、非选择题
13.回答问题:
(1)甲、乙两试管分别盛有5 mLFeCl3溶液和5 mLFeCl2溶液,各滴入几滴KSCN溶液。填写下表:
试 样 滴入KSCN溶液后的现象 两试管里产生不同的现象有何用途
甲试管(FeCl3)
乙试管(FeCl2)
(2)在盛有3 mLFeCl3溶液的试管中加入少量铁粉,若充分反应后没有固体物剩余。该试管的溶液中存在什么金属阳离子?如何进一步得到肯定答案?
14.铁及其化合物之间的转化关系如图所示。
回答下列问题:
(1)反应①的离子方程式为 。
(2)完成反应②还需加入 (填“氧化剂”或“还原剂”)。
(3)完成反应③还需用到的试剂为 (填化学式),检验的试剂为 。
(4)向溶液中加入溶液的现象为 。
15.在化学学习中,了解知识的发展历程,可以促进我们正确理解科学本质
(1)十八世纪,化学家发现某些金属与酸反应能生成一种气体,该气体被称为“会制造水的物质”,写出该气体燃烧制造水的化学方程式:
(2)俄国化学家贝开托夫于1865年发表了金属活动性顺序;某同学将铝片放入氯化铜溶液中,发现有红色固体和无色气体生成
①写出生成红色固体的化学方程式: .
②利用温度传感器和传感器监测实验过程中的相关数据(如图所示).
说明该过程 (“放热”或“吸热”),溶液的酸性 (“增强”或“减弱”);推测铝与溶液中的反应生成无色气体是 (填物质化学式)
16.向13.6g铁和氧化铁的化合物中,加入稀硫酸,固体完全溶解,且放出(标准状况),向反应后的溶液中滴入溶液,无明显现象,继续向溶液中逐滴滴加溶液,一段时间后生成白色沉淀,当生成沉淀的质量恰好达到最大时,共消耗2mol/L的溶液。试计算:
(1)原硫酸的物质的量浓度
(2)原混合物中铁和氧化铁的物质的量之比为
17.某磁黄铁矿的主要成分是FeXS(S为-2价), 磁黄铁矿中既含有二价铁又含有三价铁。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应,生成2.4g硫单质、 0.5molFeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。
回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+ (二价铁) 与Fe3+ (三价铁)的物质的量之比为 。
(2)该磁黄铁矿FeXS中,x= (保留 2位有效数字)
18.i.完成该化学方程式:KClO3+HCl(浓) →KCl+ ClO2↑+ Cl2↑+H2O 。
ii.用2.7g铝和过量200mL浓度为2mol/L的盐酸反应,回答下列问题:
(1)反应消耗 mol HCl;
(2)在标准状况下产生的气体体积为 升;
(3)溶液中生成物的物质的量浓度为 。(假设反应后溶液体积不变)
19.A、B、C、D都是中学化学中常见物质。其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去)。根据题意回答下列问题:
(1)若A、B、C的焰色反应均为黄色,C为食品工业中的一种应用广泛的疏松剂,D的过度排放会造成温室效应。
①A的化学式: ,B的俗名: 。
②反应II的离子方程式是 。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是 。
②反应III的离子方程式是 。
③设计实验方案检验B中阳离子 。
20.已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
(1)写出下列物质的化学式A: ,Q: ,W: 。
(2)按要求写出下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:
②R与B溶液反应时的离子方程式:
③D与盐酸反应的离子方程式:
(3)简述检验气体C的方法:
21.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡,静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为 反应。(填可逆不可逆)。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色, 一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 。
22.某实验小组利用下图装置制备白色沉淀,请回答下列问题:
(1)分液漏斗、大具支试管、小具支试管分别盛装的物质是 、 、 (填编号)。
A.还原铁粉 B.浓硫酸 C.稀硫酸 D.氢氧化钠溶液
(2)制备操作:实验过程中产生的气体从 (填“开关①”或“开关②”)导出,赶出装置中的氧气;待氧气全部赶尽后,再关闭 (填“开关①”或“开关②”),打开 (填“开关①”或“开关②”),得到沉淀。
(3)待保护气体失去作用后,白色沉淀会转化为灰绿色,最终变成红褐色,该化学方程式为 。
(4)研究发现被氧气氧化的反应速率与大小有关,室温下其他条件相同时,为3的氧化速率 (填“大于”、“等于”或“小于”)为11的氧化速率。
【参考答案】
一、选择题
1.B
解析:A.若加盐酸时有气体产生,说明样品中还有铁粉,不能证明脱氧剂未变质,可能部分变质,A正确;
B.若滴加KSCN溶液,无明显变化,说明加入盐酸后的溶液中没有Fe3+,这可能是发生了Fe+2Fe3+=3Fe2+,再滴加氯水显血红色,故不能证明脱氧剂未变质,B错误;
C.若滴加KSCN溶液,溶液显血红色,说明加入盐酸后的溶液中含有Fe3+,所以证明脱氧剂已变质,C正确;
D.若加入铜粉充分反应后,溶液呈蓝色,说明加入盐酸后的溶液中含有Fe3+,发生Cu+2Fe3+=Cu2++2Fe2+,证明脱氧剂已变质,D正确;
故选B。
2.B
解析:A.不锈钢是铁合金,A不符合题意;
B.金刚石为碳单质,不是合金,B符合题意;
C.硬铝是铝合金,C不符合题意;
D.特种钢是铁合金,D不符合题意;
故选B。
3.D
【分析】FeSO4溶液能被氧化为Fe2(SO4)3而变质。
解析:A.铜与三价铁反应能生成铜离子,使FeSO4溶液含有杂质,故A不符合题意;
B.氯水具有强氧化性,使二价铁氧化为三价铁而变质,故B不符合题意;
C.溴水具有强氧化性,使二价铁氧化为三价铁而变质,故C不符合题意;
D.铁粉与三价铁反应能生成二价铁,可防止亚铁离子被氧化而变质,能得到较纯的FeSO4溶液,故D符合题意;
故答案为D。
4.D
解析:地壳中含量最多的前五种元素:氧、硅、铝、铁、钙,汉字中带金字旁(汞合金)除外的属于金属元素,所以地壳中含量排第一的金属元素是铝。
答案选D。
5.A
解析:A.常温下,铝制品耐腐蚀是因为铝与空气中氧气反应,表面生成一层致密的氧化铝薄膜,阻止铝与氧气继续反应,A错误;
B.金属钠可用于制造高压钠灯,发黄光,常用作路灯,B正确;
C.碳酸氢钠受热易分解放出二氧化碳气体,可作食品膨松剂,C正确;
D.节假日里燃放的烟花利用了一些金属的焰色反应,比如钠的焰色反应为黄色,D正确;
答案选A。
6.A
【分析】部分被氧化的合金样品(氧化产物为)共5.76g,与足量稀硫酸反应,先是金属氧化物和硫酸反应生成硫酸铁、硫酸铜,硫酸铁与铁反应生成硫酸亚铁,硫酸铜与铁反应生成铜和硫酸亚铁,剩余的铁与稀硫酸反应生成氢气和硫酸亚铁,因此滤渣是铜单质,滤液加入足量氢氧化钠溶液得到氢氧化亚铁沉淀,过滤,在空气中充分灼烧得到氧化铁3.2g。
解析:A. 铁离子的氧化性大于氢离子的氧化性,由于样品中铁和稀硫酸反应生成了氢气,则说明溶液中没有铁离子,故A错误;
B. 滤渣3.2g是铜的质量,最后得到固体3.2g是氧化铁的质量,则铁元素的质量为,则金属总质量为5.44g,样品中氧原子的质量为5.76g 5.44g=0.32g,则氧原子的物质的量为0.02mol,故C正确;
C. 最后得到固体3.2g是氧化铁的质量,则样品中铁的物质的量为,反应后溶液中的溶质为硫酸和硫酸亚铁,根据质量守恒分析,消耗的硫酸物质的量等于生成的硫酸亚铁的物质的量,则溶解样品的过程中消耗硫酸的总物质的量为0.04mol,故C正确;
D. 利用质量守恒分析消耗的硫酸的氢一部分变为了氢气,一部分和氧化物反应变为了水,根据氧化物中氧的物质的量为0.02mol,则生成水物质的量为0.02mol,则生成氢气的物质的量为0.04mol 0.02mol=0.02mol,则标准状况下体积为0.448L即,故D正确。
综上所述,答案为A。
7.D
解析:A.常温下,铝遇到浓硝酸发生钝化,选项A错误;
B.少量通入NaClO溶液中,反应生成氯化钠和硫酸,反应的离子方程式为:,选项B错误;
C.向溶液中加入过量NaOH溶液并加热,反应生成碳酸钠、氨气和水,反应的离子方程式为:,选项C错误;
D.向溶液中加溶液至中性,反应生成硫酸钠、硫酸钡和水,反应的离子方程式为:,选项D正确;
答案选D。
8.C
解析:A.重晶石的化学式为,故A正确;
B.芒硝是硫酸钠的结晶水合物,化学式为:,故B正确;
C.金刚砂,学名碳化硅,分子式为:SiC,故C错误;
D.刚玉的化学组成为,故D正确;
故选C。
9.A
解析:A.钠为活泼金属,能与空气中的氧气、水反应引发安全事故,因此实验未用完的钠可放回原试剂瓶,故A错误;
B.亚铁离子易被氧化为铁离子,硫酸亚铁溶液保存时需加入少量铁粉防止亚铁离子被氧化,故B正确;
C.次氯酸不稳定受热或见光易分解,难以保存,常制成具有漂白作用的次氯酸盐,故C正确;
D.次氯酸不稳定受热或见光易分解,因此氯水保存在棕色细口瓶中,置于阴凉干燥处,故D正确;
故选A。
10.C
解析:A.过滤时需要用玻璃棒引流,不能直接倾倒,图甲装置中过滤时没有用玻璃棒引流,A错误;
B.氯气在水中溶解度较小,不能完成“喷泉”实验,B错误;
C.因为氢氧化亚铁极易被氧化,故制取氢氧化亚铁时应隔绝空气进行,煤油起到隔绝空气的作用,C正确;
D.称量NaOH时,应将NaOH固体放入小烧杯中,以防止NaOH受潮附在纸上或仪器上,D错误;
故选C。
11.D
解析:A.Al和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为,A错误;
B.铁和稀硫酸反应生成亚铁离子,离子反应为,B错误;
C.离子方程式电荷不守恒,应为,C错误;
D.溶液中加入新制氯水离子方程式为,D正确;
故选D。
12.C
解析:A.钠为活泼金属,取用钠时,不能用手直接接触钠,而要用镊子夹取,故A正确;
B.做钠在空气中燃烧的实验时,不得近距离俯视坩埚以防被伤,并应使用坩埚钳夹取坩埚以防烫伤,故B正确;
C.炽热的钢水注入模具之前,模具必须进行充分的干燥处理,以防止铁和水高温反应生成四氧化三铁和氢气,故C错误;
D.活泼金属可能会和水反应,火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火,故D正确;
故选C。
二、非选择题
13.(1)溶液变成红色;溶液没有变色;常用KSCN溶液检验Fe3+的存在。
(2)答:若铁粉不足,反应后溶液里存在的金属离子可能是Fe2+和Fe3+,若铁粉恰好与Fe3+完全反应,则反应后溶液中的金属离子是Fe2+。
取少量反应后的溶液于另一试管中,滴入几滴KSCN溶液,观察溶液是否变红,若变红说明是Fe2+和Fe3+,若不变色,则说明是Fe2+。
解析:(1)FeCl3溶液中加入KSCN溶液,两者反应生成血红色的Fe(SCN)3溶液,FeCl2溶液中加入KSCN溶液,溶液不变色,根据这一现象可以检验溶液中是否有Fe3+的存在,所以故为:溶液变成红色;溶液没有变色;常用KSCN溶液检验Fe3+的存在;
(2)在FeCl3溶液中加入铁粉,发生Fe+2FeCl3=3FeCl2,所以溶液中一定有Fe2+,若Fe粉过量,溶液中金属阳离子只有Fe2+,若没有固体剩余,可能是Fe粉不足,溶液中除Fe2+外,还有Fe3+,另一种可能是恰好反应,此时溶液中只有Fe2+,所以正确答案是:若铁粉不足,反应后溶液里存在的金属离子可能是Fe2+和Fe3+,若铁粉恰好与Fe3+完全反应,则反应后溶液中的金属离子是Fe2+;如果要进一步确定是否有Fe3+,可以取少量反应后的溶液于另一试管中,滴入几滴KSCN溶液,观察溶液是否变红,若变红说明是Fe2+和Fe3+,若不变色,则说明是Fe2+,故为:取少量反应后的溶液于另一试管中,滴入几滴KSCN溶液,观察溶液是否变红,若变红说明是Fe2+和Fe3+,若不变色,则说明是Fe2+。
14.(1)
(2)氧化剂
(3) 溶液
(4)产生白色沉淀,迅速变成灰绿色,最后变成红褐色
解析:(1)反应①是铁与盐酸反应生成氯化亚铁和氢气,离子方程式为:。
(2)反应②是FeCl2转化为FeCl3,铁元素化合价升高,被氧化,需要加入氧化剂才能实现。
(3)反应③是Fe转化为FeCl3,是铁与氯气加热化合生成氯化铁,故需要加入Cl2;遇到KSCN溶液变成血红色,所以检验的试剂为KSCN溶液。
(4)向溶液中加入溶液发生的反应是Fe2++2OH-=Fe(OH)2↓, 氢氧化亚铁是白色沉淀,且极其不稳定,在空气中遇到氧气,迅速变成灰绿色,最后变成红褐色的Fe(OH)3,所以现象是:产生白色沉淀,迅速变成灰绿色,最后变成红褐色。
15.(1)
(2) 2Al+3CuCl2=2AlCl3+3Cu 放热 增强 H2
解析:(1)活泼金属和酸反应生成氢气,氢气和氧气点燃生成水,;
(2)①铝的活动性大于铜,将铝片放入氯化铜溶液中,反应生成铜、氯化铝,化学方程式:2Al+3CuCl2=2AlCl3+3Cu;
②由图1可知,反应后温度升高,则反应放热;由图2可知,pH减小,溶液酸性增强;铝和溶液中氢离子反应生成氢气,故为H2。
16.5mol/L 2:1
解析:(1)根据题给信息可知,向反应后的溶液中滴入溶液,无明显现象,说明溶液中不存在铁离子;铁和氧化铁与硫酸反应后溶液中溶质为硫酸亚铁、硫酸,加入氢氧化钠溶液后,使亚铁离子全部转化为氢氧化亚铁,反应后的溶液溶质只有硫酸钠,根据硫酸根离子守恒可知:n(H2SO4)=n(Na2SO4),根据钠离子守恒可以知道,n(Na2SO4)=n(NaOH)= ×2mol/L×0.25L=0.25mol,所以原硫酸溶液的物质的量浓度为 c(H2SO4)= =2.5mol/L;
(2)铁和硫酸反应方程式:Fe+H2SO4=FeSO4+H2↑,固体加入酸后放出(标准状况),氢气的量为0.05mol,根据方程式反应关系可知,消耗铁的量为0.05mol,质量为m1(Fe)= 0.05mol×56g/mol=2.8g;设氧化铁为mg,反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,根据关系Fe2O3~ Fe2(SO4)3可知,160g:1mol=mg:xmol,x=mol;所以n(Fe3+)= mol;铁离子能够与铁反应生成亚铁离子,方程式为:2Fe3++Fe=3Fe2+,根据2Fe3+~Fe关系可知:2mol:56g=:yg,y= g,则消耗的m2(Fe)=g;故m1(Fe)+ m2(Fe)+m(Fe2O3)=13.6g;2.8++m=13.6,计算出m=8g,故m(Fe2O3)=8g;则m(Fe)=13.6-8=5.6g,故铁和氧化铁的物质的量之比为: =2:1。
17.(1)7:3 (2)0.87
解析:(1)n(S)=2.4g÷32g/mol=0.075mol,根据转移电子守恒得n(Fe3+)==0.15mol,则n(Fe2+)=0.5mol-0.15mol=0.35mol,该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量的比0.35:0.15=7:3;
(2)根据氢原子、氯原子守恒得n(H2S)=n(HCl)=n(FeCl2)=0.5mol,FexS中n(S)=0.075mol+0.5mol=0.575mol,n(Fe)=0.5mol,所以n(Fe):n(S)=0.5mol:0.575mol≈0.87,即x=0.87。
18. 2KClO3+4HCl(浓) =2KCl+ 2ClO2↑+ Cl2↑+2H2O 0.3 3.36 0.5mol/L
解析:i.根据同种元素发生氧化还原反应(归中反应)时,化合价变化规律“只靠拢不交叉”分析可知,反应中KClO3中+5价Cl,降低到ClO2中+4价的氯,HCl中的-1价氯,升高到氯气中0价的氯,还有部分-1价氯没有变价;根据化合价升降总数相等,原子守恒,得到配平后的方程式为:2KClO3+4HCl(浓) =2KCl+ 2ClO2↑+ Cl2↑+2H2O;
故答案为:2KClO3+4HCl(浓) =2KCl+ 2ClO2↑+ Cl2↑+2H2O;
ⅱ.2.7g铝的物质的量为0.1mol,根据化学方程式2Al+6HCl =2AlCl3+ 3H2↑,求得消耗的氯化氢为0.3mol,产生的氢气为0.15mol,生成氯化铝为0.1mol,则:
(1)反应消耗0.3mol HCl;
(2)在标准状况下产生的氢气体积为0.15mol×22.4L/mol=3.36L;
(3)溶液中氯化铝的物质的量浓度为0.1mol/0.2L=0.5mol/L;
故本题答案为:0.3;3.36;0.5mol/L。
【点睛】根据化学方程式求算未知量时要注意:(1)化学方程式所表示的是纯净物之间的关系,因此不纯物质必须换算成纯净物的量再进行计算. (2)在所列比例式中,同一物质上下单位要一致,不同物质左右要对应,此为易错点。
19.(1) NaOH 纯碱(或苏打) CO+CO2+H2O=2HCO
(2) Fe+2Fe3+=3Fe2+ Cl2+2Fe2+=2Cl-+2Fe3+ 取少量B的溶液于试管中,向其中滴加KSCN溶液,若出现血红色,说明B中的阳离子是Fe3+
解析:若A、B、C的焰色反应均为黄色,均含有Na元素, D的过度排放会造成温室效应,D为CO2,A能与二氧化碳反应生成B,B能与二氧化碳反应生成C,C为厨房中的用品,则C为NaHCO3,B为碳酸钠,且A与C反应得到B,则A为NaOH。若A、D均为单质,D元素的一种红棕色氧化物常用作颜料,为Fe2O3,则D为Fe,且A为气体,由转化关系可知A具有强氧化性,将Fe氧化为高价态,可推知A为Cl2、B为FeCl3、C为FeCl2。
(1)由上述分析可知,A的化学式为NaOH,B为碳酸钠,俗名纯碱或苏打;②反应II的离子方程式是:;
(2)反应II的离子方程式是Fe+2Fe3+=3Fe2+;②反应III的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+;③B中含有阳离子为Fe3+,检验方法是:取少量B的溶液于试管中,向其中滴加KSCN溶液,若出现血红色,说明B中的阳离子是Fe3+。
20.Na2O2 Al2O3 FeCl3 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Fe3O4+8H+= Fe3++2Fe2++4H2O 用带火星的木条伸入收集满该气体的集气瓶瓶口,若木条复燃,则气体是氧气
【分析】H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体,则H为氢氧化亚铁,金属T为Fe;氢氧化亚铁与潮湿的空气反应生成氢氧化铁,M为氢氧化铁;氢氧化铁与盐酸反应生成氯化铁,则W为氯化铁;A为淡黄色固体,则A为过氧化钠,B为氢氧化钠,C为氧气;D为四氧化三铁;可以和氢氧化钠反应的金属为Al;氧气与铝反应生成氧化铝,则Q为氧化铝、N为偏铝酸钠。
解析:(1)分析可知,A为过氧化钠,化学式为Na2O2;Q为氧化铝,化学式为Al2O3;W为氯化铁,化学式为FeCl3;
(2) ①H(氢氧化亚铁)在潮湿空气中变成M(氢氧化铁)的过程中为氢氧化亚铁与氧气、水反应生成氢氧化铁,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②R与B溶液反应为Al与NaOH反应生成偏铝酸钠和氢气,离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③D与盐酸反应为四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水,离子方程式为Fe3O4+8H+= Fe3++2Fe2++4H2O;
(3)通常用带火星的木条靠近盛有该气体的集气瓶,若木条复燃,则为氧气。
21. 防止氯化亚铁被氧化 2Fe2++Cl2=2Fe3++2Cl- 隔绝空气(排除氧气对实验的影响) Fe2+ 可逆 反应生成的Fe3+催化了H2O2的分解
【分析】(1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁;
(3)煤油不溶于水,密度比水小,浮在液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,是亚铁离子检验的特征反应现象,第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用。
解析:(1)FeCl2易被空气中的氧气氧化,而铁和氯化铁可反应生成氯化亚铁,则在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;
故答案为防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为2Fe2++Cl2=2Fe3++2Cl-;
(3)FeCl2易被空气中的氧气氧化,煤油不溶于水,密度比水小,浮于液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
故答案为隔绝空气(排除氧气对实验的影响);
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子检验的特征反应现象,实验②检验的离子是Fe2+,①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色,说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:2Fe3++2I =I2+2Fe2+,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
故答案为Fe2+;可逆;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用,产生气泡的原因是反应生成的Fe3+催化了H2O2的分解;
故答案为反应生成的Fe3+催化了H2O2的分解。
22.(1) C A D
(2)开关② 开关② 开关①
(3)
(4)小于
解析:根据制备物质的性质判断,实验操作,将氧气排除,利用气压差将液体混合更能保持物质的纯净度,不能被氧气氧化,根据物质的性质判断反应类型,利用化合价的升降配平 氧化还原反应。
(1)根据装置制取氢氧化亚铁判断,需要的试剂有氢氧化钠,铁和稀硫酸,铁先跟稀硫酸发生反应生成硫酸亚铁,硫酸亚铁再与氢氧化钠发生反应生成氢氧化亚铁,液体装在分液漏斗,硫酸亚铁和氢氧化钠反应混合需要利用气压差,故大大具支试管铁,使其产生氢气,利用氢气将产生的硫酸亚铁压至小小具支试管中的氢氧化钠中,故答案为:C、A、D。
(2)根据导管的长度判断,导管插入溶液中
(3)红褐色沉淀是氢氧化铁,根据化合价的升降守恒配平得方程式为:;
(4)再碱性条件更容易生成氢氧化铁,导致离子浓度减小,更容易反应,反应速率更快,故答案为:小于
