3.2.2铝合金物质的量在化学方程式计算中的应用(课件)(共30张PPT)2023-2024学年高一化学同步教学课件(人教版2019必修第一册)
文档属性
| 名称 | 3.2.2铝合金物质的量在化学方程式计算中的应用(课件)(共30张PPT)2023-2024学年高一化学同步教学课件(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 66.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 16:15:10 | ||
图片预览











文档简介
(共30张PPT)
1. 铁合金:
2. 新型合金:
储氢合金、钛合金、耐热合金、形状记忆合金
温故知新
第二课时 铝合金 物质的量在化学方程式计算中的应用
第三章 铁 金属材料
第二节 金属材料
素养要求
1.认识铝及氧化铝与酸碱的反应,能科学、合理的选择和使用金属材料,培养学生的科学态度和社会责任感。
2.能从物质的量的角度认识物质的组成及化学变化,能运用物质的量与其他物理量之间的换算关系进行有关计算。
3.能结合物质的量在化学方程式计算中的应用,进一步体会守恒思想,强化宏观辨识与微观探析能力。
车载桌
铝 合 金
1
铝及其合金
任务一 铝合金
铝合金是目前用途广泛的合金之一,例如:硬铝、镁铝合金
铝合金 成分元素 主要特征 主要用途
硬铝
Cu 4%、Mg 0.5%、
Mn 0.5%、Si 0.7%
密度小,强度和硬度都比纯铝的大,具有较强的抗腐蚀能力
用于汽车、飞机、火箭、船舶等制造业
镁铝合金
Al、Mg(10%~20%)
强度和硬度都比纯铝和纯镁的大
用于火箭、飞机、轮船等制造业
任务一 合金的认识
【思考1】为什么铝合金的制品不需要特殊的防腐处理
【思考2】如何证明氧化膜的存在
在常温下形成致密保护膜的金属,如铝、镁等金属;铁在高温下形成致密保护膜,俗称“烤蓝”;铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
任务二 铝与氧化铝
【实验】用坩埚钳或镊子夹取一段铝片在酒精灯外焰持续灼烧,观察现象。
现象:
铝片红热、熔而不滴
熔点Al2O3高于Al
物质 熔点/℃ 沸点/℃
Al
Al2O3
660
2050
2467
2980
结论:
方程式:
4Al + 3O2=2Al2O3
1、铝与氧化铝的化学性质
【小结】Al2O3白色固体,难溶于水,熔点高(2050℃),硬度大,沸点高(2980℃),用于制造耐火材料(坩埚、燃烧管等)
p82【实验3-4】
任务二 铝与氧化铝
在一支试管中加入5mL 盐酸,再向试管中加入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
【实验现象】
铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声
Al2O3+6HCl = 2AlCl3+3H2O
2Al+6HCl = 2AlCl3+3H2↑
【化学方程式】
【离子方程式】
Al2O3+6H+=2Al3++3H2O
2Al+6H+= 2Al3++3H2↑
任务二 铝与氧化铝
p82【实验3-5】
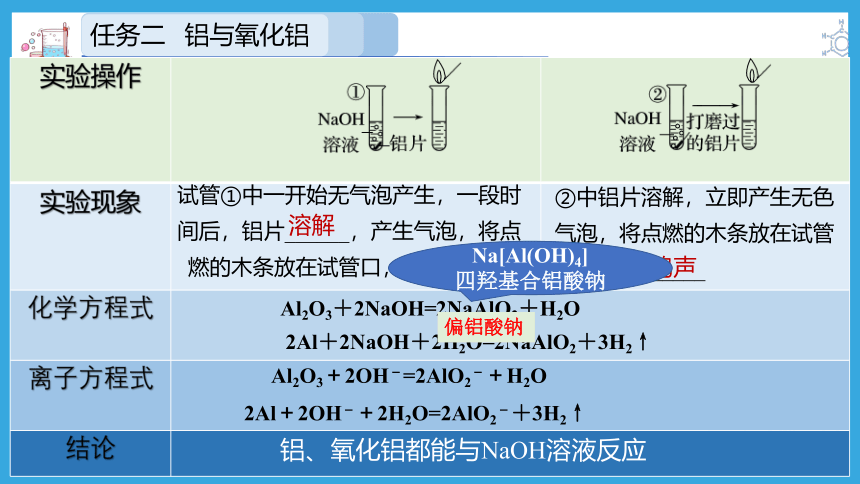
在两支试管中分别加入少量NaOH溶液,向其中一支试管中加入一小块铝片,向另一支试管中加入用砂纸打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
任务二 铝与氧化铝
实验操作
实验现象
化学方程式 离子方程式 结论 试管①中一开始无气泡产生,一段时间后,铝片______,产生气泡,将点燃的木条放在试管口,有________
溶解
爆鸣声
②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,有________
爆鸣声
Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+2OH-=2AlO2-+H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑
铝、氧化铝都能与NaOH溶液反应
Na[Al(OH)4]
四羟基合铝酸钠
偏铝酸钠
任务二 铝与氧化铝
归纳
两性氧化物
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3等,其与强酸、强碱反应的离子方程式分别为
Al2O3+6H+= 2Al3++3H2O,
Al2O3+2OH-= 2AlO2-+H2O。
【思考3】为什么铝合金的器皿不能过长时间存储酸或碱的溶液
任务二 铝与氧化铝
铝块
2、铝的物理性质
铝在自然界中以化合态形式存在,是地壳中含量最多的金属元素
存在形式:
颜色、状态:
银白色有金属光泽的固体(常温下)
硬度:
延展性好
是电和热的良导体
导电/热性:
(2022·上海闵行模拟)有关铝合金说法错误的是( )
A.密度小 B.耐腐蚀
C.熔点比纯铝高 D.硬度大于纯铝
C
典例分析
2
物质的量在化学方程式计算中的应用
任务三 物质的量在化学方程式计算中的应用
1.以物质的量为中心的转化
物质的量在化学方程式计算中的应用
2Na + 2H2O == 2NaOH + H2↑
2
2
2
1
化学计量数之比
∶
∶
∶
扩大6.02×1023倍
2×6.02×1023
2×6.02×1023
2×6.02×1023
1×6.02×1023
∶
∶
∶
物质的量之比
2 mol
2 mol
2 mol
1 mol
∶
∶
∶
化学计量数之比,等于各物质的粒子数之比,也等于各物质的物质的量之比
任务三 物质的量在化学方程式计算中的应用
3.物质的量应用于化学方程式计算的基本步骤
任务三 物质的量在化学方程式计算中的应用
任务三 物质的量在化学方程式计算中的应用
P85 例题 250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁的物质的量;
Fe + H2SO4 == FeSO4 + H2↑
1
n(Fe)
n(Fe)=0.50mol
1
0.50mol
解:参加反应的硫酸的物质的量为0.25 L×2 mol/LL =0.50 mol
答:参加反应的铁的物质的量为0.50 mol。
任务三 物质的量在化学方程式计算中的应用
250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(2)生成的氢气在标准状况下的体积。
V(H2)=11.2L
1
0.50 mol
22.4 L
V(H2)
解:参加反应的硫酸的物质的量为0.25 L×2 mol/L=0.50 mol
答:生成的氢气在标准状况下的体积为11.2L。
Fe + H2SO4 == FeSO4 + H2↑
归纳
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据不足量的物质进行计算。
对应练习
5.4 g铝与足量NaOH溶液反应生成的氢气在标准状况下的体积是多少?
请尝试用以下两种方法解答:
体会第2种方法的简便快捷。
提示 方法一:
设生成标准状况下氢气的物质的量为n(H2)
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2 3
0.2 mol n(H2)
解得n(H2)=0.3 mol,所以V(H2)=n(H2)·Vm=0.3 mol×22.4 L·mol-1=6.72 L
即生成标准状况下氢气的体积是6.72 L。
方法二:设生成标准状况下H2的体积为V(H2)
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2×27 g 3×22.4 L
5.4 g V(H2)
即生成标准状况下H2的体积是6.72 L。
限时训练
3
任务四 限时训练
1.(2022·金华东阳横店高级中学高一月考)某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是( )
A
2、在一定条件下7 g炭粉与氧气反应生成21 g氧化物,则生成物中CO与CO2的物质的量之比是
A.1∶1 B.2∶1 C.2∶3 D.3∶2
A
任务四 限时训练
3.(2022·北京平谷高一期末)探究铝的性质实验
Ⅰ Ⅱ
现象:立即产生气泡 现象:开始没气泡一段时间后产生气泡
下列说法不正确的是( )
A.从元素化合价角度看,产生的气体只能是H2 B.实验Ⅰ证明NaOH是氧化剂
C.实验Ⅱ说明Al2O3具有酸性氧化物的性质
D.实验Ⅰ和Ⅱ反应后的溶液中微粒种类完全相同
B
任务四 限时训练
4.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为
A.1.0 mol·L-1 B.2.0 mol·L-1 C.1.5 mol·L-1 D.3.0 mol·L-1
B
5.(2023·洛阳高一期末)标准状况下,将钠、镁各0.3 mol分别放入100 mL 1 mol·L-1的硫酸中,反应产生的气体体积之比是
A.1∶1 B.2∶3 C.3∶2 D.2∶1
C
任务四 限时训练
6.(2022·上海徐汇中学高一月考)已知二氧化锰与浓盐酸在加热条件下发生反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,用8.7 g二氧化锰与足量的浓盐酸混合加热,充分反应,计算:
(1)消耗浓盐酸中溶质的物质的量为__________。
(2)产生的Cl2在标准状况下的体积为________。
(3)将反应后的溶液加水稀释至400 mL,则此溶液中MnCl2的物质的量浓度是_____________。
0.4 mol
2.24 L
0.25 mol·L-1
1. 铁合金:
2. 新型合金:
储氢合金、钛合金、耐热合金、形状记忆合金
温故知新
第二课时 铝合金 物质的量在化学方程式计算中的应用
第三章 铁 金属材料
第二节 金属材料
素养要求
1.认识铝及氧化铝与酸碱的反应,能科学、合理的选择和使用金属材料,培养学生的科学态度和社会责任感。
2.能从物质的量的角度认识物质的组成及化学变化,能运用物质的量与其他物理量之间的换算关系进行有关计算。
3.能结合物质的量在化学方程式计算中的应用,进一步体会守恒思想,强化宏观辨识与微观探析能力。
车载桌
铝 合 金
1
铝及其合金
任务一 铝合金
铝合金是目前用途广泛的合金之一,例如:硬铝、镁铝合金
铝合金 成分元素 主要特征 主要用途
硬铝
Cu 4%、Mg 0.5%、
Mn 0.5%、Si 0.7%
密度小,强度和硬度都比纯铝的大,具有较强的抗腐蚀能力
用于汽车、飞机、火箭、船舶等制造业
镁铝合金
Al、Mg(10%~20%)
强度和硬度都比纯铝和纯镁的大
用于火箭、飞机、轮船等制造业
任务一 合金的认识
【思考1】为什么铝合金的制品不需要特殊的防腐处理
【思考2】如何证明氧化膜的存在
在常温下形成致密保护膜的金属,如铝、镁等金属;铁在高温下形成致密保护膜,俗称“烤蓝”;铁或铝遇到浓H2SO4或浓HNO3时,迅速反应生成致密氧化膜,称为钝化。
任务二 铝与氧化铝
【实验】用坩埚钳或镊子夹取一段铝片在酒精灯外焰持续灼烧,观察现象。
现象:
铝片红热、熔而不滴
熔点Al2O3高于Al
物质 熔点/℃ 沸点/℃
Al
Al2O3
660
2050
2467
2980
结论:
方程式:
4Al + 3O2=2Al2O3
1、铝与氧化铝的化学性质
【小结】Al2O3白色固体,难溶于水,熔点高(2050℃),硬度大,沸点高(2980℃),用于制造耐火材料(坩埚、燃烧管等)
p82【实验3-4】
任务二 铝与氧化铝
在一支试管中加入5mL 盐酸,再向试管中加入一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
【实验现象】
铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声
Al2O3+6HCl = 2AlCl3+3H2O
2Al+6HCl = 2AlCl3+3H2↑
【化学方程式】
【离子方程式】
Al2O3+6H+=2Al3++3H2O
2Al+6H+= 2Al3++3H2↑
任务二 铝与氧化铝
p82【实验3-5】
在两支试管中分别加入少量NaOH溶液,向其中一支试管中加入一小块铝片,向另一支试管中加入用砂纸打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象?
任务二 铝与氧化铝
实验操作
实验现象
化学方程式 离子方程式 结论 试管①中一开始无气泡产生,一段时间后,铝片______,产生气泡,将点燃的木条放在试管口,有________
溶解
爆鸣声
②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口,有________
爆鸣声
Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+2OH-=2AlO2-+H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑
铝、氧化铝都能与NaOH溶液反应
Na[Al(OH)4]
四羟基合铝酸钠
偏铝酸钠
任务二 铝与氧化铝
归纳
两性氧化物
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3等,其与强酸、强碱反应的离子方程式分别为
Al2O3+6H+= 2Al3++3H2O,
Al2O3+2OH-= 2AlO2-+H2O。
【思考3】为什么铝合金的器皿不能过长时间存储酸或碱的溶液
任务二 铝与氧化铝
铝块
2、铝的物理性质
铝在自然界中以化合态形式存在,是地壳中含量最多的金属元素
存在形式:
颜色、状态:
银白色有金属光泽的固体(常温下)
硬度:
延展性好
是电和热的良导体
导电/热性:
(2022·上海闵行模拟)有关铝合金说法错误的是( )
A.密度小 B.耐腐蚀
C.熔点比纯铝高 D.硬度大于纯铝
C
典例分析
2
物质的量在化学方程式计算中的应用
任务三 物质的量在化学方程式计算中的应用
1.以物质的量为中心的转化
物质的量在化学方程式计算中的应用
2Na + 2H2O == 2NaOH + H2↑
2
2
2
1
化学计量数之比
∶
∶
∶
扩大6.02×1023倍
2×6.02×1023
2×6.02×1023
2×6.02×1023
1×6.02×1023
∶
∶
∶
物质的量之比
2 mol
2 mol
2 mol
1 mol
∶
∶
∶
化学计量数之比,等于各物质的粒子数之比,也等于各物质的物质的量之比
任务三 物质的量在化学方程式计算中的应用
3.物质的量应用于化学方程式计算的基本步骤
任务三 物质的量在化学方程式计算中的应用
任务三 物质的量在化学方程式计算中的应用
P85 例题 250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁的物质的量;
Fe + H2SO4 == FeSO4 + H2↑
1
n(Fe)
n(Fe)=0.50mol
1
0.50mol
解:参加反应的硫酸的物质的量为0.25 L×2 mol/LL =0.50 mol
答:参加反应的铁的物质的量为0.50 mol。
任务三 物质的量在化学方程式计算中的应用
250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(2)生成的氢气在标准状况下的体积。
V(H2)=11.2L
1
0.50 mol
22.4 L
V(H2)
解:参加反应的硫酸的物质的量为0.25 L×2 mol/L=0.50 mol
答:生成的氢气在标准状况下的体积为11.2L。
Fe + H2SO4 == FeSO4 + H2↑
归纳
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据不足量的物质进行计算。
对应练习
5.4 g铝与足量NaOH溶液反应生成的氢气在标准状况下的体积是多少?
请尝试用以下两种方法解答:
体会第2种方法的简便快捷。
提示 方法一:
设生成标准状况下氢气的物质的量为n(H2)
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2 3
0.2 mol n(H2)
解得n(H2)=0.3 mol,所以V(H2)=n(H2)·Vm=0.3 mol×22.4 L·mol-1=6.72 L
即生成标准状况下氢气的体积是6.72 L。
方法二:设生成标准状况下H2的体积为V(H2)
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2×27 g 3×22.4 L
5.4 g V(H2)
即生成标准状况下H2的体积是6.72 L。
限时训练
3
任务四 限时训练
1.(2022·金华东阳横店高级中学高一月考)某溶液中加入铝粉,有H2放出,在该溶液中一定能大量共存的离子组是( )
A
2、在一定条件下7 g炭粉与氧气反应生成21 g氧化物,则生成物中CO与CO2的物质的量之比是
A.1∶1 B.2∶1 C.2∶3 D.3∶2
A
任务四 限时训练
3.(2022·北京平谷高一期末)探究铝的性质实验
Ⅰ Ⅱ
现象:立即产生气泡 现象:开始没气泡一段时间后产生气泡
下列说法不正确的是( )
A.从元素化合价角度看,产生的气体只能是H2 B.实验Ⅰ证明NaOH是氧化剂
C.实验Ⅱ说明Al2O3具有酸性氧化物的性质
D.实验Ⅰ和Ⅱ反应后的溶液中微粒种类完全相同
B
任务四 限时训练
4.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为
A.1.0 mol·L-1 B.2.0 mol·L-1 C.1.5 mol·L-1 D.3.0 mol·L-1
B
5.(2023·洛阳高一期末)标准状况下,将钠、镁各0.3 mol分别放入100 mL 1 mol·L-1的硫酸中,反应产生的气体体积之比是
A.1∶1 B.2∶3 C.3∶2 D.2∶1
C
任务四 限时训练
6.(2022·上海徐汇中学高一月考)已知二氧化锰与浓盐酸在加热条件下发生反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,用8.7 g二氧化锰与足量的浓盐酸混合加热,充分反应,计算:
(1)消耗浓盐酸中溶质的物质的量为__________。
(2)产生的Cl2在标准状况下的体积为________。
(3)将反应后的溶液加水稀释至400 mL,则此溶液中MnCl2的物质的量浓度是_____________。
0.4 mol
2.24 L
0.25 mol·L-1
