第3章 物质在水溶液中的行为 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第3章 物质在水溶液中的行为 测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 654.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 16:17:30 | ||
图片预览



文档简介
第3章 物质在水溶液中的行为 测试题
一、选择题
1.下列说法正确的是
A.溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
B.溶度积常数是不受任何条件影响的常数,简称溶度积
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向
D.所有物质的溶度积都是随温度的升高而增大的
2.镍电池芯废料中主要含有金属镍,还含有金属钴、铁、铝。一种从镍电池芯废料中回收金属的工艺流程如下:
下列说法正确的是
A.“酸溶”时,若改用浓硫酸,反应速率更快,效果更好
B.在“氧化除杂”和“酸溶”中的作用不同
C.“钴镍分离”时发生反应的离子方程式为
D.“结晶”时,快速蒸发溶液,得到的晶体颗粒较大
3.下列各组离子在指定溶液中可能大量共存的是
A.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH、Cl-、Brˉ
B.能使酚酞变红的溶液:Mg2+、Fe3+、Na+、ClO-
C.含有大量 Fe2+的溶液:Na+、NH、SO、OH-
D.0.1mol/LNa2CO3溶液:Κ+、Cu2+、SO、Clˉ
4.25℃时,难溶盐CaSO4、CaCO3、MnCO3溶液中阳离子浓度的负对数和阴离子浓度的负对数的关系如图所示。下列说法错误的是
A.25℃,
B.向A点对应的溶液中加入固体CaCl2,可得到Y点对应的溶液
C.25℃,三种物质的溶解度:MnCO3D.25℃,向100mLMnCO3饱和溶液中加入0.01mol CaCl2(s),有CaCO3沉淀生成
5.下列实验操作、现象与结论均正确的是
选项 操作 现象 结论
A 向溶液中滴入KSCN溶液和新制氯水 溶液变血红色 原溶液中一定有Fe2+
B 把红色的鲜花放入干燥的氯气中 花的颜色无明显变化 干燥的氯气没有漂白性
C 将0.1mol/L的NaCl溶液滴入硝酸银溶液至不再有沉淀产生,再滴加0.1mol/L KI溶液 先有白色沉淀生成,后变为黄色沉淀 Ksp(AgCl)>Ksp(AgI)
D 将稀硫酸滴入淀粉溶液中,加热一段时间,再加入新制的Cu(OH)2悬浊液并加热 溶液中未出现砖红色沉淀 淀粉未水解
A.A B.B C.C D.D
6.“水是生存之本、文明之源。”下列关于水处理方法叙述错误的是
A.硫酸铝钾或硫酸铝作净水剂,可吸附沉降水中悬浮物
B.硬水均可用加热煮沸的方法降低其中、的浓度
C.可用FeS作为沉淀剂除去废水中、等重金属离子
D.工业使用漂白粉时常加入少量的醋酸缩短达到漂白效果的时间
7.常温下,下列物质水溶液呈碱性的是
A.NH4Cl B.NaCl C.CuSO4 D.NaHCO3
8.根据下列溶液中的平衡图像所得出的结论正确的是
A.若图甲表示稀释起始pH相同的NaOH溶液与氨水,则曲线b对应NaOH溶液,且稀释后对应的溶液中水的电离程度比a中小
B.若图乙表示其他条件相同时,的分解曲线,则说明溶液pH越大,的分解速率越慢
C.若图丙表示室温下,向25mL0.1NaOH溶液中逐滴加入0.2溶液,则B点:,
D.若图丁表示室温时,醋酸和醋酸钠的混合溶液中与的浓度与pH的关系,则可知室温下醋酸的电离平衡常数为
9.下列反应的离子方程式正确的是
A.用惰性电极电解氯化镁溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑
B.碱性高锰酸钾溶液和草酸:2+H2C2O4+2OH-=2+2CO2↑+2H2O
C.Ba(OH)2溶液与足量NaHCO3溶液:2+Ba2++2OH-=BaCO3↓+2H2O+
D.Ca(ClO)2溶液通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
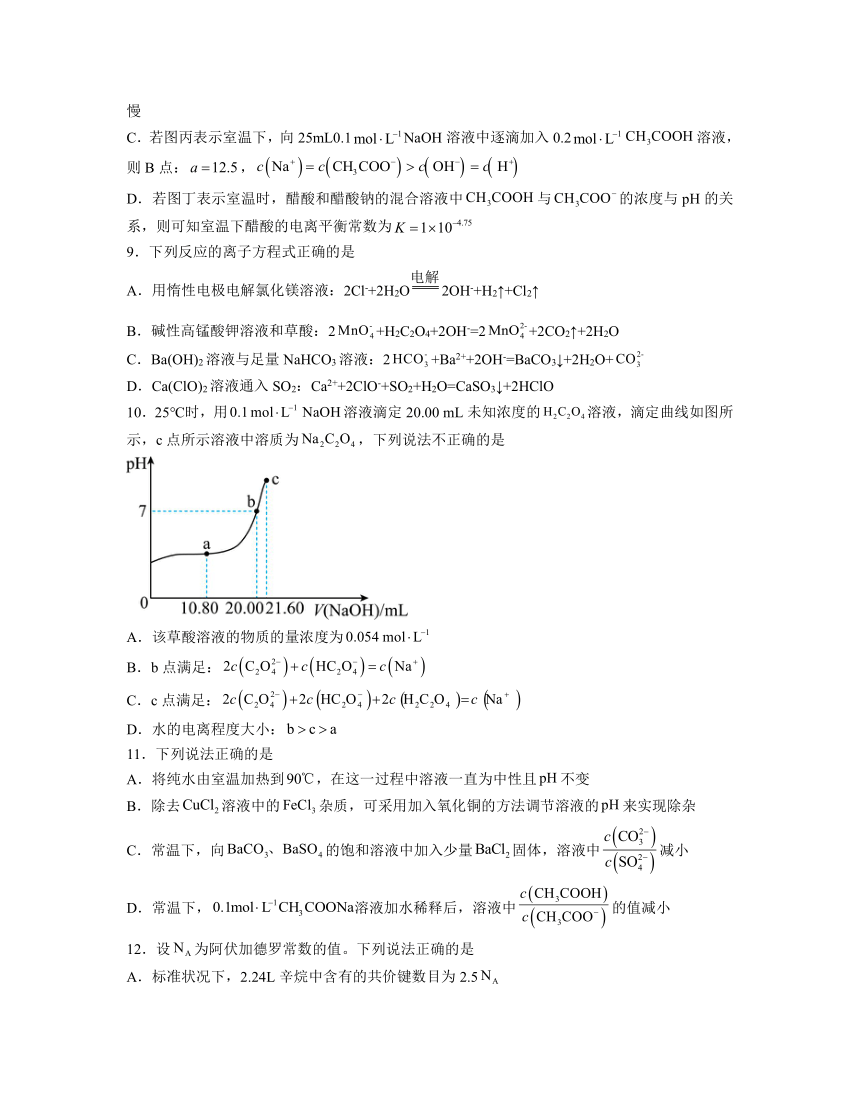
10.25℃时,用溶液滴定20.00 mL未知浓度的溶液,滴定曲线如图所示,c点所示溶液中溶质为,下列说法不正确的是
A.该草酸溶液的物质的量浓度为
B.b点满足:
C.c点满足:
D.水的电离程度大小:
11.下列说法正确的是
A.将纯水由室温加热到,在这一过程中溶液一直为中性且不变
B.除去溶液中的杂质,可采用加入氧化铜的方法调节溶液的来实现除杂
C.常温下,向的饱和溶液中加入少量固体,溶液中减小
D.常温下,溶液加水稀释后,溶液中的值减小
12.设为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L辛烷中含有的共价键数目为2.5
B.和的混合物中,含有的离子总数为3
C.与0.4L10mol/L的浓盐酸充分反应,生成的氯气分子数为1
D.常温下,pH=1的盐酸溶液中,由水电离出来的数目为
13.2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验””演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质 B.醋酸钠溶液呈碱性
C.升高温度,水解常数增大 D.加入氯化钠固体,无沉淀生成
14.下列溶液一定呈中性的是
A. 的溶液 B. 时的氯化钠溶液
C.由强酸、强碱等物质的量反应得到的溶液 D.非电解质溶于水得到的溶液
15.常温下,有以下三种溶液:①pH=3的盐酸,②pH=11的氨水,③将溶液①和②等体积混合得到的溶液,下列有关这三种溶液的说法正确的是
A.溶液①和溶液②中由水电离出的c(OH-)相等
B.三种溶液的导电能力:③>②>①
C.溶液③中离子浓度:c(NH)>c(Cl-)>c(H+)>c(OH-)
D.将溶液①和溶液②都稀释10倍后,两者pH的差值小于6
二、填空题
16.按要求回答下列问题
Ⅰ、(1)已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
(2)已知:碳的燃烧热ΔH1=akJ·mol-1,
S(s)+2K(s)=K2S(s);ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s)ΔH3=ckJ·mol-1,
则S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)ΔH= 。
(3)肼N2H4(l)可作为火箭发动机的燃料,与氧化剂N2O4(g)反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l)ΔH1=-195kJ/mol
②N2H4(l)+O2(g)===N2(g)+2H2O(g)ΔH2=-534.2kJ/mol
写出N2H4(l)和N2O4(l)反应的热化学方程式
Ⅱ、在一定温度下,有a,盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。
(3)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
Ⅲ、25℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加入蒸馏水 mL
(2)如果加入pH=10的NaOH溶液,应加NaOH溶液 mL;
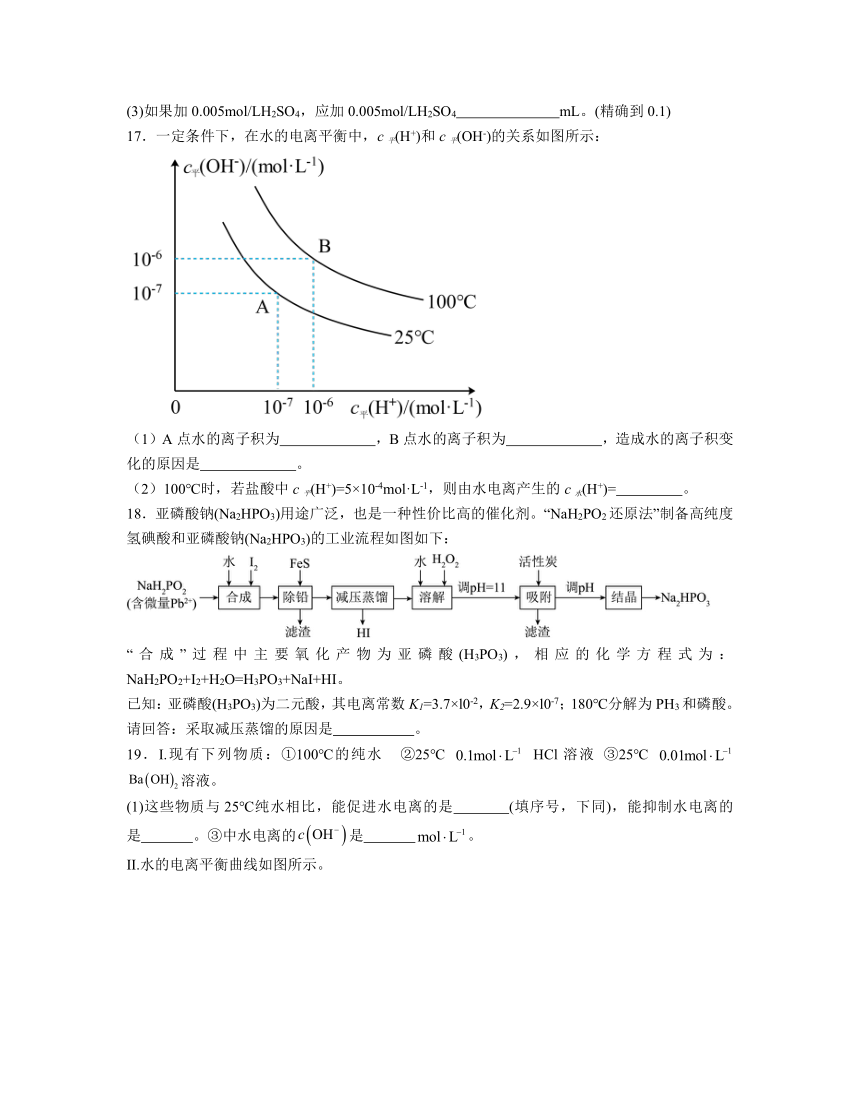
(3)如果加0.005mol/LH2SO4,应加0.005mol/LH2SO4 mL。(精确到0.1)
17.一定条件下,在水的电离平衡中,c平(H+)和c平(OH-)的关系如图所示:
(1)A点水的离子积为 ,B点水的离子积为 ,造成水的离子积变化的原因是 。
(2)100℃时,若盐酸中c平(H+)=5×10-4mol·L-1,则由水电离产生的c水(H+)= 。
18.亚磷酸钠(Na2HPO3)用途广泛,也是一种性价比高的催化剂。“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图如下:
“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。
请回答:采取减压蒸馏的原因是 。
19.I.现有下列物质:①100℃的纯水 ②25℃ HCl溶液 ③25℃ 溶液。
(1)这些物质与25℃纯水相比,能促进水电离的是 (填序号,下同),能抑制水电离的是 。③中水电离的是 。
II.水的电离平衡曲线如图所示。
(2)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(3)25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱溶液与强酸溶液的体积比是 。
(4)100℃时,纯水中的 ,这种水显 (填“酸”“碱”或“中”)性;若温度不变,滴入稀盐酸使,则 。
20.混合碱(Na2CO3与NaHCO3,或Na2CO3与NaOH的混合物)的成分及含量可用双指示剂法测定。步骤如下:取混合碱溶液25.00 mL,滴加2滴酚酞为指示剂,用0.2000 mol·L 1的盐酸滴定液滴定至溶液呈微红色,记下消耗盐酸体积为22.50 mL;再滴加2滴甲基橙,继续滴定至溶液由黄色变为橙色,记下第二次滴定消耗盐酸的体积12.50 mL。(已知:H2CO3的Ka1 = 4.3 × 10-7;Ka2 = 5.6 × 10-11)
请计算:
(1)混合碱成分及物质的量之比为 。
(2)混合碱溶液中Na2CO3的浓度为 mol·L 1.(写出计算过程)
21.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请回答下列问题:
(1)碳酸钠俗称 ,可作为碱使用的原因是 (用离子方程式表示)。
(2)为抑制水解,实验室中配制FeCl3溶液时常加入 (填名称)。将FeCl3溶液和NaHCO3溶液混合,产生红褐色沉淀和无色气体,反应的离子方程式为 。
(3)25℃时,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为 。
(4)25℃时,Ksp(AgCl)=1.8×10-10.现将足量氯化银固体放入100 mL 0.2 mol/L AgNO3溶液中,则溶液中氯离子的浓度为 mol·L-1(忽略溶液体积的变化)。
(5)某温度时,Ksp(BaCO3)=2.6×10 9,Ksp(BaSO4)=1.1×10 10.在该温度下,向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中= (保留三位有效数字)。
22.Ⅰ.某易溶于水的正盐X由3种元素组成,兴趣小组对化合物X开展探究实验。
①A和B均为纯净物,生成的A全部逸出,且可使品红溶液褪色。
②溶液C中的溶质只含一种阴离子,进行焰色反应,发现透过蓝色钴玻片,火焰呈紫色;
③用酸性:标准溶液滴定用5.40gX配成的溶液,发生反应:,消耗0.032mol。(注:忽略加入固体X后溶液的体积变化)。
请回答:
((1))组成X的3种元素是 (填元素符号),X的化学式是 。
(2)若吸收气体A的KOH不足,,该反应的化学方程式是 。
(3)固体X与稀盐酸发生反应的离子方程式是 。
Ⅱ.(4)某研究小组为讨论(aq)与(aq)的反应原理,提出了两种可能:
①发生双水解反应;
② 。
(5)在探究前,先进行了一个实验,选择实验用品如下:溶液、稀溶液、稀盐酸、试管、胶头滴管。从选择的药品分析,设计这个实验的目的是 。
23.将过量的溶液滴入到一定量溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
(一)猜想与假设
猜想一:固体为。
猜想二:固体为,理由:溶液呈 (填“酸性”或“碱性”)。
猜想三:固体为和的混合物。
(二)查阅资料
①和晶体均不带结晶水;
②、受热易分解分别生成两种氧化物。
(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经 、洗涤、低温烘干得蓝色固体。
Ⅱ.用如图所示装置,探究固体的成分。
(1)若用装置A、B组合进行实验,B中无现象,则猜想 正确。
(2)若用装置A、C组合进行实验,C中无现象,则猜想 正确。
(3)小组同学将装置按A、 、 (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的。实验中:B中的现象为 ,C中的现象为 。
(四)实验结论:固体为和的混合物。
经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的溶液和一定量反应的离子方程式 。
【参考答案】
一、选择题
1.C
解析:A.溶度积是沉淀溶解平衡时难溶电解质在溶液中各离子浓度幂的乘积,A项错误;
B.溶度积与温度有关,B项错误;
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向,若Qc>Ksp,则平衡向生成沉淀的方向移动;若Qc<Ksp,则平衡向沉淀溶解的方向移动;若Qc=Ksp,则平衡不移动,C项正确;
D.Ca(OH)2的Ksp随温度升高而减小,D项错误;
故选C。
2.B
解析:A.浓硫酸会使得铁、铝钝化,反而会降低反应速率,A错误;
B.在“氧化除杂”是将亚铁离子转化为铁离子,过氧化氢起氧化剂作用,利于将铁转化为氢氧化铁沉淀而除去;“酸溶”中是将三价钴转化为二价钴,过氧化氢起还原剂作用,B正确;
C.“钴镍分离”时发生反应为次氯酸根离子、二价钴离子反应转化为氢氧化钴沉淀,反应中所得溶液为酸性,故离子方程式为,C错误;
D.“结晶”时,缓慢蒸发溶液,晶体颗粒长的较大,得到的晶体颗粒较大,D错误;
故选B。
3.A
解析:A. 能使碘化钾淀粉试纸变蓝的溶液可能为溴水,此时四种离子可能共存,A正确;
B.能使酚酞变红的溶液含有大量氢氧根离子,铁离子、镁离子不能共存,B错误;
C.大量Fe2+的溶液,OH-离子不共存,C错误;
D.在0.1mol/LNa2CO3溶液中,铜离子不能共存,D错误;
故选A。
4.B
解析:A. ,,选项A正确;
B. 向A点对应的溶液中加入固体,钙离子浓度增大,减小,不可能得到Y点对应的溶液,选项B错误;
C. 比较三种物质的Ksp,,三种物质的溶解度:,选项C正确;
D. 饱和溶液中c()=10-5.3mol L-1,,向饱和溶液中加入,c(Ca2+)= =0.1mol L-1,Qc=c()c(Ca2+)=10-5.3×0.1=10-6.3>10-8.6,有沉淀生成, 选项D正确;
答案选B。
5.C
解析:A.向溶液中滴入KSCN溶液和新制氯水,若溶液中存在三价铁离子溶液也会变红色,即原溶液中有Fe3+没有Fe2+时也能满足现象,A错误;
B.鲜花中存在水分,放入干燥的氯气中,氯气也可以和水反应生成次氯酸,即花的颜色也会褪去,B错误;
C.将0.1mol/L的NaCl溶液滴入硝酸银溶液至不再有沉淀产生,氯离子恰好完全反应,再滴加0.1mol/L KI溶液,即先有白色沉淀氯化银生成,后转变为黄色沉淀碘化银,难溶转化为更难溶,即Ksp(AgCl)>Ksp(AgI),C正确;
D.将稀硫酸滴入淀粉溶液中加热一段时间,应先加入氢氧化钠溶液调至碱性之后再加入新制的Cu(OH)2悬浊液并加热检验淀粉是否水解生成葡萄糖,D错误;
故选C。
6.B
解析:A.铝离子水解生成氢氧化铝胶体,可吸附沉降水中悬浮物,A正确;
B.碳酸氢钙、碳酸氢镁不稳定加热可转化为沉淀,但不是让所有情况的硬水都可用加热煮沸的方法降低其中、的浓度,B错误;
C.FeS作为沉淀剂可将铜离子、银离子转化为难溶的硫化铜、硫化银沉淀,除去废水中、等重金属离子,C正确;
D.醋酸可以和次氯酸根离子转化为强氧化性的次氯酸,缩短达到漂白效果的时间,D正确;
故选B。
7.D
解析:A.NH4Cl溶液中铵根离子水解显酸性,故A不符合题意;
B.NaCl不发生水解,溶液呈中性,故B不符合题意;
C.CuSO4溶液中铜离子水解显酸性,故C不符合题意;
D.NaHCO3溶液中碳酸氢根水解大于电离,溶液显碱性,故D符合题意;
综上所述,答案为D。
8.D
解析:A.稀释起始pH相同的NaOH溶液与氨水,强碱的pH变化大,b对应的是NaOH溶液,稀释后NaOH溶液中OH-离子浓度小,对水的电离抑制程度小,水电离程度大,故A错误;
B.由图得知,碱性强的H2O2分解速率大,故B错误;
C.向25mL0.1NaOH溶液中逐滴加入0.2溶液12.5ml时,正好完全反应生成醋酸钠,醋酸根离子水解溶液应该显碱性,B点对应的pH=7,说明加入的醋酸体积大于12.5ml,故C错误;
D.丁图中由交叉点得知,与的浓度相等时,对应的pH=4.75,由电离常数公式K==,故D正确;
答案选D。
9.C
解析:A.正确的离子方程式为Mg2++2Cl +2H2OMg(OH)2↓+H2↑+Cl2↑,选项A错误;
B.正确的离子方程式为2+H2C2O4+6OH-=2+2+4H2O,选项B错误;
C.Ba(OH)2溶液与足量NaHCO3溶液反应生成碳酸钡、碳酸钠和水,反应的离子方程式为:2+Ba2++2OH-=BaCO3↓+2H2O+,选项C正确;
D.要发生氧化还原反应,Ca(ClO)2溶液通入足量SO2:Ca2++2ClO +2SO2+2H2O=CaSO4↓+2Cl-+4H++,Ca(ClO)2溶液通入少量SO2:Ca2++3ClO +SO2+H2O=CaSO4↓+Cl-+2HClO,选项D错误;
答案选C。
10.D
解析:A.草酸为二元弱酸,c点所示溶液中溶质为,则此时两者恰好反应,则该草酸溶液的物质的量浓度为,A正确;
B.b点由电荷守恒可知:,此时pH=7,则,B正确;
C.c点所示溶液中溶质为,由物料守恒可知,,C正确;
D.酸和碱会抑制水的电离,盐的水解会促进水的电离,c点所示溶液中溶质为,此时水的电离程度最大,故水的电离程度大小:,D错误;
故选D。
11.B
解析:A.水的电离是吸热反应,升高温度,能促进水的电离,氢离子浓度增大,水的值变小,故错误;
B. 除去溶液中的杂质,可采用加入氧化铜的方法调节溶液的来实现除杂,氧化铜消耗铁离子水解产生的氢离子,促进铁离子水解,同时生成氯化铜,不引入杂质,故B正确;
C.温度不变溶度积常数不变,不变,故C错误;
D.常温下,溶液加水稀释过程中,溶液碱性减弱,增大,溶液中,只与温度有关,增大,因而增大,故D错误;
故选B。
12.B
解析:A.标准状况下,2.24L辛烷为非气态物质,A错误;
B.和的摩尔质量均为78g/mol,则78g和的混合物的物质的量为1mol,1mol由2mol和1mol构成,1mol由2mol和1mol构成,因此1mol和的混合物中含有的离子总数为3,B正确;
C.0.4L10mol/L的浓盐酸物质的量为4mol,1mol与4mol的浓盐酸充分反应,因二氧化锰只与浓盐酸反应,和稀盐酸不反应,则盐酸不能反应完全,则生成的氯气分子个数小于1,C错误;
D.溶液体积未知,不能确定溶液中水电离出的数目,D错误;
故答案为:B。
13.D
解析:A.醋酸钠是可溶性盐,是强电解质,A正确;
B.醋酸钠是强碱弱酸盐,水解显碱性,B正确;
C.水解平衡吸热,温度升高,水解平衡右移,水解常数增大,C正确;
D.加入氯化钠固体,钠离子增多,根据同离子效应可知,过饱和醋酸钠溶液中析出醋酸钠晶体,D错误;
故选D。
14.B
解析:A.在室温下,pH=7的溶液为中性,若温度不是室温,则pH=7的溶液不一定是中性溶液,选项A错误;
B.氯化钠溶液中,c(H+)= c(OH-)的溶液一定为中性溶液,选项B正确;
C.强酸、强碱的元数没有确定,所以二者以等物质的量反应得到的溶液不一定是中性溶液,选项C错误;
D.非电解质溶于水若发生反应产生酸或碱,则溶液可能显酸性或碱性,因此不一定得到中性溶液,选项D错误;
答案选B。
15.A
解析:A.酸中由水电离出的c(OH-)或c(H+)取决于溶液中的c(OH-),碱中由水电离出的c(OH-)或c(H+)取决于溶液中的c(H+),pH=3的盐酸和pH=11的氨水中由水电离出的c(OH-)都是10-11mol/L,故A项正确;
B.溶液①和溶液②中离子浓度相等,导电能力相同,溶液③为氨水和氯化铵的混合溶液,由于体积增大1倍,离子浓度减小,导电能力弱于溶液①和溶液②,故B项错误;
C.溶液③为氨水和氯化铵的混合溶液,溶液呈碱性,故C项错误;
D.pH=3的盐酸稀释10倍后pH=4,pH=11的氨水稀释10倍后,pH介于10和11之间,两者pH的差值大于6,故D项错误;
故答案为:A。
二、填空题
16.N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1 3a+b-ckJ·mol-1 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH=-873.4kJ·mol-1 b>a>c c>a>b c>a=b 900 1000 81,82
解析:Ⅰ、(1)在反应N2+3H2 2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ mol-1;
(2)由信息可知,①C(s)+O2(g)=CO2(g)△H1=a kJ mol 1; ②S(s)+2K(s)=K2S(s)△H2=b kJ mol 1;③2K(s)+N2(g)+3O2(g)=2KNO3(s)△H3=c kJ mol 1,结合盖斯定律可知,②+①×3 ③得到S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g),则△H=(3a+b c) kJ·mol-1;
(3)①N2(g)+2O2(g)=N2O4(l)△H1= 195kJ mol 1;②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2= 534.2kJ mol 1;根据盖斯定律写出肼和N2O4反应的热化学方程:②×2 ①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H= 873.4kJ/mol;故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H= 873.4kJ/mol;
Ⅱ、(1)硫酸为二元酸,盐酸为强酸,醋酸为弱酸,则物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c,故答案为:b>a>c;
(2)同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸,则中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是b>a=c,
故答案为:b>a=c;
(3)当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,故答案为:c>a=b;
(4)醋酸在稀释过程中,会促进电离,所以氢离子的物质的量增加,氢离子的浓度变化程度小,硫酸和盐酸溶液中氢离子物质的量不变且相等,所以c(H+)由大到小的顺序是c>a=b,故答案为:c>a=b;
Ⅲ、pH=12的NaOH溶液中c(OH )=0.01mol/L,pH降为11,则溶液中c(OH )=0.001mol/L,
(1)设加入水的体积为xL,溶液稀释前后溶质的物质的量不变,则
0.01mol/L×0.1L=0.001mol/L×(0.1+x)L,x=0.9L,即900ml,故答案为:900;
(2)pH=10的氢氧化钠溶液中c(OH )=0.0001mol/L,设pH=10的氢氧化钠的体积为yL,则0,01mol/L×0.1L+0.0001mol/L×yL=0.001mol/L×(0.1+y)L,y=1L=1000mL,故答案为:1000;
(3)0.005mol/LH2SO4溶液中c(H+)=0,005mol/L×2=0.01mol/L,设0.005mol/LH2SO4溶液的体积为xL,则0.01mol/L×0.1L-0.01mol/L×xL=0.001mol/L×(0.1+x)L,解得x=81.82mL,故答案为:81.82。
17.1×10-14mol2·L-2 1×10-12mol2·L-2 水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大 2×10-9mol·L-1
解析:(1)由A点的H+、OH-的浓度可得Kw=c平(H+)·c平(OH-)=1×10-14mol2·L-2,同理可知B点的Kw=c平(H+)·c平(OH-)=1×10-12mol2·L-2,水的离子积变大的原因是水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大;
(2)若盐酸中c平(H+)=5×10-4mol·L-1,则c水(H+)=c平(OH-)==2×10-9mol·L-1。
18.防止温度高于180℃时H3PO3分解为PH3和磷酸
【分析】NaH2PO2被I2氧化为亚磷酸,用FeS除铅,滤液中含有亚磷酸和氢碘酸,减压蒸馏,将沸点低的HI蒸出,亚磷酸和NaI的混合物中加入水和H2O2,H2O2将I-氧化为I2,调节溶液的pH,并加入活性炭将I2吸附,过滤后调节滤液的pH,然后结晶得到亚磷酸钠。
解析:由亚磷酸180℃分解为PH3和磷酸可知,为防止亚磷酸发生分解反应,将亚磷酸转化为亚磷酸二氢钠时,应采用减压蒸馏,故答案为:防止温度高于180℃时H3PO3分解为PH3和磷酸。
19.(1) ① ②③
(2)
(3)
(4) 中
解析:(1)水电离:,是吸热过程,与25℃纯水相比,能促进水电离的是①;酸或碱电离出的H+和OH-均抑制水的电离,能抑制水电离的是②③;③25℃ 溶液中=0.02mol/L,则水电离的是。
(2)从图中可知,25℃时水的离子积常数Kw(25℃)=c(H+)·c(OH-)=10-14(mol/L)2,100℃时,水的电离平衡状态到B点,则此时水的离子积Kw(100℃)=c(H+)·c(OH-)=10-12(mol/L)2,水的离子积从增加到。
(3)pH=13的强碱溶液c(OH-)=0.1mol/L,pH=2的强酸溶液c(H+)=0.01mol/L,根据题意,所得混合液显碱性,则有,则强碱溶液与强酸溶液的体积比是。
(4)根据图示可知,100℃时,纯水中的mol/L,这种水,显中性;若温度不变,滴入稀盐酸使,则。
20.:4 0.1000 mol·L 1
【分析】滴酚酞为指示剂,发生的反应为:OH-+H+=H2O,CO+H+=HCO,或只发生CO+H+=HCO,甲基橙为指示剂时,发生HCO+H+=H2O+CO2 ↑。由于两次消耗的酸的体积不相同,且第一次多于第二次,混合碱成分是Na2CO3与NaOH。
解析:(1)由分析可知:混合碱成分是Na2CO3与NaOH及物质的量之比为12.50 mL:(22.50 mL-12.50 mL)=5 :4。故答案为:5 :4;
(2)n(Na2CO3)+n(NaOH)=0.2000mol·L 1×22.50mL=4.5×10-3mol,n(Na2CO3)=4.5×10-3mol=2.5×10-3mol, 混合碱溶液中Na2CO3的浓度为 =0.1000 mol·L 1。
故答案为:0.1000 mol·L 1。
21.纯碱或苏打 CO+H2O =HCO+OH- 盐酸 Fe3++3HCO=Fe(OH)3↓+3CO2↑ 1∶104 9×10-10 23.6
解析:(1)碳酸钠俗称苏打或纯碱,由于碳酸根离子存在水解:CO+H2O =HCO+OH-,所以溶液呈碱性,可作为碱使用;
(2)Fe3+存在水解平衡:Fe3++3H2OFe(OH)3+3H+,因此常加入盐酸增大氢离子浓度,从而抑制其水解,将FeCl3溶液和NaHCO3溶液混合,产生氢氧化铁的红褐色沉淀和无色的二氧化碳气体,反应的离子方程式为Fe3++3HCO=Fe(OH)3↓+3CO2↑;
(3)pH=5的醋酸溶液中,c(H+)=10-5mol/L,则c(OH-)==10-9mol/L,则由水电离出的c(H+)=c(OH-)=10-9mol/L,pH=5的硫酸铝溶液中,溶液中的氢离子全部由水电离,因此有水电离出的c(H+)=10-5mol/L,两者之比为:10-9mol/L:10-5mol/L=1∶104;
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银固体放入100 mL 0.2 mol/L AgNO3溶液中,则溶液中氯离子的浓度为mol/L;
(5)。
22.K、S、O 发生氧化还原反应 检验是否变质
【分析】气体A可使品红溶液褪色,则说明A为SO2或Cl2,溶液C的焰色反应透过蓝色钴玻璃观察火焰呈紫色,说明溶液C中含有K元素,X能发生反应:,说明X中含有S、O元素,因此组成X的3种元素为K、S、O;根据元素守恒可知,反应生成的淡黄色固体为S,则n(S)=0.01mol,溶液C中的溶质只含一种阴离子,说明反应过程中盐酸过量,则该阴离子为Cl-,稀释至1000ml并测得其pH为2,c(H+)=0.01mol/L,则溶液C中的c(H+)=0.1mol/L,又原盐酸溶液c(Cl-)=0.5mol/L,根据电荷守恒可知,c(K+)=c(Cl-)-c(H+)=0.4mol/L[此时溶液中c(OH-)浓度低于10-5mol/L,可认为其不存在],则n(K+)=0.4mol/L×0.1L=0.04mol,反应过程中H+与X中部分的O原子组成H2O,反应消耗n(H+)=0.4mol/L×0.1L=0.04mol,则消耗X中n(O)=0.02mol,设生成SO2物质的量为ymol,根据质量守恒可知,,解得y=0.05,因此5.40gX中K+的物质的量为0.04mol,S原子的物质的量为0.01mol+0.05mol=0.06mol,O原子的物质的量为0.02mol+0.05mol×2=0.12mol,则各原子物质的量之比为n(K):n(S):n(O)=0.04mol:0.06mol:0.12mol=2:3:6,则X的化学式为K2S3O6。
解析:Ⅰ.(1)由上述分析可知,组成X的3种元素为K、S、O;X的化学式为K2S3O6;故答案为:K、S、O;K2S3O6;
(2)SO2与KOH先后发生反应:SO2+2KOH=K2SO3+H2O、SO2+K2SO3+H2O=2KHSO3,因此时,反应方程式为;
(3)K2S3O6与稀盐酸反应生成S、SO2、H2O,根据氧化还原反应化合价升降守恒、电荷守恒以及原子守恒可知K2S5O6与稀盐酸反应的离子方程式为;
Ⅱ.(4)(aq)与(aq)可能发生双水解反应或者发生氧化还原反应,故答案为②:发生氧化还原反应;
(5)溶液D为SO2与足量KOH反应所得溶液,溶液中溶质为KOH、K2SO3,取少量溶液于试管中,向溶液中滴加过量稀盐酸后再加入BaCl2稀溶液,若有白色沉淀生成,则说明K2SO3已变质生成K2SO4,从而避免检验与Fe3+反应生成的干扰。
23.碱性 过滤 二 一 C B 澄清的石灰水变浑浊 白色固体变蓝
解析:猜想二:碳酸钠为强碱弱酸盐,在水中会进行水解生成氢氧根离子,显碱性;
Ⅰ.分离固体和液体的方法为过滤。
(1)若用装置A、B组合进行实验,B中无现象,即澄清的石灰水没有变浑浊,说明没有二氧化碳生成,则固体没有碳酸铜,只有氢氧化铜,故猜想二正确。
(2)若用装置A、C组合进行实验,C中无现象,即无水硫酸铜不变蓝说明没有水生成,固体中没有氢氧化铜,只有碳酸铜,故猜想一正确。
(3)要证明生成物中有水和二氧化碳,应先证明水再证明二氧化碳,若先证明二氧化碳的话,通过澄清的石灰水,会带出水蒸气,干扰水蒸气的检验,气体通过澄清的石灰水,若变浑浊,C中无水硫酸铜白色固体变蓝色,说明有二氧化碳和水,则证明猜想三是正确的。
(四)经实验测得,混合物中两种固体的物质的量之比为1:1,过量的溶液和一定量反应的离子方程式:
一、选择题
1.下列说法正确的是
A.溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
B.溶度积常数是不受任何条件影响的常数,简称溶度积
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向
D.所有物质的溶度积都是随温度的升高而增大的
2.镍电池芯废料中主要含有金属镍,还含有金属钴、铁、铝。一种从镍电池芯废料中回收金属的工艺流程如下:
下列说法正确的是
A.“酸溶”时,若改用浓硫酸,反应速率更快,效果更好
B.在“氧化除杂”和“酸溶”中的作用不同
C.“钴镍分离”时发生反应的离子方程式为
D.“结晶”时,快速蒸发溶液,得到的晶体颗粒较大
3.下列各组离子在指定溶液中可能大量共存的是
A.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH、Cl-、Brˉ
B.能使酚酞变红的溶液:Mg2+、Fe3+、Na+、ClO-
C.含有大量 Fe2+的溶液:Na+、NH、SO、OH-
D.0.1mol/LNa2CO3溶液:Κ+、Cu2+、SO、Clˉ
4.25℃时,难溶盐CaSO4、CaCO3、MnCO3溶液中阳离子浓度的负对数和阴离子浓度的负对数的关系如图所示。下列说法错误的是
A.25℃,
B.向A点对应的溶液中加入固体CaCl2,可得到Y点对应的溶液
C.25℃,三种物质的溶解度:MnCO3
5.下列实验操作、现象与结论均正确的是
选项 操作 现象 结论
A 向溶液中滴入KSCN溶液和新制氯水 溶液变血红色 原溶液中一定有Fe2+
B 把红色的鲜花放入干燥的氯气中 花的颜色无明显变化 干燥的氯气没有漂白性
C 将0.1mol/L的NaCl溶液滴入硝酸银溶液至不再有沉淀产生,再滴加0.1mol/L KI溶液 先有白色沉淀生成,后变为黄色沉淀 Ksp(AgCl)>Ksp(AgI)
D 将稀硫酸滴入淀粉溶液中,加热一段时间,再加入新制的Cu(OH)2悬浊液并加热 溶液中未出现砖红色沉淀 淀粉未水解
A.A B.B C.C D.D
6.“水是生存之本、文明之源。”下列关于水处理方法叙述错误的是
A.硫酸铝钾或硫酸铝作净水剂,可吸附沉降水中悬浮物
B.硬水均可用加热煮沸的方法降低其中、的浓度
C.可用FeS作为沉淀剂除去废水中、等重金属离子
D.工业使用漂白粉时常加入少量的醋酸缩短达到漂白效果的时间
7.常温下,下列物质水溶液呈碱性的是
A.NH4Cl B.NaCl C.CuSO4 D.NaHCO3
8.根据下列溶液中的平衡图像所得出的结论正确的是
A.若图甲表示稀释起始pH相同的NaOH溶液与氨水,则曲线b对应NaOH溶液,且稀释后对应的溶液中水的电离程度比a中小
B.若图乙表示其他条件相同时,的分解曲线,则说明溶液pH越大,的分解速率越慢
C.若图丙表示室温下,向25mL0.1NaOH溶液中逐滴加入0.2溶液,则B点:,
D.若图丁表示室温时,醋酸和醋酸钠的混合溶液中与的浓度与pH的关系,则可知室温下醋酸的电离平衡常数为
9.下列反应的离子方程式正确的是
A.用惰性电极电解氯化镁溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑
B.碱性高锰酸钾溶液和草酸:2+H2C2O4+2OH-=2+2CO2↑+2H2O
C.Ba(OH)2溶液与足量NaHCO3溶液:2+Ba2++2OH-=BaCO3↓+2H2O+
D.Ca(ClO)2溶液通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
10.25℃时,用溶液滴定20.00 mL未知浓度的溶液,滴定曲线如图所示,c点所示溶液中溶质为,下列说法不正确的是
A.该草酸溶液的物质的量浓度为
B.b点满足:
C.c点满足:
D.水的电离程度大小:
11.下列说法正确的是
A.将纯水由室温加热到,在这一过程中溶液一直为中性且不变
B.除去溶液中的杂质,可采用加入氧化铜的方法调节溶液的来实现除杂
C.常温下,向的饱和溶液中加入少量固体,溶液中减小
D.常温下,溶液加水稀释后,溶液中的值减小
12.设为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L辛烷中含有的共价键数目为2.5
B.和的混合物中,含有的离子总数为3
C.与0.4L10mol/L的浓盐酸充分反应,生成的氯气分子数为1
D.常温下,pH=1的盐酸溶液中,由水电离出来的数目为
13.2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验””演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质 B.醋酸钠溶液呈碱性
C.升高温度,水解常数增大 D.加入氯化钠固体,无沉淀生成
14.下列溶液一定呈中性的是
A. 的溶液 B. 时的氯化钠溶液
C.由强酸、强碱等物质的量反应得到的溶液 D.非电解质溶于水得到的溶液
15.常温下,有以下三种溶液:①pH=3的盐酸,②pH=11的氨水,③将溶液①和②等体积混合得到的溶液,下列有关这三种溶液的说法正确的是
A.溶液①和溶液②中由水电离出的c(OH-)相等
B.三种溶液的导电能力:③>②>①
C.溶液③中离子浓度:c(NH)>c(Cl-)>c(H+)>c(OH-)
D.将溶液①和溶液②都稀释10倍后,两者pH的差值小于6
二、填空题
16.按要求回答下列问题
Ⅰ、(1)已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 。
(2)已知:碳的燃烧热ΔH1=akJ·mol-1,
S(s)+2K(s)=K2S(s);ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s)ΔH3=ckJ·mol-1,
则S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)ΔH= 。
(3)肼N2H4(l)可作为火箭发动机的燃料,与氧化剂N2O4(g)反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l)ΔH1=-195kJ/mol
②N2H4(l)+O2(g)===N2(g)+2H2O(g)ΔH2=-534.2kJ/mol
写出N2H4(l)和N2O4(l)反应的热化学方程式
Ⅱ、在一定温度下,有a,盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)若三者c(H+)相同时,物质的量浓度由大到小的顺序是 。
(3)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
Ⅲ、25℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加入蒸馏水 mL
(2)如果加入pH=10的NaOH溶液,应加NaOH溶液 mL;
(3)如果加0.005mol/LH2SO4,应加0.005mol/LH2SO4 mL。(精确到0.1)
17.一定条件下,在水的电离平衡中,c平(H+)和c平(OH-)的关系如图所示:
(1)A点水的离子积为 ,B点水的离子积为 ,造成水的离子积变化的原因是 。
(2)100℃时,若盐酸中c平(H+)=5×10-4mol·L-1,则由水电离产生的c水(H+)= 。
18.亚磷酸钠(Na2HPO3)用途广泛,也是一种性价比高的催化剂。“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图如下:
“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。
请回答:采取减压蒸馏的原因是 。
19.I.现有下列物质:①100℃的纯水 ②25℃ HCl溶液 ③25℃ 溶液。
(1)这些物质与25℃纯水相比,能促进水电离的是 (填序号,下同),能抑制水电离的是 。③中水电离的是 。
II.水的电离平衡曲线如图所示。
(2)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(3)25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱溶液与强酸溶液的体积比是 。
(4)100℃时,纯水中的 ,这种水显 (填“酸”“碱”或“中”)性;若温度不变,滴入稀盐酸使,则 。
20.混合碱(Na2CO3与NaHCO3,或Na2CO3与NaOH的混合物)的成分及含量可用双指示剂法测定。步骤如下:取混合碱溶液25.00 mL,滴加2滴酚酞为指示剂,用0.2000 mol·L 1的盐酸滴定液滴定至溶液呈微红色,记下消耗盐酸体积为22.50 mL;再滴加2滴甲基橙,继续滴定至溶液由黄色变为橙色,记下第二次滴定消耗盐酸的体积12.50 mL。(已知:H2CO3的Ka1 = 4.3 × 10-7;Ka2 = 5.6 × 10-11)
请计算:
(1)混合碱成分及物质的量之比为 。
(2)混合碱溶液中Na2CO3的浓度为 mol·L 1.(写出计算过程)
21.物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请回答下列问题:
(1)碳酸钠俗称 ,可作为碱使用的原因是 (用离子方程式表示)。
(2)为抑制水解,实验室中配制FeCl3溶液时常加入 (填名称)。将FeCl3溶液和NaHCO3溶液混合,产生红褐色沉淀和无色气体,反应的离子方程式为 。
(3)25℃时,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为 。
(4)25℃时,Ksp(AgCl)=1.8×10-10.现将足量氯化银固体放入100 mL 0.2 mol/L AgNO3溶液中,则溶液中氯离子的浓度为 mol·L-1(忽略溶液体积的变化)。
(5)某温度时,Ksp(BaCO3)=2.6×10 9,Ksp(BaSO4)=1.1×10 10.在该温度下,向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中= (保留三位有效数字)。
22.Ⅰ.某易溶于水的正盐X由3种元素组成,兴趣小组对化合物X开展探究实验。
①A和B均为纯净物,生成的A全部逸出,且可使品红溶液褪色。
②溶液C中的溶质只含一种阴离子,进行焰色反应,发现透过蓝色钴玻片,火焰呈紫色;
③用酸性:标准溶液滴定用5.40gX配成的溶液,发生反应:,消耗0.032mol。(注:忽略加入固体X后溶液的体积变化)。
请回答:
((1))组成X的3种元素是 (填元素符号),X的化学式是 。
(2)若吸收气体A的KOH不足,,该反应的化学方程式是 。
(3)固体X与稀盐酸发生反应的离子方程式是 。
Ⅱ.(4)某研究小组为讨论(aq)与(aq)的反应原理,提出了两种可能:
①发生双水解反应;
② 。
(5)在探究前,先进行了一个实验,选择实验用品如下:溶液、稀溶液、稀盐酸、试管、胶头滴管。从选择的药品分析,设计这个实验的目的是 。
23.将过量的溶液滴入到一定量溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
(一)猜想与假设
猜想一:固体为。
猜想二:固体为,理由:溶液呈 (填“酸性”或“碱性”)。
猜想三:固体为和的混合物。
(二)查阅资料
①和晶体均不带结晶水;
②、受热易分解分别生成两种氧化物。
(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经 、洗涤、低温烘干得蓝色固体。
Ⅱ.用如图所示装置,探究固体的成分。
(1)若用装置A、B组合进行实验,B中无现象,则猜想 正确。
(2)若用装置A、C组合进行实验,C中无现象,则猜想 正确。
(3)小组同学将装置按A、 、 (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的。实验中:B中的现象为 ,C中的现象为 。
(四)实验结论:固体为和的混合物。
经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的溶液和一定量反应的离子方程式 。
【参考答案】
一、选择题
1.C
解析:A.溶度积是沉淀溶解平衡时难溶电解质在溶液中各离子浓度幂的乘积,A项错误;
B.溶度积与温度有关,B项错误;
C.可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向,若Qc>Ksp,则平衡向生成沉淀的方向移动;若Qc<Ksp,则平衡向沉淀溶解的方向移动;若Qc=Ksp,则平衡不移动,C项正确;
D.Ca(OH)2的Ksp随温度升高而减小,D项错误;
故选C。
2.B
解析:A.浓硫酸会使得铁、铝钝化,反而会降低反应速率,A错误;
B.在“氧化除杂”是将亚铁离子转化为铁离子,过氧化氢起氧化剂作用,利于将铁转化为氢氧化铁沉淀而除去;“酸溶”中是将三价钴转化为二价钴,过氧化氢起还原剂作用,B正确;
C.“钴镍分离”时发生反应为次氯酸根离子、二价钴离子反应转化为氢氧化钴沉淀,反应中所得溶液为酸性,故离子方程式为,C错误;
D.“结晶”时,缓慢蒸发溶液,晶体颗粒长的较大,得到的晶体颗粒较大,D错误;
故选B。
3.A
解析:A. 能使碘化钾淀粉试纸变蓝的溶液可能为溴水,此时四种离子可能共存,A正确;
B.能使酚酞变红的溶液含有大量氢氧根离子,铁离子、镁离子不能共存,B错误;
C.大量Fe2+的溶液,OH-离子不共存,C错误;
D.在0.1mol/LNa2CO3溶液中,铜离子不能共存,D错误;
故选A。
4.B
解析:A. ,,选项A正确;
B. 向A点对应的溶液中加入固体,钙离子浓度增大,减小,不可能得到Y点对应的溶液,选项B错误;
C. 比较三种物质的Ksp,,三种物质的溶解度:,选项C正确;
D. 饱和溶液中c()=10-5.3mol L-1,,向饱和溶液中加入,c(Ca2+)= =0.1mol L-1,Qc=c()c(Ca2+)=10-5.3×0.1=10-6.3>10-8.6,有沉淀生成, 选项D正确;
答案选B。
5.C
解析:A.向溶液中滴入KSCN溶液和新制氯水,若溶液中存在三价铁离子溶液也会变红色,即原溶液中有Fe3+没有Fe2+时也能满足现象,A错误;
B.鲜花中存在水分,放入干燥的氯气中,氯气也可以和水反应生成次氯酸,即花的颜色也会褪去,B错误;
C.将0.1mol/L的NaCl溶液滴入硝酸银溶液至不再有沉淀产生,氯离子恰好完全反应,再滴加0.1mol/L KI溶液,即先有白色沉淀氯化银生成,后转变为黄色沉淀碘化银,难溶转化为更难溶,即Ksp(AgCl)>Ksp(AgI),C正确;
D.将稀硫酸滴入淀粉溶液中加热一段时间,应先加入氢氧化钠溶液调至碱性之后再加入新制的Cu(OH)2悬浊液并加热检验淀粉是否水解生成葡萄糖,D错误;
故选C。
6.B
解析:A.铝离子水解生成氢氧化铝胶体,可吸附沉降水中悬浮物,A正确;
B.碳酸氢钙、碳酸氢镁不稳定加热可转化为沉淀,但不是让所有情况的硬水都可用加热煮沸的方法降低其中、的浓度,B错误;
C.FeS作为沉淀剂可将铜离子、银离子转化为难溶的硫化铜、硫化银沉淀,除去废水中、等重金属离子,C正确;
D.醋酸可以和次氯酸根离子转化为强氧化性的次氯酸,缩短达到漂白效果的时间,D正确;
故选B。
7.D
解析:A.NH4Cl溶液中铵根离子水解显酸性,故A不符合题意;
B.NaCl不发生水解,溶液呈中性,故B不符合题意;
C.CuSO4溶液中铜离子水解显酸性,故C不符合题意;
D.NaHCO3溶液中碳酸氢根水解大于电离,溶液显碱性,故D符合题意;
综上所述,答案为D。
8.D
解析:A.稀释起始pH相同的NaOH溶液与氨水,强碱的pH变化大,b对应的是NaOH溶液,稀释后NaOH溶液中OH-离子浓度小,对水的电离抑制程度小,水电离程度大,故A错误;
B.由图得知,碱性强的H2O2分解速率大,故B错误;
C.向25mL0.1NaOH溶液中逐滴加入0.2溶液12.5ml时,正好完全反应生成醋酸钠,醋酸根离子水解溶液应该显碱性,B点对应的pH=7,说明加入的醋酸体积大于12.5ml,故C错误;
D.丁图中由交叉点得知,与的浓度相等时,对应的pH=4.75,由电离常数公式K==,故D正确;
答案选D。
9.C
解析:A.正确的离子方程式为Mg2++2Cl +2H2OMg(OH)2↓+H2↑+Cl2↑,选项A错误;
B.正确的离子方程式为2+H2C2O4+6OH-=2+2+4H2O,选项B错误;
C.Ba(OH)2溶液与足量NaHCO3溶液反应生成碳酸钡、碳酸钠和水,反应的离子方程式为:2+Ba2++2OH-=BaCO3↓+2H2O+,选项C正确;
D.要发生氧化还原反应,Ca(ClO)2溶液通入足量SO2:Ca2++2ClO +2SO2+2H2O=CaSO4↓+2Cl-+4H++,Ca(ClO)2溶液通入少量SO2:Ca2++3ClO +SO2+H2O=CaSO4↓+Cl-+2HClO,选项D错误;
答案选C。
10.D
解析:A.草酸为二元弱酸,c点所示溶液中溶质为,则此时两者恰好反应,则该草酸溶液的物质的量浓度为,A正确;
B.b点由电荷守恒可知:,此时pH=7,则,B正确;
C.c点所示溶液中溶质为,由物料守恒可知,,C正确;
D.酸和碱会抑制水的电离,盐的水解会促进水的电离,c点所示溶液中溶质为,此时水的电离程度最大,故水的电离程度大小:,D错误;
故选D。
11.B
解析:A.水的电离是吸热反应,升高温度,能促进水的电离,氢离子浓度增大,水的值变小,故错误;
B. 除去溶液中的杂质,可采用加入氧化铜的方法调节溶液的来实现除杂,氧化铜消耗铁离子水解产生的氢离子,促进铁离子水解,同时生成氯化铜,不引入杂质,故B正确;
C.温度不变溶度积常数不变,不变,故C错误;
D.常温下,溶液加水稀释过程中,溶液碱性减弱,增大,溶液中,只与温度有关,增大,因而增大,故D错误;
故选B。
12.B
解析:A.标准状况下,2.24L辛烷为非气态物质,A错误;
B.和的摩尔质量均为78g/mol,则78g和的混合物的物质的量为1mol,1mol由2mol和1mol构成,1mol由2mol和1mol构成,因此1mol和的混合物中含有的离子总数为3,B正确;
C.0.4L10mol/L的浓盐酸物质的量为4mol,1mol与4mol的浓盐酸充分反应,因二氧化锰只与浓盐酸反应,和稀盐酸不反应,则盐酸不能反应完全,则生成的氯气分子个数小于1,C错误;
D.溶液体积未知,不能确定溶液中水电离出的数目,D错误;
故答案为:B。
13.D
解析:A.醋酸钠是可溶性盐,是强电解质,A正确;
B.醋酸钠是强碱弱酸盐,水解显碱性,B正确;
C.水解平衡吸热,温度升高,水解平衡右移,水解常数增大,C正确;
D.加入氯化钠固体,钠离子增多,根据同离子效应可知,过饱和醋酸钠溶液中析出醋酸钠晶体,D错误;
故选D。
14.B
解析:A.在室温下,pH=7的溶液为中性,若温度不是室温,则pH=7的溶液不一定是中性溶液,选项A错误;
B.氯化钠溶液中,c(H+)= c(OH-)的溶液一定为中性溶液,选项B正确;
C.强酸、强碱的元数没有确定,所以二者以等物质的量反应得到的溶液不一定是中性溶液,选项C错误;
D.非电解质溶于水若发生反应产生酸或碱,则溶液可能显酸性或碱性,因此不一定得到中性溶液,选项D错误;
答案选B。
15.A
解析:A.酸中由水电离出的c(OH-)或c(H+)取决于溶液中的c(OH-),碱中由水电离出的c(OH-)或c(H+)取决于溶液中的c(H+),pH=3的盐酸和pH=11的氨水中由水电离出的c(OH-)都是10-11mol/L,故A项正确;
B.溶液①和溶液②中离子浓度相等,导电能力相同,溶液③为氨水和氯化铵的混合溶液,由于体积增大1倍,离子浓度减小,导电能力弱于溶液①和溶液②,故B项错误;
C.溶液③为氨水和氯化铵的混合溶液,溶液呈碱性,故C项错误;
D.pH=3的盐酸稀释10倍后pH=4,pH=11的氨水稀释10倍后,pH介于10和11之间,两者pH的差值大于6,故D项错误;
故答案为:A。
二、填空题
16.N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1 3a+b-ckJ·mol-1 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH=-873.4kJ·mol-1 b>a>c c>a>b c>a=b 900 1000 81,82
解析:Ⅰ、(1)在反应N2+3H2 2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ mol-1;
(2)由信息可知,①C(s)+O2(g)=CO2(g)△H1=a kJ mol 1; ②S(s)+2K(s)=K2S(s)△H2=b kJ mol 1;③2K(s)+N2(g)+3O2(g)=2KNO3(s)△H3=c kJ mol 1,结合盖斯定律可知,②+①×3 ③得到S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g),则△H=(3a+b c) kJ·mol-1;
(3)①N2(g)+2O2(g)=N2O4(l)△H1= 195kJ mol 1;②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2= 534.2kJ mol 1;根据盖斯定律写出肼和N2O4反应的热化学方程:②×2 ①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H= 873.4kJ/mol;故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H= 873.4kJ/mol;
Ⅱ、(1)硫酸为二元酸,盐酸为强酸,醋酸为弱酸,则物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c,故答案为:b>a>c;
(2)同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸,则中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是b>a=c,
故答案为:b>a=c;
(3)当c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,故答案为:c>a=b;
(4)醋酸在稀释过程中,会促进电离,所以氢离子的物质的量增加,氢离子的浓度变化程度小,硫酸和盐酸溶液中氢离子物质的量不变且相等,所以c(H+)由大到小的顺序是c>a=b,故答案为:c>a=b;
Ⅲ、pH=12的NaOH溶液中c(OH )=0.01mol/L,pH降为11,则溶液中c(OH )=0.001mol/L,
(1)设加入水的体积为xL,溶液稀释前后溶质的物质的量不变,则
0.01mol/L×0.1L=0.001mol/L×(0.1+x)L,x=0.9L,即900ml,故答案为:900;
(2)pH=10的氢氧化钠溶液中c(OH )=0.0001mol/L,设pH=10的氢氧化钠的体积为yL,则0,01mol/L×0.1L+0.0001mol/L×yL=0.001mol/L×(0.1+y)L,y=1L=1000mL,故答案为:1000;
(3)0.005mol/LH2SO4溶液中c(H+)=0,005mol/L×2=0.01mol/L,设0.005mol/LH2SO4溶液的体积为xL,则0.01mol/L×0.1L-0.01mol/L×xL=0.001mol/L×(0.1+x)L,解得x=81.82mL,故答案为:81.82。
17.1×10-14mol2·L-2 1×10-12mol2·L-2 水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大 2×10-9mol·L-1
解析:(1)由A点的H+、OH-的浓度可得Kw=c平(H+)·c平(OH-)=1×10-14mol2·L-2,同理可知B点的Kw=c平(H+)·c平(OH-)=1×10-12mol2·L-2,水的离子积变大的原因是水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大;
(2)若盐酸中c平(H+)=5×10-4mol·L-1,则c水(H+)=c平(OH-)==2×10-9mol·L-1。
18.防止温度高于180℃时H3PO3分解为PH3和磷酸
【分析】NaH2PO2被I2氧化为亚磷酸,用FeS除铅,滤液中含有亚磷酸和氢碘酸,减压蒸馏,将沸点低的HI蒸出,亚磷酸和NaI的混合物中加入水和H2O2,H2O2将I-氧化为I2,调节溶液的pH,并加入活性炭将I2吸附,过滤后调节滤液的pH,然后结晶得到亚磷酸钠。
解析:由亚磷酸180℃分解为PH3和磷酸可知,为防止亚磷酸发生分解反应,将亚磷酸转化为亚磷酸二氢钠时,应采用减压蒸馏,故答案为:防止温度高于180℃时H3PO3分解为PH3和磷酸。
19.(1) ① ②③
(2)
(3)
(4) 中
解析:(1)水电离:,是吸热过程,与25℃纯水相比,能促进水电离的是①;酸或碱电离出的H+和OH-均抑制水的电离,能抑制水电离的是②③;③25℃ 溶液中=0.02mol/L,则水电离的是。
(2)从图中可知,25℃时水的离子积常数Kw(25℃)=c(H+)·c(OH-)=10-14(mol/L)2,100℃时,水的电离平衡状态到B点,则此时水的离子积Kw(100℃)=c(H+)·c(OH-)=10-12(mol/L)2,水的离子积从增加到。
(3)pH=13的强碱溶液c(OH-)=0.1mol/L,pH=2的强酸溶液c(H+)=0.01mol/L,根据题意,所得混合液显碱性,则有,则强碱溶液与强酸溶液的体积比是。
(4)根据图示可知,100℃时,纯水中的mol/L,这种水,显中性;若温度不变,滴入稀盐酸使,则。
20.:4 0.1000 mol·L 1
【分析】滴酚酞为指示剂,发生的反应为:OH-+H+=H2O,CO+H+=HCO,或只发生CO+H+=HCO,甲基橙为指示剂时,发生HCO+H+=H2O+CO2 ↑。由于两次消耗的酸的体积不相同,且第一次多于第二次,混合碱成分是Na2CO3与NaOH。
解析:(1)由分析可知:混合碱成分是Na2CO3与NaOH及物质的量之比为12.50 mL:(22.50 mL-12.50 mL)=5 :4。故答案为:5 :4;
(2)n(Na2CO3)+n(NaOH)=0.2000mol·L 1×22.50mL=4.5×10-3mol,n(Na2CO3)=4.5×10-3mol=2.5×10-3mol, 混合碱溶液中Na2CO3的浓度为 =0.1000 mol·L 1。
故答案为:0.1000 mol·L 1。
21.纯碱或苏打 CO+H2O =HCO+OH- 盐酸 Fe3++3HCO=Fe(OH)3↓+3CO2↑ 1∶104 9×10-10 23.6
解析:(1)碳酸钠俗称苏打或纯碱,由于碳酸根离子存在水解:CO+H2O =HCO+OH-,所以溶液呈碱性,可作为碱使用;
(2)Fe3+存在水解平衡:Fe3++3H2OFe(OH)3+3H+,因此常加入盐酸增大氢离子浓度,从而抑制其水解,将FeCl3溶液和NaHCO3溶液混合,产生氢氧化铁的红褐色沉淀和无色的二氧化碳气体,反应的离子方程式为Fe3++3HCO=Fe(OH)3↓+3CO2↑;
(3)pH=5的醋酸溶液中,c(H+)=10-5mol/L,则c(OH-)==10-9mol/L,则由水电离出的c(H+)=c(OH-)=10-9mol/L,pH=5的硫酸铝溶液中,溶液中的氢离子全部由水电离,因此有水电离出的c(H+)=10-5mol/L,两者之比为:10-9mol/L:10-5mol/L=1∶104;
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银固体放入100 mL 0.2 mol/L AgNO3溶液中,则溶液中氯离子的浓度为mol/L;
(5)。
22.K、S、O 发生氧化还原反应 检验是否变质
【分析】气体A可使品红溶液褪色,则说明A为SO2或Cl2,溶液C的焰色反应透过蓝色钴玻璃观察火焰呈紫色,说明溶液C中含有K元素,X能发生反应:,说明X中含有S、O元素,因此组成X的3种元素为K、S、O;根据元素守恒可知,反应生成的淡黄色固体为S,则n(S)=0.01mol,溶液C中的溶质只含一种阴离子,说明反应过程中盐酸过量,则该阴离子为Cl-,稀释至1000ml并测得其pH为2,c(H+)=0.01mol/L,则溶液C中的c(H+)=0.1mol/L,又原盐酸溶液c(Cl-)=0.5mol/L,根据电荷守恒可知,c(K+)=c(Cl-)-c(H+)=0.4mol/L[此时溶液中c(OH-)浓度低于10-5mol/L,可认为其不存在],则n(K+)=0.4mol/L×0.1L=0.04mol,反应过程中H+与X中部分的O原子组成H2O,反应消耗n(H+)=0.4mol/L×0.1L=0.04mol,则消耗X中n(O)=0.02mol,设生成SO2物质的量为ymol,根据质量守恒可知,,解得y=0.05,因此5.40gX中K+的物质的量为0.04mol,S原子的物质的量为0.01mol+0.05mol=0.06mol,O原子的物质的量为0.02mol+0.05mol×2=0.12mol,则各原子物质的量之比为n(K):n(S):n(O)=0.04mol:0.06mol:0.12mol=2:3:6,则X的化学式为K2S3O6。
解析:Ⅰ.(1)由上述分析可知,组成X的3种元素为K、S、O;X的化学式为K2S3O6;故答案为:K、S、O;K2S3O6;
(2)SO2与KOH先后发生反应:SO2+2KOH=K2SO3+H2O、SO2+K2SO3+H2O=2KHSO3,因此时,反应方程式为;
(3)K2S3O6与稀盐酸反应生成S、SO2、H2O,根据氧化还原反应化合价升降守恒、电荷守恒以及原子守恒可知K2S5O6与稀盐酸反应的离子方程式为;
Ⅱ.(4)(aq)与(aq)可能发生双水解反应或者发生氧化还原反应,故答案为②:发生氧化还原反应;
(5)溶液D为SO2与足量KOH反应所得溶液,溶液中溶质为KOH、K2SO3,取少量溶液于试管中,向溶液中滴加过量稀盐酸后再加入BaCl2稀溶液,若有白色沉淀生成,则说明K2SO3已变质生成K2SO4,从而避免检验与Fe3+反应生成的干扰。
23.碱性 过滤 二 一 C B 澄清的石灰水变浑浊 白色固体变蓝
解析:猜想二:碳酸钠为强碱弱酸盐,在水中会进行水解生成氢氧根离子,显碱性;
Ⅰ.分离固体和液体的方法为过滤。
(1)若用装置A、B组合进行实验,B中无现象,即澄清的石灰水没有变浑浊,说明没有二氧化碳生成,则固体没有碳酸铜,只有氢氧化铜,故猜想二正确。
(2)若用装置A、C组合进行实验,C中无现象,即无水硫酸铜不变蓝说明没有水生成,固体中没有氢氧化铜,只有碳酸铜,故猜想一正确。
(3)要证明生成物中有水和二氧化碳,应先证明水再证明二氧化碳,若先证明二氧化碳的话,通过澄清的石灰水,会带出水蒸气,干扰水蒸气的检验,气体通过澄清的石灰水,若变浑浊,C中无水硫酸铜白色固体变蓝色,说明有二氧化碳和水,则证明猜想三是正确的。
(四)经实验测得,混合物中两种固体的物质的量之比为1:1,过量的溶液和一定量反应的离子方程式:
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
