湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高三上学期期中联考化学试题(含答案)
文档属性
| 名称 | 湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高三上学期期中联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 17:18:18 | ||
图片预览



文档简介
2023年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考
高三化学试卷
考试时间:2023年11月2日下午14:30-17:05 试卷满分:100分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 Cl 35.5 Fe 56
一、选择题:(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.“增蓝天,保碧水,护净土”,下列关于推进生态环境治理现代化建设的叙述正确的是( )
A.河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以直接饮用
B.在一定条件下,选择合适的催化剂将氧化为甲酸
C.推广使用煤气化和液化技术,获得清洁燃料和化工原料
D.纳米铁粉可以通过吸附作用高效地除去被污染水体中的、等重金属离子
2.下列化学用语或图示表达正确的是( )
A.的共价键电子云轮廓图: B.的VSEPR模型为:
C.醛基的电子式: D.原子电子排布式可能为:
3.冠醚因分子结构如皇冠而得名,某冠醚分子c可识别,其合成方法如下。下列说法正确的是( )
A.c可与形成超分子 B.每个a分子中有6个n键
C.c核磁共振氢谱有5组峰 D.该反应有生成,属于缩聚反应
4.下列有关电极方程式或离子方程式错误的是( )
A.少量气体通入足量溶液中:
B.铅酸蓄电池充电时的阳极反应:
C.溶液中加入产生沉淀:
D.含等物质的量的、、的溶液中通入适量氯气:
5.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 检验干燥氯气是否具有漂白性 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 一段时间后,有色鲜花褪色,说明干燥氯气有漂白性
B 证明氯水能氧化 将少量铁屑加入过量的氯水中,并滴加2滴溶液 未见溶液变为红色,说明氯水能氧化
C 证明甲基对苯环性质有影响 向酸性溶液中加入甲苯 酸性溶液褪色,证明甲基对苯环性质有影响
D 确定某钠盐的成分 向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液 品红溶液褪色,说明该钠盐一定为或
6.设为阿伏伽德罗常数的值,下列说法正确的是( )
A.56g铁完全发生吸氧腐蚀,则在电化学反应过程中转移的电子数为3
B.足量与0.1充分反应生成的分子数目为0.1
C.1中含键个数为7
D.常温下,1L的溶液中,水电离出的数目为10
7.下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 物质转化关系 a b c d
①
② NO
③
④ S
A.②④ B.①③ C.②③ D.①
8.缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法正确的是( )
A.、、均为缺电子化合物
B.的键角大于的键角
C.与化合反应产物中,B和N的杂化方式相同
D.和都是极性分子
9.软硬酸碱理论认为,常见的硬酸有、、等,软酸有、、等;硬碱有、等,软碱有、等;酸碱结合的原则为:“硬酸优先与硬碱结合,软酸优先与软碱结合,软和硬结合一般不稳定”。该原则一般可用于判断物质稳定性及反应发生的方向等。下列叙述正确的是( )
A.稳定性比较:
B.稳定性比较:
C.反应难以向右进行
D.含的红色溶液中加入适量后溶液褪色,说明碱的“硬度”:
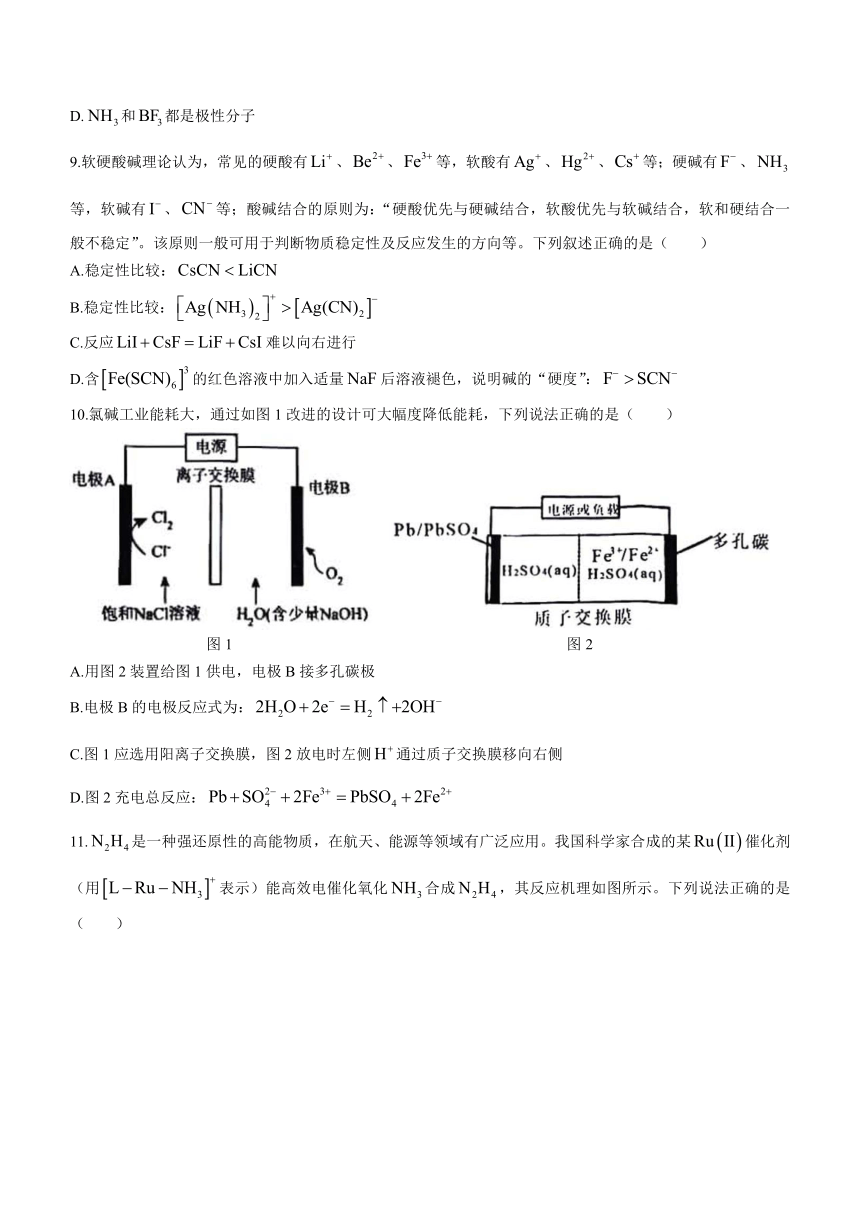
10.氯碱工业能耗大,通过如图1改进的设计可大幅度降低能耗,下列说法正确的是( )
图1 图2
A.用图2装置给图1供电,电极B接多孔碳极
B.电极B的电极反应式为:
C.图1应选用阳离子交换膜,图2放电时左侧通过质子交换膜移向右侧
D.图2充电总反应:
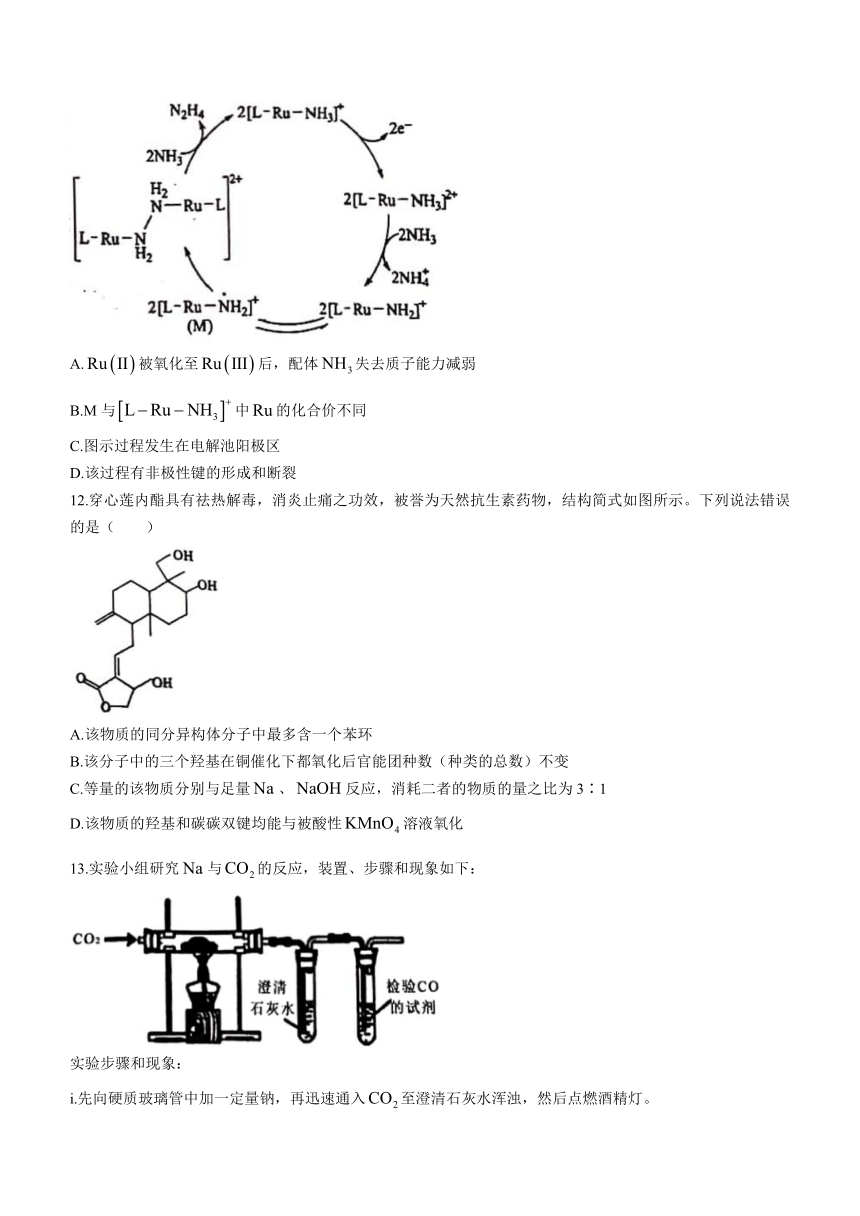
11.是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某催化剂(用表示)能高效电催化氧化合成,其反应机理如图所示。下列说法正确的是( )
A.被氧化至后,配体失去质子能力减弱
B.M与中的化合价不同
C.图示过程发生在电解池阳极区
D.该过程有非极性键的形成和断裂
12.穿心莲内酯具有祛热解毒,消炎止痛之功效,被誉为天然抗生素药物,结构简式如图所示。下列说法错误的是( )
A.该物质的同分异构体分子中最多含一个苯环
B.该分子中的三个羟基在铜催化下都氧化后官能团种数(种类的总数)不变
C.等量的该物质分别与足量、反应,消耗二者的物质的量之比为3∶1
D.该物质的羟基和碳碳双键均能与被酸性溶液氧化
13.实验小组研究与的反应,装置、步骤和现象如下:
实验步骤和现象:
i.先向硬质玻璃管中加一定量钠,再迅速通入至澄清石灰水浑浊,然后点燃酒精灯。
ii.一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验的试剂未见明显变化。
iii.将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量溶液,产生白色沉淀:再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
iv.将管壁上的黑色物质与浓硫酸混合加热,生成能使品红溶液褪色的气体。
下列说法不正确的是( )
A.实验证明与的反应的氧化产物为,还原产物为C
B.步骤iii证明与也可以发生类似于与的反应
C.步骤iv发生反应的化学方程式为(浓)
D.根据以上实验推测:与金属K也可以发生反应并被还原
14.25℃时,用溶液分别滴定弱酸、、三种溶液,随变化关系如图所示[p表示负对数,M表示、、等],已知,下列有关分析正确的是( )
A.①代表滴定溶液的变化关系
B.①与③直线交点对应的
C.调整溶液的,可使工业废水中的沉淀完全
D.固体比固体难溶解于溶液
15.有一种蓝色晶体可表示为:,研究表明它的结构特性是、分别占据立方体的顶点,自身互不相邻,而位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法错误的是( )
A.该晶体是离子晶体
B.若M离子位于上述立方体的体心,立方体的棱长为a,M的相对原子量为b,则晶体密度为
C.晶体的化学式可表示为,且M呈+1价
D.若M离子位于上述立方体的体心,则空缺率(体心中没有的占总体心的百分比)为50%
二、非选择题:(本题共4个小题,共55分)
16.(14分)资料显示,可以将氧化为。某小组同学设计实验探究被氧化的产物及铜元素的价态。已知:易溶于溶液,发生反应(红棕色);和氧化性几乎相同。
将等体积的溶液加入到n铜粉和m()的固体混合物中,振荡。
实验记录如下:
实验现象
实验Ⅰ 0.01 极少量溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 部分溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
(1)基态的电子排布式________________________。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有(蓝色)或(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去的原理是_________________________。
ii.查阅资料,(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:_________________________,_________________________。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入溶液,___________________(填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________________。
(4)上述实验结果,仅将氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了能将氧化为。装置如图所示,a物质为_____________,b试剂为_____________。
17.(15分)某重要的医药中间体,合成路线如下图。回答下列问题;
已知:、为间位定位基,、为邻对位定位基。
(1)物质B的化学名称为______________,反应⑨产物“中间体”的无氧官能团名称_____________。
(2)反应⑧的化学方程式为__________________________,反应⑨的反应类型为_____________。
(3)设计反应①和反应⑦的目的是_______________________________________。
(4)符合下列条件的物质的同分异构体有_____________种。
a.苯环上有四个取代基 b.能与碳酸氢钠反应 c.有碱性且能发生银镜反应。
(5)根据题干信息,设计以为原料制备的合成路线(无机试剂自选)
_________________________________________________________________。
18.(12分)一种银钢矿主要成分为、、、、、、、等物质,从该矿获得稀有金属的工艺流程如图所示:
该工艺条件下,金属离子开始沉淀和完全沉淀的如表:
金属离子
开始沉淀的 2.2 2.1 2.6 4.6 6.24 7.1
完全沉淀()的 3.2 3.4 4.3 6.6 8.24 9.1
(1)“浸出”过程中金、银、铜分别转化为、、进入溶液,同时生成硫,写出发生反应的离子方程式_____________。
(2)高温水蒸气除铁利用了易水解的性质,写出该反应的化学方程式_____________。
(3)“二次还原”得到的滤渣主要成分_____________。
(4)“二次中和”得到的滤渣除少量外,主要成分还有_____________。(写化学式)。
(5)“分铅锌”步骤中,维持饱和水溶液的浓度为0.01,为使沉淀完全(沉淀完全是指离子浓度小于或等于),需控制溶液的不小于_____________。
已知:;,;
(6)已知:氧化还原反应可看成由两个半反应组成,每个半反应具有一定的电极电势(用“”表示),越大则该物质的氧化性越强,越低则该物质的还原性越强。浸出步骤中金反应的两个半反应如下:
, ,
(与半反应式的系数无关,仅与浓度有关,)
如上图是的浸出率与溶液浓度的关系,请解释A点之前,金浸出率增大的原因是______________。
19.(14分)空气中含量的控制和资源利用具有重要意义。
(1)已知25℃、101下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
①几种化学键的键能如图表所示,则______________。
化学键
键能/ 413 a 463 797.5
②反应Ⅰ的速率方程为,其中x表示相应气体的物质的量分数,为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后,此时反应Ⅰ的速率______________(用含k的代数式表示)。
(2)向刚性密闭容器中通入一定量和.,发生反应Ⅰ和反应Ⅱ,温度对和的物质的量分数影响如图所示。
图中表示物质的量分数的为___________(填“m”或“n”);为提高的选择性,可采取的措施有______________________(写出1条即可)。
(3)催化电解吸收的溶液可将转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率()随电解电压的变化如图乙所示。
其中,,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①当电解电压为时,电解过程中含碳还原产物的为0,阴极主要还原产物为__________________(填化学式)。
②当电解电压为时,阴极由生成的电极反应式为__________________。
③当电解电压为时,电解生成的和的物质的量之比为__________________。
2023年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考
高三化学参考答案
一、选择题:本题共15小题,每小题3分,共45分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C D A A B D D C D C C B A B B
二、非选择题:本题共4小题,共55分。
注:有关反应方程式的书写中,化学式错误或未配平,不得分;
同一反应中的“条件、=、↑、↓”等一处或多处错误合计扣1分。
16.(14分)
(1) (2分)
(2)i.易溶于,加入,平衡逆向移动,减少(2分)
ii.(2分)
(2分)
(3)白色沉淀逐渐溶解(2分)
(或,2分)
(4)铜(1分) 含m的4的溶液(或含的溶液,1分)
17.(15分)
(1)邻硝基甲苯(或2-硝基甲苯)(2分) 氨基、碳氯键(2分)
(2)(2分)
取代反应(或水解反应,1分)
(3)保护、对位氢原子,防止下一步发生反应(2分)
(4)30(2分)
(5)(4分)
18.(12分)
(1) (2分)
(2) (2分)
(3)、、(无不得分,无和不扣分,2分)
(4)、(2分)
(5)1.24(2分)
(6)增大,均减小,次氯酸氧化性减弱,的还原性增强,A点之前,减弱程度小于增强程度,故的浸出率增大(2分)
19.(14分)
(1)①436(2分) ②0.09k(2分)
(2)n(2分) 加压、降温(2分,写出1条即可)
(3)①(2分) ②(2分)
③1∶2(2分)
2023年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考
高三化学试题解析
1.A.明矾不能杀菌消毒
B.转化为甲酸是还原反应
D.纳米铁粉可以通过置换高效地除去被污染水体中的铜离子和银离子
2.A.的共价键电子云轮廓图是椭球形
B.的VSEPR模型为四面体形
C.醛基的电子式氧原子还应有2对未共用电子
D.激发态原子电子排布式可能为:
3.B.每个a分子中有2个大键
C.c左右对称和上下对称,c核磁共振氢谱有4组峰
D.该反应有生成,属于取代反应
4.A.少量气体通入足量溶液中会有次氯酸生成
D.氯气与碘离子的物质的量相等即可
5.A.鲜花中含有水分,不能证明干燥氯气有无漂白性
B.将少量铁屑加入过量的氯水中,溶液颜色不变为红,证明氯水能氧化了
C.向酸性溶液中加入甲苯,能证明的是苯环对甲基有影响,
D.该钠盐也可能是,,氯气也能品红褪色
6.A.铁发生吸氧腐蚀的电化学反应过程中每个铁原子失去2个电子
B.与反应的可逆的
C.1中含键个数为9,配位键也是键
7.②和④中c到b都不能一步实现,③中d到a不能一步实现
8.A.和均不为缺电子化合物
B.是三角锥形,键角107°:是平面正三角形结构,键角120°
C.与化合反应产物中,B和N都是杂化
D.是极性分子,是非极性分子
9.A.是软配软,是硬配软,稳定性比较:
B.软配硬,小是软配软,稳定性比较:
C.按照软硬酸碱理论和更稳定,所以反应可以发生
D.是硬酸,代替,说明更硬
10.A.图1电极B是阴极,图2放电时多孔碳是正极,因此电极B应接电极
B.电极B为阴极,电极上是氧气得电子
11.A.被氧化至后,中的带有更多的正电荷,其与N原子成键后,吸引电子的能力比强,这种作用使得配体中的键极性变强且更易断裂,因此其失去质子()的能力增强
B.当变为M时,N原子的孤电子对拆为2个电子并转移给1个电子,其中的化合价变为+2,因此M与中的化合价相同
C.该过程的总反应式为
D.整个过程无非极性键的断裂
12.A.由不饱和度推该物质的同分异构体分子中最多含一个苯环
B.三个羟基在铜催化下都氧化后官能团种数增加一种
D.能催化氧化的羟基,也能与被酸性溶液氧化
13.A.将硬质玻璃管中的固体溶于水,未见气泡产生,说明不存在和;向滤液中加入过量溶液,产生白色沉淀,加入盐酸,产生气体说明白色固体中存在;再次过滤,滤液呈碱性,说明白色固体中也存在,所以氧化产物有和.
14.A.、的结构相似,随变化关系图中应该是平行线,因更难溶,①②分别代表滴定溶液、溶液的变化关系,③代表滴定溶液的变化关系
B.由图知①与③直线交点,即,得,,则
C.,当时,,所以未沉淀完全,
D.据
,同理可求溶解于溶液平衡常数,固体比固体更易溶解于溶液,故D错误;
15.A.该晶体由阴阳离子构成的,所以该晶体为离子晶体
B.晶体密度应该为
C.根据晶胞结构可知,、、的个数比为1∶1∶6,根据化合价代数和为零可知,M的化合价为+1价,晶体的化学式可表示为
D.根据晶胞结构,可知每个立方体平均含有M也是0.5个,而M的离子位于上述立方体的体心上,所以两个立方体中一个有,而另一个必无,所以空缺率为50%,
16.因溶解度较小,与接触不充分,将转化为可以提高与的接触面积,提高反应速率。加入,平衡逆向移动,和浓度减小,加入氨水后转化为,被氧化为,故而产生无色溶液变为蓝色溶液的现象。
【小问1详解】略
【小问2详解】
加入,平衡逆向移动,浓度减小,浓度增加,其目的为:除去,防止干扰后续实验。加入氨水后转化为,无色的被氧化为蓝色的,方程式为、
。
【小问3详解】实验Ⅲ无白色沉淀,说明溶液可以使沉淀溶解
【小问4详解】
要验证能将氧化为,原电池负极材料为,b为含n的4的溶液。
17.(1)(2)见答案
(3)根据反应流程分析,设计反应①和反应⑦的目的是保护、对位氢原子,防止下一步发生反应:
(4)根据所给条件,苯环上四个取代基分别是:羧基,醛基,氨基,甲基。苯环上若有3个不同取代基有10种,这10种中的每一种苯环上剩下3个氢环境都不同,所以共有
(5)氨基来自于硝基还原,故第一步引入硝基,硝基是间位定位基,甲基是邻对位定位基,故第二步引入邻位溴,氨基易氧化,所以第三步氧化甲基,最后还原硝基
18.本题是一道由银铟矿制备稀有金属的工业流程题,首先用氯化钠,盐酸,次氯酸钠混合物从原材料浸出有用的物质,之后用水蒸气使其中的三价铁生成氧化铁,再用碳酸钙中和过量的酸,再用铜置换出银和铜,再用铁置换出其中的铜,再经过调和除杂,最终得到贫液,以此解题。
【小问3详解】
“二次还原”加入铁主要是与铜离子反应,方程式为:,可能过量
【小问4详解】
“二次中和”加入碳酸钙调,根据表中信息得到的滤渣还有、;
【小问5详解】
沉淀完全,溶液中,此时,
,,,,
,,,,,不小于1.24;
【小问6详解】
由可知,越大,越小,即氧化性越小,由
可知,越大,越小,的氧化性越弱,的还原性越强,故答案为:增大,均减小,次氯酸氧化性减弱,的还原性增强,A点之前,减弱程度小于增强程度,故的浸出率增大
19.(1)①根据Ⅲ ,由反应物总键能-产物总键能,可得,;
②,根据速率方程为
(2)根据图像可知横坐标为温度的倒数,由于Ⅰ式吸热,降温物质的量分数减小,为线式放热,降温物质的最分数增大,为m。
要使合成的选择性提高,由于①吸热②放热,可采取降温措施使得②正移:又由于②中正反应气体量减小,可采取加压方式使②正移。
(3)当电解电压为时,电解过程中含碳还原产物的为0,说明二氧化碳未得电子,为氢离子得电子变成氢气。当电解电压为时,根据得失电子守恒、原子守恒和电荷守恒可知碱性条件下阴极由生成的电极反应式为。当电解电压为时,电解过程中还原产物的为24%,还原产物的为8%,每生成1转移12,每生成1转移2,故电解生成的和的物质的量之比为。
高三化学试卷
考试时间:2023年11月2日下午14:30-17:05 试卷满分:100分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 Cl 35.5 Fe 56
一、选择题:(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.“增蓝天,保碧水,护净土”,下列关于推进生态环境治理现代化建设的叙述正确的是( )
A.河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以直接饮用
B.在一定条件下,选择合适的催化剂将氧化为甲酸
C.推广使用煤气化和液化技术,获得清洁燃料和化工原料
D.纳米铁粉可以通过吸附作用高效地除去被污染水体中的、等重金属离子
2.下列化学用语或图示表达正确的是( )
A.的共价键电子云轮廓图: B.的VSEPR模型为:
C.醛基的电子式: D.原子电子排布式可能为:
3.冠醚因分子结构如皇冠而得名,某冠醚分子c可识别,其合成方法如下。下列说法正确的是( )
A.c可与形成超分子 B.每个a分子中有6个n键
C.c核磁共振氢谱有5组峰 D.该反应有生成,属于缩聚反应
4.下列有关电极方程式或离子方程式错误的是( )
A.少量气体通入足量溶液中:
B.铅酸蓄电池充电时的阳极反应:
C.溶液中加入产生沉淀:
D.含等物质的量的、、的溶液中通入适量氯气:
5.下列方案设计、现象和结论都正确的是( )
选项 目的 方案设计 现象和结论
A 检验干燥氯气是否具有漂白性 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 一段时间后,有色鲜花褪色,说明干燥氯气有漂白性
B 证明氯水能氧化 将少量铁屑加入过量的氯水中,并滴加2滴溶液 未见溶液变为红色,说明氯水能氧化
C 证明甲基对苯环性质有影响 向酸性溶液中加入甲苯 酸性溶液褪色,证明甲基对苯环性质有影响
D 确定某钠盐的成分 向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液 品红溶液褪色,说明该钠盐一定为或
6.设为阿伏伽德罗常数的值,下列说法正确的是( )
A.56g铁完全发生吸氧腐蚀,则在电化学反应过程中转移的电子数为3
B.足量与0.1充分反应生成的分子数目为0.1
C.1中含键个数为7
D.常温下,1L的溶液中,水电离出的数目为10
7.下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 物质转化关系 a b c d
①
② NO
③
④ S
A.②④ B.①③ C.②③ D.①
8.缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法正确的是( )
A.、、均为缺电子化合物
B.的键角大于的键角
C.与化合反应产物中,B和N的杂化方式相同
D.和都是极性分子
9.软硬酸碱理论认为,常见的硬酸有、、等,软酸有、、等;硬碱有、等,软碱有、等;酸碱结合的原则为:“硬酸优先与硬碱结合,软酸优先与软碱结合,软和硬结合一般不稳定”。该原则一般可用于判断物质稳定性及反应发生的方向等。下列叙述正确的是( )
A.稳定性比较:
B.稳定性比较:
C.反应难以向右进行
D.含的红色溶液中加入适量后溶液褪色,说明碱的“硬度”:
10.氯碱工业能耗大,通过如图1改进的设计可大幅度降低能耗,下列说法正确的是( )
图1 图2
A.用图2装置给图1供电,电极B接多孔碳极
B.电极B的电极反应式为:
C.图1应选用阳离子交换膜,图2放电时左侧通过质子交换膜移向右侧
D.图2充电总反应:
11.是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某催化剂(用表示)能高效电催化氧化合成,其反应机理如图所示。下列说法正确的是( )
A.被氧化至后,配体失去质子能力减弱
B.M与中的化合价不同
C.图示过程发生在电解池阳极区
D.该过程有非极性键的形成和断裂
12.穿心莲内酯具有祛热解毒,消炎止痛之功效,被誉为天然抗生素药物,结构简式如图所示。下列说法错误的是( )
A.该物质的同分异构体分子中最多含一个苯环
B.该分子中的三个羟基在铜催化下都氧化后官能团种数(种类的总数)不变
C.等量的该物质分别与足量、反应,消耗二者的物质的量之比为3∶1
D.该物质的羟基和碳碳双键均能与被酸性溶液氧化
13.实验小组研究与的反应,装置、步骤和现象如下:
实验步骤和现象:
i.先向硬质玻璃管中加一定量钠,再迅速通入至澄清石灰水浑浊,然后点燃酒精灯。
ii.一段时间后,硬质玻璃管中有白色物质产生,管壁上有黑色物质出现。检验的试剂未见明显变化。
iii.将硬质玻璃管中的固体溶于水,未见气泡产生;过滤,向滤液中加入过量溶液,产生白色沉淀:再次过滤,滤液呈碱性;取白色沉淀加入盐酸,产生气体。
iv.将管壁上的黑色物质与浓硫酸混合加热,生成能使品红溶液褪色的气体。
下列说法不正确的是( )
A.实验证明与的反应的氧化产物为,还原产物为C
B.步骤iii证明与也可以发生类似于与的反应
C.步骤iv发生反应的化学方程式为(浓)
D.根据以上实验推测:与金属K也可以发生反应并被还原
14.25℃时,用溶液分别滴定弱酸、、三种溶液,随变化关系如图所示[p表示负对数,M表示、、等],已知,下列有关分析正确的是( )
A.①代表滴定溶液的变化关系
B.①与③直线交点对应的
C.调整溶液的,可使工业废水中的沉淀完全
D.固体比固体难溶解于溶液
15.有一种蓝色晶体可表示为:,研究表明它的结构特性是、分别占据立方体的顶点,自身互不相邻,而位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法错误的是( )
A.该晶体是离子晶体
B.若M离子位于上述立方体的体心,立方体的棱长为a,M的相对原子量为b,则晶体密度为
C.晶体的化学式可表示为,且M呈+1价
D.若M离子位于上述立方体的体心,则空缺率(体心中没有的占总体心的百分比)为50%
二、非选择题:(本题共4个小题,共55分)
16.(14分)资料显示,可以将氧化为。某小组同学设计实验探究被氧化的产物及铜元素的价态。已知:易溶于溶液,发生反应(红棕色);和氧化性几乎相同。
将等体积的溶液加入到n铜粉和m()的固体混合物中,振荡。
实验记录如下:
实验现象
实验Ⅰ 0.01 极少量溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 部分溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
(1)基态的电子排布式________________________。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有(蓝色)或(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去的原理是_________________________。
ii.查阅资料,(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:_________________________,_________________________。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入溶液,___________________(填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________________。
(4)上述实验结果,仅将氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了能将氧化为。装置如图所示,a物质为_____________,b试剂为_____________。
17.(15分)某重要的医药中间体,合成路线如下图。回答下列问题;
已知:、为间位定位基,、为邻对位定位基。
(1)物质B的化学名称为______________,反应⑨产物“中间体”的无氧官能团名称_____________。
(2)反应⑧的化学方程式为__________________________,反应⑨的反应类型为_____________。
(3)设计反应①和反应⑦的目的是_______________________________________。
(4)符合下列条件的物质的同分异构体有_____________种。
a.苯环上有四个取代基 b.能与碳酸氢钠反应 c.有碱性且能发生银镜反应。
(5)根据题干信息,设计以为原料制备的合成路线(无机试剂自选)
_________________________________________________________________。
18.(12分)一种银钢矿主要成分为、、、、、、、等物质,从该矿获得稀有金属的工艺流程如图所示:
该工艺条件下,金属离子开始沉淀和完全沉淀的如表:
金属离子
开始沉淀的 2.2 2.1 2.6 4.6 6.24 7.1
完全沉淀()的 3.2 3.4 4.3 6.6 8.24 9.1
(1)“浸出”过程中金、银、铜分别转化为、、进入溶液,同时生成硫,写出发生反应的离子方程式_____________。
(2)高温水蒸气除铁利用了易水解的性质,写出该反应的化学方程式_____________。
(3)“二次还原”得到的滤渣主要成分_____________。
(4)“二次中和”得到的滤渣除少量外,主要成分还有_____________。(写化学式)。
(5)“分铅锌”步骤中,维持饱和水溶液的浓度为0.01,为使沉淀完全(沉淀完全是指离子浓度小于或等于),需控制溶液的不小于_____________。
已知:;,;
(6)已知:氧化还原反应可看成由两个半反应组成,每个半反应具有一定的电极电势(用“”表示),越大则该物质的氧化性越强,越低则该物质的还原性越强。浸出步骤中金反应的两个半反应如下:
, ,
(与半反应式的系数无关,仅与浓度有关,)
如上图是的浸出率与溶液浓度的关系,请解释A点之前,金浸出率增大的原因是______________。
19.(14分)空气中含量的控制和资源利用具有重要意义。
(1)已知25℃、101下,在合成塔中,可通过二氧化碳和氢气合成甲醇,后续可制备甲酸。某反应体系中发生反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
①几种化学键的键能如图表所示,则______________。
化学键
键能/ 413 a 463 797.5
②反应Ⅰ的速率方程为,其中x表示相应气体的物质的量分数,为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。已知平衡后,此时反应Ⅰ的速率______________(用含k的代数式表示)。
(2)向刚性密闭容器中通入一定量和.,发生反应Ⅰ和反应Ⅱ,温度对和的物质的量分数影响如图所示。
图中表示物质的量分数的为___________(填“m”或“n”);为提高的选择性,可采取的措施有______________________(写出1条即可)。
(3)催化电解吸收的溶液可将转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率()随电解电压的变化如图乙所示。
其中,,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①当电解电压为时,电解过程中含碳还原产物的为0,阴极主要还原产物为__________________(填化学式)。
②当电解电压为时,阴极由生成的电极反应式为__________________。
③当电解电压为时,电解生成的和的物质的量之比为__________________。
2023年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考
高三化学参考答案
一、选择题:本题共15小题,每小题3分,共45分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C D A A B D D C D C C B A B B
二、非选择题:本题共4小题,共55分。
注:有关反应方程式的书写中,化学式错误或未配平,不得分;
同一反应中的“条件、=、↑、↓”等一处或多处错误合计扣1分。
16.(14分)
(1) (2分)
(2)i.易溶于,加入,平衡逆向移动,减少(2分)
ii.(2分)
(2分)
(3)白色沉淀逐渐溶解(2分)
(或,2分)
(4)铜(1分) 含m的4的溶液(或含的溶液,1分)
17.(15分)
(1)邻硝基甲苯(或2-硝基甲苯)(2分) 氨基、碳氯键(2分)
(2)(2分)
取代反应(或水解反应,1分)
(3)保护、对位氢原子,防止下一步发生反应(2分)
(4)30(2分)
(5)(4分)
18.(12分)
(1) (2分)
(2) (2分)
(3)、、(无不得分,无和不扣分,2分)
(4)、(2分)
(5)1.24(2分)
(6)增大,均减小,次氯酸氧化性减弱,的还原性增强,A点之前,减弱程度小于增强程度,故的浸出率增大(2分)
19.(14分)
(1)①436(2分) ②0.09k(2分)
(2)n(2分) 加压、降温(2分,写出1条即可)
(3)①(2分) ②(2分)
③1∶2(2分)
2023年秋季鄂东南省级示范高中教育教学改革联盟学校期中联考
高三化学试题解析
1.A.明矾不能杀菌消毒
B.转化为甲酸是还原反应
D.纳米铁粉可以通过置换高效地除去被污染水体中的铜离子和银离子
2.A.的共价键电子云轮廓图是椭球形
B.的VSEPR模型为四面体形
C.醛基的电子式氧原子还应有2对未共用电子
D.激发态原子电子排布式可能为:
3.B.每个a分子中有2个大键
C.c左右对称和上下对称,c核磁共振氢谱有4组峰
D.该反应有生成,属于取代反应
4.A.少量气体通入足量溶液中会有次氯酸生成
D.氯气与碘离子的物质的量相等即可
5.A.鲜花中含有水分,不能证明干燥氯气有无漂白性
B.将少量铁屑加入过量的氯水中,溶液颜色不变为红,证明氯水能氧化了
C.向酸性溶液中加入甲苯,能证明的是苯环对甲基有影响,
D.该钠盐也可能是,,氯气也能品红褪色
6.A.铁发生吸氧腐蚀的电化学反应过程中每个铁原子失去2个电子
B.与反应的可逆的
C.1中含键个数为9,配位键也是键
7.②和④中c到b都不能一步实现,③中d到a不能一步实现
8.A.和均不为缺电子化合物
B.是三角锥形,键角107°:是平面正三角形结构,键角120°
C.与化合反应产物中,B和N都是杂化
D.是极性分子,是非极性分子
9.A.是软配软,是硬配软,稳定性比较:
B.软配硬,小是软配软,稳定性比较:
C.按照软硬酸碱理论和更稳定,所以反应可以发生
D.是硬酸,代替,说明更硬
10.A.图1电极B是阴极,图2放电时多孔碳是正极,因此电极B应接电极
B.电极B为阴极,电极上是氧气得电子
11.A.被氧化至后,中的带有更多的正电荷,其与N原子成键后,吸引电子的能力比强,这种作用使得配体中的键极性变强且更易断裂,因此其失去质子()的能力增强
B.当变为M时,N原子的孤电子对拆为2个电子并转移给1个电子,其中的化合价变为+2,因此M与中的化合价相同
C.该过程的总反应式为
D.整个过程无非极性键的断裂
12.A.由不饱和度推该物质的同分异构体分子中最多含一个苯环
B.三个羟基在铜催化下都氧化后官能团种数增加一种
D.能催化氧化的羟基,也能与被酸性溶液氧化
13.A.将硬质玻璃管中的固体溶于水,未见气泡产生,说明不存在和;向滤液中加入过量溶液,产生白色沉淀,加入盐酸,产生气体说明白色固体中存在;再次过滤,滤液呈碱性,说明白色固体中也存在,所以氧化产物有和.
14.A.、的结构相似,随变化关系图中应该是平行线,因更难溶,①②分别代表滴定溶液、溶液的变化关系,③代表滴定溶液的变化关系
B.由图知①与③直线交点,即,得,,则
C.,当时,,所以未沉淀完全,
D.据
,同理可求溶解于溶液平衡常数,固体比固体更易溶解于溶液,故D错误;
15.A.该晶体由阴阳离子构成的,所以该晶体为离子晶体
B.晶体密度应该为
C.根据晶胞结构可知,、、的个数比为1∶1∶6,根据化合价代数和为零可知,M的化合价为+1价,晶体的化学式可表示为
D.根据晶胞结构,可知每个立方体平均含有M也是0.5个,而M的离子位于上述立方体的体心上,所以两个立方体中一个有,而另一个必无,所以空缺率为50%,
16.因溶解度较小,与接触不充分,将转化为可以提高与的接触面积,提高反应速率。加入,平衡逆向移动,和浓度减小,加入氨水后转化为,被氧化为,故而产生无色溶液变为蓝色溶液的现象。
【小问1详解】略
【小问2详解】
加入,平衡逆向移动,浓度减小,浓度增加,其目的为:除去,防止干扰后续实验。加入氨水后转化为,无色的被氧化为蓝色的,方程式为、
。
【小问3详解】实验Ⅲ无白色沉淀,说明溶液可以使沉淀溶解
【小问4详解】
要验证能将氧化为,原电池负极材料为,b为含n的4的溶液。
17.(1)(2)见答案
(3)根据反应流程分析,设计反应①和反应⑦的目的是保护、对位氢原子,防止下一步发生反应:
(4)根据所给条件,苯环上四个取代基分别是:羧基,醛基,氨基,甲基。苯环上若有3个不同取代基有10种,这10种中的每一种苯环上剩下3个氢环境都不同,所以共有
(5)氨基来自于硝基还原,故第一步引入硝基,硝基是间位定位基,甲基是邻对位定位基,故第二步引入邻位溴,氨基易氧化,所以第三步氧化甲基,最后还原硝基
18.本题是一道由银铟矿制备稀有金属的工业流程题,首先用氯化钠,盐酸,次氯酸钠混合物从原材料浸出有用的物质,之后用水蒸气使其中的三价铁生成氧化铁,再用碳酸钙中和过量的酸,再用铜置换出银和铜,再用铁置换出其中的铜,再经过调和除杂,最终得到贫液,以此解题。
【小问3详解】
“二次还原”加入铁主要是与铜离子反应,方程式为:,可能过量
【小问4详解】
“二次中和”加入碳酸钙调,根据表中信息得到的滤渣还有、;
【小问5详解】
沉淀完全,溶液中,此时,
,,,,
,,,,,不小于1.24;
【小问6详解】
由可知,越大,越小,即氧化性越小,由
可知,越大,越小,的氧化性越弱,的还原性越强,故答案为:增大,均减小,次氯酸氧化性减弱,的还原性增强,A点之前,减弱程度小于增强程度,故的浸出率增大
19.(1)①根据Ⅲ ,由反应物总键能-产物总键能,可得,;
②,根据速率方程为
(2)根据图像可知横坐标为温度的倒数,由于Ⅰ式吸热,降温物质的量分数减小,为线式放热,降温物质的最分数增大,为m。
要使合成的选择性提高,由于①吸热②放热,可采取降温措施使得②正移:又由于②中正反应气体量减小,可采取加压方式使②正移。
(3)当电解电压为时,电解过程中含碳还原产物的为0,说明二氧化碳未得电子,为氢离子得电子变成氢气。当电解电压为时,根据得失电子守恒、原子守恒和电荷守恒可知碱性条件下阴极由生成的电极反应式为。当电解电压为时,电解过程中还原产物的为24%,还原产物的为8%,每生成1转移12,每生成1转移2,故电解生成的和的物质的量之比为。
同课章节目录
