到实验室去:二氧化碳的实验室制取与性质同步练习(含答案)
文档属性
| 名称 | 到实验室去:二氧化碳的实验室制取与性质同步练习(含答案) |
|
|
| 格式 | doc | ||
| 文件大小 | 718.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 17:42:34 | ||
图片预览


文档简介
到实验室去:二氧化碳的实验室制取与性质同步练习
姓名: 班级:
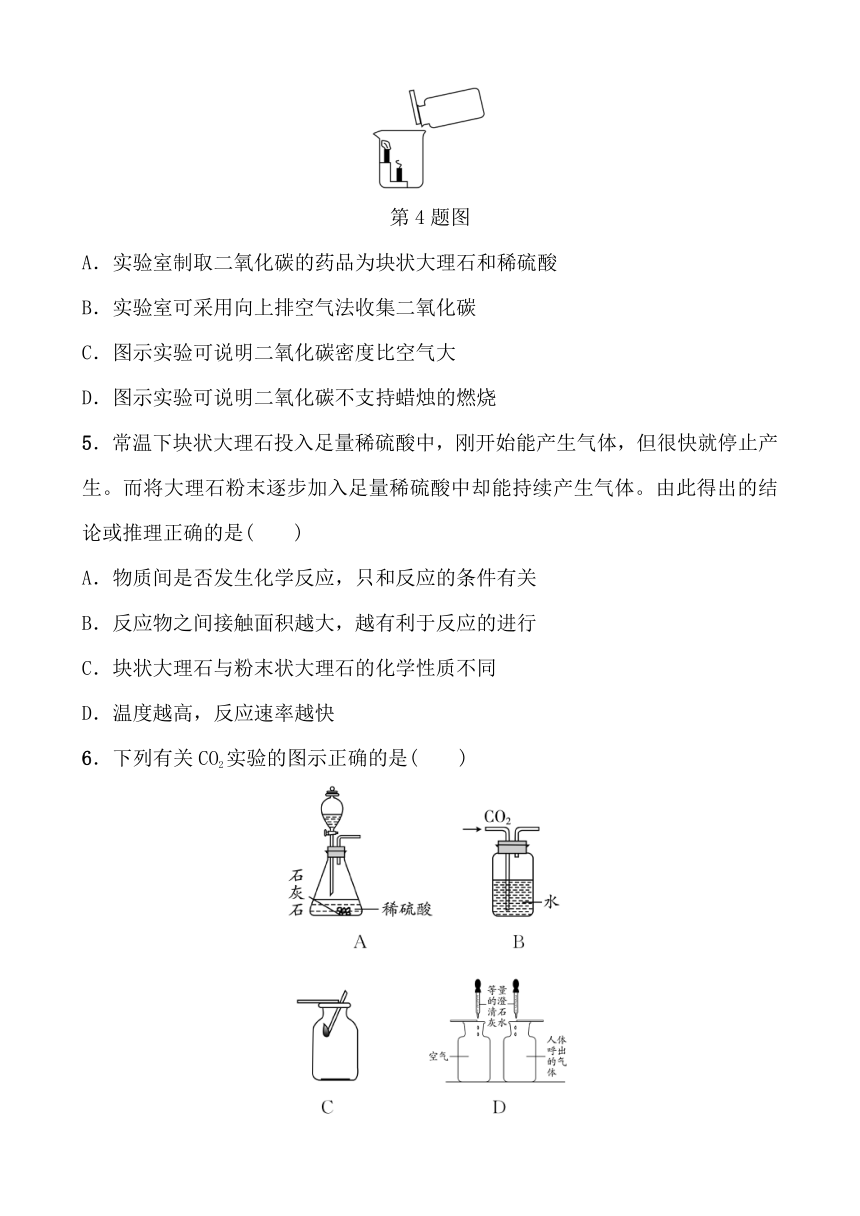
1.以下均为实验室制取二氧化碳的发生装置图,其中能控制反应随时发生或停止的装置是( )
A B C D
2.下列关于实验室制取CO2的说法正确的是( )
3.实验室制备二氧化碳气体,通常有以下几个步骤:①检查装置的气密性 ②连接仪器 ③加入大理石 ④加入稀盐酸 ⑤收集 ⑥验满
其中排列顺序正确的是( )
A.①②③④⑤⑥ B.②①④③⑤⑥
C.②①③④⑤⑥ D.②③④①⑤⑥
4.小金通过实验室制取和收集二氧化碳的方法获得了一瓶二氧化碳气体。接着利用这瓶二氧化碳气体完成了图示实验,观察到蜡烛火焰自下而上依次熄灭。下列说法错误的是( )
第4题图
A.实验室制取二氧化碳的药品为块状大理石和稀硫酸
B.实验室可采用向上排空气法收集二氧化碳
C.图示实验可说明二氧化碳密度比空气大
D.图示实验可说明二氧化碳不支持蜡烛的燃烧
5.常温下块状大理石投入足量稀硫酸中,刚开始能产生气体,但很快就停止产生。而将大理石粉末逐步加入足量稀硫酸中却能持续产生气体。由此得出的结论或推理正确的是( )
A.物质间是否发生化学反应,只和反应的条件有关
B.反应物之间接触面积越大,越有利于反应的进行
C.块状大理石与粉末状大理石的化学性质不同
D.温度越高,反应速率越快
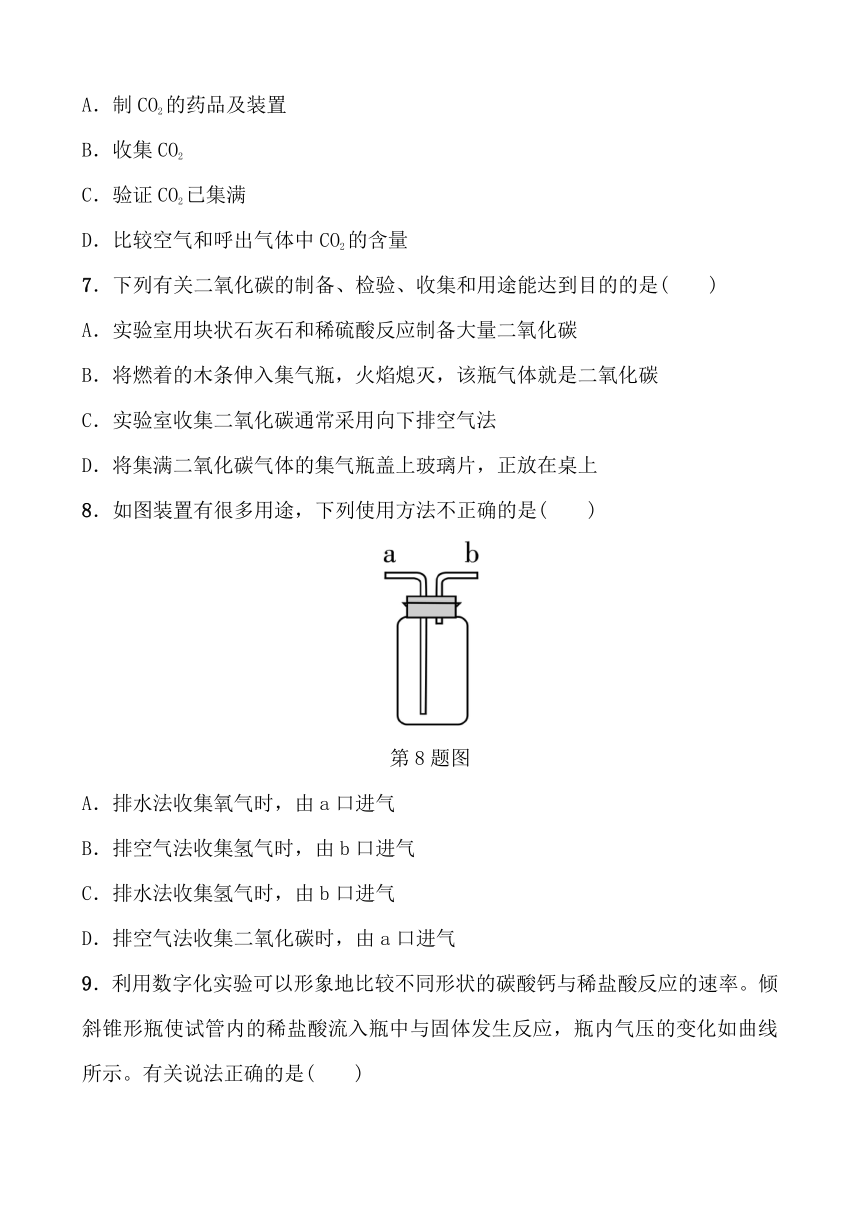
6.下列有关CO2实验的图示正确的是( )
A.制CO2的药品及装置
B.收集CO2
C.验证CO2已集满
D.比较空气和呼出气体中CO2的含量
7.下列有关二氧化碳的制备、检验、收集和用途能达到目的的是( )
A.实验室用块状石灰石和稀硫酸反应制备大量二氧化碳
B.将燃着的木条伸入集气瓶,火焰熄灭,该瓶气体就是二氧化碳
C.实验室收集二氧化碳通常采用向下排空气法
D.将集满二氧化碳气体的集气瓶盖上玻璃片,正放在桌上
8.如图装置有很多用途,下列使用方法不正确的是( )
第8题图
A.排水法收集氧气时,由a口进气
B.排空气法收集氢气时,由b口进气
C.排水法收集氢气时,由b口进气
D.排空气法收集二氧化碳时,由a口进气
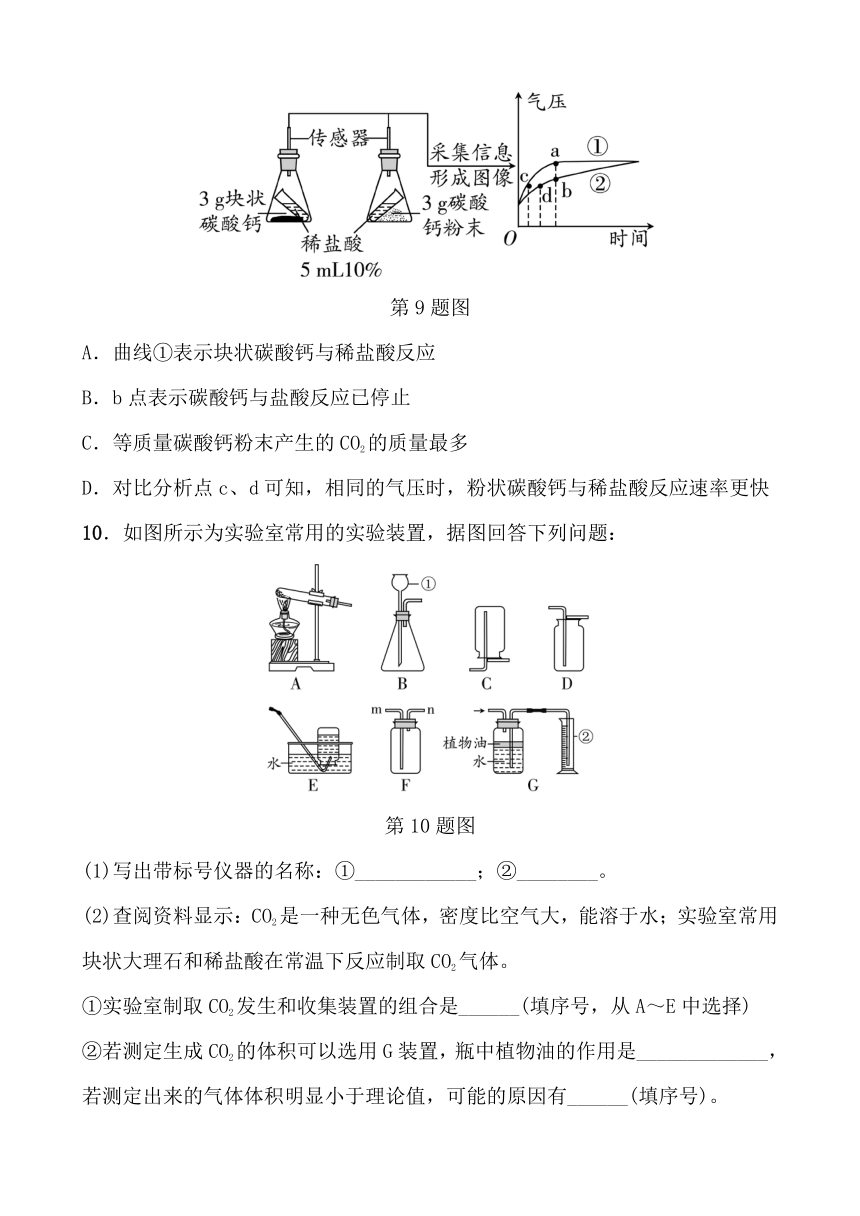
9.利用数字化实验可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,瓶内气压的变化如曲线所示。有关说法正确的是( )
第9题图
A.曲线①表示块状碳酸钙与稀盐酸反应
B.b点表示碳酸钙与盐酸反应已停止
C.等质量碳酸钙粉末产生的CO2的质量最多
D.对比分析点c、d可知,相同的气压时,粉状碳酸钙与稀盐酸反应速率更快
10.如图所示为实验室常用的实验装置,据图回答下列问题:
第10题图
(1)写出带标号仪器的名称:①____________;②________。
(2)查阅资料显示:CO2是一种无色气体,密度比空气大,能溶于水;实验室常用块状大理石和稀盐酸在常温下反应制取CO2气体。
①实验室制取CO2发生和收集装置的组合是______(填序号,从A~E中选择)
②若测定生成CO2的体积可以选用G装置,瓶中植物油的作用是_____________,若测定出来的气体体积明显小于理论值,可能的原因有______(填序号)。
A.反应一开始产生气体就通入G中
B.等气体平稳产生时才通入G中
C.装置漏气
D.收集气体前G装置中植物油上方原本有空气
③若用F装置收集CO2,则CO2由______(填“m”或“n”)管口通入。
11.[2022·台州]二氧化碳是一种与人类生产、生活有密切关系的气体,对地球生命具有重要意义。
(1)二氧化碳的发现
17世纪初,海尔蒙特发现木炭燃烧后不但有灰烬,还产生了一种不可见的气体,于是他将该气体命名为“森林之精”,蜡烛的火焰会在该气体中熄灭,说明了这种气体的化学性质有________________________。
(2)二氧化碳的制取
实验室常用石灰石和稀盐酸反应制取二氧化碳。现要制取4.4克二氧化碳,至少需要含碳酸钙质量分数为80%的石灰石多少克?
(3)二氧化碳的减排和消耗
人类降低空气中的二氧化碳含量的研究有两个方向:一是减少二氧化碳的排放,二是增加二氧化碳的消耗。请写出一条你能做到的消耗二氧化碳的方式或途径:____________。
12.某化学兴趣小组选用如图装置,进行CO2的实验室制取和性质实验,请你根据所学知识,据图回答下列问题:
第12题图
(1)用装置甲制取氧气,应选择的药品是____________________________。
(2)用装置乙收集CO2时,导管口a应与______(填“b”或“c”)相连。
(3)用图丙所示的质地较软的塑料瓶收集CO2,再倒入约1/3体积的紫色石蕊试液,立即旋紧瓶盖,振荡,观察到的现象是____________________________。
(4)往图丁的烧杯内缓缓通入CO2,超薄材料做成的内充空气的气球会慢慢浮起,由此得出CO2具有的性质是______________________。
(5)将甲、戊装置连接,可检验二氧化碳,则戊中的液体是______________。
13.如图是实验室中常见装置,回答下列问题:
查阅资料:①常温下,CO2难溶于饱和NaHCO3溶液 ②浓H2SO4能吸收CO2中的水蒸气。
第13题图
(1)写出仪器X、Z的名称:
X____________;Z__________。
(2)实验室制取CO2应选用的发生装置是______(填序号),反应的化学方程式
是_____________________;此装置制取气体的不足之处是_______________。
(3)常温下,下列收集CO2的方法中不可行的是______(填序号)。
a.向上排空气法
b.向下排空气法
c.排饱和NaHCO3溶液法
(4)若要收集干燥的CO2,可将含有水蒸气的CO2通过装置C后再收集,则C中盛放的试剂Y是__________。
(5)向集满CO2的集气瓶中加入澄清石灰水,反应的化学方程式为___________。
(6)某兴趣小组的同学连接A、G、H装置进行实验。若实验时G装置中蜡烛燃烧更剧烈,H 装置中溶液变浑浊,则A装置中反应的化学方程式为___________。
(7)如图装置可用于气体的收集、检验、除杂和体积的测量等,不能完成的实验是________(填序号)。
第13题图
A.气体从b端通入,可用于实验室收集氧气
B.若瓶内为澄清石灰水,气体从b通入可检验其中是否混有二氧化碳
C.该装置内装水可用于医疗中给病人供氧呼吸,能观察氧气的输出速度
D.收集难溶于水的气体,瓶内装满水,气体从b端通入
14.[2022·温州]实验室制取二氧化碳时,选择合适溶质质量分数的盐酸,有利于减少盐酸浪费。小明分别取400 g溶质质量分数为7.3%、14.6%、21.9%的盐酸与足量的石灰石反应,进行A、B、C三组实验,产生二氧化碳的快慢与时间关系如图,算得盐酸利用率如表(盐酸利用率是指收集到的气体体积理论上所需要的盐酸量与实际消耗的盐酸总量的比值)。
组别 A B C
盐酸溶质质量分数 7.3% 14.6% 21.9%
盐酸利用率 82.5% 81.5% 72.1%
第14题图
(1)小明在实验过程中发现,发生装置中的锥形瓶外壁发烫。推测图中C组在第5~10分钟时反应快速变慢的主要原因是______________________________。
(2)小明用400 g盐酸进行A组实验,可收集到二氧化碳气体约多少升?(盐酸与石灰石反应的化学方程式为:2HCl+CaCO3===CaCl2+H2O+CO2↑,常温常压下二氧化碳的密度约为2 g/L)
(3)实验中,小明想在10分钟内制取10 L二氧化碳气体,综合考虑各种因素,选用哪种溶质质量分数的盐酸更合适,并说明理由。_______________。
答案
1-9 ABCAB DDAD
10.答案:(1)①长颈漏斗 ②量筒
(2)①BD ②防止二氧化碳溶于水且与水反应 BC ③m
11.答案:(1)不能燃烧也不支持燃烧
(2)解:设需要碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 4.4 g
=
x=10 g
石灰石的质量为=12.5 g
答:至少需要含碳酸钙质量分数为80%的石灰石12.5 g。
(3)植树造林
12.答案:(1)过氧化氢溶液和二氧化锰 (2)c (3)溶液变为红色,塑料瓶变瘪
(4)密度比空气的大 (5)澄清石灰水
13.答案:(1)长颈漏斗 锥形瓶
(2)A CaCO3+2HCl===CaCl2+CO2↑+H2O 不能控制反应的速率,浪费药品等 (3)b (4)浓硫酸
(5)CO2 +Ca(OH)2===CaCO3↓+ H2O
(6)2H2O22H2O+ O2↑ (7)AB
14.答案:(1)盐酸溶质质量分数越大,越易挥发;温度升高,加快盐酸挥发;反应速度越快,消耗的盐酸越多;上述结果引起盐酸溶质质量分数快速减小,故反应快速变慢
(2)解:参加反应的稀盐酸溶质质量:m=400 g×7.3%×82.5%=24.09 g
设生成二氧化碳的质量为x。
2HCl+CaCO3===CaCl2+H2O+CO2↑
73 44
24.09 g x
=
解得:x=14.52g
V==7.26 L
答:可收集到二氧化碳气体7.26 L。
(3)选B,前10分钟反应快慢适中,盐酸利用率较高,能满足收集10 L二氧化碳
解析:(1)盐酸溶质质量分数越大,越易挥发;发生装置中的锥形瓶外壁发烫,说明反应放热,温度升高,加快盐酸挥发,反应速度越快,消耗的盐酸越多。上述结果引起盐酸溶质质量分数快速减小,故反应快速变慢。
由图像可知,B前10分钟反应快慢适中,盐酸利用率较高,每分钟产生二氧化碳体积大于1 L,能满足十分钟内收集10 L二氧化碳。
姓名: 班级:
1.以下均为实验室制取二氧化碳的发生装置图,其中能控制反应随时发生或停止的装置是( )
A B C D
2.下列关于实验室制取CO2的说法正确的是( )
3.实验室制备二氧化碳气体,通常有以下几个步骤:①检查装置的气密性 ②连接仪器 ③加入大理石 ④加入稀盐酸 ⑤收集 ⑥验满
其中排列顺序正确的是( )
A.①②③④⑤⑥ B.②①④③⑤⑥
C.②①③④⑤⑥ D.②③④①⑤⑥
4.小金通过实验室制取和收集二氧化碳的方法获得了一瓶二氧化碳气体。接着利用这瓶二氧化碳气体完成了图示实验,观察到蜡烛火焰自下而上依次熄灭。下列说法错误的是( )
第4题图
A.实验室制取二氧化碳的药品为块状大理石和稀硫酸
B.实验室可采用向上排空气法收集二氧化碳
C.图示实验可说明二氧化碳密度比空气大
D.图示实验可说明二氧化碳不支持蜡烛的燃烧
5.常温下块状大理石投入足量稀硫酸中,刚开始能产生气体,但很快就停止产生。而将大理石粉末逐步加入足量稀硫酸中却能持续产生气体。由此得出的结论或推理正确的是( )
A.物质间是否发生化学反应,只和反应的条件有关
B.反应物之间接触面积越大,越有利于反应的进行
C.块状大理石与粉末状大理石的化学性质不同
D.温度越高,反应速率越快
6.下列有关CO2实验的图示正确的是( )
A.制CO2的药品及装置
B.收集CO2
C.验证CO2已集满
D.比较空气和呼出气体中CO2的含量
7.下列有关二氧化碳的制备、检验、收集和用途能达到目的的是( )
A.实验室用块状石灰石和稀硫酸反应制备大量二氧化碳
B.将燃着的木条伸入集气瓶,火焰熄灭,该瓶气体就是二氧化碳
C.实验室收集二氧化碳通常采用向下排空气法
D.将集满二氧化碳气体的集气瓶盖上玻璃片,正放在桌上
8.如图装置有很多用途,下列使用方法不正确的是( )
第8题图
A.排水法收集氧气时,由a口进气
B.排空气法收集氢气时,由b口进气
C.排水法收集氢气时,由b口进气
D.排空气法收集二氧化碳时,由a口进气
9.利用数字化实验可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。倾斜锥形瓶使试管内的稀盐酸流入瓶中与固体发生反应,瓶内气压的变化如曲线所示。有关说法正确的是( )
第9题图
A.曲线①表示块状碳酸钙与稀盐酸反应
B.b点表示碳酸钙与盐酸反应已停止
C.等质量碳酸钙粉末产生的CO2的质量最多
D.对比分析点c、d可知,相同的气压时,粉状碳酸钙与稀盐酸反应速率更快
10.如图所示为实验室常用的实验装置,据图回答下列问题:
第10题图
(1)写出带标号仪器的名称:①____________;②________。
(2)查阅资料显示:CO2是一种无色气体,密度比空气大,能溶于水;实验室常用块状大理石和稀盐酸在常温下反应制取CO2气体。
①实验室制取CO2发生和收集装置的组合是______(填序号,从A~E中选择)
②若测定生成CO2的体积可以选用G装置,瓶中植物油的作用是_____________,若测定出来的气体体积明显小于理论值,可能的原因有______(填序号)。
A.反应一开始产生气体就通入G中
B.等气体平稳产生时才通入G中
C.装置漏气
D.收集气体前G装置中植物油上方原本有空气
③若用F装置收集CO2,则CO2由______(填“m”或“n”)管口通入。
11.[2022·台州]二氧化碳是一种与人类生产、生活有密切关系的气体,对地球生命具有重要意义。
(1)二氧化碳的发现
17世纪初,海尔蒙特发现木炭燃烧后不但有灰烬,还产生了一种不可见的气体,于是他将该气体命名为“森林之精”,蜡烛的火焰会在该气体中熄灭,说明了这种气体的化学性质有________________________。
(2)二氧化碳的制取
实验室常用石灰石和稀盐酸反应制取二氧化碳。现要制取4.4克二氧化碳,至少需要含碳酸钙质量分数为80%的石灰石多少克?
(3)二氧化碳的减排和消耗
人类降低空气中的二氧化碳含量的研究有两个方向:一是减少二氧化碳的排放,二是增加二氧化碳的消耗。请写出一条你能做到的消耗二氧化碳的方式或途径:____________。
12.某化学兴趣小组选用如图装置,进行CO2的实验室制取和性质实验,请你根据所学知识,据图回答下列问题:
第12题图
(1)用装置甲制取氧气,应选择的药品是____________________________。
(2)用装置乙收集CO2时,导管口a应与______(填“b”或“c”)相连。
(3)用图丙所示的质地较软的塑料瓶收集CO2,再倒入约1/3体积的紫色石蕊试液,立即旋紧瓶盖,振荡,观察到的现象是____________________________。
(4)往图丁的烧杯内缓缓通入CO2,超薄材料做成的内充空气的气球会慢慢浮起,由此得出CO2具有的性质是______________________。
(5)将甲、戊装置连接,可检验二氧化碳,则戊中的液体是______________。
13.如图是实验室中常见装置,回答下列问题:
查阅资料:①常温下,CO2难溶于饱和NaHCO3溶液 ②浓H2SO4能吸收CO2中的水蒸气。
第13题图
(1)写出仪器X、Z的名称:
X____________;Z__________。
(2)实验室制取CO2应选用的发生装置是______(填序号),反应的化学方程式
是_____________________;此装置制取气体的不足之处是_______________。
(3)常温下,下列收集CO2的方法中不可行的是______(填序号)。
a.向上排空气法
b.向下排空气法
c.排饱和NaHCO3溶液法
(4)若要收集干燥的CO2,可将含有水蒸气的CO2通过装置C后再收集,则C中盛放的试剂Y是__________。
(5)向集满CO2的集气瓶中加入澄清石灰水,反应的化学方程式为___________。
(6)某兴趣小组的同学连接A、G、H装置进行实验。若实验时G装置中蜡烛燃烧更剧烈,H 装置中溶液变浑浊,则A装置中反应的化学方程式为___________。
(7)如图装置可用于气体的收集、检验、除杂和体积的测量等,不能完成的实验是________(填序号)。
第13题图
A.气体从b端通入,可用于实验室收集氧气
B.若瓶内为澄清石灰水,气体从b通入可检验其中是否混有二氧化碳
C.该装置内装水可用于医疗中给病人供氧呼吸,能观察氧气的输出速度
D.收集难溶于水的气体,瓶内装满水,气体从b端通入
14.[2022·温州]实验室制取二氧化碳时,选择合适溶质质量分数的盐酸,有利于减少盐酸浪费。小明分别取400 g溶质质量分数为7.3%、14.6%、21.9%的盐酸与足量的石灰石反应,进行A、B、C三组实验,产生二氧化碳的快慢与时间关系如图,算得盐酸利用率如表(盐酸利用率是指收集到的气体体积理论上所需要的盐酸量与实际消耗的盐酸总量的比值)。
组别 A B C
盐酸溶质质量分数 7.3% 14.6% 21.9%
盐酸利用率 82.5% 81.5% 72.1%
第14题图
(1)小明在实验过程中发现,发生装置中的锥形瓶外壁发烫。推测图中C组在第5~10分钟时反应快速变慢的主要原因是______________________________。
(2)小明用400 g盐酸进行A组实验,可收集到二氧化碳气体约多少升?(盐酸与石灰石反应的化学方程式为:2HCl+CaCO3===CaCl2+H2O+CO2↑,常温常压下二氧化碳的密度约为2 g/L)
(3)实验中,小明想在10分钟内制取10 L二氧化碳气体,综合考虑各种因素,选用哪种溶质质量分数的盐酸更合适,并说明理由。_______________。
答案
1-9 ABCAB DDAD
10.答案:(1)①长颈漏斗 ②量筒
(2)①BD ②防止二氧化碳溶于水且与水反应 BC ③m
11.答案:(1)不能燃烧也不支持燃烧
(2)解:设需要碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 4.4 g
=
x=10 g
石灰石的质量为=12.5 g
答:至少需要含碳酸钙质量分数为80%的石灰石12.5 g。
(3)植树造林
12.答案:(1)过氧化氢溶液和二氧化锰 (2)c (3)溶液变为红色,塑料瓶变瘪
(4)密度比空气的大 (5)澄清石灰水
13.答案:(1)长颈漏斗 锥形瓶
(2)A CaCO3+2HCl===CaCl2+CO2↑+H2O 不能控制反应的速率,浪费药品等 (3)b (4)浓硫酸
(5)CO2 +Ca(OH)2===CaCO3↓+ H2O
(6)2H2O22H2O+ O2↑ (7)AB
14.答案:(1)盐酸溶质质量分数越大,越易挥发;温度升高,加快盐酸挥发;反应速度越快,消耗的盐酸越多;上述结果引起盐酸溶质质量分数快速减小,故反应快速变慢
(2)解:参加反应的稀盐酸溶质质量:m=400 g×7.3%×82.5%=24.09 g
设生成二氧化碳的质量为x。
2HCl+CaCO3===CaCl2+H2O+CO2↑
73 44
24.09 g x
=
解得:x=14.52g
V==7.26 L
答:可收集到二氧化碳气体7.26 L。
(3)选B,前10分钟反应快慢适中,盐酸利用率较高,能满足收集10 L二氧化碳
解析:(1)盐酸溶质质量分数越大,越易挥发;发生装置中的锥形瓶外壁发烫,说明反应放热,温度升高,加快盐酸挥发,反应速度越快,消耗的盐酸越多。上述结果引起盐酸溶质质量分数快速减小,故反应快速变慢。
由图像可知,B前10分钟反应快慢适中,盐酸利用率较高,每分钟产生二氧化碳体积大于1 L,能满足十分钟内收集10 L二氧化碳。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
