第五单元 第一节 化学反应中的质量守恒同步练习(含答案)
文档属性
| 名称 | 第五单元 第一节 化学反应中的质量守恒同步练习(含答案) |
|
|
| 格式 | doc | ||
| 文件大小 | 627.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 17:59:06 | ||
图片预览


文档简介
姓名: 班级:
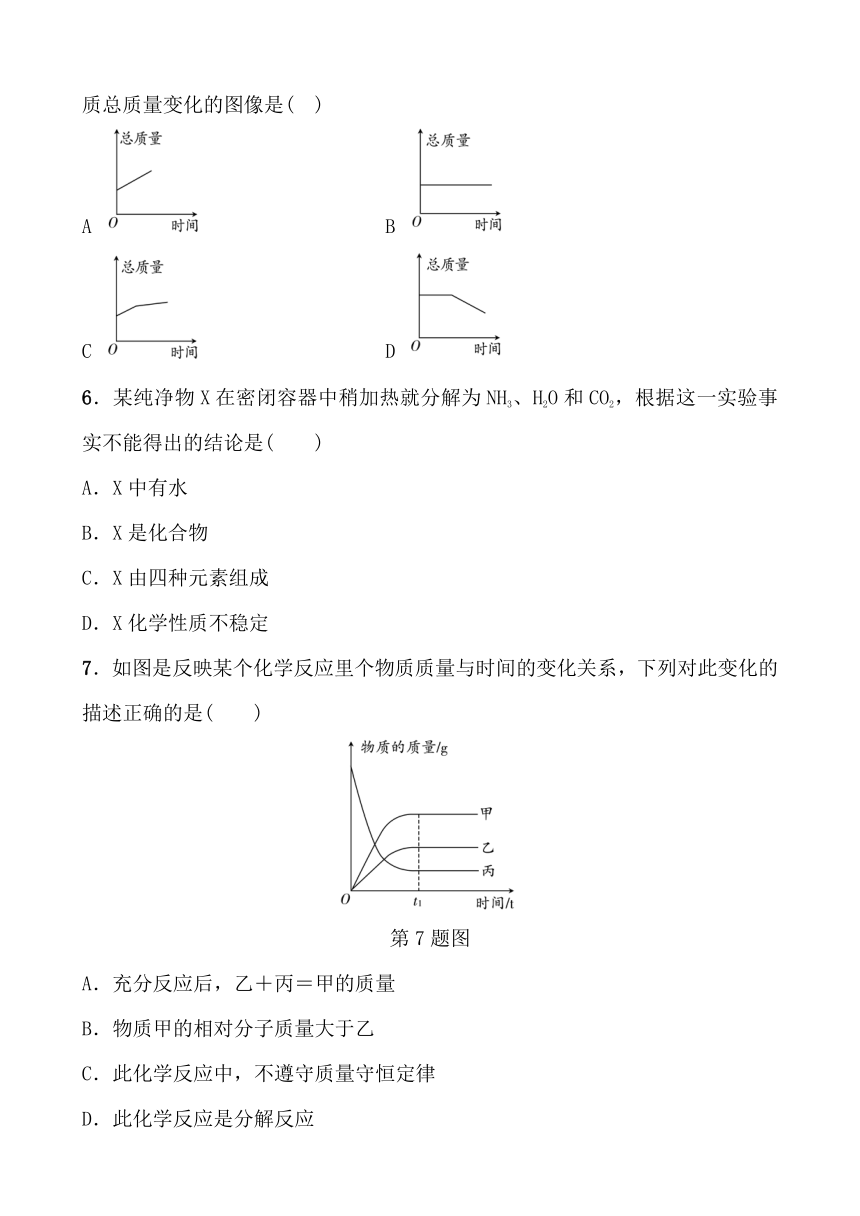
1.下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氧气反应生成2 L水
B.蜡烛完全燃烧后消失不见了,不遵循质量守恒定律
C.只有固体或液体间的反应才遵循质量守恒定律
D.铁丝在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝与氧气的质量之和
2.下列实验能够用于直接验证质量守恒定律的是( )
A B
C D
3.在某化学反应 2XY+Y2===2Z中,Z物质的化学式符合( )
A.XY2 B.X2Y
C.X2Y2 D.X3Y2
4.石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的化学方程式为CaCN2+3H2O=== CaCO3+2X,则X化学式为( )
A.NO B.N2
C.CO2 D.NH3
5.红磷在耐高温的密闭容器中(内含空气)加热,能符合题意表示容器里所盛物质总质量变化的图像是( )
A B
C D
6.某纯净物X在密闭容器中稍加热就分解为NH3、H2O和CO2,根据这一实验事实不能得出的结论是( )
A.X中有水
B.X是化合物
C.X由四种元素组成
D.X化学性质不稳定
7.如图是反映某个化学反应里个物质质量与时间的变化关系,下列对此变化的描述正确的是( )
第7题图
A.充分反应后,乙+丙=甲的质量
B.物质甲的相对分子质量大于乙
C.此化学反应中,不遵守质量守恒定律
D.此化学反应是分解反应
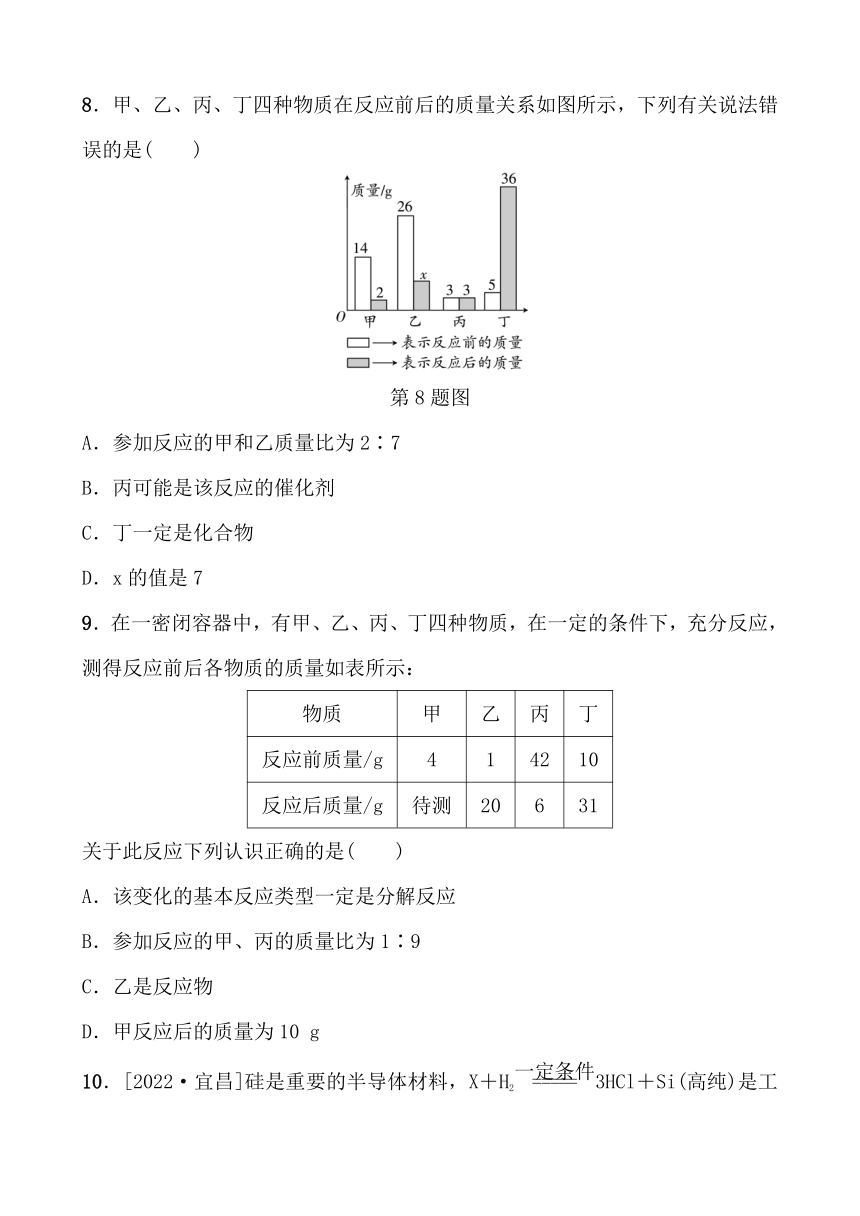
8.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
第8题图
A.参加反应的甲和乙质量比为2∶7
B.丙可能是该反应的催化剂
C.丁一定是化合物
D.x的值是7
9.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质的质量如表所示:
物质 甲 乙 丙 丁
反应前质量/g 4 1 42 10
反应后质量/g 待测 20 6 31
关于此反应下列认识正确的是( )
A.该变化的基本反应类型一定是分解反应
B.参加反应的甲、丙的质量比为1∶9
C.乙是反应物
D.甲反应后的质量为10 g
10.[2022·宜昌]硅是重要的半导体材料,X+H23HCl+Si(高纯)是工业制硅流程中的化学反应之一。下列说法错误的是( )
A.反应中元素种类不变
B.反应中各原子数目不变
C.X的化学式是SiHCl2
D.副产品可用于生产盐酸
11.如图为某反应的微观示意图,其中不同的球代表不同元素的原子。下列说法错误的是( )
第11题图
A.生成物可能都是氧化物
B.乙中元素的化合价在反应前后保持不变
C.生成物的分子个数比为1∶2
D.反应前后原子的种类和数目都不变
12.已知某纯净物4.6 g在足量的氧气中充分燃烧后,生成8.8 g二氧化碳和5.4 g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
13.四种物质在一定的条件下充分混合,测得反应前后各物质的质量分数如图。下列说法错误的是( )
第13题图
A.乙可能是该反应的催化剂
B.生成的甲、丁两物质的质量之比为1∶8
C.丁一定是化合物
D.参加反应的丁的质量一定等于生成的甲和丙的质量之和
14.某密闭容器中,12 g A加热完全分解产生B和C,其中B的质量为2 g,同
时C又能部分分解产生0.1 g D和7.9 g E,则最终该密闭容器中B和C的质量
比为( )
A.1∶1 B.1∶2
C.1∶4 D.1∶5
15.下列关于质量守恒定律的理解,错误的是( )
A.宏观:实际参加反应的反应物的总质量等于生成物的总质量
B.微观:反应前后原子种类和个数不变
C.一切化学反应都符合质量守恒定律
D.煤燃烧后灰渣质量小于煤,不能用质量守恒定律解释
16.84消毒液(有效成分为次氯酸钠,化学式为NaClO)、过氧乙酸(化学式为CH3COOOH)消毒液成了家庭、医院、宾馆常用的消毒剂。NaClO中氯元素的化合价为________。CH3COOOH中碳、氢、氧三种元素的质量比为____________;过氧乙酸具有强腐蚀性,且在室温下易分解成乙酸和一种常见气体X,化学方程式为:2CH3COOOH===2CH3COOH+X↑,则X的化学式为________。
17.如图是某化学反应前后微观模拟图,请根据图示回答下列问题:
第17题图
(1)该化学反应中,参加反应的“”和“”与反应后生成的“”各粒子间的个数比为____________。
(2)该反应的基本反应类型为____________。
(3)该反应中的生成物________(填“可能”或“不可能”)属于氧化物。
(4)该化学反应中不变的微粒是________(画微粒符号)。
18.已知一定质量的纯净物A跟16 g氧气进行充分的燃烧,恰好完全反应后,生成11 g二氧化碳和9 g水,请回答下列问题:
(1)参加反应的物质A的质量是______。
(2)组成物质A的元素,一定有________(填元素符号)。
(3)物质A中各元素的质量比为________。
19.小希同学在复习《质量守恒定律》时,回忆老师做的以下四个演示实验:
第19题图
(1)在实验Ⅰ中,他观察到的现象是__________(填序号)。
a.红磷燃烧,产生大量的白烟
b.气球先变大后变小,甚至缩进玻璃管中
c.待锥形瓶冷却后,天平仍然保持平衡
d.待锥形瓶冷却后,天平指针向右偏
e.待锥形瓶冷却后,天平指针向左偏
(2)在实验Ⅲ结束后,天平指针向右偏,他认为导致天平不平衡的原因是___,若想天平仍然能保持平衡,需确保此实验在________体系中进行。
(3)实验Ⅳ中镁条完全燃烧后,称量得知陶土网上留下的固体反而比反应前镁条还轻,其原因可能是_________________(写出其中一条)。
(4)根据质量守恒定律可知,在化学反应前后,一定没有发生变化的是______
(填序号)。
a.元素种类 b.元素化合价 c.分子种类
d.分子质量 e.原子种类 f.原子质量
答案
1-15 DBADB ADABC BBBAD
16.答案:+1 6∶1∶12 O2
17.答案:(1)2∶1∶2 (2)化合反应 (3)可能 (4)、
18.答案:(1)4 g (2)C、H (3)3∶1
19.答案:(1)abc
(2)反应生成的二氧化碳气体逸出装置
密闭
反应生成的氧化镁固体小颗粒部分扩散到空气中(合理即可) (4)aef
1.下列说法正确的是( )
A.根据质量守恒定律,1 L氢气和1 L氧气反应生成2 L水
B.蜡烛完全燃烧后消失不见了,不遵循质量守恒定律
C.只有固体或液体间的反应才遵循质量守恒定律
D.铁丝在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝与氧气的质量之和
2.下列实验能够用于直接验证质量守恒定律的是( )
A B
C D
3.在某化学反应 2XY+Y2===2Z中,Z物质的化学式符合( )
A.XY2 B.X2Y
C.X2Y2 D.X3Y2
4.石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的化学方程式为CaCN2+3H2O=== CaCO3+2X,则X化学式为( )
A.NO B.N2
C.CO2 D.NH3
5.红磷在耐高温的密闭容器中(内含空气)加热,能符合题意表示容器里所盛物质总质量变化的图像是( )
A B
C D
6.某纯净物X在密闭容器中稍加热就分解为NH3、H2O和CO2,根据这一实验事实不能得出的结论是( )
A.X中有水
B.X是化合物
C.X由四种元素组成
D.X化学性质不稳定
7.如图是反映某个化学反应里个物质质量与时间的变化关系,下列对此变化的描述正确的是( )
第7题图
A.充分反应后,乙+丙=甲的质量
B.物质甲的相对分子质量大于乙
C.此化学反应中,不遵守质量守恒定律
D.此化学反应是分解反应
8.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
第8题图
A.参加反应的甲和乙质量比为2∶7
B.丙可能是该反应的催化剂
C.丁一定是化合物
D.x的值是7
9.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质的质量如表所示:
物质 甲 乙 丙 丁
反应前质量/g 4 1 42 10
反应后质量/g 待测 20 6 31
关于此反应下列认识正确的是( )
A.该变化的基本反应类型一定是分解反应
B.参加反应的甲、丙的质量比为1∶9
C.乙是反应物
D.甲反应后的质量为10 g
10.[2022·宜昌]硅是重要的半导体材料,X+H23HCl+Si(高纯)是工业制硅流程中的化学反应之一。下列说法错误的是( )
A.反应中元素种类不变
B.反应中各原子数目不变
C.X的化学式是SiHCl2
D.副产品可用于生产盐酸
11.如图为某反应的微观示意图,其中不同的球代表不同元素的原子。下列说法错误的是( )
第11题图
A.生成物可能都是氧化物
B.乙中元素的化合价在反应前后保持不变
C.生成物的分子个数比为1∶2
D.反应前后原子的种类和数目都不变
12.已知某纯净物4.6 g在足量的氧气中充分燃烧后,生成8.8 g二氧化碳和5.4 g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
13.四种物质在一定的条件下充分混合,测得反应前后各物质的质量分数如图。下列说法错误的是( )
第13题图
A.乙可能是该反应的催化剂
B.生成的甲、丁两物质的质量之比为1∶8
C.丁一定是化合物
D.参加反应的丁的质量一定等于生成的甲和丙的质量之和
14.某密闭容器中,12 g A加热完全分解产生B和C,其中B的质量为2 g,同
时C又能部分分解产生0.1 g D和7.9 g E,则最终该密闭容器中B和C的质量
比为( )
A.1∶1 B.1∶2
C.1∶4 D.1∶5
15.下列关于质量守恒定律的理解,错误的是( )
A.宏观:实际参加反应的反应物的总质量等于生成物的总质量
B.微观:反应前后原子种类和个数不变
C.一切化学反应都符合质量守恒定律
D.煤燃烧后灰渣质量小于煤,不能用质量守恒定律解释
16.84消毒液(有效成分为次氯酸钠,化学式为NaClO)、过氧乙酸(化学式为CH3COOOH)消毒液成了家庭、医院、宾馆常用的消毒剂。NaClO中氯元素的化合价为________。CH3COOOH中碳、氢、氧三种元素的质量比为____________;过氧乙酸具有强腐蚀性,且在室温下易分解成乙酸和一种常见气体X,化学方程式为:2CH3COOOH===2CH3COOH+X↑,则X的化学式为________。
17.如图是某化学反应前后微观模拟图,请根据图示回答下列问题:
第17题图
(1)该化学反应中,参加反应的“”和“”与反应后生成的“”各粒子间的个数比为____________。
(2)该反应的基本反应类型为____________。
(3)该反应中的生成物________(填“可能”或“不可能”)属于氧化物。
(4)该化学反应中不变的微粒是________(画微粒符号)。
18.已知一定质量的纯净物A跟16 g氧气进行充分的燃烧,恰好完全反应后,生成11 g二氧化碳和9 g水,请回答下列问题:
(1)参加反应的物质A的质量是______。
(2)组成物质A的元素,一定有________(填元素符号)。
(3)物质A中各元素的质量比为________。
19.小希同学在复习《质量守恒定律》时,回忆老师做的以下四个演示实验:
第19题图
(1)在实验Ⅰ中,他观察到的现象是__________(填序号)。
a.红磷燃烧,产生大量的白烟
b.气球先变大后变小,甚至缩进玻璃管中
c.待锥形瓶冷却后,天平仍然保持平衡
d.待锥形瓶冷却后,天平指针向右偏
e.待锥形瓶冷却后,天平指针向左偏
(2)在实验Ⅲ结束后,天平指针向右偏,他认为导致天平不平衡的原因是___,若想天平仍然能保持平衡,需确保此实验在________体系中进行。
(3)实验Ⅳ中镁条完全燃烧后,称量得知陶土网上留下的固体反而比反应前镁条还轻,其原因可能是_________________(写出其中一条)。
(4)根据质量守恒定律可知,在化学反应前后,一定没有发生变化的是______
(填序号)。
a.元素种类 b.元素化合价 c.分子种类
d.分子质量 e.原子种类 f.原子质量
答案
1-15 DBADB ADABC BBBAD
16.答案:+1 6∶1∶12 O2
17.答案:(1)2∶1∶2 (2)化合反应 (3)可能 (4)、
18.答案:(1)4 g (2)C、H (3)3∶1
19.答案:(1)abc
(2)反应生成的二氧化碳气体逸出装置
密闭
反应生成的氧化镁固体小颗粒部分扩散到空气中(合理即可) (4)aef
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
