第41讲 弱电解质的电离平衡(基础课)(共69张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第41讲 弱电解质的电离平衡(基础课)(共69张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 17:56:22 | ||
图片预览









文档简介
(共69张PPT)
第41讲 弱电解质的电离平衡(基础课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.了解弱电解质电离平衡的特征及影响因素。 2.理解电离(平衡)常数的含义和有关计算及应用。 3.了解“一元强酸(碱)和一元弱酸(碱)”的比较。
知识点一 弱电解质的电离平衡
必备知识梳理
关键能力训练
01
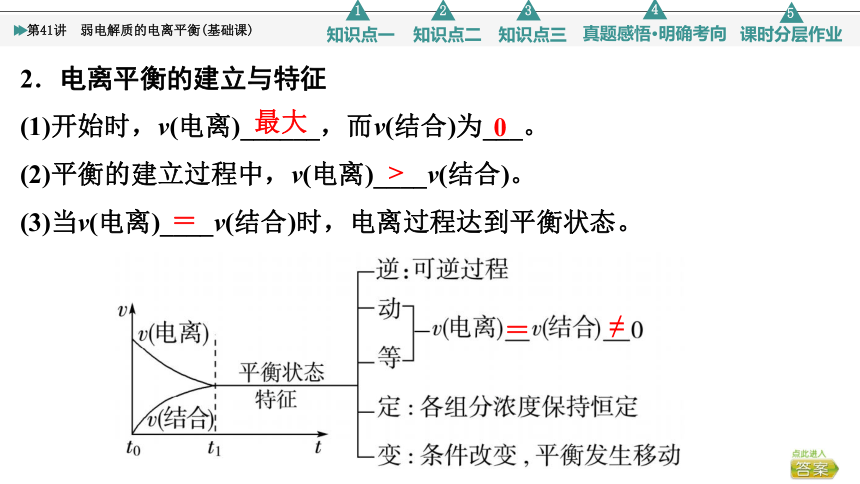
1.弱电解质的电离平衡
一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率______时,电离过程达到平衡状态。
相等
2.电离平衡的建立与特征
(1)开始时,v(电离)______,而v(结合)为___。
(2)平衡的建立过程中,v(电离)____v(结合)。
(3)当v(电离)____v(结合)时,电离过程达到平衡状态。
=
≠
最大
0
>
=
3.影响电离平衡的因素
(1)内因:弱电解质本身的性质——决定因素。
(2)外因
①温度:弱电解质电离一般是吸热的,故升温,电离平衡______移动,电离程度______。
②浓度:用同一弱电解质配制溶液,增大溶液的浓度,电离平衡______移动,溶液中离子的浓度增大,但电离程度减小;稀释溶液时,电离平衡______移动,电离程度增大,但溶液中离子的浓度减小。
③同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡______移动,电离程度______。
④反应离子:加入能与弱电解质电离出的离子反应的离子时,电离平衡______移动,电离程度______。
正向
增大
正向
正向
逆向
减小
正向
增大
①电离平衡向右移动,电解质分子的浓度不一定减小,如对于CH3COOH CH3COO-+H+,平衡后,加入冰醋酸,c(CH3COOH)增大,平衡右移。
②电离平衡向右移动,电离程度也不一定增大,如增大弱电解质的浓度,电离平衡向右移动,弱电解质的电离程度减小。
③电离平衡向右移动,离子的浓度不一定增大,如在CH3COOH溶液中加水稀释或加少量NaOH固体,都会引起平衡向右移动,但c(CH3COOH)、c(H+)都比原平衡时小。
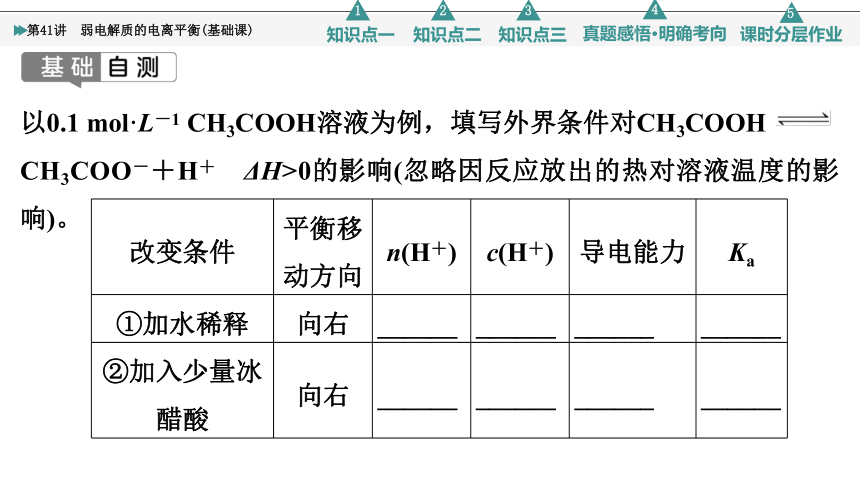
以0.1 mol·L-1 CH3COOH溶液为例,填写外界条件对CH3COOH
CH3COO-+H+ ΔH>0的影响(忽略因反应放出的热对溶液温度的影响)。
改变条件 平衡移动方向 n(H+) c(H+) 导电能力 Ka
①加水稀释 向右 ______ ______ ______ ______
②加入少量冰醋酸 向右 ______ ______ ______ ______
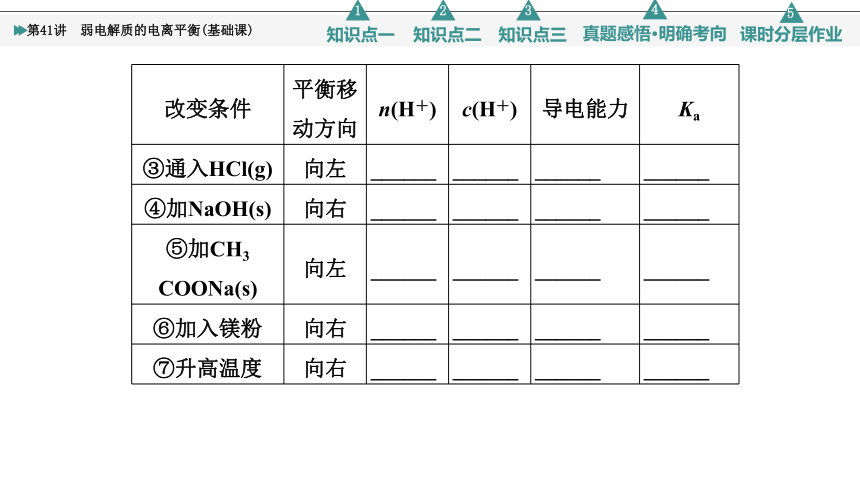
改变条件 平衡移动方向 n(H+) c(H+) 导电能力 Ka
③通入HCl(g) 向左 ______ ______ ______ ______
④加NaOH(s) 向右 ______ ______ ______ ______
⑤加CH3 COONa(s) 向左 ______ ______ ______ ______
⑥加入镁粉 向右 ______ ______ ______ ______
⑦升高温度 向右 ______ ______ ______ ______
[答案] ①增大 减小 减弱 不变 ②增大 增大 增强 不变 ③增大 增大 增强 不变 ④减小 减小 增强 不变 ⑤减小 减小 增强 不变 ⑥减小 减小 增强 不变 ⑦增大 增大 增强 增大
1.稀氨水中存在着下列平衡:NH3·H2O +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是( )
①NH4Cl固体 ②硫酸 ③NaOH固体
④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥
C.③ D.③⑤
C [若在氨水中加入NH4Cl固体,c(NH )增大,平衡向逆反应方向移动,c(OH-)减小,①不符合题意;硫酸中的H+与OH-反应,使c(OH-)减小,平衡向正反应方向移动,②不符合题意;当在氨水中加入NaOH固体后,c(OH-)增大,平衡向逆反应方向移动,③符合题意;若在氨水中加入水,稀释溶液,平衡向正反应方向移动,c(OH-)减小,④不符合题意;电离属于吸热过程,加热,平衡向正反应方向移动,⑤不符合题意;加入MgSO4固体发生反应,溶液中c(OH-)减小,平衡向正反应方向移动,⑥不符合题意。]
2.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:cB.a、b、c三点CH3COOH的电离程度:cC.若用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a~b段导电能力增强的主要原因是CH3COOH电离程度增大,b~c段导电能力减弱的主要原因是溶液体积增大,离子浓度减小
D [A项,由导电能力知c(H+):b>a>c,故pH:c>a>b;B项,加水体积越大,越利于CH3COOH电离,故电离程度:c>b>a;C项,用湿润的pH试纸测量a处溶液的pH,相当于稀释a点溶液,c(H+)增大,pH偏小。]
3.H2S水溶液中存在电离平衡H2S H++HS-和HS- H++S2-。下列说法正确的是( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
C [加水促进H2S的电离,由于溶液体积增大,氢离子浓度减小,A错误;B项反应:2H2S+SO2===3S↓+2H2O,当SO2过量时,溶液显酸性,因H2SO3酸性比H2S强,故pH减小,错误;滴加新制氯水,发生反应Cl2+H2S===2HCl+S↓,平衡向左移动,生成了强酸,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应H2S+Cu2+===CuS↓+2H+,H+浓度增大,D项错误。]
4.常温下将浓度为0.1 mol·L-1 HF溶液加水稀释,下列各量如何变化?(填“变大”“变小”或“不变”)
[答案] (1)变大 变大 (2)不变 不变
加水稀释粒子浓度比值变化分析模型
知识点二 电离常数及其有关计算
02
必备知识梳理
关键能力训练
1.电离常数
(1)电离常数表达式
①一元弱酸HA的电离常数:根据HA H++A-,可表示为Ka=_________。
②一元弱碱BOH的电离常数:根据BOH B++OH-,可表示为Kb=__________。
③多元弱酸,如H2A的Ka1=___________ ,Ka2= __________ 。
(2)电离常数意义:相同条件下,Ka(Kb)值越大,表示该弱电解质______电离,所对应的酸性(碱性)相对______。
(3)电离常数的影响因素
①电离常数本质上与弱电解质相对强弱有关。
②外因:只与______有关,与电解质的浓度、酸碱性无关,由于电离过程是______的,故温度升高,Ka(Kb)______。
③多元弱酸是分步电离的,各级电离常数的大小关系是K1____K2____K3……,其理由是前面电离出的H+抑制后面各步的电离,故其酸性主要取决于第____步电离。
越易
越强
温度
吸热
增大
一
2.电离常数[Ka(Kb)]与电离度(α)的计算模板
(1)一元弱酸(以CH3COOH为例)
设常温下,浓度为c mol·L-1的醋酸的电离度为α
CH3COOH CH3COO-+H+
起始/
(mol·L-1) c 0 0
转化/
(mol·L-1) c·α c·α c·α
平衡/
(mol·L-1) c-cα≈c c·α c·α
(2)一元弱碱(如NH3·H2O,电离常数为Kb)
1.判断正误(正确的打“√”,错误的打“×”)
(1)弱电解质加水稀释,平衡右移,电离度增大,电离常数增大。( )
(2)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大。( )
(3)HF溶液中加NaOH溶液,HF的电离常数增大。( )
(4)HF的电离常数与F-的水解常数互为倒数。( )
(5)25 ℃时,浓度均为0.1 mol/L的HA与NaA混合液呈碱性是因为Ka(HA)[答案] (1)× (2)× (3)× (4)× (5)√
2.25 ℃时,0.1 mol/L的HA溶液的pH=3,则HA的电离度为________,电离常数为________。
[答案] 1.0% 1.0×10-5
电离常数的应用
1.部分弱酸的电离平衡常数如下表:
弱酸 HCOOH H2S H2CO3 HClO
电离平衡常数(25 ℃) Ka=1.77×10-4 Ka1=1.1× 10-7; Ka2=1.3× 10-13 Ka1=4.5× 10-7; Ka2=4.7× 10-11 Ka=4.0×10-8
按要求回答下列问题:
(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为________________。
(3)运用上述电离常数及物质的特性判断下列化学方程式不正确的是________(填序号)。
(4)25 ℃,相同浓度的下列溶液
①Na2S ②Na2CO3 ③NaHCO3 ④NaClO
pH由大到小的顺序为__________(填“序号”)。
电离平衡常数(K)的三大应用
(1)判断弱电解质的相对强弱,K越大,相对越强。
(2)判断盐溶液中酸碱性强弱,K越大,对应的盐水解程度越小,呈现的酸、碱性越弱。
(3)判断复分解反应能否发生,K较大的酸或碱能制K较小的酸或碱。
电离常数的有关计算
题点1 混合溶液中的Ka/Kb计算
特定条件下的Ka或Kb的有关计算
25 ℃时,a mol·L-1弱酸盐NaA溶液与b mol·L-1 的强酸HB溶液等体积混合,溶液呈中性,则HA的电离常数Ka按如下三步骤求算:
(1)电荷守恒 c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-) c(A-)=c(Na+)-c(B-)= mol·L-1。
2.(1)25 ℃时,用0.1 mol·L-1的CH3COOH溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离常数为Ka,忽略混合时溶液体积的变化,则Ka为__________________(用含V的式子表示)。
(2)25 ℃时,向含a mol NH4NO3的溶液中滴加b L氨水呈中性,则所滴加氨水的浓度为________ mol·L-1(用含a和b的代数式表示)[已知Kb(NH3·H2O)=2×10-5]。
(3)常温下,将a mol·L-1的CH3COOH溶液与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液的pH为7,则该混合液中CH3COOH的电离常数Ka=________(用含a和b的代数式表示)。
题点2 根据图像灵活确定电离常数Ka/Kb
4.甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为CH3NH2+H2O CH3NH +OH-。常温下,向20.0 mL 0.10 mol·L-1的甲胺溶液中滴加V mL 0.10 mol·L-1的稀盐酸,混合溶液的pH与相关粒子浓度的关系如图所示。
则常温下,甲胺的电离常数表达式Kb=_________________________,
其数值为________。
利用图像求电离常数的步骤(以HA为例)
知识点三 一元强酸(碱)和一元弱酸(碱)的比较
03
必备知识梳理
关键能力训练
1.一元强酸(碱)和一元弱酸(碱)的比较
(1)相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较 项目 酸 c(H+) pH 中和碱的能力 与足量Zn反应产生H2的量 开始与金属反应的速率
一元强酸 大 小 相同 ______ 大
一元弱酸 小 大 小
相同
(2)相同pH、相同体积的一元强酸与一元弱酸的比较
比较 项目 酸 c(H+) c(酸) 中和碱的能力 与足量Zn反应产生H2的量 开始与金属反应的速率
一元强酸 相同 小 小 ____ 相同
一元弱酸 大 大 ____ 说明:一元强碱与一元弱碱的比较规律与以上类似。
少
多
2.图像法理解一强一弱稀释规律
(1)相同体积、相同浓度的盐酸、醋酸
加水稀释到相同的倍数,______的pH大 加水稀释到相同的pH,______加入的水多
醋酸
盐酸
(2)相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,______的pH大 加水稀释到相同的pH,______加入的水多
盐酸
醋酸
强弱电解质的判定
弱电解质判断的四角度(以弱酸为例)
角度一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
角度二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH加水稀释100倍后,1角度三:根据弱酸的正盐能发生水解判断,如判断CH3COOH为弱酸可用以下现象判断:
(1)向一定浓度的醋酸钠溶液中,加入几滴酚酞试剂,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。
角度四:根据等体积、等pH的酸中和碱的量判断,如消耗的碱越多,酸越弱。
1.为了证明HF是弱酸,甲、乙、丙、丁四位同学分别设计以下实验进行探究。
(1)甲同学取一定体积的HF溶液,滴入2滴紫色石蕊溶液,显红色,再加入NaF固体观察到的现象是____________,则证明HF为弱酸。
(2)乙同学取10 mL未知浓度的HF溶液,测其pH为a(a<5),然后用蒸馏水稀释至1 000 mL。再测其pH为b,若要认为HF为弱酸,则a、b应满足的关系是b<________(用含a的代数式表示)。
(3)丙同学用pH试纸测得室温下0.10 mol·L-1的HF溶液的pH为2,则测定HF为弱酸,由丙同学的实验数据可得室温下HF的电离平衡常数约为________。
(4)丁同学用pH试纸测室温下0.1 mol/L NaF溶液的pH__________7,则说明HF为弱酸,其理由是__________________________________________
____________________________________ (写离子方程式)。
[答案] (1)红色变浅 (2)a+2 (3)1×10-3 (4)> F-+H2O HF+OH-
一强一弱的比较
2.(2022·长沙模拟)关于室温下pH相同、体积相同的氨水与氢氧化钠两种稀溶液,下列叙述正确的是( )
A.氨水中的c(NH )与NaOH溶液中的c(Na+)相同
B.温度均升高20 ℃(不考虑挥发),两溶液的pH均不变
C.加水稀释相同的倍数后,两种溶液的pH不再相同
D.与等物质的量浓度的盐酸反应,恰好中和时所消耗的盐酸的体积相同
AC [B项,氨水升温,电离程度变大,c(OH-)增大,pH变大,错误;D项,pH相同的氨水浓度大于NaOH溶液的浓度,消耗的盐酸的体积不相同,错误。]
3.某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液n(Na+)相同
C [加相同体积水,曲线Ⅱ对应的pH变化较大,代表较强的酸,即HNO2,A错误;酸溶液中pH越小,水的电离程度越小,即b点(1)酸、碱溶液稀释与ΔpH的关系
①ΔpH相同,强酸或强碱稀释的倍数小于弱酸或弱碱稀释的倍数。
②稀释相同倍数,强酸或强碱的ΔpH大于弱酸或弱碱的ΔpH。
(2)酸、碱稀释过程中的pH变化图像
真题感悟·明确考向
04
真题 感悟
情境 探究
1.(2022·浙江1月选考,T17)已知25 ℃时,二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
1
3
2
1
3
2
2.(2022·全国乙卷,T13)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
1
3
2
1
3
2
3.(2022·广东选择性考试,T17节选)某小组研究25 ℃下HAc电离平衡的影响因素。
提出假设 稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。
1
3
2
设计方案并完成实验 用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
1
3
2
序号 V(HAc) /mL V(NaAc) /mL V(H2O) /mL n(NaAc) ∶n(HAc) pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a b 3∶4 4.53
Ⅷ 4.00 4.00 32.00 1∶1 4.65
(1)根据表中信息,补充数据:a=__________,b=__________。
(2)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡________(填“正”或“逆”)向移动;结合表中数据,给出判断理由:_____________________
____________________________________________________________。
(3)由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。
实验结论 假设成立。
[答案] (1)3.00 33.00 (2)正 实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1
1
3
2
T ℃时,向浓度均为1 mol·L-1的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lg c)的关系如图所示。下列叙述错误的是( )
A.酸性:HA>HB
B.a点对应的溶液中:c(HA)=0.1 mol·L-1,c(H+)=0.01 mol·L-1
C.T ℃时,弱酸HB的pKa≈5
D.弱酸的Ka随溶液浓度的降低而增大
D [从图中得到,浓度相等的时候,HB溶液的pH更大,说明HB的酸性更弱,A项正确;a点溶液的纵坐标为4,即溶液的pH为2(注意纵坐标为pH的2倍),所以c(H+)=0.01 mol·L-1,a点溶液的横坐标为-1,即lg c(HA)=-1,所以c(HA)=0.1 mol·L-1,B项正确;从图中得到,1 mol·L-1的HB溶液的pH=2.5,即c(H+)=10-2.5 mol·L-1,所以Ka≈
=10-5,pKa≈5,C项正确;Ka是电离常数,其数值只与温度相关,温度不变,Ka不变,D项错误。]
谢谢观看 THANK YOU!
第41讲 弱电解质的电离平衡(基础课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.了解弱电解质电离平衡的特征及影响因素。 2.理解电离(平衡)常数的含义和有关计算及应用。 3.了解“一元强酸(碱)和一元弱酸(碱)”的比较。
知识点一 弱电解质的电离平衡
必备知识梳理
关键能力训练
01
1.弱电解质的电离平衡
一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率和离子结合成弱电解质分子的速率______时,电离过程达到平衡状态。
相等
2.电离平衡的建立与特征
(1)开始时,v(电离)______,而v(结合)为___。
(2)平衡的建立过程中,v(电离)____v(结合)。
(3)当v(电离)____v(结合)时,电离过程达到平衡状态。
=
≠
最大
0
>
=
3.影响电离平衡的因素
(1)内因:弱电解质本身的性质——决定因素。
(2)外因
①温度:弱电解质电离一般是吸热的,故升温,电离平衡______移动,电离程度______。
②浓度:用同一弱电解质配制溶液,增大溶液的浓度,电离平衡______移动,溶液中离子的浓度增大,但电离程度减小;稀释溶液时,电离平衡______移动,电离程度增大,但溶液中离子的浓度减小。
③同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡______移动,电离程度______。
④反应离子:加入能与弱电解质电离出的离子反应的离子时,电离平衡______移动,电离程度______。
正向
增大
正向
正向
逆向
减小
正向
增大
①电离平衡向右移动,电解质分子的浓度不一定减小,如对于CH3COOH CH3COO-+H+,平衡后,加入冰醋酸,c(CH3COOH)增大,平衡右移。
②电离平衡向右移动,电离程度也不一定增大,如增大弱电解质的浓度,电离平衡向右移动,弱电解质的电离程度减小。
③电离平衡向右移动,离子的浓度不一定增大,如在CH3COOH溶液中加水稀释或加少量NaOH固体,都会引起平衡向右移动,但c(CH3COOH)、c(H+)都比原平衡时小。
以0.1 mol·L-1 CH3COOH溶液为例,填写外界条件对CH3COOH
CH3COO-+H+ ΔH>0的影响(忽略因反应放出的热对溶液温度的影响)。
改变条件 平衡移动方向 n(H+) c(H+) 导电能力 Ka
①加水稀释 向右 ______ ______ ______ ______
②加入少量冰醋酸 向右 ______ ______ ______ ______
改变条件 平衡移动方向 n(H+) c(H+) 导电能力 Ka
③通入HCl(g) 向左 ______ ______ ______ ______
④加NaOH(s) 向右 ______ ______ ______ ______
⑤加CH3 COONa(s) 向左 ______ ______ ______ ______
⑥加入镁粉 向右 ______ ______ ______ ______
⑦升高温度 向右 ______ ______ ______ ______
[答案] ①增大 减小 减弱 不变 ②增大 增大 增强 不变 ③增大 增大 增强 不变 ④减小 减小 增强 不变 ⑤减小 减小 增强 不变 ⑥减小 减小 增强 不变 ⑦增大 增大 增强 增大
1.稀氨水中存在着下列平衡:NH3·H2O +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是( )
①NH4Cl固体 ②硫酸 ③NaOH固体
④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥
C.③ D.③⑤
C [若在氨水中加入NH4Cl固体,c(NH )增大,平衡向逆反应方向移动,c(OH-)减小,①不符合题意;硫酸中的H+与OH-反应,使c(OH-)减小,平衡向正反应方向移动,②不符合题意;当在氨水中加入NaOH固体后,c(OH-)增大,平衡向逆反应方向移动,③符合题意;若在氨水中加入水,稀释溶液,平衡向正反应方向移动,c(OH-)减小,④不符合题意;电离属于吸热过程,加热,平衡向正反应方向移动,⑤不符合题意;加入MgSO4固体发生反应,溶液中c(OH-)减小,平衡向正反应方向移动,⑥不符合题意。]
2.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c
D.a~b段导电能力增强的主要原因是CH3COOH电离程度增大,b~c段导电能力减弱的主要原因是溶液体积增大,离子浓度减小
D [A项,由导电能力知c(H+):b>a>c,故pH:c>a>b;B项,加水体积越大,越利于CH3COOH电离,故电离程度:c>b>a;C项,用湿润的pH试纸测量a处溶液的pH,相当于稀释a点溶液,c(H+)增大,pH偏小。]
3.H2S水溶液中存在电离平衡H2S H++HS-和HS- H++S2-。下列说法正确的是( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
C [加水促进H2S的电离,由于溶液体积增大,氢离子浓度减小,A错误;B项反应:2H2S+SO2===3S↓+2H2O,当SO2过量时,溶液显酸性,因H2SO3酸性比H2S强,故pH减小,错误;滴加新制氯水,发生反应Cl2+H2S===2HCl+S↓,平衡向左移动,生成了强酸,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应H2S+Cu2+===CuS↓+2H+,H+浓度增大,D项错误。]
4.常温下将浓度为0.1 mol·L-1 HF溶液加水稀释,下列各量如何变化?(填“变大”“变小”或“不变”)
[答案] (1)变大 变大 (2)不变 不变
加水稀释粒子浓度比值变化分析模型
知识点二 电离常数及其有关计算
02
必备知识梳理
关键能力训练
1.电离常数
(1)电离常数表达式
①一元弱酸HA的电离常数:根据HA H++A-,可表示为Ka=_________。
②一元弱碱BOH的电离常数:根据BOH B++OH-,可表示为Kb=__________。
③多元弱酸,如H2A的Ka1=___________ ,Ka2= __________ 。
(2)电离常数意义:相同条件下,Ka(Kb)值越大,表示该弱电解质______电离,所对应的酸性(碱性)相对______。
(3)电离常数的影响因素
①电离常数本质上与弱电解质相对强弱有关。
②外因:只与______有关,与电解质的浓度、酸碱性无关,由于电离过程是______的,故温度升高,Ka(Kb)______。
③多元弱酸是分步电离的,各级电离常数的大小关系是K1____K2____K3……,其理由是前面电离出的H+抑制后面各步的电离,故其酸性主要取决于第____步电离。
越易
越强
温度
吸热
增大
一
2.电离常数[Ka(Kb)]与电离度(α)的计算模板
(1)一元弱酸(以CH3COOH为例)
设常温下,浓度为c mol·L-1的醋酸的电离度为α
CH3COOH CH3COO-+H+
起始/
(mol·L-1) c 0 0
转化/
(mol·L-1) c·α c·α c·α
平衡/
(mol·L-1) c-cα≈c c·α c·α
(2)一元弱碱(如NH3·H2O,电离常数为Kb)
1.判断正误(正确的打“√”,错误的打“×”)
(1)弱电解质加水稀释,平衡右移,电离度增大,电离常数增大。( )
(2)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大。( )
(3)HF溶液中加NaOH溶液,HF的电离常数增大。( )
(4)HF的电离常数与F-的水解常数互为倒数。( )
(5)25 ℃时,浓度均为0.1 mol/L的HA与NaA混合液呈碱性是因为Ka(HA)
2.25 ℃时,0.1 mol/L的HA溶液的pH=3,则HA的电离度为________,电离常数为________。
[答案] 1.0% 1.0×10-5
电离常数的应用
1.部分弱酸的电离平衡常数如下表:
弱酸 HCOOH H2S H2CO3 HClO
电离平衡常数(25 ℃) Ka=1.77×10-4 Ka1=1.1× 10-7; Ka2=1.3× 10-13 Ka1=4.5× 10-7; Ka2=4.7× 10-11 Ka=4.0×10-8
按要求回答下列问题:
(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为________________。
(3)运用上述电离常数及物质的特性判断下列化学方程式不正确的是________(填序号)。
(4)25 ℃,相同浓度的下列溶液
①Na2S ②Na2CO3 ③NaHCO3 ④NaClO
pH由大到小的顺序为__________(填“序号”)。
电离平衡常数(K)的三大应用
(1)判断弱电解质的相对强弱,K越大,相对越强。
(2)判断盐溶液中酸碱性强弱,K越大,对应的盐水解程度越小,呈现的酸、碱性越弱。
(3)判断复分解反应能否发生,K较大的酸或碱能制K较小的酸或碱。
电离常数的有关计算
题点1 混合溶液中的Ka/Kb计算
特定条件下的Ka或Kb的有关计算
25 ℃时,a mol·L-1弱酸盐NaA溶液与b mol·L-1 的强酸HB溶液等体积混合,溶液呈中性,则HA的电离常数Ka按如下三步骤求算:
(1)电荷守恒 c(Na+)+c(H+)=c(OH-)+c(A-)+c(B-) c(A-)=c(Na+)-c(B-)= mol·L-1。
2.(1)25 ℃时,用0.1 mol·L-1的CH3COOH溶液滴定20 mL 0.1 mol·L-1的NaOH溶液,当滴加V mL CH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离常数为Ka,忽略混合时溶液体积的变化,则Ka为__________________(用含V的式子表示)。
(2)25 ℃时,向含a mol NH4NO3的溶液中滴加b L氨水呈中性,则所滴加氨水的浓度为________ mol·L-1(用含a和b的代数式表示)[已知Kb(NH3·H2O)=2×10-5]。
(3)常温下,将a mol·L-1的CH3COOH溶液与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液的pH为7,则该混合液中CH3COOH的电离常数Ka=________(用含a和b的代数式表示)。
题点2 根据图像灵活确定电离常数Ka/Kb
4.甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为CH3NH2+H2O CH3NH +OH-。常温下,向20.0 mL 0.10 mol·L-1的甲胺溶液中滴加V mL 0.10 mol·L-1的稀盐酸,混合溶液的pH与相关粒子浓度的关系如图所示。
则常温下,甲胺的电离常数表达式Kb=_________________________,
其数值为________。
利用图像求电离常数的步骤(以HA为例)
知识点三 一元强酸(碱)和一元弱酸(碱)的比较
03
必备知识梳理
关键能力训练
1.一元强酸(碱)和一元弱酸(碱)的比较
(1)相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较 项目 酸 c(H+) pH 中和碱的能力 与足量Zn反应产生H2的量 开始与金属反应的速率
一元强酸 大 小 相同 ______ 大
一元弱酸 小 大 小
相同
(2)相同pH、相同体积的一元强酸与一元弱酸的比较
比较 项目 酸 c(H+) c(酸) 中和碱的能力 与足量Zn反应产生H2的量 开始与金属反应的速率
一元强酸 相同 小 小 ____ 相同
一元弱酸 大 大 ____ 说明:一元强碱与一元弱碱的比较规律与以上类似。
少
多
2.图像法理解一强一弱稀释规律
(1)相同体积、相同浓度的盐酸、醋酸
加水稀释到相同的倍数,______的pH大 加水稀释到相同的pH,______加入的水多
醋酸
盐酸
(2)相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,______的pH大 加水稀释到相同的pH,______加入的水多
盐酸
醋酸
强弱电解质的判定
弱电解质判断的四角度(以弱酸为例)
角度一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
角度二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH加水稀释100倍后,1
(1)向一定浓度的醋酸钠溶液中,加入几滴酚酞试剂,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。
角度四:根据等体积、等pH的酸中和碱的量判断,如消耗的碱越多,酸越弱。
1.为了证明HF是弱酸,甲、乙、丙、丁四位同学分别设计以下实验进行探究。
(1)甲同学取一定体积的HF溶液,滴入2滴紫色石蕊溶液,显红色,再加入NaF固体观察到的现象是____________,则证明HF为弱酸。
(2)乙同学取10 mL未知浓度的HF溶液,测其pH为a(a<5),然后用蒸馏水稀释至1 000 mL。再测其pH为b,若要认为HF为弱酸,则a、b应满足的关系是b<________(用含a的代数式表示)。
(3)丙同学用pH试纸测得室温下0.10 mol·L-1的HF溶液的pH为2,则测定HF为弱酸,由丙同学的实验数据可得室温下HF的电离平衡常数约为________。
(4)丁同学用pH试纸测室温下0.1 mol/L NaF溶液的pH__________7,则说明HF为弱酸,其理由是__________________________________________
____________________________________ (写离子方程式)。
[答案] (1)红色变浅 (2)a+2 (3)1×10-3 (4)> F-+H2O HF+OH-
一强一弱的比较
2.(2022·长沙模拟)关于室温下pH相同、体积相同的氨水与氢氧化钠两种稀溶液,下列叙述正确的是( )
A.氨水中的c(NH )与NaOH溶液中的c(Na+)相同
B.温度均升高20 ℃(不考虑挥发),两溶液的pH均不变
C.加水稀释相同的倍数后,两种溶液的pH不再相同
D.与等物质的量浓度的盐酸反应,恰好中和时所消耗的盐酸的体积相同
AC [B项,氨水升温,电离程度变大,c(OH-)增大,pH变大,错误;D项,pH相同的氨水浓度大于NaOH溶液的浓度,消耗的盐酸的体积不相同,错误。]
3.某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液n(Na+)相同
C [加相同体积水,曲线Ⅱ对应的pH变化较大,代表较强的酸,即HNO2,A错误;酸溶液中pH越小,水的电离程度越小,即b点
①ΔpH相同,强酸或强碱稀释的倍数小于弱酸或弱碱稀释的倍数。
②稀释相同倍数,强酸或强碱的ΔpH大于弱酸或弱碱的ΔpH。
(2)酸、碱稀释过程中的pH变化图像
真题感悟·明确考向
04
真题 感悟
情境 探究
1.(2022·浙江1月选考,T17)已知25 ℃时,二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
1
3
2
1
3
2
2.(2022·全国乙卷,T13)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
1
3
2
1
3
2
3.(2022·广东选择性考试,T17节选)某小组研究25 ℃下HAc电离平衡的影响因素。
提出假设 稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。
1
3
2
设计方案并完成实验 用浓度均为0.1 mol·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
1
3
2
序号 V(HAc) /mL V(NaAc) /mL V(H2O) /mL n(NaAc) ∶n(HAc) pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a b 3∶4 4.53
Ⅷ 4.00 4.00 32.00 1∶1 4.65
(1)根据表中信息,补充数据:a=__________,b=__________。
(2)由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡________(填“正”或“逆”)向移动;结合表中数据,给出判断理由:_____________________
____________________________________________________________。
(3)由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。
实验结论 假设成立。
[答案] (1)3.00 33.00 (2)正 实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1
1
3
2
T ℃时,向浓度均为1 mol·L-1的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lg c)的关系如图所示。下列叙述错误的是( )
A.酸性:HA>HB
B.a点对应的溶液中:c(HA)=0.1 mol·L-1,c(H+)=0.01 mol·L-1
C.T ℃时,弱酸HB的pKa≈5
D.弱酸的Ka随溶液浓度的降低而增大
D [从图中得到,浓度相等的时候,HB溶液的pH更大,说明HB的酸性更弱,A项正确;a点溶液的纵坐标为4,即溶液的pH为2(注意纵坐标为pH的2倍),所以c(H+)=0.01 mol·L-1,a点溶液的横坐标为-1,即lg c(HA)=-1,所以c(HA)=0.1 mol·L-1,B项正确;从图中得到,1 mol·L-1的HB溶液的pH=2.5,即c(H+)=10-2.5 mol·L-1,所以Ka≈
=10-5,pKa≈5,C项正确;Ka是电离常数,其数值只与温度相关,温度不变,Ka不变,D项错误。]
谢谢观看 THANK YOU!
同课章节目录
