第43讲 滴定曲线和中和滴定的拓展应用(能力课) 课件(共38张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第43讲 滴定曲线和中和滴定的拓展应用(能力课) 课件(共38张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 17:59:25 | ||
图片预览










文档简介
(共38张PPT)
第43讲 滴定曲线和中和滴定的拓展应用(能力课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.理解滴定曲线的含义及各点的粒子浓度大小分析。 2.了解中和滴定的拓展应用——氧化还原滴定、沉淀滴定等。
考点一 两类滴定曲线的分析
核心知能突破
关键能力训练
01
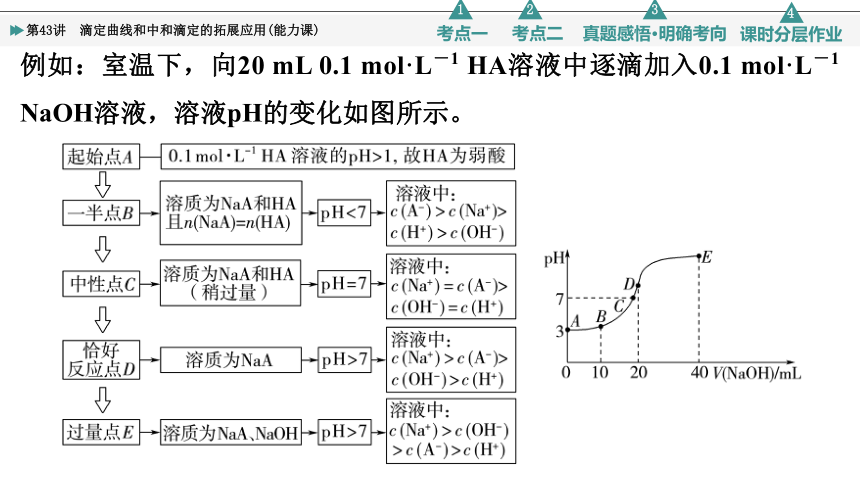
1.中和滴定曲线“5点”分析法
抓反应的“起始”点 判断酸、碱的相对强弱
抓反应“一半”点 判断是哪种溶质的等量混合
抓“恰好”反应点 判断生成的溶质成分及溶液的酸碱性
抓溶液的“中性”点 判断溶液中溶质的成分及哪种物质过量或不足
抓反应的“过量”点 判断溶液中的溶质,判断哪种物质过量
例如:室温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示。
2.沉淀滴定曲线分析
某温度下,向10 mL 0.01 mol·L-1 PbCl2溶液中滴加0.01 mol·L-1的Na2S溶液,滴加过程中-lg c(Pb2+)与Na2S溶液体积的关系如图所示。
2.(2022·葫芦岛二模)室温下用0.1 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.1 mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法不正确的是( )
A.导电能力:a点溶液>b点溶液
B.b点溶液中c(HB)C.a点溶液中由水电离出的c(H+)为3×10-13 mol·L-1
D.HA对应曲线上c点溶液呈碱性因是A-+H2O HA+OH-
D [根据图示可知HA为强酸,HB为弱酸,c点时NaOH过量呈碱性,D项错误。]
沉淀滴定曲线分析
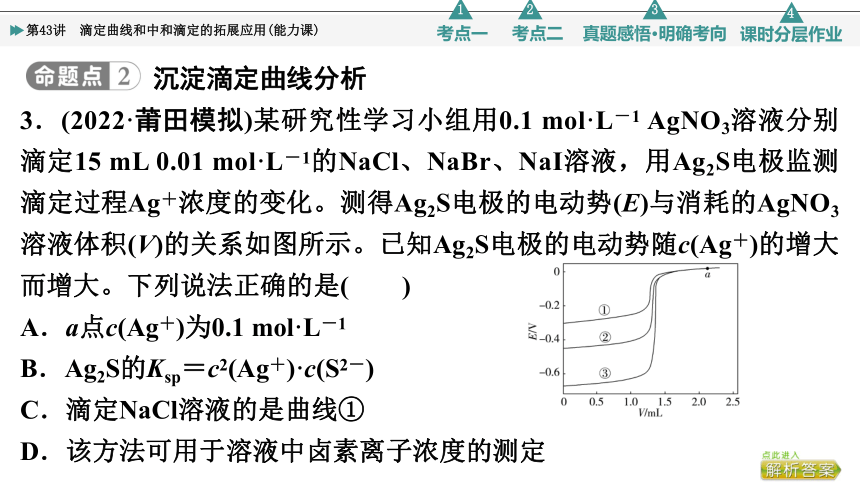
3.(2022·莆田模拟)某研究性学习小组用0.1 mol·L-1 AgNO3溶液分别滴定15 mL 0.01 mol·L-1的NaCl、NaBr、NaI溶液,用Ag2S电极监测滴定过程Ag+浓度的变化。测得Ag2S电极的电动势(E)与消耗的AgNO3溶液体积(V)的关系如图所示。已知Ag2S电极的电动势随c(Ag+)的增大而增大。下列说法正确的是( )
A.a点c(Ag+)为0.1 mol·L-1
B.Ag2S的Ksp=c2(Ag+)·c(S2-)
C.滴定NaCl溶液的是曲线①
D.该方法可用于溶液中卤素离子浓度的测定
BC [A项,向溶液中加入0.1 mol·L-1的AgNO3溶液,c(Ag+)都会小于0.1 mol·L-1,错误;D项,由于不知道具体电动势与卤素离子浓度、银离子浓度的具体关系,所以该方法不可用于溶液中卤素离子浓度的测定,D错误。]
4.某温度下,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中溶液中-lg c(Cu2+)和-lg c(Zn2+)与Na2S溶液体积(V)的关系如图所示。[已知:Ksp(ZnS)>Ksp(CuS),lg 3≈0.5],下列说法错误的是( )
A.溶液pH:aB.a点的ZnCl2溶液中:c(Cl-)<2[c(Zn2+)+c(H+)]
C.a—b—e为滴定CuCl2溶液的曲线
D.d点纵坐标约为33.9
C [已知:Ksp(ZnS)>Ksp(CuS),故终点时-lgc(Zn2+)<-lgc(Cu2+),故a—b—e表示ZnCl2的滴定曲线,C错误。]
考点二 中和滴定的拓展应用
02
核心知能突破
关键能力训练
1.氧化还原滴定
(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
(2)试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C等。
(3)指示剂:①涉及I2的常用淀粉溶液;
②涉及Fe3+的常用KSCN溶液;
③涉及高锰酸钾的不用指示剂。
(4)示例:Na2S2O3溶液滴定碘液
原理 2Na2S2O3+I2===Na2S4O6+2NaI
指示剂 用淀粉作指示剂
终点 判断 当滴入最后半滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点
2. 沉淀滴定
(1)概念:沉淀滴定是利用沉淀反应进行滴定、测量分析的方法,生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度。
(2)原理:沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时常以CrO 为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。
氧化还原反应滴定
1.(2022·青岛模拟)目前,利用氧化还原滴定原理测定高铁酸钾纯度最为常见的方法是亚铬酸盐法:
准确称取a g高铁酸钾粗品配成V1 mL溶液,取V2 mL该待测液于锥形瓶中,加入浓碱性溶液和过量的三价铬盐。再加稀硫酸和指示剂二苯胺磺酸钠,用c mol·L-1硫酸亚铁铵标准液滴定至溶液颜色由紫色变成浅绿色,即为终点,共消耗标准液V3 mL(假设杂质不参与反应)。
(1)标准液应注入________(填“酸式”或“碱式”)滴定管。
(2)滴定时发生反应的离子方程式为____________________________________
__________________________________________________________。
(3)该粗品中高铁酸钾的质量分数为________(用含字母的代数式表示)。
(4)若硫酸亚铁铵标准液放在空气中时间过长,则测得粗品中高铁酸钾质量分数________(填“偏大”“偏小”或“不变”)。
2.用标准KMnO4溶液滴定待测H2O2水溶液中H2O2含量时,终点现象为___________________________________________________________
_________________________________________________________,
滴定结束读数时俯视读数,测定H2O2的含量________(填“偏大”或“偏小”)。
[答案] 当滴加最后半滴KMnO4溶液时,溶液由无色变为浅红色,且半分钟不褪色 偏小
沉淀滴定
3.莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 AgCl AgBr AgCN Ag2CrO4 AgSCN
颜色 白 浅黄 白 砖红 白
溶解度/ (mol·L-1) 1.34× 10-6 7.1× 10-7 1.1× 10-8 6.5× 10-5 1.0×
10-6
(1)滴定终点的现象是__________________________________________
_________________________________________________________。
(2)若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是________(填字母)。
A.NaCl B.BaBr2 C.Na2CrO4
(3)根据表中数据,Ksp(AgCl)=________(保留2位有效数字)。
[解析] 沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时常以CrO 为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。(3)S(AgCl)=1.34×10-6,故AgCl的饱和溶液中c(Cl-)=c(Ag+)=1.34×10-6 mol/L,Ksp(AgCl)=(1.34×10-6)2≈1.8×10-12。
[答案] (1)滴入最后半滴标准液时,生成砖红色沉淀且半分钟内不溶解 (2)C (3)1.8×10-12
真题感悟·明确考向
03
1.(2022·湖南选择性考试,T10)室温时,用0.100 mol·L-1的标准AgNO3溶液滴定15.00 mL浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lg c(Ag+)与V(AgNO3)的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17]。下列说法正确的是( )
A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100 mol·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
1
3
2
1
3
2
1
3
2
C [在NaX溶液中,X-发生水解反应:X-+H2O HX+OH-,溶液中存在c(Na+)>c(X-)>c(OH-)>c(H+),A判断正确;等浓度的NaX、NaY、NaZ三种溶液的pH大小关系:NaZ>NaY>NaX,根据“越弱越水解”可知,酸性:HX>HY>HZ,则电离常数关系:Ka(HX)>Ka(HY)>Ka(HZ),B判断正确;pH=7时,根据电荷守恒,三种溶液混合后分别存在c(Cl-)+c(X-)=c(Na+)、c(Cl-)+c(Y-)=c(Na+)、c(Cl-)+c(Z-)=c(Na+),由于三种一元酸的酸性强弱不同,则向其盐溶液中加入HCl的物质的量不同,则c(X-)、c(Y-)、c(Z-)三者不等,C判断错误;分别加入20.00 mL盐酸后,均恰好完全反应,三种溶液的溶质分别为HX与NaCl、HY与NaCl、HZ与NaCl,三种溶液混合后的溶液中存在电荷守恒:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-),D判断正确。]
1
3
2
3.(2022·河北选择性考试)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入10.00 g香菇样品和400 mL水;锥形瓶中加入125 mL水、1 mL淀粉溶液,并预加0.30 mL 0.010 00 mol·L-1的碘标准溶液,搅拌。
1
3
2
②以0.2 L·min-1流速向三颈烧瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00 mL碘标准溶液。
③做空白实验,消耗了0.10 mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:Ka1(H3PO4)=7.1×10-3,Ka1(H2SO3)=1.3×10-2。
1
3
2
回答下列问题:
(1)装置图中仪器a、b的名称分别为________、________。
(2)三颈烧瓶适宜的规格为________(填标号)。
A.250 mL B.500 mL C.1 000 mL
(3)解释加入H3PO4,能够生成SO2的原因:
________________________________________________________________________。
1
3
2
(4)滴定管在使用前需要________、洗涤、润洗;滴定终点时溶液的颜色为________;滴定反应的离子方程式为________________________
________________________________________________。
(5)若先加磷酸再通氮气,会使测定结果________(填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为________mg·kg-1(以SO2计,结果保留三位有效数字)。
1
3
2
[解析] 由题中信息可知,检测香菇中添加剂亚硫酸盐的含量的原理是:用过量的磷酸与其中的亚硫酸盐反应生成SO2,用氮气将SO2排入锥形瓶中被水吸收,最后用碘标准溶液滴定,测出样品中亚硫酸盐含量。(2)三颈烧瓶中加入10.00 g香菇样品和400 mL水,向其中加入H3PO4的体积不超过10 mL。在加热时,三颈烧瓶中的液体不能超过其容积的 ,因此,三颈烧瓶适宜的规格为1 000 mL。(5)若先加磷酸再通氮气,则不能将装置中的空气及时排出,有部分亚硫酸盐和SO2被装置中的氧气氧化,碘的标准液的消耗量将减少 ,因此会使测定结果偏低。
1
3
2
1
3
2
1
3
2
谢谢观看 THANK YOU!
第43讲 滴定曲线和中和滴定的拓展应用(能力课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.理解滴定曲线的含义及各点的粒子浓度大小分析。 2.了解中和滴定的拓展应用——氧化还原滴定、沉淀滴定等。
考点一 两类滴定曲线的分析
核心知能突破
关键能力训练
01
1.中和滴定曲线“5点”分析法
抓反应的“起始”点 判断酸、碱的相对强弱
抓反应“一半”点 判断是哪种溶质的等量混合
抓“恰好”反应点 判断生成的溶质成分及溶液的酸碱性
抓溶液的“中性”点 判断溶液中溶质的成分及哪种物质过量或不足
抓反应的“过量”点 判断溶液中的溶质,判断哪种物质过量
例如:室温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示。
2.沉淀滴定曲线分析
某温度下,向10 mL 0.01 mol·L-1 PbCl2溶液中滴加0.01 mol·L-1的Na2S溶液,滴加过程中-lg c(Pb2+)与Na2S溶液体积的关系如图所示。
2.(2022·葫芦岛二模)室温下用0.1 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.1 mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法不正确的是( )
A.导电能力:a点溶液>b点溶液
B.b点溶液中c(HB)
D.HA对应曲线上c点溶液呈碱性因是A-+H2O HA+OH-
D [根据图示可知HA为强酸,HB为弱酸,c点时NaOH过量呈碱性,D项错误。]
沉淀滴定曲线分析
3.(2022·莆田模拟)某研究性学习小组用0.1 mol·L-1 AgNO3溶液分别滴定15 mL 0.01 mol·L-1的NaCl、NaBr、NaI溶液,用Ag2S电极监测滴定过程Ag+浓度的变化。测得Ag2S电极的电动势(E)与消耗的AgNO3溶液体积(V)的关系如图所示。已知Ag2S电极的电动势随c(Ag+)的增大而增大。下列说法正确的是( )
A.a点c(Ag+)为0.1 mol·L-1
B.Ag2S的Ksp=c2(Ag+)·c(S2-)
C.滴定NaCl溶液的是曲线①
D.该方法可用于溶液中卤素离子浓度的测定
BC [A项,向溶液中加入0.1 mol·L-1的AgNO3溶液,c(Ag+)都会小于0.1 mol·L-1,错误;D项,由于不知道具体电动势与卤素离子浓度、银离子浓度的具体关系,所以该方法不可用于溶液中卤素离子浓度的测定,D错误。]
4.某温度下,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中溶液中-lg c(Cu2+)和-lg c(Zn2+)与Na2S溶液体积(V)的关系如图所示。[已知:Ksp(ZnS)>Ksp(CuS),lg 3≈0.5],下列说法错误的是( )
A.溶液pH:a
C.a—b—e为滴定CuCl2溶液的曲线
D.d点纵坐标约为33.9
C [已知:Ksp(ZnS)>Ksp(CuS),故终点时-lgc(Zn2+)<-lgc(Cu2+),故a—b—e表示ZnCl2的滴定曲线,C错误。]
考点二 中和滴定的拓展应用
02
核心知能突破
关键能力训练
1.氧化还原滴定
(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
(2)试剂:常见用于滴定的氧化剂有KMnO4、K2Cr2O7等;常见用于滴定的还原剂有亚铁盐、草酸、维生素C等。
(3)指示剂:①涉及I2的常用淀粉溶液;
②涉及Fe3+的常用KSCN溶液;
③涉及高锰酸钾的不用指示剂。
(4)示例:Na2S2O3溶液滴定碘液
原理 2Na2S2O3+I2===Na2S4O6+2NaI
指示剂 用淀粉作指示剂
终点 判断 当滴入最后半滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色,说明到达滴定终点
2. 沉淀滴定
(1)概念:沉淀滴定是利用沉淀反应进行滴定、测量分析的方法,生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-的浓度。
(2)原理:沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时常以CrO 为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。
氧化还原反应滴定
1.(2022·青岛模拟)目前,利用氧化还原滴定原理测定高铁酸钾纯度最为常见的方法是亚铬酸盐法:
准确称取a g高铁酸钾粗品配成V1 mL溶液,取V2 mL该待测液于锥形瓶中,加入浓碱性溶液和过量的三价铬盐。再加稀硫酸和指示剂二苯胺磺酸钠,用c mol·L-1硫酸亚铁铵标准液滴定至溶液颜色由紫色变成浅绿色,即为终点,共消耗标准液V3 mL(假设杂质不参与反应)。
(1)标准液应注入________(填“酸式”或“碱式”)滴定管。
(2)滴定时发生反应的离子方程式为____________________________________
__________________________________________________________。
(3)该粗品中高铁酸钾的质量分数为________(用含字母的代数式表示)。
(4)若硫酸亚铁铵标准液放在空气中时间过长,则测得粗品中高铁酸钾质量分数________(填“偏大”“偏小”或“不变”)。
2.用标准KMnO4溶液滴定待测H2O2水溶液中H2O2含量时,终点现象为___________________________________________________________
_________________________________________________________,
滴定结束读数时俯视读数,测定H2O2的含量________(填“偏大”或“偏小”)。
[答案] 当滴加最后半滴KMnO4溶液时,溶液由无色变为浅红色,且半分钟不褪色 偏小
沉淀滴定
3.莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 AgCl AgBr AgCN Ag2CrO4 AgSCN
颜色 白 浅黄 白 砖红 白
溶解度/ (mol·L-1) 1.34× 10-6 7.1× 10-7 1.1× 10-8 6.5× 10-5 1.0×
10-6
(1)滴定终点的现象是__________________________________________
_________________________________________________________。
(2)若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是________(填字母)。
A.NaCl B.BaBr2 C.Na2CrO4
(3)根据表中数据,Ksp(AgCl)=________(保留2位有效数字)。
[解析] 沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液测定溶液中Cl-的含量时常以CrO 为指示剂,这是因为AgCl比Ag2CrO4更难溶的缘故。(3)S(AgCl)=1.34×10-6,故AgCl的饱和溶液中c(Cl-)=c(Ag+)=1.34×10-6 mol/L,Ksp(AgCl)=(1.34×10-6)2≈1.8×10-12。
[答案] (1)滴入最后半滴标准液时,生成砖红色沉淀且半分钟内不溶解 (2)C (3)1.8×10-12
真题感悟·明确考向
03
1.(2022·湖南选择性考试,T10)室温时,用0.100 mol·L-1的标准AgNO3溶液滴定15.00 mL浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lg c(Ag+)与V(AgNO3)的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17]。下列说法正确的是( )
A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100 mol·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
1
3
2
1
3
2
1
3
2
C [在NaX溶液中,X-发生水解反应:X-+H2O HX+OH-,溶液中存在c(Na+)>c(X-)>c(OH-)>c(H+),A判断正确;等浓度的NaX、NaY、NaZ三种溶液的pH大小关系:NaZ>NaY>NaX,根据“越弱越水解”可知,酸性:HX>HY>HZ,则电离常数关系:Ka(HX)>Ka(HY)>Ka(HZ),B判断正确;pH=7时,根据电荷守恒,三种溶液混合后分别存在c(Cl-)+c(X-)=c(Na+)、c(Cl-)+c(Y-)=c(Na+)、c(Cl-)+c(Z-)=c(Na+),由于三种一元酸的酸性强弱不同,则向其盐溶液中加入HCl的物质的量不同,则c(X-)、c(Y-)、c(Z-)三者不等,C判断错误;分别加入20.00 mL盐酸后,均恰好完全反应,三种溶液的溶质分别为HX与NaCl、HY与NaCl、HZ与NaCl,三种溶液混合后的溶液中存在电荷守恒:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-),D判断正确。]
1
3
2
3.(2022·河北选择性考试)某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
①三颈烧瓶中加入10.00 g香菇样品和400 mL水;锥形瓶中加入125 mL水、1 mL淀粉溶液,并预加0.30 mL 0.010 00 mol·L-1的碘标准溶液,搅拌。
1
3
2
②以0.2 L·min-1流速向三颈烧瓶中通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00 mL碘标准溶液。
③做空白实验,消耗了0.10 mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:Ka1(H3PO4)=7.1×10-3,Ka1(H2SO3)=1.3×10-2。
1
3
2
回答下列问题:
(1)装置图中仪器a、b的名称分别为________、________。
(2)三颈烧瓶适宜的规格为________(填标号)。
A.250 mL B.500 mL C.1 000 mL
(3)解释加入H3PO4,能够生成SO2的原因:
________________________________________________________________________。
1
3
2
(4)滴定管在使用前需要________、洗涤、润洗;滴定终点时溶液的颜色为________;滴定反应的离子方程式为________________________
________________________________________________。
(5)若先加磷酸再通氮气,会使测定结果________(填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为________mg·kg-1(以SO2计,结果保留三位有效数字)。
1
3
2
[解析] 由题中信息可知,检测香菇中添加剂亚硫酸盐的含量的原理是:用过量的磷酸与其中的亚硫酸盐反应生成SO2,用氮气将SO2排入锥形瓶中被水吸收,最后用碘标准溶液滴定,测出样品中亚硫酸盐含量。(2)三颈烧瓶中加入10.00 g香菇样品和400 mL水,向其中加入H3PO4的体积不超过10 mL。在加热时,三颈烧瓶中的液体不能超过其容积的 ,因此,三颈烧瓶适宜的规格为1 000 mL。(5)若先加磷酸再通氮气,则不能将装置中的空气及时排出,有部分亚硫酸盐和SO2被装置中的氧气氧化,碘的标准液的消耗量将减少 ,因此会使测定结果偏低。
1
3
2
1
3
2
1
3
2
谢谢观看 THANK YOU!
同课章节目录
