第46讲 水溶液中陌生图像分点突破(能力课)(共38张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第46讲 水溶液中陌生图像分点突破(能力课)(共38张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 18:04:41 | ||
图片预览










文档简介
(共38张PPT)
第46讲 水溶液中陌生图像分点突破(能力课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.理解分布系数与溶液pH的关系图像及其应用。 2.理解以对数或负对数为坐标的特殊图像分析及应用。
考点一 分布系数曲线的图像分析
核心知能突破
关键能力训练
01
1.单一分布系数曲线
分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。利用图像中交点对应的pH可求pKa(pKa为电离常数的负对数)。
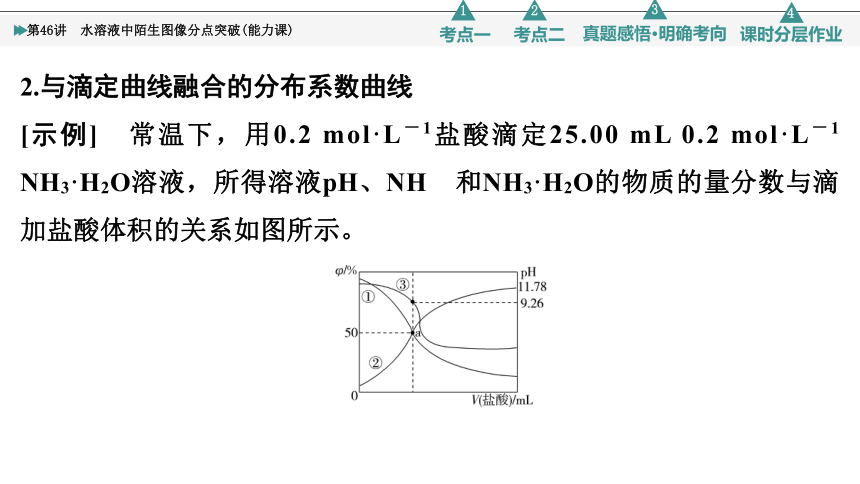
2.与滴定曲线融合的分布系数曲线
[示例] 常温下,用0.2 mol·L-1盐酸滴定25.00 mL 0.2 mol·L-1 NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。
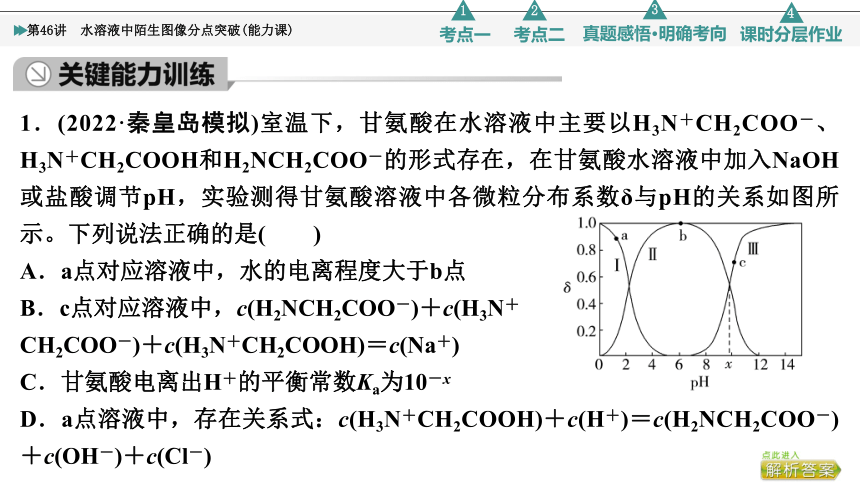
1.(2022·秦皇岛模拟)室温下,甘氨酸在水溶液中主要以H3N+CH2COO-、H3N+CH2COOH和H2NCH2COO-的形式存在,在甘氨酸水溶液中加入NaOH或盐酸调节pH,实验测得甘氨酸溶液中各微粒分布系数δ与pH的关系如图所示。下列说法正确的是( )
A.a点对应溶液中,水的电离程度大于b点
B.c点对应溶液中,c(H2NCH2COO-)+c(H3N+
CH2COO-)+c(H3N+CH2COOH)=c(Na+)
C.甘氨酸电离出H+的平衡常数Ka为10-x
D.a点溶液中,存在关系式:c(H3N+CH2COOH)+c(H+)=c(H2NCH2COO-)+c(OH-)+c(Cl-)
CD [甘氨酸分子中有氨基和羧基,氨基有碱性,在酸性较强的溶液中会结合H+形成H3N+CH2COOH;羧基有酸性,在碱性较强的溶液中会与OH-反应生成H2NCH2COO-和H2O,故随着pH增大,曲线Ⅰ~Ⅲ分别表示H3N+CH2COOH、H3N+CH2COO-、H2NCH2COO-。A项,a点对应溶液是b点对应溶液中加入酸的结果,酸的加入抑制水的电离,故a点对应溶液中水的电离程度小于b点,错误;B项,题给守恒关系式为H2NCH2COONa的物料守恒关系式,题中未给出甘氨酸和加入NaOH的量的关系,故无法判断,错误;C项,甘氨酸的酸式电离为H3N+CH2COO- H2NCH2COO-+H+,Ka= ,当c(H2NCH2COO-)=c(H3N+CH2COO-)时,pH=x,则Ka=c(H+)=10-x,正确;D项,a点对应溶液是向甘氨酸水溶液中加入了盐酸,根据电荷守恒,阴离子还有c(Cl-),即c(H3N+CH2COOH)+c(H+)=c(H2NCH2COO-)+c(OH-)+c(Cl-),正确。]
2.(2022·淄博模拟)溶液中各含氮(或碳)微粒的分布系数δ是指某含氮(或碳)微粒的浓度占各含氮(或碳)微粒浓度之和的百分比。25 ℃时,向0.1 mol·L-1的NH4HCO3溶液(pH=7.8)中滴加适量的盐酸或NaOH溶液,溶液中含氮(或碳)各微粒的分布系数δ与pH的关系如图所示(不考虑溶液中的CO2和NH3分子)。下列说法正确的是( )
A.Kb(NH3·H2O)3.(2022·烟台模拟)25 ℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1 NaOH溶液调节其pH,溶液中H2A、HA-、A2-的物质的量浓度及pH变化如图所示。下列说法错误的是( )
A.25 ℃时,该二元弱酸的Ka1=10-4
B.pH=5时,c(H2A)=100c(A2-)
C.V(NaOH)=0.015 L时,c(Na+)<3c(A2-)
D.加NaOH溶液调pH至12的过程中,水的电离程度一直增大
CD [由图像可知,c(HA-)=c(H2A)时,对应pH=4,c(HA-)=c(A2-)时,对应pH=8,则Ka1=10-4,Ka2=10-8,Ka1×Ka2= =10-12,则pH=5时,c(H+)=10-5 mol·L-1,c(H2A)=100c(A2-),A、B正确;V(NaOH)=0.015 L时,c(HA-)=c(A2-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),该点溶液呈碱性,则c(H+)c(HA-)+2c(A2-),由于此时c(HA-)=c(A2-),则有c(Na+)>3c(A2-),C错误;加NaOH溶液调pH至12的过程中,先生成易水解的盐,水的电离程度先增大,恰好完全反应生成Na2A时水的电离程度最大,随后NaOH过量,水的电离程度减小,D错误。]
考点二 坐标为对数或负对数的图像分析
02
核心知能突破
关键能力训练
1.常见定量关系
2.常见图像示例分析
(1)常温下,二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
(2)常温下将KOH溶液滴入二元弱酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系图:
(3)pOH—pH曲线
1.(2022·黄石模拟)酒石酸(简写为H2R)是葡萄酒中主要的有机酸之一。在25 ℃时,调节25 mL 0.1 mol·L-1酒石酸溶液的pH,溶液中R2-及HR-的pc与pH的关系如图所示(忽略溶液体积变化)。图中pc表示R2-或HR-的浓度负对数(pc=-lg c)。下列有关叙述错误的是( )
A.酒石酸的Ka1约为1×10-3
B.b点:c(HR-)>c(R2-)>c(OH-)
C.由a点经b点到c点的过程中,水的电离程度先增大后减小
D.酒石酸可与Na2CO3溶液反应产生CO2
3.(2022·济南模拟)谷氨酸
真题感悟·明确考向
03
真题 感悟
情境 探究
1
3
2
1
3
2
2.(2020·全国Ⅰ卷,T13)以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。
[比如A2-的分布系数:
下列叙述正确的是( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
1
3
2
C [由题图可知加入40 mL NaOH溶液时达到滴定终点,又H2A为二元酸,则H2A溶液的浓度为0.100 0 mol·L-1,由题图可知,没有加入NaOH溶液时,H2A溶液的pH约为1.0,分析可知H2A第一步完全电离,曲线①代表δ(HA-),曲线②代表δ(A2-),A项错误,B项错误;由题图可知δ(HA-)=δ(A2-)时溶液pH=2.0,即c(HA-)=c(A2-)时溶液pH=2.0,则Ka(HA-)=
=1.0×10-2,C项正确;滴定终点时溶液中存在的离子有Na+、H+、A2-、HA-、OH-,根据电荷守恒有c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时c(H+)1
3
2
3.(2020·山东等级考,T15)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和lg c(OH-)随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=-lg Ka
1
3
2
1
3
2
谢谢观看 THANK YOU!
第46讲 水溶液中陌生图像分点突破(能力课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.理解分布系数与溶液pH的关系图像及其应用。 2.理解以对数或负对数为坐标的特殊图像分析及应用。
考点一 分布系数曲线的图像分析
核心知能突破
关键能力训练
01
1.单一分布系数曲线
分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。利用图像中交点对应的pH可求pKa(pKa为电离常数的负对数)。
2.与滴定曲线融合的分布系数曲线
[示例] 常温下,用0.2 mol·L-1盐酸滴定25.00 mL 0.2 mol·L-1 NH3·H2O溶液,所得溶液pH、NH 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。
1.(2022·秦皇岛模拟)室温下,甘氨酸在水溶液中主要以H3N+CH2COO-、H3N+CH2COOH和H2NCH2COO-的形式存在,在甘氨酸水溶液中加入NaOH或盐酸调节pH,实验测得甘氨酸溶液中各微粒分布系数δ与pH的关系如图所示。下列说法正确的是( )
A.a点对应溶液中,水的电离程度大于b点
B.c点对应溶液中,c(H2NCH2COO-)+c(H3N+
CH2COO-)+c(H3N+CH2COOH)=c(Na+)
C.甘氨酸电离出H+的平衡常数Ka为10-x
D.a点溶液中,存在关系式:c(H3N+CH2COOH)+c(H+)=c(H2NCH2COO-)+c(OH-)+c(Cl-)
CD [甘氨酸分子中有氨基和羧基,氨基有碱性,在酸性较强的溶液中会结合H+形成H3N+CH2COOH;羧基有酸性,在碱性较强的溶液中会与OH-反应生成H2NCH2COO-和H2O,故随着pH增大,曲线Ⅰ~Ⅲ分别表示H3N+CH2COOH、H3N+CH2COO-、H2NCH2COO-。A项,a点对应溶液是b点对应溶液中加入酸的结果,酸的加入抑制水的电离,故a点对应溶液中水的电离程度小于b点,错误;B项,题给守恒关系式为H2NCH2COONa的物料守恒关系式,题中未给出甘氨酸和加入NaOH的量的关系,故无法判断,错误;C项,甘氨酸的酸式电离为H3N+CH2COO- H2NCH2COO-+H+,Ka= ,当c(H2NCH2COO-)=c(H3N+CH2COO-)时,pH=x,则Ka=c(H+)=10-x,正确;D项,a点对应溶液是向甘氨酸水溶液中加入了盐酸,根据电荷守恒,阴离子还有c(Cl-),即c(H3N+CH2COOH)+c(H+)=c(H2NCH2COO-)+c(OH-)+c(Cl-),正确。]
2.(2022·淄博模拟)溶液中各含氮(或碳)微粒的分布系数δ是指某含氮(或碳)微粒的浓度占各含氮(或碳)微粒浓度之和的百分比。25 ℃时,向0.1 mol·L-1的NH4HCO3溶液(pH=7.8)中滴加适量的盐酸或NaOH溶液,溶液中含氮(或碳)各微粒的分布系数δ与pH的关系如图所示(不考虑溶液中的CO2和NH3分子)。下列说法正确的是( )
A.Kb(NH3·H2O)
A.25 ℃时,该二元弱酸的Ka1=10-4
B.pH=5时,c(H2A)=100c(A2-)
C.V(NaOH)=0.015 L时,c(Na+)<3c(A2-)
D.加NaOH溶液调pH至12的过程中,水的电离程度一直增大
CD [由图像可知,c(HA-)=c(H2A)时,对应pH=4,c(HA-)=c(A2-)时,对应pH=8,则Ka1=10-4,Ka2=10-8,Ka1×Ka2= =10-12,则pH=5时,c(H+)=10-5 mol·L-1,c(H2A)=100c(A2-),A、B正确;V(NaOH)=0.015 L时,c(HA-)=c(A2-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),该点溶液呈碱性,则c(H+)
考点二 坐标为对数或负对数的图像分析
02
核心知能突破
关键能力训练
1.常见定量关系
2.常见图像示例分析
(1)常温下,二元弱酸H2Y溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示:
(2)常温下将KOH溶液滴入二元弱酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系图:
(3)pOH—pH曲线
1.(2022·黄石模拟)酒石酸(简写为H2R)是葡萄酒中主要的有机酸之一。在25 ℃时,调节25 mL 0.1 mol·L-1酒石酸溶液的pH,溶液中R2-及HR-的pc与pH的关系如图所示(忽略溶液体积变化)。图中pc表示R2-或HR-的浓度负对数(pc=-lg c)。下列有关叙述错误的是( )
A.酒石酸的Ka1约为1×10-3
B.b点:c(HR-)>c(R2-)>c(OH-)
C.由a点经b点到c点的过程中,水的电离程度先增大后减小
D.酒石酸可与Na2CO3溶液反应产生CO2
3.(2022·济南模拟)谷氨酸
真题感悟·明确考向
03
真题 感悟
情境 探究
1
3
2
1
3
2
2.(2020·全国Ⅰ卷,T13)以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。
[比如A2-的分布系数:
下列叙述正确的是( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
1
3
2
C [由题图可知加入40 mL NaOH溶液时达到滴定终点,又H2A为二元酸,则H2A溶液的浓度为0.100 0 mol·L-1,由题图可知,没有加入NaOH溶液时,H2A溶液的pH约为1.0,分析可知H2A第一步完全电离,曲线①代表δ(HA-),曲线②代表δ(A2-),A项错误,B项错误;由题图可知δ(HA-)=δ(A2-)时溶液pH=2.0,即c(HA-)=c(A2-)时溶液pH=2.0,则Ka(HA-)=
=1.0×10-2,C项正确;滴定终点时溶液中存在的离子有Na+、H+、A2-、HA-、OH-,根据电荷守恒有c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时c(H+)
3
2
3.(2020·山东等级考,T15)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和lg c(OH-)随pH变化的关系如图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=-lg Ka
1
3
2
1
3
2
谢谢观看 THANK YOU!
同课章节目录
