第47讲 沉淀溶解平衡(基础课)(共46张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第47讲 沉淀溶解平衡(基础课)(共46张PPT)-2024届高考化学一轮复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 00:00:00 | ||
图片预览











文档简介
(共46张PPT)
第47讲 沉淀溶解平衡(基础课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.了解沉淀溶解平衡的建立与特征。 2.理解溶度积(Ksp)的表达式、基本计算和应用。 3.理解沉淀溶解平衡影响因素和三种应用(沉淀溶解、生成和转化)。
知识点一 沉淀溶解平衡和溶度积常数
必备知识梳理
关键能力训练
01
1.沉淀溶解平衡
(1)AgCl溶于水中的过程
一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面进入水中,即______过程;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,即______过程。在一定温度下,当沉淀和溶解的速率相等时,得到AgCl的饱和溶液,即建立动态平衡AgCl(s) Ag+(aq)+Cl-(aq)。
溶解
沉淀
(2)沉淀溶解平衡的含义与特征
①含义:在一定温度下的水溶液中,当难溶电解质沉淀和溶解的速率______时,即建立了沉淀溶解平衡。
②四大特征:等—动—定—变。
相等
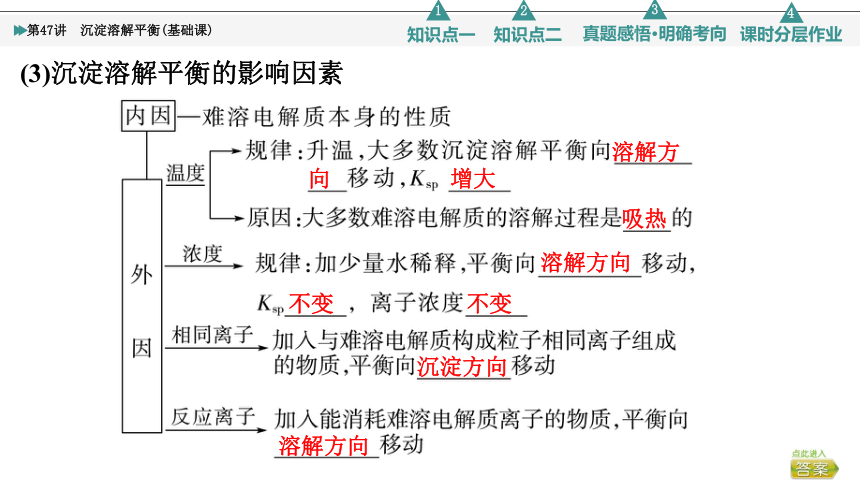
(3)沉淀溶解平衡的影响因素
溶解方
向
增大
吸热
溶解方向
不变
不变
沉淀方向
溶解方向
20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
2.溶度积常数——简称溶度积
(1)溶度积与离子积比较
溶度积 离子积
符号 Ksp Q
表达式 Ksp(AmBn)=______________________,式中的浓度都是平衡时浓度 Q(AmBn)=______________________,
式中的浓度是任意时刻的浓度
cm(An+)·cn(Bm-)
cm(An+)·cn(Bm-)
溶度积 离子积
应用 判断难溶电解质在给定条件下沉淀能否生成或溶解 ①Q>Ksp:溶液过饱和,有______析出 ②Q=Ksp:溶液饱和,处于______状态 ③Q<Ksp:溶液________,无沉淀析出 沉淀
平衡
未饱和
(2)溶度积(Ksp)的意义与影响因素
Ksp反映了难溶电解质在水中的溶解能力,与难溶电解质的性质和______有关,与浓度、酸碱性无关。
绝大多数难溶盐的溶解是______过程,升高温度,平衡向______方向移动,Ksp______。
温度
吸热
溶解
增大
1.判断正误(正确的打“√”,错误的打“×”)
(1)向AgNO3溶液中加过量稀盐酸充分反应,溶液中c(Ag+)=0 mol/L。( )
(2)一定温度下,AgCl在水中的溶解度大于在稀盐酸中的溶解度,但Ksp(AgCl)相同。( )
(3)BaSO4在任何溶液达平衡时,c(Ba2+)=c(SO ),Ksp(BaSO4)不变。( )
(4)Fe(OH)3的溶度积Ksp=c(Fe3+)·c(OH-)。( )
(5)当沉淀溶解平衡移动时,该沉淀的Ksp一定改变。( )
(6)用沉淀法除杂不可能将杂质离子全部通过沉淀除去,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已经完全。( )
[答案] (1)× (2)√ (3)× (4)× (5)× (6)√
沉淀溶解平衡的影响因素
1.下列有关AgCl沉淀溶解平衡的说法中正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
[答案] A
2.已知:常温下,Ksp(BaSO4)=a。取过量BaSO4溶于蒸馏水,过滤得到滤液R溶液。下列有关说法正确的是( )
A.R溶液中c(Ba2+)=a mol·L-1
B.常温下,向R溶液中加入少量Na2SO4固体,产生白色沉淀
C.常温下,向R溶液中加入少量BaCl2固体,Ksp(BaSO4)增大
Ksp的基本计算与应用
3.在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是( )
A.饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B.25 ℃时,FeS的溶解度大于CuS的溶解度
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D.向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
B [A项,c(Cu2+)= ×10-18 mol·L-1,错误;C项,ZnS比FeS难溶,ZnS先沉淀,错误;D项,Ksp只与温度有关,错误。]
4.(1)某温度下,已知Ksp(AgCl)=1.80×10-10,将2.2×10-3 mol·L-1的NaCl和2.0×10-3 mol·L-1 AgNO3等体积混合是否有沉淀生成?写出推理过程。若有沉淀生成,请计算反应后Ag+浓度。______________________。
(2)室温下,Mg(OH)2的Ksp=5×10-13,计算室温下,饱和Mg(OH)2的pH=________。
(3)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO 的浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为________________。
知识点二 沉淀溶解平衡的应用
02
必备知识梳理
关键能力训练
1.沉淀的生成——分离提纯某些离子
(1)调节pH法
如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为________________________________________________。
(2)沉淀剂法
①用沉淀剂Na2S除去废水中的Cu2+、Hg2+,其离子方程式分别为____________________________、____________________________。
②除去某溶液中的SO ,用钡盐而不用钙盐的原因是____________________
__________________________________________________________________。
Cu2++S2-===CuS↓
Hg2++S2-===HgS↓
(2)Mg(OH)2溶于盐酸、NH4Cl溶液的离子方程式分别为_____________
_________________、_______________________________________。
减小
<
溶解
Mg(OH)2+2H+
===Mg2++2H2O
3.沉淀的转化
(1)实验探究
①2 mL 0.1 mol/L NaCl(aq)
黄
黑
②2 mL 0.1 mol/L MgCl2(aq)
(2)规律:一般说来,溶解度小的沉淀容易转化成____________的沉淀。沉淀的溶解度差别越大,越容易转化。但溶解度小的沉淀在一定条件下也可以转化为溶解度大的沉淀。
(3)应用
①锅炉除垢:用Na2CO3溶液处理,将CaSO4转化为CaCO3,离子方程式为______________________________________________。
②矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为____________________________________________。
溶解度更小
沉淀溶解平衡的实验探究
1.为研究沉淀的生成及转化,某小组进行如下实验。
关于该实验的分析不正确的是( )
A.①浊液中存在平衡:AgSCN(s) Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
D [根据信息,①中KSCN量不足,②中说明存在SCN-,因此存在溶解平衡:AgSCN(s) Ag+(aq)+SCN-(aq),故A说法正确,B说法正确;AgI是黄色沉淀,③中现象是有黄色沉淀生成,说明有AgI产生,故C说法正确;可能是浊液中剩余AgNO3,c(I-)×c(Ag+)>Ksp(AgI),出现黄色沉淀,故D说法错误。]
2.某兴趣小组进行下列实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是 ( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH 可能是④中沉淀溶解的原因
C [MgCl2溶液与NaOH溶液等体积混合得到Mg(OH)2悬浊液,剩余NaOH,但仍存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)。实验②中可能是因为剩余的NaOH能和氯化铁反应生成Fe(OH)3,不能比较Fe(OH)3和Mg(OH)2的溶解能力,故C错误。]
沉淀溶解平衡的工业应用
3.化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
4.往锅炉中注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述中正确的是 ( )
A.温度升高,Na2CO3溶液的Kw增大,c(OH-)减小
B.CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C.CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
真题感悟·明确考向
03
真题 感悟
情境 探究
1
3
2
1
3
2
2.(2021·海南等级考,T16节选)(1)25 ℃时,潮湿的石膏雕像表面会发生反应:CaSO4(s)+CO (aq) CaCO3(s)+SO (aq),其平衡常数K=________。[已知Ksp(CaSO4)=9.1×10-6,Ksp(CaCO3)=2.8×10-9]
(2)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因:___________
_________________________________________________________。
1
3
2
1
3
2
1
3
2
(2)(2020·全国Ⅲ卷,T27改编)已知溶液中金属离子开始沉淀和沉淀完全的pH如表所示:
1
3
2
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时 (c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
利用上述表格数据,计算Ni(OH)2的Ksp=________________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是______________(“转化”后的溶液中只有Ni2+和Fe3+,回收Ni2+)。
1
3
2
1
3
2
[答案] (1)8.37
(2)0.01×(107.2-14)2[或10-5×(108.7-14)2] 3.2~6.2
1
3
2
“钡餐”是一种造影剂,用于在X线照射下显示消化道有无病变。可溶性钡盐有毒,医院中常用硫酸钡(俗称“钡餐”)作为内服造影剂,其不溶于水和脂质,所以不会被胃肠道黏膜吸收,因此对人基本无毒性。医院抢救钡离子中毒患者时除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是( )
A.BaCO3的溶度积常数表达式为Ksp(BaCO3)=n(Ba2+)·n(CO )
B.可用2%~5%的Na2SO4溶液给钡离子中毒患者洗胃
C.若误服含c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
谢谢观看 THANK YOU!
第47讲 沉淀溶解平衡(基础课)
第四部分 化学反应原理
第八章 水溶液中的离子反应与平衡
1.了解沉淀溶解平衡的建立与特征。 2.理解溶度积(Ksp)的表达式、基本计算和应用。 3.理解沉淀溶解平衡影响因素和三种应用(沉淀溶解、生成和转化)。
知识点一 沉淀溶解平衡和溶度积常数
必备知识梳理
关键能力训练
01
1.沉淀溶解平衡
(1)AgCl溶于水中的过程
一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面进入水中,即______过程;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,即______过程。在一定温度下,当沉淀和溶解的速率相等时,得到AgCl的饱和溶液,即建立动态平衡AgCl(s) Ag+(aq)+Cl-(aq)。
溶解
沉淀
(2)沉淀溶解平衡的含义与特征
①含义:在一定温度下的水溶液中,当难溶电解质沉淀和溶解的速率______时,即建立了沉淀溶解平衡。
②四大特征:等—动—定—变。
相等
(3)沉淀溶解平衡的影响因素
溶解方
向
增大
吸热
溶解方向
不变
不变
沉淀方向
溶解方向
20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
2.溶度积常数——简称溶度积
(1)溶度积与离子积比较
溶度积 离子积
符号 Ksp Q
表达式 Ksp(AmBn)=______________________,式中的浓度都是平衡时浓度 Q(AmBn)=______________________,
式中的浓度是任意时刻的浓度
cm(An+)·cn(Bm-)
cm(An+)·cn(Bm-)
溶度积 离子积
应用 判断难溶电解质在给定条件下沉淀能否生成或溶解 ①Q>Ksp:溶液过饱和,有______析出 ②Q=Ksp:溶液饱和,处于______状态 ③Q<Ksp:溶液________,无沉淀析出 沉淀
平衡
未饱和
(2)溶度积(Ksp)的意义与影响因素
Ksp反映了难溶电解质在水中的溶解能力,与难溶电解质的性质和______有关,与浓度、酸碱性无关。
绝大多数难溶盐的溶解是______过程,升高温度,平衡向______方向移动,Ksp______。
温度
吸热
溶解
增大
1.判断正误(正确的打“√”,错误的打“×”)
(1)向AgNO3溶液中加过量稀盐酸充分反应,溶液中c(Ag+)=0 mol/L。( )
(2)一定温度下,AgCl在水中的溶解度大于在稀盐酸中的溶解度,但Ksp(AgCl)相同。( )
(3)BaSO4在任何溶液达平衡时,c(Ba2+)=c(SO ),Ksp(BaSO4)不变。( )
(4)Fe(OH)3的溶度积Ksp=c(Fe3+)·c(OH-)。( )
(5)当沉淀溶解平衡移动时,该沉淀的Ksp一定改变。( )
(6)用沉淀法除杂不可能将杂质离子全部通过沉淀除去,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已经完全。( )
[答案] (1)× (2)√ (3)× (4)× (5)× (6)√
沉淀溶解平衡的影响因素
1.下列有关AgCl沉淀溶解平衡的说法中正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
[答案] A
2.已知:常温下,Ksp(BaSO4)=a。取过量BaSO4溶于蒸馏水,过滤得到滤液R溶液。下列有关说法正确的是( )
A.R溶液中c(Ba2+)=a mol·L-1
B.常温下,向R溶液中加入少量Na2SO4固体,产生白色沉淀
C.常温下,向R溶液中加入少量BaCl2固体,Ksp(BaSO4)增大
Ksp的基本计算与应用
3.在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是( )
A.饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B.25 ℃时,FeS的溶解度大于CuS的溶解度
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D.向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
B [A项,c(Cu2+)= ×10-18 mol·L-1,错误;C项,ZnS比FeS难溶,ZnS先沉淀,错误;D项,Ksp只与温度有关,错误。]
4.(1)某温度下,已知Ksp(AgCl)=1.80×10-10,将2.2×10-3 mol·L-1的NaCl和2.0×10-3 mol·L-1 AgNO3等体积混合是否有沉淀生成?写出推理过程。若有沉淀生成,请计算反应后Ag+浓度。______________________。
(2)室温下,Mg(OH)2的Ksp=5×10-13,计算室温下,饱和Mg(OH)2的pH=________。
(3)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO 的浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为________________。
知识点二 沉淀溶解平衡的应用
02
必备知识梳理
关键能力训练
1.沉淀的生成——分离提纯某些离子
(1)调节pH法
如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为________________________________________________。
(2)沉淀剂法
①用沉淀剂Na2S除去废水中的Cu2+、Hg2+,其离子方程式分别为____________________________、____________________________。
②除去某溶液中的SO ,用钡盐而不用钙盐的原因是____________________
__________________________________________________________________。
Cu2++S2-===CuS↓
Hg2++S2-===HgS↓
(2)Mg(OH)2溶于盐酸、NH4Cl溶液的离子方程式分别为_____________
_________________、_______________________________________。
减小
<
溶解
Mg(OH)2+2H+
===Mg2++2H2O
3.沉淀的转化
(1)实验探究
①2 mL 0.1 mol/L NaCl(aq)
黄
黑
②2 mL 0.1 mol/L MgCl2(aq)
(2)规律:一般说来,溶解度小的沉淀容易转化成____________的沉淀。沉淀的溶解度差别越大,越容易转化。但溶解度小的沉淀在一定条件下也可以转化为溶解度大的沉淀。
(3)应用
①锅炉除垢:用Na2CO3溶液处理,将CaSO4转化为CaCO3,离子方程式为______________________________________________。
②矿物转化:CuSO4溶液遇PbS转化为CuS,离子方程式为____________________________________________。
溶解度更小
沉淀溶解平衡的实验探究
1.为研究沉淀的生成及转化,某小组进行如下实验。
关于该实验的分析不正确的是( )
A.①浊液中存在平衡:AgSCN(s) Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
D [根据信息,①中KSCN量不足,②中说明存在SCN-,因此存在溶解平衡:AgSCN(s) Ag+(aq)+SCN-(aq),故A说法正确,B说法正确;AgI是黄色沉淀,③中现象是有黄色沉淀生成,说明有AgI产生,故C说法正确;可能是浊液中剩余AgNO3,c(I-)×c(Ag+)>Ksp(AgI),出现黄色沉淀,故D说法错误。]
2.某兴趣小组进行下列实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是 ( )
A.将①中所得浊液过滤,所得滤液中含少量Mg2+
B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH 可能是④中沉淀溶解的原因
C [MgCl2溶液与NaOH溶液等体积混合得到Mg(OH)2悬浊液,剩余NaOH,但仍存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)。实验②中可能是因为剩余的NaOH能和氯化铁反应生成Fe(OH)3,不能比较Fe(OH)3和Mg(OH)2的溶解能力,故C错误。]
沉淀溶解平衡的工业应用
3.化工生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
4.往锅炉中注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述中正确的是 ( )
A.温度升高,Na2CO3溶液的Kw增大,c(OH-)减小
B.CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C.CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
真题感悟·明确考向
03
真题 感悟
情境 探究
1
3
2
1
3
2
2.(2021·海南等级考,T16节选)(1)25 ℃时,潮湿的石膏雕像表面会发生反应:CaSO4(s)+CO (aq) CaCO3(s)+SO (aq),其平衡常数K=________。[已知Ksp(CaSO4)=9.1×10-6,Ksp(CaCO3)=2.8×10-9]
(2)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因:___________
_________________________________________________________。
1
3
2
1
3
2
1
3
2
(2)(2020·全国Ⅲ卷,T27改编)已知溶液中金属离子开始沉淀和沉淀完全的pH如表所示:
1
3
2
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时 (c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
利用上述表格数据,计算Ni(OH)2的Ksp=________________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是______________(“转化”后的溶液中只有Ni2+和Fe3+,回收Ni2+)。
1
3
2
1
3
2
[答案] (1)8.37
(2)0.01×(107.2-14)2[或10-5×(108.7-14)2] 3.2~6.2
1
3
2
“钡餐”是一种造影剂,用于在X线照射下显示消化道有无病变。可溶性钡盐有毒,医院中常用硫酸钡(俗称“钡餐”)作为内服造影剂,其不溶于水和脂质,所以不会被胃肠道黏膜吸收,因此对人基本无毒性。医院抢救钡离子中毒患者时除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是( )
A.BaCO3的溶度积常数表达式为Ksp(BaCO3)=n(Ba2+)·n(CO )
B.可用2%~5%的Na2SO4溶液给钡离子中毒患者洗胃
C.若误服含c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
谢谢观看 THANK YOU!
同课章节目录
