化学人教版(2019)必修第一册第四章 物质结构 元素周期律 单元复习(共67张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册第四章 物质结构 元素周期律 单元复习(共67张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 21:11:30 | ||
图片预览





文档简介
(共67张PPT)
当你越来越有能力时,自然会有人看得起你;改变自己,你才有自信,梦想才会慢慢的实现。
喷泉之所以漂亮是因为她有了压力;
瀑布之所以壮观是因为她没有了退路;
水之所以能穿石是因为永远在坚持。
《物质结构 元素周期律》素养提升复习
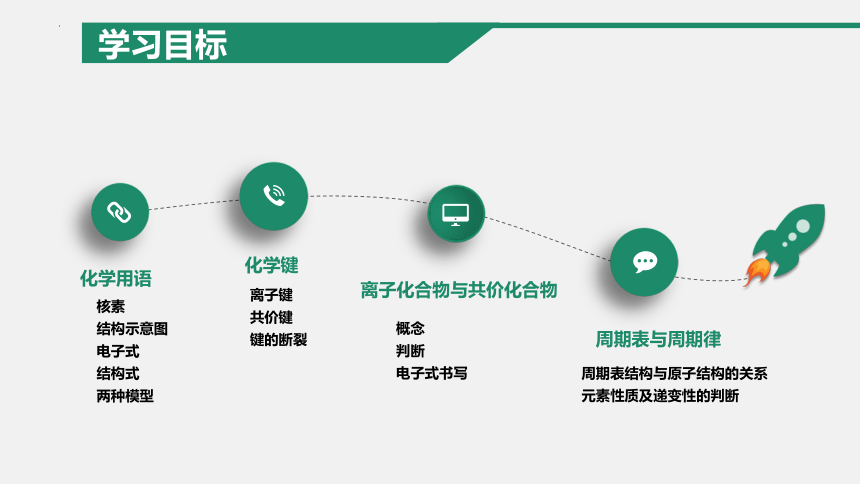
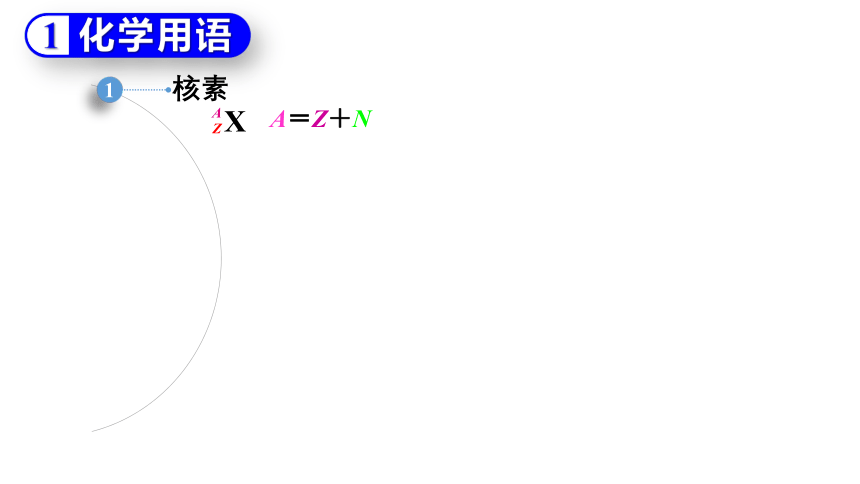
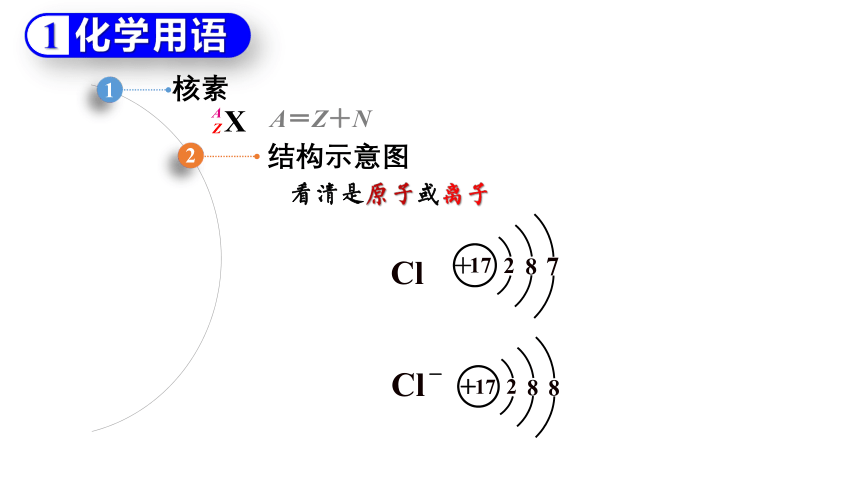
核素
结构示意图
电子式
结构式
两种模型
离子键
共价键
键的断裂
概念
判断
电子式书写
周期表结构与原子结构的关系
元素性质及递变性的判断
化学用语
化学键
离子化合物与共价化合物
周期表与周期律
学习目标
学习目标
1
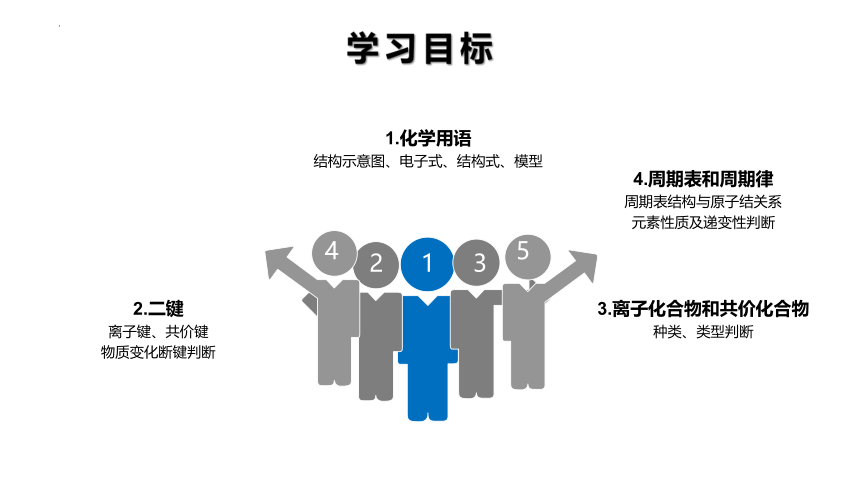
1.化学用语
结构示意图、电子式、结构式、模型
2
2.二键
离子键、共价键
物质变化断键判断
3
3.离子化合物和共价化合物
种类、类型判断
4
5
4.周期表和周期律
周期表结构与原子结关系
元素性质及递变性判断
化学用语的表达有哪些方式?
01
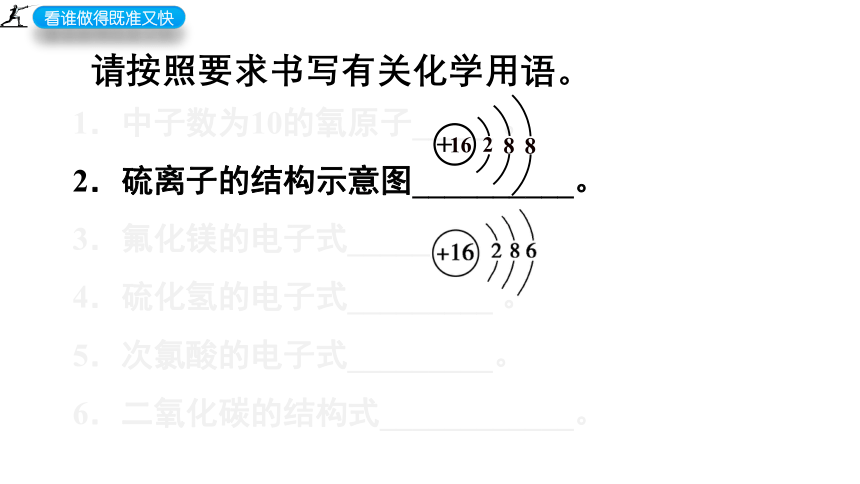
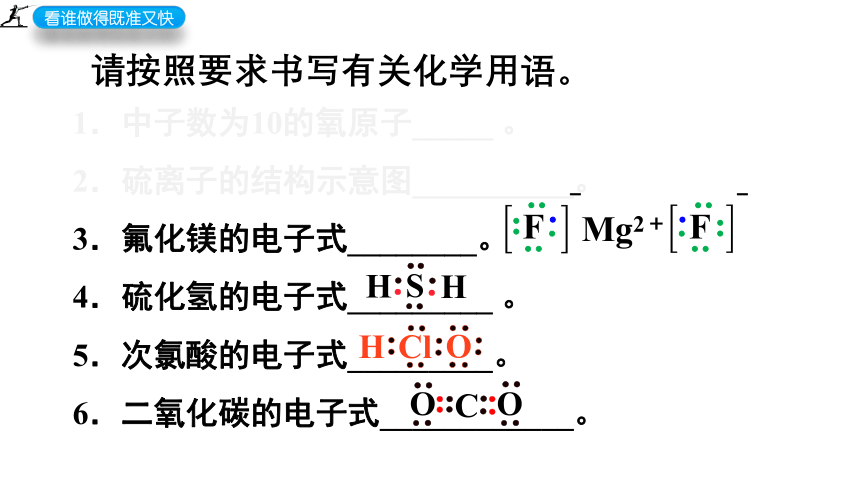
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的结构式____________。
看谁做得既准又快
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的结构式____________。
看谁做得既准又快
O
18
8
化学用语
1
1
核素
A=Z+N
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的结构式____________。
看谁做得既准又快
化学用语
1
1
2
核素
看清是原子或离子
结构示意图
A=Z+N
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的电子式____________。
看谁做得既准又快
F
-
Mg2+
F
-
化学用语
1
1
2
3
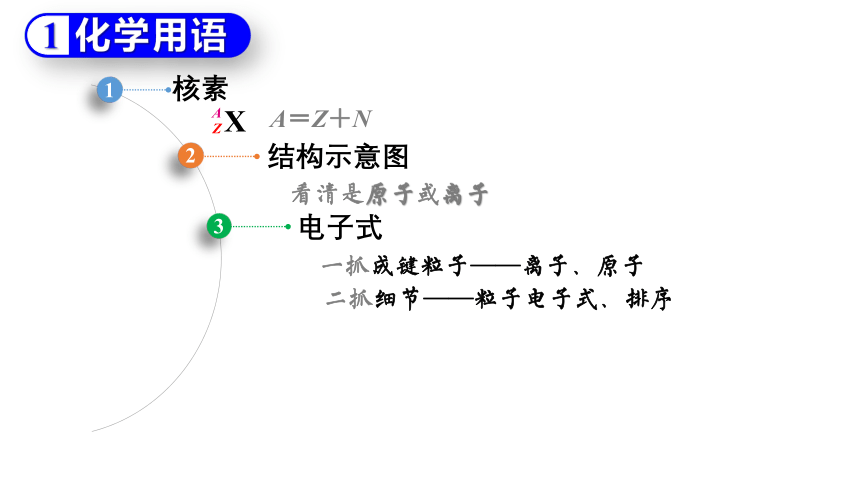
核素
看清是原子或离子
结构示意图
一抓成键粒子——离子、原子
电子式
A=Z+N
二抓细节——粒子电子式、排序
电子式书写
01
不错写 [ ]
02
不“偷”电子
03
不“丢”电子
04
不站错队
写出下列物质的电子式
1. PH3
2. BF3
3. H2O2
4. Na2O2
5. 10电子的二核阴离子
6. 10电子的四核分子
看谁做得既准又快
写出有关物质的结构式
看谁做得既准又快
1. 氮气
2. 氨气
3. 四氯化碳
化学用语
1
1
2
3
4
核素
看清是原子或离子
结构示意图
带相反电荷离子之间的相互作用
电子式
共价分子
结构式
A=Z+N
如H—Cl
写出有关物质的结构式
看谁做得既准又快
H—O—O—H
O=C=O
1. 过氧化氢
2. 二氧化碳
3. 10电子的三核分子
H—O—H
1. H2O分子的球棍模型:
2. CCl4分子的球棍模型:
联想与质疑
化学用语
1
1
2
3
4
5
核素
看清是原子或离子
结构示意图
带相反电荷离子之间的相互作用
电子式
共价分子
结构式
球棍模型和比例模型能表示分子的空间结构
两模型
A=Z+N
温馨提醒
原子的相对大小
分子的形状
即原子在空间的相对位置
A.氢氧根的电子式:
B.CO2分子的球棍模型:
C.质子数为6,质量数为14的原子:
D.HClO的结构式:H—O—Cl
下列化学用语使用正确的是
C.Cl-的结构示意图:
B.HF的电子式:
D.NH4Cl的电子式:
下列表示物质结构的化学用语正确的是
A.8个中子的碳原子:
成功体验
如何判断物质中存在的化学键?
02
阴阳离子
原
子
电子
得失
静电
作用
离子键
离子化合物
形成表示
MgCl2
电离
共用
电子对
共价键
共价化合物
共价单质
形成表示
NH3
2.1 判断
离子键与共价键
2
离子键 共价键
元素
性质
类别
一般为
活泼金属与活泼非金属
非金属与非金属
熔融导电
熔融不导电
活泼金属氧化物
强碱、多数盐、NaH
非金属氧化物及氢化物
酸、个别盐如AlCl3
请判断下列说法是否正确:
1.离子键中只能由活泼的金属和活泼的非金属元素形成
2.共价化合物每个原子必须达到2电子或8电子结构
3.物质中一定存在化学键
4.若熔融时化合物导电,说明含有离子键
考考你自己
一定含有
有且只含有
考考你自己
按照要求各举一物质,并画出电子式:
1.只有离子键
2.只含共价键
3.含有极性键的离子化合物
4.含有非极性键的离子化合物
5.含有极性键的共价化合物
6.含有非极性键的共价化合物
以下反应中,断了哪些化学键?
问题解决
2Na2O2+2CO2=2Na2CO3+O2
2NaHCO3 Na2CO3+CO2↑+H2O
2.2 断裂
离子键和共价键
2
化学反应
1
断键
下列过程中,共价键和离子键均被破坏的是
A.乙醇溶于水
B.KOH融化
C.NaHSO4溶于水
D.HCl气体溶于水
问题解决
E.金刚石的融化
2.2 断裂
离子键和共价键
2
化学反应
1
2
离子化合物及共价化合物电离
断键
3
某些物质的熔化(不电离)
未断键
升华、挥发、液化、吸附、蒸馏
某些物质的熔化,如冰
下列变化过程中,不需要破坏化学键的是
A.加热分解硫化氢
B.硝酸溶于水
C.水通电分解
D.氯气的液化
看我七十二变
根据物质中存在的化学键如何将其进行分类?
03
请判断能力下列说法是否正确:
1.离子化合物中只有离子键
2.非金属元素间不能形成离子化合物
3.共价化合物中可能有离子键
4.共价化合物都是电解质
5.硫酸中含有氢离子
问题解决
如何判断物质是离子化合物或是共价化合物?
离子化合物和共价化合物
3
据元素种类
活泼金属与活泼非金属
1
三判据
一般是离子化合物
2
据类别
离子化合物
强碱、活泼金属氧化物、大多数盐
共价化合物
酸、非金属氧化物及氢化物、少数盐、多数有机物
3
据实验
测熔融状态下的导电性
若导电是离子化合物
下列物质中含有共价键的离子化合物的是
A.SiO2
B.Na2O2
C.MgF2
D.KOH
试一试
某离子化合物中,阳离子和阴离子的电子层结构与氖原子电子层结构相同,则此离子化合物的化学式为
A.MgCl2
B.NaF
C.MgO
D.K2S
深化理解
10电子微粒
1. 原子和离子
2. 分子
OH-
NH4+
哪两种粒子间可发生反应?
NH2-
归纳与整理
18电子微粒
1. 原子和离子
HS-
2. 分子
归纳与整理
下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n:n(Na)>n(Mg)>n(Cl)>n(Br)
看谁做得既准又快
关于周期律和周期表你知道多少?
03
请在下表中填入各族的序号:
1 H
2 Be
3 Mg
4 Ca — — — — — Fe — — Cu Zn Ga Ge
5 Sr — — — — — — — — — Cd In Sn Sb Te
6 Ba — — — — — — — — — Hg Tl Pb Bi Po At
7 Fr Ra — — — — — — — — — 看谁做得既准又快
请在下表中填入主族、0族元素的元素符号:
ⅠA 0
1 H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 Be
3 Mg ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 Ca — — — — — Fe — — — Zn Ga Ge
5 Sr — — — — — — — — — Cd In Sn Sb Te
6 Ba — — — — — — — — — Hg Tl Pb Bi Po At
7 Fr Ra — — — — — — — — — 看谁做得既准又快
请在下表中填入主族、0族元素的元素符号:
ⅠA 0
1 H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 Be
3 Mg ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 Ca — — — — — Fe — — — Zn Ga Ge
5 Sr — — — — — — — — — Cd In Sn Sb Te
6 Ba — — — — — — — — — Hg Tl Pb Bi Po At
7 Fr Ra — — — — — — — — — 看谁做得既准又快
Li
Na
K
Rb
Cs
B
Al
C
Si
N
P
As
O
S
Se
F
Cl
Br
I
He
Ne
Ar
Kr
Xe
Rn
3.1 周期表结构
周期表与周期律
3
3.2 周期表与原子结构关系
周期表与周期律
3
周期数=电子层数(原子)
主族数=最外层电子数(原子)
以下事实能说明氯的非金属性大于硫的是
A.氯是气体,硫是固体
B.HCl的酸性大于H2S
C.H2SO4的酸性大于HClO
D.氯与水反应,硫不与水反应
E .氯气能与硫化钠反应生成硫
F .氯与硫元素能形成SCl2
问题解决
3.3 金属性判断
周期表与周期律
3
反应易则强
02
01
03
金属性
判断
金属单质与水反应的难易
金属单质与酸反应的难易
反应速率快则强
金属元素最高价氧化物
对应的水化物碱性
碱性强则强
金属间的置换反应
04
3.4 非金属性判断
周期表与周期律
3
反应易则强
02
01
03
非金属性
判断
非金属单质与H2反应的难易
非金属氢化物的热稳定性
稳定者则强
最高价氧化物
对应的水化物酸性
酸性强则强
×
非金属间的置换反应
04
右表为元素周期表的一部分。
碳 氮 Y
X 硫 Z
(1)表中元素原子半径最大的是(写元素符号)_____。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是____。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
牛刀小试
下列有关物质的性质比较不正确的是
A.原子半径:钠大于氧
B.稳定性:硅化氢大于氟化氢
C.酸性:硫酸大于磷酸
D.碱性:氢氧化钠大于氢氧化钾
看我七十二变
3.5 周期律
周期表与周期律
3
原子半径
金属性
非金属性
问题解决
(2021年江苏会考)短周期主族元素X、Y、Z的原子序数依次增大:X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是
A.原子半径r(Z)>r(Y)>r(X)
B.X的简单气态氢化物的热稳定性比Z弱
C.X、Y、Z三种元素可形成化合物Y2ZX4
D.Y形成的最高价氧化物的水化物是弱碱
X
Y
Z
O
Na
S
3.6 构、位、性考查
周期表与周期律
3
① 根据题干中的信息——
元素的相对位置、原子结构特点、物质的用途或性质等
判断出各元素
② 画出各元素的相对位置
③ 对各选项进行筛选
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
问题解决
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。
11+1
Y+Y+1
5
4
Y=7
N
O
问题解决
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
下列说法正确的是
Z与W形成的某种物质可能含共价键
X与Z形成的某种物质可能含非极性键
问题解决
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
电子式书写与判断
抓住原子的最外层上的未成对电子数
有关解题提醒
1.化学用语:审清题目的要求
2.键型与物质类型:
①不是所有物质都含有化学键
②非金属元素也可形成离子键
③有的物质中共价键不一定是2电子或8电子的结构
3.周期律与周期表:
①注意要求书写是符号、名称/结构式、电子式
②审题:是氢化物、氧化物/最高价氧化物的水化物
用化学用语表示 NH3+HCl=NH4Cl中的相关微粒,其中正确的是
A.中子数为8 的氮原子:
B.HCl 的电子式:
C.NH3的结构式:
D.Cl 的结构示意图:
成功体验
短周期主族元素X、Y、Z、W的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素。Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族。下列说法正确的是
牛刀小试
Y
X
O
N
Z
Al
W
S
A.原子半径:r(X)<r(Y)<r(Z)<r(W)
B.Y、W组成的某种化合物能形成酸雨
C.W的简单气态氢化物的热稳定性比Y的强
D.常温下Z的单质与W的最高价氧化的水化物不反应
下列说法正确的是
牛刀小试
Y
X
O
N
Z
Al
W
S
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)> r(Z)> r(Y)> r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
成功体验
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。
成功体验
Y
X
Mg
O
Z
Si
W
S
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
成功体验
Y
X
Mg
O
Z
Si
W
S
当你越来越有能力时,自然会有人看得起你;改变自己,你才有自信,梦想才会慢慢的实现。
喷泉之所以漂亮是因为她有了压力;
瀑布之所以壮观是因为她没有了退路;
水之所以能穿石是因为永远在坚持。
《物质结构 元素周期律》素养提升复习
核素
结构示意图
电子式
结构式
两种模型
离子键
共价键
键的断裂
概念
判断
电子式书写
周期表结构与原子结构的关系
元素性质及递变性的判断
化学用语
化学键
离子化合物与共价化合物
周期表与周期律
学习目标
学习目标
1
1.化学用语
结构示意图、电子式、结构式、模型
2
2.二键
离子键、共价键
物质变化断键判断
3
3.离子化合物和共价化合物
种类、类型判断
4
5
4.周期表和周期律
周期表结构与原子结关系
元素性质及递变性判断
化学用语的表达有哪些方式?
01
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的结构式____________。
看谁做得既准又快
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的结构式____________。
看谁做得既准又快
O
18
8
化学用语
1
1
核素
A=Z+N
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的结构式____________。
看谁做得既准又快
化学用语
1
1
2
核素
看清是原子或离子
结构示意图
A=Z+N
请按照要求书写有关化学用语。
1.中子数为10的氧原子_____ 。
2.硫离子的结构示意图__________。
3.氟化镁的电子式________。
4.硫化氢的电子式_________ 。
5.次氯酸的电子式_________。
6.二氧化碳的电子式____________。
看谁做得既准又快
F
-
Mg2+
F
-
化学用语
1
1
2
3
核素
看清是原子或离子
结构示意图
一抓成键粒子——离子、原子
电子式
A=Z+N
二抓细节——粒子电子式、排序
电子式书写
01
不错写 [ ]
02
不“偷”电子
03
不“丢”电子
04
不站错队
写出下列物质的电子式
1. PH3
2. BF3
3. H2O2
4. Na2O2
5. 10电子的二核阴离子
6. 10电子的四核分子
看谁做得既准又快
写出有关物质的结构式
看谁做得既准又快
1. 氮气
2. 氨气
3. 四氯化碳
化学用语
1
1
2
3
4
核素
看清是原子或离子
结构示意图
带相反电荷离子之间的相互作用
电子式
共价分子
结构式
A=Z+N
如H—Cl
写出有关物质的结构式
看谁做得既准又快
H—O—O—H
O=C=O
1. 过氧化氢
2. 二氧化碳
3. 10电子的三核分子
H—O—H
1. H2O分子的球棍模型:
2. CCl4分子的球棍模型:
联想与质疑
化学用语
1
1
2
3
4
5
核素
看清是原子或离子
结构示意图
带相反电荷离子之间的相互作用
电子式
共价分子
结构式
球棍模型和比例模型能表示分子的空间结构
两模型
A=Z+N
温馨提醒
原子的相对大小
分子的形状
即原子在空间的相对位置
A.氢氧根的电子式:
B.CO2分子的球棍模型:
C.质子数为6,质量数为14的原子:
D.HClO的结构式:H—O—Cl
下列化学用语使用正确的是
C.Cl-的结构示意图:
B.HF的电子式:
D.NH4Cl的电子式:
下列表示物质结构的化学用语正确的是
A.8个中子的碳原子:
成功体验
如何判断物质中存在的化学键?
02
阴阳离子
原
子
电子
得失
静电
作用
离子键
离子化合物
形成表示
MgCl2
电离
共用
电子对
共价键
共价化合物
共价单质
形成表示
NH3
2.1 判断
离子键与共价键
2
离子键 共价键
元素
性质
类别
一般为
活泼金属与活泼非金属
非金属与非金属
熔融导电
熔融不导电
活泼金属氧化物
强碱、多数盐、NaH
非金属氧化物及氢化物
酸、个别盐如AlCl3
请判断下列说法是否正确:
1.离子键中只能由活泼的金属和活泼的非金属元素形成
2.共价化合物每个原子必须达到2电子或8电子结构
3.物质中一定存在化学键
4.若熔融时化合物导电,说明含有离子键
考考你自己
一定含有
有且只含有
考考你自己
按照要求各举一物质,并画出电子式:
1.只有离子键
2.只含共价键
3.含有极性键的离子化合物
4.含有非极性键的离子化合物
5.含有极性键的共价化合物
6.含有非极性键的共价化合物
以下反应中,断了哪些化学键?
问题解决
2Na2O2+2CO2=2Na2CO3+O2
2NaHCO3 Na2CO3+CO2↑+H2O
2.2 断裂
离子键和共价键
2
化学反应
1
断键
下列过程中,共价键和离子键均被破坏的是
A.乙醇溶于水
B.KOH融化
C.NaHSO4溶于水
D.HCl气体溶于水
问题解决
E.金刚石的融化
2.2 断裂
离子键和共价键
2
化学反应
1
2
离子化合物及共价化合物电离
断键
3
某些物质的熔化(不电离)
未断键
升华、挥发、液化、吸附、蒸馏
某些物质的熔化,如冰
下列变化过程中,不需要破坏化学键的是
A.加热分解硫化氢
B.硝酸溶于水
C.水通电分解
D.氯气的液化
看我七十二变
根据物质中存在的化学键如何将其进行分类?
03
请判断能力下列说法是否正确:
1.离子化合物中只有离子键
2.非金属元素间不能形成离子化合物
3.共价化合物中可能有离子键
4.共价化合物都是电解质
5.硫酸中含有氢离子
问题解决
如何判断物质是离子化合物或是共价化合物?
离子化合物和共价化合物
3
据元素种类
活泼金属与活泼非金属
1
三判据
一般是离子化合物
2
据类别
离子化合物
强碱、活泼金属氧化物、大多数盐
共价化合物
酸、非金属氧化物及氢化物、少数盐、多数有机物
3
据实验
测熔融状态下的导电性
若导电是离子化合物
下列物质中含有共价键的离子化合物的是
A.SiO2
B.Na2O2
C.MgF2
D.KOH
试一试
某离子化合物中,阳离子和阴离子的电子层结构与氖原子电子层结构相同,则此离子化合物的化学式为
A.MgCl2
B.NaF
C.MgO
D.K2S
深化理解
10电子微粒
1. 原子和离子
2. 分子
OH-
NH4+
哪两种粒子间可发生反应?
NH2-
归纳与整理
18电子微粒
1. 原子和离子
HS-
2. 分子
归纳与整理
下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n:n(Na)>n(Mg)>n(Cl)>n(Br)
看谁做得既准又快
关于周期律和周期表你知道多少?
03
请在下表中填入各族的序号:
1 H
2 Be
3 Mg
4 Ca — — — — — Fe — — Cu Zn Ga Ge
5 Sr — — — — — — — — — Cd In Sn Sb Te
6 Ba — — — — — — — — — Hg Tl Pb Bi Po At
7 Fr Ra — — — — — — — — — 看谁做得既准又快
请在下表中填入主族、0族元素的元素符号:
ⅠA 0
1 H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 Be
3 Mg ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 Ca — — — — — Fe — — — Zn Ga Ge
5 Sr — — — — — — — — — Cd In Sn Sb Te
6 Ba — — — — — — — — — Hg Tl Pb Bi Po At
7 Fr Ra — — — — — — — — — 看谁做得既准又快
请在下表中填入主族、0族元素的元素符号:
ⅠA 0
1 H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 Be
3 Mg ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
4 Ca — — — — — Fe — — — Zn Ga Ge
5 Sr — — — — — — — — — Cd In Sn Sb Te
6 Ba — — — — — — — — — Hg Tl Pb Bi Po At
7 Fr Ra — — — — — — — — — 看谁做得既准又快
Li
Na
K
Rb
Cs
B
Al
C
Si
N
P
As
O
S
Se
F
Cl
Br
I
He
Ne
Ar
Kr
Xe
Rn
3.1 周期表结构
周期表与周期律
3
3.2 周期表与原子结构关系
周期表与周期律
3
周期数=电子层数(原子)
主族数=最外层电子数(原子)
以下事实能说明氯的非金属性大于硫的是
A.氯是气体,硫是固体
B.HCl的酸性大于H2S
C.H2SO4的酸性大于HClO
D.氯与水反应,硫不与水反应
E .氯气能与硫化钠反应生成硫
F .氯与硫元素能形成SCl2
问题解决
3.3 金属性判断
周期表与周期律
3
反应易则强
02
01
03
金属性
判断
金属单质与水反应的难易
金属单质与酸反应的难易
反应速率快则强
金属元素最高价氧化物
对应的水化物碱性
碱性强则强
金属间的置换反应
04
3.4 非金属性判断
周期表与周期律
3
反应易则强
02
01
03
非金属性
判断
非金属单质与H2反应的难易
非金属氢化物的热稳定性
稳定者则强
最高价氧化物
对应的水化物酸性
酸性强则强
×
非金属间的置换反应
04
右表为元素周期表的一部分。
碳 氮 Y
X 硫 Z
(1)表中元素原子半径最大的是(写元素符号)_____。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是____。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
牛刀小试
下列有关物质的性质比较不正确的是
A.原子半径:钠大于氧
B.稳定性:硅化氢大于氟化氢
C.酸性:硫酸大于磷酸
D.碱性:氢氧化钠大于氢氧化钾
看我七十二变
3.5 周期律
周期表与周期律
3
原子半径
金属性
非金属性
问题解决
(2021年江苏会考)短周期主族元素X、Y、Z的原子序数依次增大:X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是
A.原子半径r(Z)>r(Y)>r(X)
B.X的简单气态氢化物的热稳定性比Z弱
C.X、Y、Z三种元素可形成化合物Y2ZX4
D.Y形成的最高价氧化物的水化物是弱碱
X
Y
Z
O
Na
S
3.6 构、位、性考查
周期表与周期律
3
① 根据题干中的信息——
元素的相对位置、原子结构特点、物质的用途或性质等
判断出各元素
② 画出各元素的相对位置
③ 对各选项进行筛选
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
问题解决
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。
11+1
Y+Y+1
5
4
Y=7
N
O
问题解决
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
下列说法正确的是
Z与W形成的某种物质可能含共价键
X与Z形成的某种物质可能含非极性键
问题解决
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
电子式书写与判断
抓住原子的最外层上的未成对电子数
有关解题提醒
1.化学用语:审清题目的要求
2.键型与物质类型:
①不是所有物质都含有化学键
②非金属元素也可形成离子键
③有的物质中共价键不一定是2电子或8电子的结构
3.周期律与周期表:
①注意要求书写是符号、名称/结构式、电子式
②审题:是氢化物、氧化物/最高价氧化物的水化物
用化学用语表示 NH3+HCl=NH4Cl中的相关微粒,其中正确的是
A.中子数为8 的氮原子:
B.HCl 的电子式:
C.NH3的结构式:
D.Cl 的结构示意图:
成功体验
短周期主族元素X、Y、Z、W的原子序数依次增大,X的最高正价与最低负价的代数和为2,Y是地壳中含量最多的元素。Z原子的最外层电子数是Y原子的最外层电子数的一半,W与Y同主族。下列说法正确的是
牛刀小试
Y
X
O
N
Z
Al
W
S
A.原子半径:r(X)<r(Y)<r(Z)<r(W)
B.Y、W组成的某种化合物能形成酸雨
C.W的简单气态氢化物的热稳定性比Y的强
D.常温下Z的单质与W的最高价氧化的水化物不反应
下列说法正确的是
牛刀小试
Y
X
O
N
Z
Al
W
S
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)> r(Z)> r(Y)> r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
成功体验
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。
成功体验
Y
X
Mg
O
Z
Si
W
S
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
成功体验
Y
X
Mg
O
Z
Si
W
S
