化学人教版(2019)必修第一册3.2.2氢氧化铝和铝三角(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2.2氢氧化铝和铝三角(共35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 36.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 21:06:24 | ||
图片预览











文档简介
(共35张PPT)
第三章 铁 金属材料
第二节 金属材料
课时2 氢氧化铝 铝盐
1.掌握氢氧化铝、重要铝盐的性质。
2.认识氢氧化铝的两性,会正确书写氢氧化铝有关
化学及离子方程式。
3.了解氢氧化铝的制备,会正确书写氢氧化铝制备的化学及离子方程式。
4. 掌握铝三角及相互转化的离子方程式。
探究课堂
氢氧化铝的物理性质
白色胶状不溶于水的固体,有较强的吸附性。
1. 氢氧化铝胶体有较强吸附性,可用于净水。
氢氧化铝的用途
探究课堂
2. 氢氧化铝碱性不强,可以用作胃酸中和剂。
推测:氢氧化铝的化学性质?
氢氧化铝的用途
氢氧化铝可与酸溶液反应生成盐和水
生活中常用明矾来净水
十二水硫酸铝钾是一种无机物,又称明矾,化学式为KAl(SO4)2·12H2O,是一种含有结晶水的硫酸钾和硫酸铝的复盐。
明矾可溶于水,发生电离:KAl(SO4)2==K++Al3++2SO42-,电离出的Al3+在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来,生活中常用于净水。
探究课堂
氢氧化铝的化学性质
探究课堂
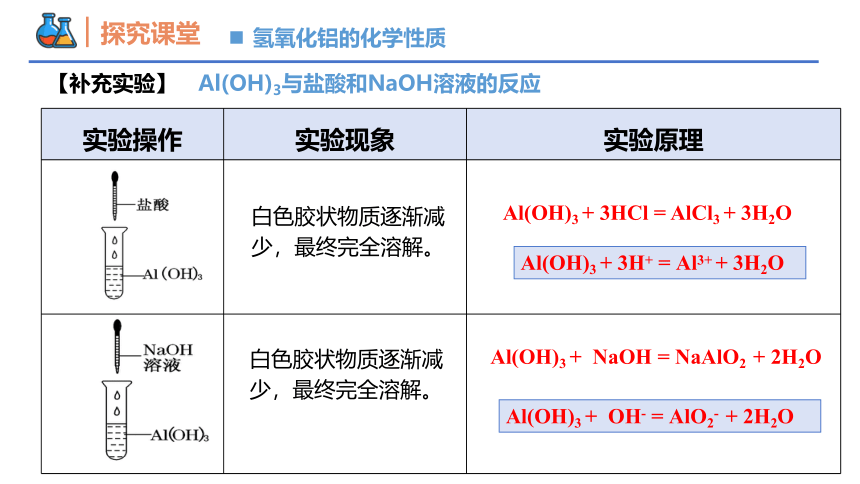
【补充实验】 Al(OH)3与盐酸和NaOH溶液的反应
实验操作 实验现象 实验原理
白色胶状物质逐渐减少,最终完全溶解。
白色胶状物质逐渐减少,最终完全溶解。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
氢氧化铝的化学性质
Al(OH)3 + NaOH = NaAlO2 + 2H2O
探究课堂
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,
叫做两性氢氧化物。
碱式电离,与酸溶液反应生成盐和水
酸式电离,与碱溶液反应生成盐和水
氢氧化铝的化学性质
Al(OH)3
Al(OH)3可以发生两种电离:
H+ + AlO2- + H2O
Al3+ + 3OH-
1.实验室制备:
氢氧化铝
Al(OH)3
向铝盐溶液中加入氨水
试管中产生__________沉淀,
氨水过量时,沉淀________
1.实验室制备:
现象:
白色胶状
原理:
不溶解
补充拓展1:氢氧化铝
Al(OH)3
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
离子方程式
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
向铝盐溶液中加入氨水
交流与讨论:为什么常用氨水与硫酸铝溶液反应制取氢氧化铝,
而不用氢氧化钠溶液呢
①Al3++3OH- = Al(OH)3↓
②Al(OH)3+ OH— = [Al(OH)4]—
Al2(SO4)3+ NaOH,首先发生反应:
当NaOH过量时
所以,生成的Al(OH)3↓会溶于过量的NaOH,不好控制的NaOH用量
注意:Al(OH)3能溶于强酸、强碱,
但不溶于弱酸(如H2CO3)和弱碱(如氨水)
1. 探究氢氧化铝的两性,是适宜的试剂是( )
A.Al、氨水、稀盐酸
B.Al2O3、氨水、稀盐酸
C.AlCl3溶液、NaOH溶液、稀盐酸
D.Na[Al(OH)4]溶液、氨水、稀盐酸
课堂检测
C
2. 要使AlCl3溶液中的Al3+完全转化为Al(OH)3沉淀,选用的合理试剂是:( )
A.NaOH溶液 B.稀氨水
C.澄清石灰水 D.Mg(OH)2
课堂检测
B
3.下列物质既与盐酸反应,又能与氢氧化钠溶液反应的是( )
A.NaHCO3 B.(NH4)2CO3 C. Al(OH)3 D.AlCl3
E.NaHSO4 F. Al2O3 G. Al H.Na2CO3
既可以与强酸反应,又能与强碱溶液反应的物质有:
Al Al2O3 Al(OH)3
如:NaHCO3 NaHSO3 NaHS Na2HPO4等
如:(NH4)2CO3 (NH4)2SO3 CH3COONH4等
√
√
√
√
√
弱酸的铵盐
弱酸的酸式盐
思维拓展
1.4
氢氧化铝受热分解
微点拨
利用此反应可以制备纯净的Al2O3。
Al(OH)3不稳定,受热易分解
2 Al(OH)3 ==== Al2O3 + 3H2O
△
探究课堂
【总结】铝、氧化铝、氢氧化铝与酸或碱的反应
1. 铝
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2. 氧化铝(两性氧化物)
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
3. 氢氧化铝(两性氢氧化物)
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
2.2
氯化铝
1.与强碱反应
(1)与少量氢氧化钠溶液反应
AlCl3+ 3NaOH === Al(OH)3↓+3NaCl
Al3++ 3OH- === Al(OH)3↓
(2)与过量氢氧化钠溶液反应
Al(OH)3 + OH- === [Al(OH)4]-
AlCl3+ 4NaOH === Na[Al(OH)4] + 3NaCl
Al3+ + 4OH- === [Al(OH)4]-
2.2
氯化铝
2.与弱碱反应
与少量或过量氨水反应
AlCl3+ 3NH3 H2O=== Al(OH)3↓+3NH4Cl
Al3++ 3NH3 H2O=== Al(OH)3↓ +3NH4+
2.3
四羟基合铝酸钠
H+ + [Al(OH)4] - === Al(OH)3↓ + H2O
[Al(OH)4] - + 4H+ === Al3+ + 4H2O
1.与强酸反应
(1)与少量盐酸反应
HCl+ Na[Al(OH)4] === Al(OH)3↓+NaCl +H2O
(2)与过量盐酸反应
4HCl+ Na[Al(OH)4] === AlCl3+NaCl + 4H2O
Al(OH)3 + 3H+ === Al3+ + 3H2O
2.3
四羟基合铝酸钠
CO2 + 2[Al(OH)4] - === 2Al(OH)3↓ + H2O
[Al(OH)4] - + CO2 === Al(OH)3↓ + HCO3-
2.与弱酸反应
(1)与少量CO2反应
CO2+ 2Na[Al(OH)4] === 2 Al(OH)3↓+Na2CO3 +H2O
(2)与过量CO2反应
CO2+ Na[Al(OH)4] === Al(OH)3↓+NaHCO3
2.3
四羟基合铝酸钠
3.与AlCl3反应
AlCl3+3Na[Al(OH)4] = 4Al(OH)3↓+3NaCl
Al3++3[Al(OH)4]- = 4Al(OH)3↓
一、铝三角
NaAlO2
AI3+
Al(OH)3
(1 )OH;NH3·H2O
(6) H+
(4)OH-(过量)
(2)OH-
(3) H+(过量)
(5)Al3+、H+、CO2
(5)3NaAlO2+AlCl3 +6H2O =4AI(OH)3↓ AlO2- +H2O +H+ =Al(OH)3↓
NaAlO2 +CO2(足量) +2H2O=NaHCO3 + Al(OH)3↓
(1)AlCl3+3NaOH=3NaCl+Al(OH)3↓;AlCl3+3NH3·H2O==Al(OH)3↓+3NH4Cl
(2)Al(OH)3+NaOH=NaAlO2+2H2O
(3)NaAlO2+4HCl(过量)=NaCl+AlCl3+2H2O
(4)AlCl3+4NaOH=NaAlO2+2H2O+3NaCl
(6)Al(OH)3 +3HCl =AlCl3 +3H2O
互滴原理:滴加顺序不同产生现象不同。
(1)NaOH和AlCl3
(2)HCl和NaAlO2
(3) Na2CO3和HCl
不加其它试剂,仅用试管和胶头滴管区别下列溶液:
【想一想】
二、铝盐与碱反应的图像
实验 NaOH AlCl3 AlCl3 NaOH NH3 H2O
AlCl3
现象
图像
先产生沉淀,后消失
先无沉淀,后产生沉淀
产生沉淀不消失
二、铝盐与碱反应的图像
实验 HCl NaAlO2 NaAlO2 HCl CO2
NaAlO2
现象
图像
先产生沉淀,后消失
先无沉淀,后产生沉淀
产生沉淀不消失
在AlCl3、MgCl2溶液中滴加NaOH溶液
先产生沉淀,后沉淀溶解
2.1
明矾
2KAl(SO4) 2+3Ba(OH)2 = 3BaSO4↓+2Al(OH)3↓+K2SO4
2KAl(SO4)2+4Ba(OH)2 = 4BaSO4↓+2KAlO2+4H2O
2Al3+ + 3SO42- +3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓
Al3+ + 2SO42- +2Ba2++4OH- = 2BaSO4↓+2[Al(OH)4]-
向硫酸铝钾溶液中滴加氢氧化钡溶液至过量发生的反应:
开始时Ba(OH)2少量:
Ba(OH)2过量:
课堂小结
氢氧化铝
物理性质
化学性质
制备
白色胶状不溶于水的固体,有较强的吸附性
用途
氢氧化铝胶体有较强吸附性,可用于净水
氢氧化铝碱性不强,可以用作胃酸中和剂
酸性:
碱性:
不稳定性:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
2Al(OH)3 3Al2O3+3H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
课堂小结
铝盐
铝盐
偏铝酸盐
和盐酸:
和碳酸:
和氢氧化钠:
和氨水:
少碱:Al3+ + 3OH- = Al(OH)3↓
过量碱:Al3+ + 4OH- = AlO2- + 2H2O
少酸:H+ + AlO2- + H2O = Al(OH)3↓
过量酸:AlO2- + 4H+ = Al3+ + 2H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
1. 下列各项操作中,发生“先沉淀后溶解”现象的为:( )
①向饱和Na2CO3溶液中通入过量的CO2
②向NaAlO2中逐滴滴入稀H2SO4至过量
③向石灰水中通入CO2至过量
④CaCl2溶液中通入CO2至过量
A.① B.①②④ C.②③ D.③④
课堂检测
C
2. 下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是:( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.Na[Al(OH)4]和H2SO4 D.浓盐酸和Na2CO3溶液
课堂检测
A
3.向含有H+、Mg2+、Al3+、NH4+的溶液中,逐滴加入NaOH溶液至过量,出现的沉淀量随NaOH溶液的加入如下图,反应的离子方程式依次为
OA段:____________________________;
AB段:____________________________;
____________________________;
BC段:____________________________;
CD段:____________________________;
课堂检测
O
A
B
C
D
NaOH
沉
淀
H+ + OH- =H2O
Mg2+ + 2OH- = Mg(OH)2↓
Al3+ + 3OH- = Al(OH)3↓
NH4+ + OH- = NH3 H2O
Al(OH)3 + OH- = [Al(OH)4]-
4.用铁、铝的混合物进行如下实验:
Fe
H2
NaOH、NaAlO2
FeCl2
H2
过滤
2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe+2H+=Fe2++H2↑
4.用铁、铝的混合物进行如下实验:
Fe
H2
NaOH、NaAlO2
FeCl2
H2
(3)A与Cl2混合光照可能发生爆炸,生成_______
(填化学式),A在该反应中作为__________
(填“氧化剂”或“还原剂”)。
HCl
还原剂
第三章 铁 金属材料
第二节 金属材料
课时2 氢氧化铝 铝盐
1.掌握氢氧化铝、重要铝盐的性质。
2.认识氢氧化铝的两性,会正确书写氢氧化铝有关
化学及离子方程式。
3.了解氢氧化铝的制备,会正确书写氢氧化铝制备的化学及离子方程式。
4. 掌握铝三角及相互转化的离子方程式。
探究课堂
氢氧化铝的物理性质
白色胶状不溶于水的固体,有较强的吸附性。
1. 氢氧化铝胶体有较强吸附性,可用于净水。
氢氧化铝的用途
探究课堂
2. 氢氧化铝碱性不强,可以用作胃酸中和剂。
推测:氢氧化铝的化学性质?
氢氧化铝的用途
氢氧化铝可与酸溶液反应生成盐和水
生活中常用明矾来净水
十二水硫酸铝钾是一种无机物,又称明矾,化学式为KAl(SO4)2·12H2O,是一种含有结晶水的硫酸钾和硫酸铝的复盐。
明矾可溶于水,发生电离:KAl(SO4)2==K++Al3++2SO42-,电离出的Al3+在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来,生活中常用于净水。
探究课堂
氢氧化铝的化学性质
探究课堂
【补充实验】 Al(OH)3与盐酸和NaOH溶液的反应
实验操作 实验现象 实验原理
白色胶状物质逐渐减少,最终完全溶解。
白色胶状物质逐渐减少,最终完全溶解。
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
氢氧化铝的化学性质
Al(OH)3 + NaOH = NaAlO2 + 2H2O
探究课堂
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,
叫做两性氢氧化物。
碱式电离,与酸溶液反应生成盐和水
酸式电离,与碱溶液反应生成盐和水
氢氧化铝的化学性质
Al(OH)3
Al(OH)3可以发生两种电离:
H+ + AlO2- + H2O
Al3+ + 3OH-
1.实验室制备:
氢氧化铝
Al(OH)3
向铝盐溶液中加入氨水
试管中产生__________沉淀,
氨水过量时,沉淀________
1.实验室制备:
现象:
白色胶状
原理:
不溶解
补充拓展1:氢氧化铝
Al(OH)3
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
离子方程式
Al3++3NH3·H2O = Al(OH)3↓+3NH4+
向铝盐溶液中加入氨水
交流与讨论:为什么常用氨水与硫酸铝溶液反应制取氢氧化铝,
而不用氢氧化钠溶液呢
①Al3++3OH- = Al(OH)3↓
②Al(OH)3+ OH— = [Al(OH)4]—
Al2(SO4)3+ NaOH,首先发生反应:
当NaOH过量时
所以,生成的Al(OH)3↓会溶于过量的NaOH,不好控制的NaOH用量
注意:Al(OH)3能溶于强酸、强碱,
但不溶于弱酸(如H2CO3)和弱碱(如氨水)
1. 探究氢氧化铝的两性,是适宜的试剂是( )
A.Al、氨水、稀盐酸
B.Al2O3、氨水、稀盐酸
C.AlCl3溶液、NaOH溶液、稀盐酸
D.Na[Al(OH)4]溶液、氨水、稀盐酸
课堂检测
C
2. 要使AlCl3溶液中的Al3+完全转化为Al(OH)3沉淀,选用的合理试剂是:( )
A.NaOH溶液 B.稀氨水
C.澄清石灰水 D.Mg(OH)2
课堂检测
B
3.下列物质既与盐酸反应,又能与氢氧化钠溶液反应的是( )
A.NaHCO3 B.(NH4)2CO3 C. Al(OH)3 D.AlCl3
E.NaHSO4 F. Al2O3 G. Al H.Na2CO3
既可以与强酸反应,又能与强碱溶液反应的物质有:
Al Al2O3 Al(OH)3
如:NaHCO3 NaHSO3 NaHS Na2HPO4等
如:(NH4)2CO3 (NH4)2SO3 CH3COONH4等
√
√
√
√
√
弱酸的铵盐
弱酸的酸式盐
思维拓展
1.4
氢氧化铝受热分解
微点拨
利用此反应可以制备纯净的Al2O3。
Al(OH)3不稳定,受热易分解
2 Al(OH)3 ==== Al2O3 + 3H2O
△
探究课堂
【总结】铝、氧化铝、氢氧化铝与酸或碱的反应
1. 铝
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2. 氧化铝(两性氧化物)
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
3. 氢氧化铝(两性氢氧化物)
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
2.2
氯化铝
1.与强碱反应
(1)与少量氢氧化钠溶液反应
AlCl3+ 3NaOH === Al(OH)3↓+3NaCl
Al3++ 3OH- === Al(OH)3↓
(2)与过量氢氧化钠溶液反应
Al(OH)3 + OH- === [Al(OH)4]-
AlCl3+ 4NaOH === Na[Al(OH)4] + 3NaCl
Al3+ + 4OH- === [Al(OH)4]-
2.2
氯化铝
2.与弱碱反应
与少量或过量氨水反应
AlCl3+ 3NH3 H2O=== Al(OH)3↓+3NH4Cl
Al3++ 3NH3 H2O=== Al(OH)3↓ +3NH4+
2.3
四羟基合铝酸钠
H+ + [Al(OH)4] - === Al(OH)3↓ + H2O
[Al(OH)4] - + 4H+ === Al3+ + 4H2O
1.与强酸反应
(1)与少量盐酸反应
HCl+ Na[Al(OH)4] === Al(OH)3↓+NaCl +H2O
(2)与过量盐酸反应
4HCl+ Na[Al(OH)4] === AlCl3+NaCl + 4H2O
Al(OH)3 + 3H+ === Al3+ + 3H2O
2.3
四羟基合铝酸钠
CO2 + 2[Al(OH)4] - === 2Al(OH)3↓ + H2O
[Al(OH)4] - + CO2 === Al(OH)3↓ + HCO3-
2.与弱酸反应
(1)与少量CO2反应
CO2+ 2Na[Al(OH)4] === 2 Al(OH)3↓+Na2CO3 +H2O
(2)与过量CO2反应
CO2+ Na[Al(OH)4] === Al(OH)3↓+NaHCO3
2.3
四羟基合铝酸钠
3.与AlCl3反应
AlCl3+3Na[Al(OH)4] = 4Al(OH)3↓+3NaCl
Al3++3[Al(OH)4]- = 4Al(OH)3↓
一、铝三角
NaAlO2
AI3+
Al(OH)3
(1 )OH;NH3·H2O
(6) H+
(4)OH-(过量)
(2)OH-
(3) H+(过量)
(5)Al3+、H+、CO2
(5)3NaAlO2+AlCl3 +6H2O =4AI(OH)3↓ AlO2- +H2O +H+ =Al(OH)3↓
NaAlO2 +CO2(足量) +2H2O=NaHCO3 + Al(OH)3↓
(1)AlCl3+3NaOH=3NaCl+Al(OH)3↓;AlCl3+3NH3·H2O==Al(OH)3↓+3NH4Cl
(2)Al(OH)3+NaOH=NaAlO2+2H2O
(3)NaAlO2+4HCl(过量)=NaCl+AlCl3+2H2O
(4)AlCl3+4NaOH=NaAlO2+2H2O+3NaCl
(6)Al(OH)3 +3HCl =AlCl3 +3H2O
互滴原理:滴加顺序不同产生现象不同。
(1)NaOH和AlCl3
(2)HCl和NaAlO2
(3) Na2CO3和HCl
不加其它试剂,仅用试管和胶头滴管区别下列溶液:
【想一想】
二、铝盐与碱反应的图像
实验 NaOH AlCl3 AlCl3 NaOH NH3 H2O
AlCl3
现象
图像
先产生沉淀,后消失
先无沉淀,后产生沉淀
产生沉淀不消失
二、铝盐与碱反应的图像
实验 HCl NaAlO2 NaAlO2 HCl CO2
NaAlO2
现象
图像
先产生沉淀,后消失
先无沉淀,后产生沉淀
产生沉淀不消失
在AlCl3、MgCl2溶液中滴加NaOH溶液
先产生沉淀,后沉淀溶解
2.1
明矾
2KAl(SO4) 2+3Ba(OH)2 = 3BaSO4↓+2Al(OH)3↓+K2SO4
2KAl(SO4)2+4Ba(OH)2 = 4BaSO4↓+2KAlO2+4H2O
2Al3+ + 3SO42- +3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓
Al3+ + 2SO42- +2Ba2++4OH- = 2BaSO4↓+2[Al(OH)4]-
向硫酸铝钾溶液中滴加氢氧化钡溶液至过量发生的反应:
开始时Ba(OH)2少量:
Ba(OH)2过量:
课堂小结
氢氧化铝
物理性质
化学性质
制备
白色胶状不溶于水的固体,有较强的吸附性
用途
氢氧化铝胶体有较强吸附性,可用于净水
氢氧化铝碱性不强,可以用作胃酸中和剂
酸性:
碱性:
不稳定性:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
2Al(OH)3 3Al2O3+3H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
课堂小结
铝盐
铝盐
偏铝酸盐
和盐酸:
和碳酸:
和氢氧化钠:
和氨水:
少碱:Al3+ + 3OH- = Al(OH)3↓
过量碱:Al3+ + 4OH- = AlO2- + 2H2O
少酸:H+ + AlO2- + H2O = Al(OH)3↓
过量酸:AlO2- + 4H+ = Al3+ + 2H2O
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
1. 下列各项操作中,发生“先沉淀后溶解”现象的为:( )
①向饱和Na2CO3溶液中通入过量的CO2
②向NaAlO2中逐滴滴入稀H2SO4至过量
③向石灰水中通入CO2至过量
④CaCl2溶液中通入CO2至过量
A.① B.①②④ C.②③ D.③④
课堂检测
C
2. 下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是:( )
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.Na[Al(OH)4]和H2SO4 D.浓盐酸和Na2CO3溶液
课堂检测
A
3.向含有H+、Mg2+、Al3+、NH4+的溶液中,逐滴加入NaOH溶液至过量,出现的沉淀量随NaOH溶液的加入如下图,反应的离子方程式依次为
OA段:____________________________;
AB段:____________________________;
____________________________;
BC段:____________________________;
CD段:____________________________;
课堂检测
O
A
B
C
D
NaOH
沉
淀
H+ + OH- =H2O
Mg2+ + 2OH- = Mg(OH)2↓
Al3+ + 3OH- = Al(OH)3↓
NH4+ + OH- = NH3 H2O
Al(OH)3 + OH- = [Al(OH)4]-
4.用铁、铝的混合物进行如下实验:
Fe
H2
NaOH、NaAlO2
FeCl2
H2
过滤
2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe+2H+=Fe2++H2↑
4.用铁、铝的混合物进行如下实验:
Fe
H2
NaOH、NaAlO2
FeCl2
H2
(3)A与Cl2混合光照可能发生爆炸,生成_______
(填化学式),A在该反应中作为__________
(填“氧化剂”或“还原剂”)。
HCl
还原剂
