福建省漳州市华安县2023-2024学年高一上学期10月月考化学试题(部分含解析)
文档属性
| 名称 | 福建省漳州市华安县2023-2024学年高一上学期10月月考化学试题(部分含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 395.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 22:48:09 | ||
图片预览



文档简介
华安县2023-2024学年高一上学期10月月考
化学试卷
姓名:___________班级:___________考号:___________
一、单选题(每题4分)
1.一般情况下,下列物质间的转化,不可能由一步实现的是
A.CuO→Cu(OH)2 B.Fe→FeCl2 C.NaCl→NaNO3 D.SO2→Na2SO3
2.下列化学用语表示不正确的是
A.互为同位素
B.中子数为18的氯原子:
C.的电离方程式:
D.的结构示意图
3.配制一定物质的量浓度的溶液的操作过程示意图如下:
下列说法中错误的是
A.“操作1”需将溶解的溶液及烧杯洗涤液全部转移到容量瓶中
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
D.所配制的溶液中为
4.NA表示阿伏加德罗常数。下列说法正确的是
A.0.5mol L-1的Na2SO4溶液中Na+的个数为NA
B.NA个Cl2分子所占有的体积为22.4L
C.18g中所含有的电子总数为10NA
D.200mL1mol L-1的乙醇(C2H5OH)溶液中所含有的H原子个数为1.2NA
5.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“酸性氧化物—酸—碱—盐”顺序排列的是
A.
B.
C.
D.
6.下列关于淀粉溶液与氯化钠的混合溶液的分离实验(如图)的说法不正确的是( )
A.一段时间后,取烧杯中的液体滴入硝酸、硝酸银混合溶液中,产生白色沉淀
B.一段时间后,取烧杯中的液体滴入碘水溶液中,碘水变蓝
C.这种分离方式叫做渗析
D.半透膜的孔径小于滤纸的孔径
7.下列各组物质,因反应条件(温度或者反应物用量)改变,不会引起产物改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.C和O2
8.VmLAl2SO43溶液中含有Al3mg,取mL该溶液用水稀释至VmL,则稀释后SO物质的量浓度为
A.mol/L B.mol/L C.mol/L D.mol/L
9.相同条件下,下列溶液导电能力最强的是
A.蔗糖水 B.醋酸 C.硫酸钠 D.氨水
10.用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LSO3中含有的分子数为NA
B.标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA
C.18gNH4+所含电子数为11NA
D.含中子的数目为9NA
11.下列物质的水溶液和熔融状态均能导电的是
A.Cl2 B.NaCl C.CH3CH2OH D.H2SO4
12.探究和与碱的反应,实验过程及结果如下。
实验装置 试剂X 实验结果
Ⅰ Ⅱ Ⅲ ①Ⅱ、Ⅲ均产生白色沉淀 ②烧杯中溶液变化如下
蒸馏水 溶液 溶液
已知:越大,越大,溶液碱性越强。下列说法不正确的是
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液的影响
B.Ⅱ和Ⅰ的曲线基本重合,说明与不反应,Ⅱ中发生反应:
C.Ⅲ比Ⅱ的曲线降低,说明与反应,Ⅲ中初期反应为:
D.Ⅲ中石灰水恰好完全反应时,溶液
13.以下实验无法鉴别和两种白色固体的是
A. B.
C. D.
14.下列关于钠及化合物的叙述中,不正确的是
A.高压钠灯可用于道路照明 B.金属钠着火,可用泡沫灭火器灭火
C.可用作抗酸药 D.可用作呼吸面具供氧剂
二、填空题(44分)
15.按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4 (NH4)2CO3 NaHCO3
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是 (填序号,下同);属于电解质的是 ;属于非电解质的是
16.我们知道海带中含有碘元素,工业上常以海带为原料提取碘单质。查有关资料可知碘单质易升华。下面是某校化学探究小组设计的从海带中提取单质碘的实验,请你完成下列实验。
(1)将干燥洁净的海带用酒精润湿后在 (填一种仪器名称)中灼烧成灰烬。
(2)将海带灰冷却至室温,然后转移到烧杯中,加蒸馏水后,搅拌、煮沸冷却、 (填一种操作名称)。
(3)在滤液中滴入几滴稀硫酸,再加入一定量的溶液,把溶液注入分液漏斗中,然后再加入振荡、静置,可以观察到层呈 色。经分液得到碘的溶液,在这一实验过程中,起 作用。
(4)取少量碘的溶液于试管中,然后进行水浴加热,待挥发完即可得到固体碘单质。不用酒精灯直接加热蒸发的原因是 。
(5)证明得到的固体是碘单质的化学方法是 。
17.新冠病毒疫情期间,含氯消毒剂得到了广泛应用。某“84”消毒液部分标签如图所示,,请回答下列问题:
【有效成分】NaClO 【质量分数】24%
【密度】1.18g cm-3 【净含量】1000mL
【注意事项】……
(1)计算该“84”消毒液的物质的量浓度为 (保留小数点后一位);
(2)现需用的的消毒液,需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还需要 ;
(3)下列情况会使所配溶液浓度偏低的是 (填序号);
①溶液未经冷却即转移至容量瓶并定容
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容摇匀后,发现液面降低,又补加少量水,重新达到刻度线
⑤定容时,仰视容量瓶的刻度线
18.某同学帮助水质监测站配制480mL0.5mol L-1的NaOH溶液以备使用。
(1)该同学应选择的玻璃仪器包括烧杯、量筒、玻璃棒、 、 。
(2)用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在如图中选出能正确表示游码位置的选项 。
附表:砝码规格
a b c d e
陆码大小/g 100 50 20 10 5
A. B. C.
(3)下列操作对所配溶液的浓度大小有何影响?(填“偏大”“偏小”或“无影响”)
①转移溶液的过程中,少量液体溅出来,浓度会 ;
②容量瓶未干燥,浓度会 ;
③定容时,俯视读数,浓度会 。
高一化学参考答案:
1.A2.A3.C4.C5.A6.B7.C8.B9.C10.D11.B12.D13.B14.B
15. NaHSO4= Na++H++SO (NH4)2CO3=2NH+CO NaHCO3= Na++HCO ①④⑨ ③⑤⑦⑧ ②⑥⑩
16. 坩埚 过滤 紫红 萃取 酒精灯直接加热时的温度高,单质碘易升华,会损失碘 取得到的固体少许,将其加入淀粉溶液中,淀粉溶液变蓝,即可证明所得固体为碘单质(其他方法合理也可)
17.(1)3.8
(2)500mL容量瓶、胶头滴管
(3)②④⑤
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签;
(1)由可知密度为1.18g/cm3质量分数为24%的NaClO溶液的物质的量浓度为mol/L=3.8mol /L;
(2)配制的的消毒液,需要使用500mL的容量瓶,故玻璃仪器除了烧杯、玻璃棒、量筒外,还需要500mL容量瓶、胶头滴管;
(3)①溶液未经冷却即转移至容量瓶并定容,由于热胀冷缩,会使所配溶液体积偏小,浓度偏高,①不符合题意;
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,会使溶质有所损失,从而使所配溶液浓度偏低,②符合题意;
③转移溶液前容量瓶内有少量蒸馏水,对所配溶液浓度无影响,因为定容时还要再加蒸馏水,③不符合题意;
④定容摇匀后,发现液面降低,又补加少量水,重新达到刻度线,会使所配溶液体积偏大,浓度偏低,④符合题意;
⑤定容时,仰视容量瓶的刻度线,会使所配溶液体积偏大,浓度偏低,⑤符合题意;
答案选②④⑤。
18.(1) 500mL容量瓶 胶头滴管
(2) cd C
(3) 偏小 无影响 偏大
解(1)该同学选择仪器时,按就近原则,应选择500mL的容量瓶,则所选玻璃仪器包括烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管。
(2)配制500mL0.5mol L-1的NaOH溶液时,所需NaOH固体的质量为0.5L×0.5mol L-1×40g/mol=10.0g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,应称取33.1g,则选取所需的砝码大小为30g,故选cd,游码在3.1g的位置,则能正确表示游码位置的选项为C。
(3)①转移溶液的过程中,少量液体溅出来,则溶质减少,溶液浓度会偏小;
②容量瓶未干燥,对溶质的物质的量、溶液的体积都不造成影响,则溶液的浓度会无影响;
③定容时,俯视读数,所配溶液体积偏小,溶液的浓度会偏大。
化学试卷
姓名:___________班级:___________考号:___________
一、单选题(每题4分)
1.一般情况下,下列物质间的转化,不可能由一步实现的是
A.CuO→Cu(OH)2 B.Fe→FeCl2 C.NaCl→NaNO3 D.SO2→Na2SO3
2.下列化学用语表示不正确的是
A.互为同位素
B.中子数为18的氯原子:
C.的电离方程式:
D.的结构示意图
3.配制一定物质的量浓度的溶液的操作过程示意图如下:
下列说法中错误的是
A.“操作1”需将溶解的溶液及烧杯洗涤液全部转移到容量瓶中
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
D.所配制的溶液中为
4.NA表示阿伏加德罗常数。下列说法正确的是
A.0.5mol L-1的Na2SO4溶液中Na+的个数为NA
B.NA个Cl2分子所占有的体积为22.4L
C.18g中所含有的电子总数为10NA
D.200mL1mol L-1的乙醇(C2H5OH)溶液中所含有的H原子个数为1.2NA
5.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“酸性氧化物—酸—碱—盐”顺序排列的是
A.
B.
C.
D.
6.下列关于淀粉溶液与氯化钠的混合溶液的分离实验(如图)的说法不正确的是( )
A.一段时间后,取烧杯中的液体滴入硝酸、硝酸银混合溶液中,产生白色沉淀
B.一段时间后,取烧杯中的液体滴入碘水溶液中,碘水变蓝
C.这种分离方式叫做渗析
D.半透膜的孔径小于滤纸的孔径
7.下列各组物质,因反应条件(温度或者反应物用量)改变,不会引起产物改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.C和O2
8.VmLAl2SO43溶液中含有Al3mg,取mL该溶液用水稀释至VmL,则稀释后SO物质的量浓度为
A.mol/L B.mol/L C.mol/L D.mol/L
9.相同条件下,下列溶液导电能力最强的是
A.蔗糖水 B.醋酸 C.硫酸钠 D.氨水
10.用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LSO3中含有的分子数为NA
B.标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA
C.18gNH4+所含电子数为11NA
D.含中子的数目为9NA
11.下列物质的水溶液和熔融状态均能导电的是
A.Cl2 B.NaCl C.CH3CH2OH D.H2SO4
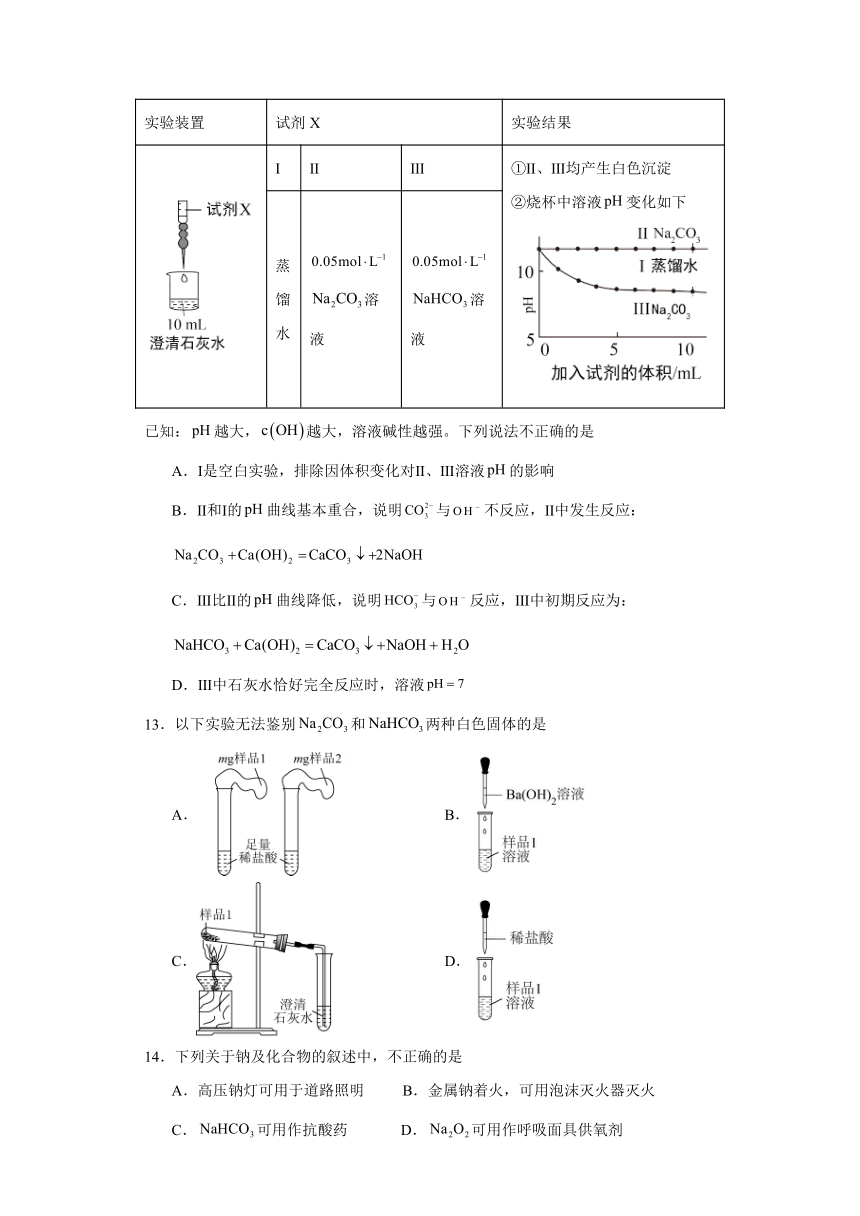
12.探究和与碱的反应,实验过程及结果如下。
实验装置 试剂X 实验结果
Ⅰ Ⅱ Ⅲ ①Ⅱ、Ⅲ均产生白色沉淀 ②烧杯中溶液变化如下
蒸馏水 溶液 溶液
已知:越大,越大,溶液碱性越强。下列说法不正确的是
A.Ⅰ是空白实验,排除因体积变化对Ⅱ、Ⅲ溶液的影响
B.Ⅱ和Ⅰ的曲线基本重合,说明与不反应,Ⅱ中发生反应:
C.Ⅲ比Ⅱ的曲线降低,说明与反应,Ⅲ中初期反应为:
D.Ⅲ中石灰水恰好完全反应时,溶液
13.以下实验无法鉴别和两种白色固体的是
A. B.
C. D.
14.下列关于钠及化合物的叙述中,不正确的是
A.高压钠灯可用于道路照明 B.金属钠着火,可用泡沫灭火器灭火
C.可用作抗酸药 D.可用作呼吸面具供氧剂
二、填空题(44分)
15.按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4 (NH4)2CO3 NaHCO3
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是 (填序号,下同);属于电解质的是 ;属于非电解质的是
16.我们知道海带中含有碘元素,工业上常以海带为原料提取碘单质。查有关资料可知碘单质易升华。下面是某校化学探究小组设计的从海带中提取单质碘的实验,请你完成下列实验。
(1)将干燥洁净的海带用酒精润湿后在 (填一种仪器名称)中灼烧成灰烬。
(2)将海带灰冷却至室温,然后转移到烧杯中,加蒸馏水后,搅拌、煮沸冷却、 (填一种操作名称)。
(3)在滤液中滴入几滴稀硫酸,再加入一定量的溶液,把溶液注入分液漏斗中,然后再加入振荡、静置,可以观察到层呈 色。经分液得到碘的溶液,在这一实验过程中,起 作用。
(4)取少量碘的溶液于试管中,然后进行水浴加热,待挥发完即可得到固体碘单质。不用酒精灯直接加热蒸发的原因是 。
(5)证明得到的固体是碘单质的化学方法是 。
17.新冠病毒疫情期间,含氯消毒剂得到了广泛应用。某“84”消毒液部分标签如图所示,,请回答下列问题:
【有效成分】NaClO 【质量分数】24%
【密度】1.18g cm-3 【净含量】1000mL
【注意事项】……
(1)计算该“84”消毒液的物质的量浓度为 (保留小数点后一位);
(2)现需用的的消毒液,需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还需要 ;
(3)下列情况会使所配溶液浓度偏低的是 (填序号);
①溶液未经冷却即转移至容量瓶并定容
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容摇匀后,发现液面降低,又补加少量水,重新达到刻度线
⑤定容时,仰视容量瓶的刻度线
18.某同学帮助水质监测站配制480mL0.5mol L-1的NaOH溶液以备使用。
(1)该同学应选择的玻璃仪器包括烧杯、量筒、玻璃棒、 、 。
(2)用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在如图中选出能正确表示游码位置的选项 。
附表:砝码规格
a b c d e
陆码大小/g 100 50 20 10 5
A. B. C.
(3)下列操作对所配溶液的浓度大小有何影响?(填“偏大”“偏小”或“无影响”)
①转移溶液的过程中,少量液体溅出来,浓度会 ;
②容量瓶未干燥,浓度会 ;
③定容时,俯视读数,浓度会 。
高一化学参考答案:
1.A2.A3.C4.C5.A6.B7.C8.B9.C10.D11.B12.D13.B14.B
15. NaHSO4= Na++H++SO (NH4)2CO3=2NH+CO NaHCO3= Na++HCO ①④⑨ ③⑤⑦⑧ ②⑥⑩
16. 坩埚 过滤 紫红 萃取 酒精灯直接加热时的温度高,单质碘易升华,会损失碘 取得到的固体少许,将其加入淀粉溶液中,淀粉溶液变蓝,即可证明所得固体为碘单质(其他方法合理也可)
17.(1)3.8
(2)500mL容量瓶、胶头滴管
(3)②④⑤
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签;
(1)由可知密度为1.18g/cm3质量分数为24%的NaClO溶液的物质的量浓度为mol/L=3.8mol /L;
(2)配制的的消毒液,需要使用500mL的容量瓶,故玻璃仪器除了烧杯、玻璃棒、量筒外,还需要500mL容量瓶、胶头滴管;
(3)①溶液未经冷却即转移至容量瓶并定容,由于热胀冷缩,会使所配溶液体积偏小,浓度偏高,①不符合题意;
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,会使溶质有所损失,从而使所配溶液浓度偏低,②符合题意;
③转移溶液前容量瓶内有少量蒸馏水,对所配溶液浓度无影响,因为定容时还要再加蒸馏水,③不符合题意;
④定容摇匀后,发现液面降低,又补加少量水,重新达到刻度线,会使所配溶液体积偏大,浓度偏低,④符合题意;
⑤定容时,仰视容量瓶的刻度线,会使所配溶液体积偏大,浓度偏低,⑤符合题意;
答案选②④⑤。
18.(1) 500mL容量瓶 胶头滴管
(2) cd C
(3) 偏小 无影响 偏大
解(1)该同学选择仪器时,按就近原则,应选择500mL的容量瓶,则所选玻璃仪器包括烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管。
(2)配制500mL0.5mol L-1的NaOH溶液时,所需NaOH固体的质量为0.5L×0.5mol L-1×40g/mol=10.0g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,应称取33.1g,则选取所需的砝码大小为30g,故选cd,游码在3.1g的位置,则能正确表示游码位置的选项为C。
(3)①转移溶液的过程中,少量液体溅出来,则溶质减少,溶液浓度会偏小;
②容量瓶未干燥,对溶质的物质的量、溶液的体积都不造成影响,则溶液的浓度会无影响;
③定容时,俯视读数,所配溶液体积偏小,溶液的浓度会偏大。
同课章节目录
