广东省揭阳市普宁市重点中学2023-2024学年高三上学期10月期中考试化学试题(含答案)
文档属性
| 名称 | 广东省揭阳市普宁市重点中学2023-2024学年高三上学期10月期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 712.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-03 22:49:37 | ||
图片预览



文档简介
普宁市重点中学2023-2024学年高三上学期10月期中考试
化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Fe-56 Mn-55 Ba-137
一、选择题:本题共16小题,1-10每小题2分,11-16每题4分,每小题只有一个选项符合题目要求。
1.化学来源于生活,下列关于宣纸的传统制作工艺主要发生化学变化的是( )
A.挑选原料 B.加碱蒸煮 C.竹帘捞纸 D.剪裁纸张
2.生活因化学更美好。下列对化学物质在生活中的用途的知识解读正确的是( )
选项 生活中的用途 知识解读
A 浸泡过溶液的硅土用作水果保鲜剂 溶液具有强氧化性
B 面包师用小苏打作发泡剂烘焙面包 小苏打受热稳定、不易分解
C 用石灰石处理酸性废水 石灰石属于强碱,具有碱性
D 镁铝合金用于制作阳台门窗 镁铝合金密度大、强度高、耐腐蚀
3.在酸性或者接近中性的条件下,易发生歧化反应,将通入溶液中,其反应为。下列有关说法错误的是( )
A.的空间结构为平面三角形
B.中心原子的杂化方式是
C.基态钾原子的价电子排布式:
D.基态的价电子轨道表示式:
4.下列颜色变化与氧化还原反应无关的是( )
A.新切开的苹果在空气中变黄,最终变为褐色
B.白色的硫酸铜固体放置在空气中变为蓝色
C.淡黄绿色的新制氯水久置后变为无色
D.淡黄色的固体放置在空气中,一段时间后变成白色
5.天然海水中主要含有、、、、、、、等离子。火力发电时燃煤排放的含的烟气可利用海水脱硫,其工艺流程如图所示。下列说法错误的是( )
A.“氧化”时,溶液的pH减小
B.“反应、稀释”时会有气体放出,此气体为
C.天然海水呈弱碱性的原因之一:
D.实验中,可用饱和溶液除去中的杂质
6.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实验的检验,才能确定其正确与否。下列类推结论中正确的是( )
A.极易溶于水,也极易溶于水
B.为分子晶体,也为分子晶体
C.是非极性分子,也是非极性分子
D.分子的空间结构为直线形,分子的空间结构也为直线形
7.在给定条件下,下列物质间的转化均能一步实现的是( )
A.
B.
C.
D.
8.下列实验中,能够正确描述反应的离子方程式的是( )
A.磁性氧化铁溶于稀:
B.海水提溴工艺中,用纯碱溶液富集:
C.用石灰乳制漂白粉:
D.用足量的碱性溶液除去水中的:
9.某实验小组欲从海带中制取少量的碘,设计了如下实验流程:
海带→海带灰→海带灰悬浊液→含碘澄清液→氧化→含的溶液→的溶液→单质碘,下列实验装置在该方案中无须使用的是( )
A. B. C. D.
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y相邻且同周期,同周期元素基态原子中X的核外末成对电子数最多,Z元素基态原子的最高能级电子数是Y元素基态原子的最低能级电子数的一半,W在元素周期表中的周期数与族序数相等。下列有关说法错误的是( )
A.第一电离能:ZB.X、Y两种元素中,Y的非金属性最强
C.X的最简单氢化物能与其最高价氧化物对应的水化物反应
D.X、Z、W元素的最高价氧化物对应的水化物之间可以相互反应
11.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.0.4mol白磷(,正四面体结构)含共价键的数目为1.2
B.0.1mol 与0.1mol 反应,生成的分子数为0.1
C.常温下,将2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3
D.常温常压下,2.2g由和组成的混合气体中含有的原子总数为0.15
12.下列实验操作与现象和结论对应正确的是( )
实验操作与现象 结论
A 加热盛有少量固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 显碱性
B 向某溶液中先加入氯化钡溶液,再滴入盐酸,先产生白色沉淀,后白色沉淀不消失 该溶液中可能含有
C 将晶体溶于稀硫酸,再滴加KSCN溶液,溶液变红 晶体已氧化变质
D 向2支盛有2mL不同浓度溶液的试管中同时加入221mL 2%溶液,未观察到明显的实验现象差异 浓度对反应速率的影响不大
13.类比法是一种学习化学的重要方法。下列说法错误的是( )
A.溶液显碱性,则溶液显碱性
B.为三角锥形分子,则为三角锥形分子
C.与水反应生成乙炔,则与水反应生成丙炔
D.酸性强于,则酸性强于
14.有机物M是重要的药物合成中间体。下列关于有机物M的说法错误的是( )
A.分子中所有的原子不可能共平面
B.能与发生显色反应
C.1mol有机物M最多能与22mol 发生加成反应
D.分子中的碳原子有2种杂化方式
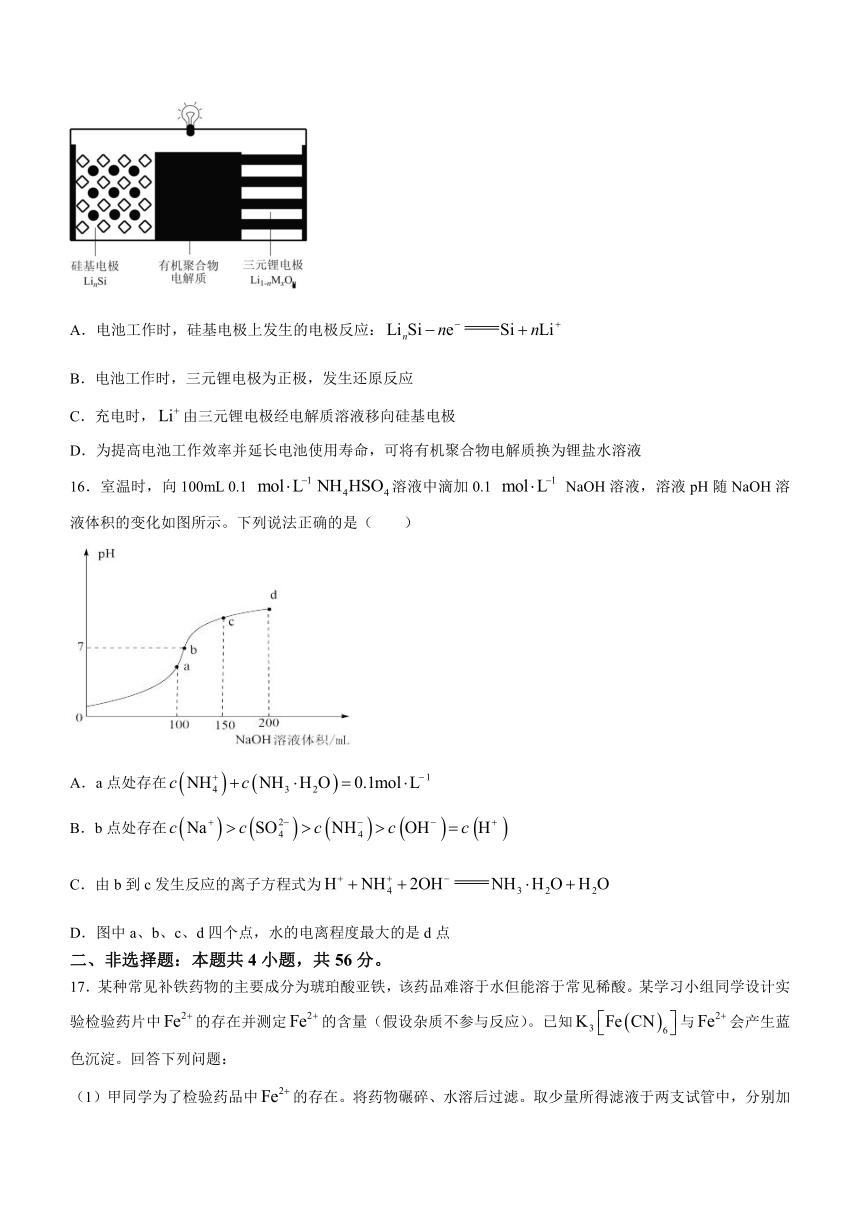
15.纳米硅基锂电池是一种新型二次电池,电池装置如图所示,电池充电时,三元锂电极上发生的电极反应为。下列说法错误的是( )
A.电池工作时,硅基电极上发生的电极反应:
B.电池工作时,三元锂电极为正极,发生还原反应
C.充电时,由三元锂电极经电解质溶液移向硅基电极
D.为提高电池工作效率并延长电池使用寿命,可将有机聚合物电解质换为锂盐水溶液
16.室温时,向100mL 0.1 溶液中滴加0.1 NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
A.a点处存在
B.b点处存在
C.由b到c发生反应的离子方程式为
D.图中a、b、c、d四个点,水的电离程度最大的是d点
二、非选择题:本题共4小题,共56分。
17.某种常见补铁药物的主要成分为琥珀酸亚铁,该药品难溶于水但能溶于常见稀酸。某学习小组同学设计实验检验药片中的存在并测定的含量(假设杂质不参与反应)。已知与会产生蓝色沉淀。回答下列问题:
(1)甲同学为了检验药品中的存在。将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时进行的下列操作不规范的是______(填标号)。
a.用玻璃棒在漏斗中搅动以加快过滤速率
b.滤纸边缘高于漏斗边缘
c.将滤纸润湿,使其紧贴漏斗内壁
②滤液加入溶液或KSCN溶液中均未出现明显现象,其主要原因为______。
(2)乙同学设计如下实验测定药片中的含量。
步骤一:取本药品10片,碾碎后加入一定浓度的稀硫酸,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量溶液后,再加入过量NaOH溶液,产生沉淀,将沉淀过滤出来后洗涤、干燥,灼烧至固体质量恒定,得0.64g固体。
①步骤二中,量取20.00mL溶液应使用的仪器为______(填“酸式滴定管”、“碱式滴定管”或“25mL量筒”)。
②步骤三中,加入溶液时发生反应的离子方程式为______,灼烧后所得固体的颜色为______。
③若将步骤三中的溶液换为也能达到目的,但使用溶液的好处是______。
④由实验数据计算,每片药片中含______mg 。
(3)也可用作补铁剂,使用时建议与维生素C同服,甲同学猜测维生素C可将转化为,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案 实验现象
取适量溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 紫色褪去
由上述实验能否得出“维生素C可将转化为”的结论?回答并说明理由:______。
18.碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(,含有和少量等杂质)为原料制备碱式碳酸铜的流程如图所示:
已知:,为无色液体,是硫、磷、硒、溴、碘、樟脑等的良好溶剂,具有挥发性。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______(任写一种)。
(2)滤渣Ⅰ经提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是______(填化学式)。由回收滤渣I中的淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是______。
(3)“除铁”时检验是否除尽时常用的化学试剂______。
(4)写出“沉锰”(除)过程中反应的离子方程式:______。
(5)“赶氨”时,最适宜的操作方法是______。
(6)测定副产品样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为______(保留到小数点后两位)
19.碳中和作为一种新型环保形式,目前已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
Ⅱ.逆水汽变换:
Ⅲ.甲醇脱水:
工艺2:利用直接加氢合成(反应Ⅳ)
①反应Ⅳ的热化学方程式为______,平衡常数______(用、表示)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是______。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内浓度保持不变
(2)工艺1需先合成甲醇。在不同压强下,按照投料合成甲醇,实验测定的平衡转化率和的平衡产率随温度的变化关系如下图所示。
①下列说法正确的是______
A.图甲纵坐标表示的平衡产率
B.
C.为了同时提高的平衡转化率和的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是______。
(3)对于合成甲醇的反应: ,一定条件下,单位时间内不同温度下测定的转化率如图丙所示。温度高于710K时,随温度的升高转化率降低的原因可能是______。
20.有机物Ⅸ是合成酮基布洛芬的重要中间体,一种合成Ⅸ的路线如图:
已知:
①
②
回答下列问题:
(1)化合物Ⅴ中含有的官能团的名称为______;化合物Ⅵ的结构简式为______。
(2)验证苯中混有化合物Ⅳ的方法是______。
(3)写出反应Ⅵ→Ⅶ的化学方程式:______,该反应的反应类型为______。
(4)化合物Ⅳ的同分异构体中能同时满足以下条件的有______种(不考虑立体异构)。
a.含有联苯结构()且其中一个苯环除连有另一个苯环外,无其他侧链;
b.能发生银镜反应。
(5)结合以上合成路线信息,设计以、为原料(其他试剂任选)合成的路线______。
高三化学期中考参考答案
一、选择题:本题共16小题,共44分。
1 2 3 4 5 6 7 8
B A B B B C B B
9 10 11 12 13 14 15 16
D A D B C C D B
二、非选择题:本题共4小题,共56分。
【17题答案】(每空2分,共16分)
(1)①ab ②该药品不溶于水
(2)①酸式滴定管 ② ③红棕色 ④无污染 ⑤224
(3)不能,维生素C具有还原性,若过量,也能与酸性高锰酸钾溶液反应使溶液褪色
【18题答案】(每空2分,共14分)
(1)搅拌;适当增加硫酸浓度;适当加热等
(2)、S、温度过低,硫的溶解速率小,温度过高,易挥发
(3)KSCN溶液
(4)
(5)将溶液加热
(6)96.57%
【19题答案】(每空2分,共12分)
(1) BD
(2)ABC 该温度时,以反应Ⅱ为主,压强对平衡移动无影响
(3)710K之前反应没有达到平衡,随着温度上升,反应速率增加,因此的转化率上升;该反应是放热反应,710K之后平衡逆向移动,的转化率下降
【20题答案】(每空2分,共14分)
(1)①酮羰基、碳溴键 ②
(2)取少量样品于试管中,滴加酸性高锰酸钾溶液,紫色褪去,说明苯中含有化合物Ⅳ
(3)①
②取代反应
(4)13
(5)
化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Fe-56 Mn-55 Ba-137
一、选择题:本题共16小题,1-10每小题2分,11-16每题4分,每小题只有一个选项符合题目要求。
1.化学来源于生活,下列关于宣纸的传统制作工艺主要发生化学变化的是( )
A.挑选原料 B.加碱蒸煮 C.竹帘捞纸 D.剪裁纸张
2.生活因化学更美好。下列对化学物质在生活中的用途的知识解读正确的是( )
选项 生活中的用途 知识解读
A 浸泡过溶液的硅土用作水果保鲜剂 溶液具有强氧化性
B 面包师用小苏打作发泡剂烘焙面包 小苏打受热稳定、不易分解
C 用石灰石处理酸性废水 石灰石属于强碱,具有碱性
D 镁铝合金用于制作阳台门窗 镁铝合金密度大、强度高、耐腐蚀
3.在酸性或者接近中性的条件下,易发生歧化反应,将通入溶液中,其反应为。下列有关说法错误的是( )
A.的空间结构为平面三角形
B.中心原子的杂化方式是
C.基态钾原子的价电子排布式:
D.基态的价电子轨道表示式:
4.下列颜色变化与氧化还原反应无关的是( )
A.新切开的苹果在空气中变黄,最终变为褐色
B.白色的硫酸铜固体放置在空气中变为蓝色
C.淡黄绿色的新制氯水久置后变为无色
D.淡黄色的固体放置在空气中,一段时间后变成白色
5.天然海水中主要含有、、、、、、、等离子。火力发电时燃煤排放的含的烟气可利用海水脱硫,其工艺流程如图所示。下列说法错误的是( )
A.“氧化”时,溶液的pH减小
B.“反应、稀释”时会有气体放出,此气体为
C.天然海水呈弱碱性的原因之一:
D.实验中,可用饱和溶液除去中的杂质
6.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实验的检验,才能确定其正确与否。下列类推结论中正确的是( )
A.极易溶于水,也极易溶于水
B.为分子晶体,也为分子晶体
C.是非极性分子,也是非极性分子
D.分子的空间结构为直线形,分子的空间结构也为直线形
7.在给定条件下,下列物质间的转化均能一步实现的是( )
A.
B.
C.
D.
8.下列实验中,能够正确描述反应的离子方程式的是( )
A.磁性氧化铁溶于稀:
B.海水提溴工艺中,用纯碱溶液富集:
C.用石灰乳制漂白粉:
D.用足量的碱性溶液除去水中的:
9.某实验小组欲从海带中制取少量的碘,设计了如下实验流程:
海带→海带灰→海带灰悬浊液→含碘澄清液→氧化→含的溶液→的溶液→单质碘,下列实验装置在该方案中无须使用的是( )
A. B. C. D.
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y相邻且同周期,同周期元素基态原子中X的核外末成对电子数最多,Z元素基态原子的最高能级电子数是Y元素基态原子的最低能级电子数的一半,W在元素周期表中的周期数与族序数相等。下列有关说法错误的是( )
A.第一电离能:Z
C.X的最简单氢化物能与其最高价氧化物对应的水化物反应
D.X、Z、W元素的最高价氧化物对应的水化物之间可以相互反应
11.设为阿伏加德罗常数的值,下列叙述正确的是( )
A.0.4mol白磷(,正四面体结构)含共价键的数目为1.2
B.0.1mol 与0.1mol 反应,生成的分子数为0.1
C.常温下,将2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3
D.常温常压下,2.2g由和组成的混合气体中含有的原子总数为0.15
12.下列实验操作与现象和结论对应正确的是( )
实验操作与现象 结论
A 加热盛有少量固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 显碱性
B 向某溶液中先加入氯化钡溶液,再滴入盐酸,先产生白色沉淀,后白色沉淀不消失 该溶液中可能含有
C 将晶体溶于稀硫酸,再滴加KSCN溶液,溶液变红 晶体已氧化变质
D 向2支盛有2mL不同浓度溶液的试管中同时加入221mL 2%溶液,未观察到明显的实验现象差异 浓度对反应速率的影响不大
13.类比法是一种学习化学的重要方法。下列说法错误的是( )
A.溶液显碱性,则溶液显碱性
B.为三角锥形分子,则为三角锥形分子
C.与水反应生成乙炔,则与水反应生成丙炔
D.酸性强于,则酸性强于
14.有机物M是重要的药物合成中间体。下列关于有机物M的说法错误的是( )
A.分子中所有的原子不可能共平面
B.能与发生显色反应
C.1mol有机物M最多能与22mol 发生加成反应
D.分子中的碳原子有2种杂化方式
15.纳米硅基锂电池是一种新型二次电池,电池装置如图所示,电池充电时,三元锂电极上发生的电极反应为。下列说法错误的是( )
A.电池工作时,硅基电极上发生的电极反应:
B.电池工作时,三元锂电极为正极,发生还原反应
C.充电时,由三元锂电极经电解质溶液移向硅基电极
D.为提高电池工作效率并延长电池使用寿命,可将有机聚合物电解质换为锂盐水溶液
16.室温时,向100mL 0.1 溶液中滴加0.1 NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
A.a点处存在
B.b点处存在
C.由b到c发生反应的离子方程式为
D.图中a、b、c、d四个点,水的电离程度最大的是d点
二、非选择题:本题共4小题,共56分。
17.某种常见补铁药物的主要成分为琥珀酸亚铁,该药品难溶于水但能溶于常见稀酸。某学习小组同学设计实验检验药片中的存在并测定的含量(假设杂质不参与反应)。已知与会产生蓝色沉淀。回答下列问题:
(1)甲同学为了检验药品中的存在。将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时进行的下列操作不规范的是______(填标号)。
a.用玻璃棒在漏斗中搅动以加快过滤速率
b.滤纸边缘高于漏斗边缘
c.将滤纸润湿,使其紧贴漏斗内壁
②滤液加入溶液或KSCN溶液中均未出现明显现象,其主要原因为______。
(2)乙同学设计如下实验测定药片中的含量。
步骤一:取本药品10片,碾碎后加入一定浓度的稀硫酸,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量溶液后,再加入过量NaOH溶液,产生沉淀,将沉淀过滤出来后洗涤、干燥,灼烧至固体质量恒定,得0.64g固体。
①步骤二中,量取20.00mL溶液应使用的仪器为______(填“酸式滴定管”、“碱式滴定管”或“25mL量筒”)。
②步骤三中,加入溶液时发生反应的离子方程式为______,灼烧后所得固体的颜色为______。
③若将步骤三中的溶液换为也能达到目的,但使用溶液的好处是______。
④由实验数据计算,每片药片中含______mg 。
(3)也可用作补铁剂,使用时建议与维生素C同服,甲同学猜测维生素C可将转化为,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案 实验现象
取适量溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 紫色褪去
由上述实验能否得出“维生素C可将转化为”的结论?回答并说明理由:______。
18.碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(,含有和少量等杂质)为原料制备碱式碳酸铜的流程如图所示:
已知:,为无色液体,是硫、磷、硒、溴、碘、樟脑等的良好溶剂,具有挥发性。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______(任写一种)。
(2)滤渣Ⅰ经提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是______(填化学式)。由回收滤渣I中的淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是______。
(3)“除铁”时检验是否除尽时常用的化学试剂______。
(4)写出“沉锰”(除)过程中反应的离子方程式:______。
(5)“赶氨”时,最适宜的操作方法是______。
(6)测定副产品样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为______(保留到小数点后两位)
19.碳中和作为一种新型环保形式,目前已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
Ⅱ.逆水汽变换:
Ⅲ.甲醇脱水:
工艺2:利用直接加氢合成(反应Ⅳ)
①反应Ⅳ的热化学方程式为______,平衡常数______(用、表示)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是______。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.容器内浓度保持不变
(2)工艺1需先合成甲醇。在不同压强下,按照投料合成甲醇,实验测定的平衡转化率和的平衡产率随温度的变化关系如下图所示。
①下列说法正确的是______
A.图甲纵坐标表示的平衡产率
B.
C.为了同时提高的平衡转化率和的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是______。
(3)对于合成甲醇的反应: ,一定条件下,单位时间内不同温度下测定的转化率如图丙所示。温度高于710K时,随温度的升高转化率降低的原因可能是______。
20.有机物Ⅸ是合成酮基布洛芬的重要中间体,一种合成Ⅸ的路线如图:
已知:
①
②
回答下列问题:
(1)化合物Ⅴ中含有的官能团的名称为______;化合物Ⅵ的结构简式为______。
(2)验证苯中混有化合物Ⅳ的方法是______。
(3)写出反应Ⅵ→Ⅶ的化学方程式:______,该反应的反应类型为______。
(4)化合物Ⅳ的同分异构体中能同时满足以下条件的有______种(不考虑立体异构)。
a.含有联苯结构()且其中一个苯环除连有另一个苯环外,无其他侧链;
b.能发生银镜反应。
(5)结合以上合成路线信息,设计以、为原料(其他试剂任选)合成的路线______。
高三化学期中考参考答案
一、选择题:本题共16小题,共44分。
1 2 3 4 5 6 7 8
B A B B B C B B
9 10 11 12 13 14 15 16
D A D B C C D B
二、非选择题:本题共4小题,共56分。
【17题答案】(每空2分,共16分)
(1)①ab ②该药品不溶于水
(2)①酸式滴定管 ② ③红棕色 ④无污染 ⑤224
(3)不能,维生素C具有还原性,若过量,也能与酸性高锰酸钾溶液反应使溶液褪色
【18题答案】(每空2分,共14分)
(1)搅拌;适当增加硫酸浓度;适当加热等
(2)、S、温度过低,硫的溶解速率小,温度过高,易挥发
(3)KSCN溶液
(4)
(5)将溶液加热
(6)96.57%
【19题答案】(每空2分,共12分)
(1) BD
(2)ABC 该温度时,以反应Ⅱ为主,压强对平衡移动无影响
(3)710K之前反应没有达到平衡,随着温度上升,反应速率增加,因此的转化率上升;该反应是放热反应,710K之后平衡逆向移动,的转化率下降
【20题答案】(每空2分,共14分)
(1)①酮羰基、碳溴键 ②
(2)取少量样品于试管中,滴加酸性高锰酸钾溶液,紫色褪去,说明苯中含有化合物Ⅳ
(3)①
②取代反应
(4)13
(5)
同课章节目录
