化学人教版(2019)选择性必修2 3.4.1配合物 课件(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.4.1配合物 课件(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-04 07:55:12 | ||
图片预览










文档简介
(共30张PPT)
第三章 第四节 配合物与超分子
第一课时 配合物
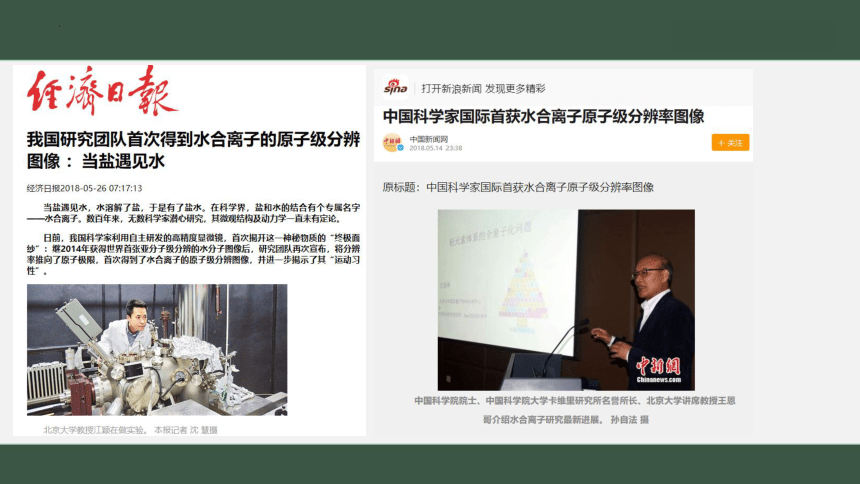
水合离子的概念提出一百多年来,科学家利用扫描隧道显微镜,原子力显微镜成像技术,第一次直接看到水合钠离子的原子级图像。水合离子在众多物理学,化学,生物学过程中扮演着重要的角色。
什么是水合离子?它是如何形成的?
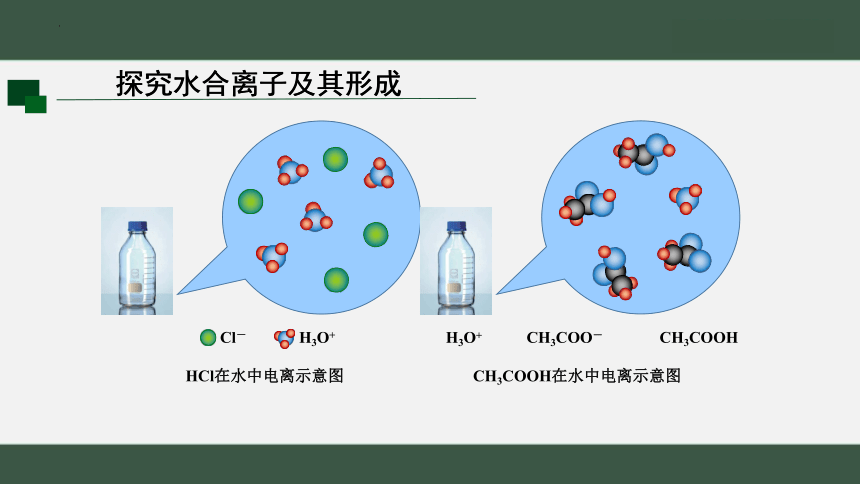
Cl- H3O+
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
探究水合离子及其形成
探究水合离子及其形成
H3O+的电子式?从化学键的角度分析H2O是如何与H+结合的
H+的1s轨道是空的,H2O分子中氧原子的孤电子对进入H+的空轨道,他们结合在一起形成了H3O+
探究水合离子及其形成
H2O与H+结合的作用力属于化学键的哪一种?
共价键
探究水合离子及其形成
1、定义
成键原子或离子一方提供空轨道,另一方提供孤电子对
而形成的,这类“电子对给予-接受”键被称为配位键。
配位键
结合H3O+和NH4+的形成,思考配位键的形成条件
配位键的形成条件
1、定义
2、配位键的形成条件
一方提供孤电子对(配体)
一方提供空轨道(接受体)
一.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对
而形成的,这类“电子对给予-接受”键被称为配位键。
配位键与一般共价键的区别是什么?
配位键的共用电子对是由一方提供而不是双方共同提供
一.配位键
配位键是一种特殊的共价键
1、定义
2、配位键的形成条件
一方提供孤电子对(配体)
一方提供空轨道(接受体)
一.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对
而形成的,这类“电子对给予-接受”键被称为配位键。
水分子除了与H+形成配位键,还能与哪些常见的微粒
形成配位键?
Na+ Mg2+ Al3+ Fe3+ Cu2+
探究其他的水合离子
观察无水硫酸铜的颜色,用药匙取少量无水硫酸铜于小烧杯中,加入约10ml蒸馏水使其溶解,注意观察现象。
蓝色微粒是什么?请同学们结合教材95页的图3-36思考回答。
[Cu(H2O)4]2+ 四水合铜离子
探究水合铜离子
Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢?
化学键
提供孤电子对
接受孤电子对
[Cu(H2O)4]2+
探究水合铜离子
除了水分子,是否还有其它的电子给予体?
NH3 X- OH- CO
探究其他的电子对给予体
探究NH3 与Cu2+能否形成配位键
取约3ml上述配制的硫酸铜溶液于试管中,向其中滴加氨水并振荡试管,直到最初产生的沉淀恰好溶解为止。
思考并讨论:蓝色沉淀是什么?为何会溶解?书写相应的化学方程式,并运用平衡原理加以解释。
思考并讨论:蓝色沉淀是什么?为何会溶解?书写相应的化学方程式,并运用平衡原理加以解释。
探究NH3 与Cu2+能否形成配位键
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Cu(OH)2 Cu2+ + 2OH-
1.氨水能够溶解氢氧化铜,说明氨气分子与铜离子间的结 合力很强,与水分子相比较,你觉得哪个更强?
铜离子与氨气分子间的配合能力更强
配位键的强度有大小之分
2.稳定的四氨合铜离子能否解离出铜离子和氨气分子?请设计实验方案。
再探配位键
方案一 取适量深蓝色溶液,滴加Na2S溶液,若出现黑色沉淀,说明四氨合铜离子能解离出铜离子
方案二 取适量深蓝色溶液,滴加稀硫酸,若出现深蓝色褪去,说明四氨合铜离子能解离出氨气分子
再探配位键
方案一对应的实验现象:出现黑色沉淀
方案二对应的实验现象:先产生沉淀,后沉淀溶解,
溶液颜色明显变浅
再探配位键
配离子也存在解离平衡
取适量深蓝色溶液,加入无水乙醇
深蓝色晶体为[Cu(NH3)4]SO4·H2O
[Cu(NH3)4]SO4在水中能否电离?请给出依据
[Cu(NH3)4]SO4 = [Cu(NH3)4]2++SO42-
制取配合物
Cu(NH3)4
SO4·H2O
内界
外界
对于配合物,外界在水溶液中易电离,但内界却难电离。
二.配合物的组成
配位数
配体
中心离子/原子
配位原子
指出冰晶石Na3AlF6中的配离子,中心离子,配位体,
配位数,配位原子
配离子 AlF6-
中心离子 Al3+
配位体 F-
配位数 6
配位原子 F
配合物概念巩固
配合物往往是有颜色的,有些配合物呈现出特征颜色,
从而可以用于物质的检验
例如课本提到的SCN-与Fe3+结合呈现血红色。NH3与
Cu2+配位生成深蓝色的四氨合铜离子。
当然,也有不呈现颜色的,比如NH3与Ag+配位生成
无色的二氨合银离子
三.配合物的应用
葡萄糖的银镜反应为何用银氨溶液而不直接用硝酸银溶液?
[Ag(NH3)2]+ Ag++2NH3
Ag+被氨气包裹着,在其被葡萄糖还原成Ag时,Ag+缓慢析出,均匀分布,有序排列,从而形成光亮的银镜
三.配合物的应用
乙二胺H2N-CH2CH2-NH2能否代替氨水和银离子配位制备银镜?给出你的依据,若能,试比较它与氨水,哪个效果更好。
可以,氮原子上有孤电子对,可以形成配位键,由于有两个氮原子,乙二胺的配位效果更好
三.配合物的应用
序号 选用配体 银配合物稳定常数 反应条件 实验结果
1 氨水 [Ag(NH3)2]+ 1.6×107 60oC水浴 8min产生明显银镜
2 乙二胺 [Ag(en)2]+ 7.0×107 室温 30s产生明显银镜
三.配合物的应用
化学事实
结构模型
组成结构
实际应用
反应性能
获取证据
预测性质
设计实验
“物质结构与性质”模块的认识—实践模型
核心意识 合作意识 竞争意识
检验
完善
构建
解释
推测
小结
1.化合物NH3与BF3可以通过配位键形成NH3·BF3,在NH3·BF3中,______原子提供孤电子对,______原子接受电子对。
2.对于配合物[Co(NH3)3(H2O)Cl2]Cl,下列说法不正确的是( )
A.配位数为6
B.提供空轨道的为Co3+
C.配位体为N、O、ClD.若往1mol该配合物中加入足量硝酸酸化的AgNO3溶液,可得到
1molAgCl沉淀
C
N
B
小试牛刀
THANKS
FOR WATCHING
第三章 第四节 配合物与超分子
第一课时 配合物
水合离子的概念提出一百多年来,科学家利用扫描隧道显微镜,原子力显微镜成像技术,第一次直接看到水合钠离子的原子级图像。水合离子在众多物理学,化学,生物学过程中扮演着重要的角色。
什么是水合离子?它是如何形成的?
Cl- H3O+
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
探究水合离子及其形成
探究水合离子及其形成
H3O+的电子式?从化学键的角度分析H2O是如何与H+结合的
H+的1s轨道是空的,H2O分子中氧原子的孤电子对进入H+的空轨道,他们结合在一起形成了H3O+
探究水合离子及其形成
H2O与H+结合的作用力属于化学键的哪一种?
共价键
探究水合离子及其形成
1、定义
成键原子或离子一方提供空轨道,另一方提供孤电子对
而形成的,这类“电子对给予-接受”键被称为配位键。
配位键
结合H3O+和NH4+的形成,思考配位键的形成条件
配位键的形成条件
1、定义
2、配位键的形成条件
一方提供孤电子对(配体)
一方提供空轨道(接受体)
一.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对
而形成的,这类“电子对给予-接受”键被称为配位键。
配位键与一般共价键的区别是什么?
配位键的共用电子对是由一方提供而不是双方共同提供
一.配位键
配位键是一种特殊的共价键
1、定义
2、配位键的形成条件
一方提供孤电子对(配体)
一方提供空轨道(接受体)
一.配位键
成键原子或离子一方提供空轨道,另一方提供孤电子对
而形成的,这类“电子对给予-接受”键被称为配位键。
水分子除了与H+形成配位键,还能与哪些常见的微粒
形成配位键?
Na+ Mg2+ Al3+ Fe3+ Cu2+
探究其他的水合离子
观察无水硫酸铜的颜色,用药匙取少量无水硫酸铜于小烧杯中,加入约10ml蒸馏水使其溶解,注意观察现象。
蓝色微粒是什么?请同学们结合教材95页的图3-36思考回答。
[Cu(H2O)4]2+ 四水合铜离子
探究水合铜离子
Cu2+与H2O是如何结合成[Cu(H2O)4]2+的呢?
化学键
提供孤电子对
接受孤电子对
[Cu(H2O)4]2+
探究水合铜离子
除了水分子,是否还有其它的电子给予体?
NH3 X- OH- CO
探究其他的电子对给予体
探究NH3 与Cu2+能否形成配位键
取约3ml上述配制的硫酸铜溶液于试管中,向其中滴加氨水并振荡试管,直到最初产生的沉淀恰好溶解为止。
思考并讨论:蓝色沉淀是什么?为何会溶解?书写相应的化学方程式,并运用平衡原理加以解释。
思考并讨论:蓝色沉淀是什么?为何会溶解?书写相应的化学方程式,并运用平衡原理加以解释。
探究NH3 与Cu2+能否形成配位键
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Cu(OH)2 Cu2+ + 2OH-
1.氨水能够溶解氢氧化铜,说明氨气分子与铜离子间的结 合力很强,与水分子相比较,你觉得哪个更强?
铜离子与氨气分子间的配合能力更强
配位键的强度有大小之分
2.稳定的四氨合铜离子能否解离出铜离子和氨气分子?请设计实验方案。
再探配位键
方案一 取适量深蓝色溶液,滴加Na2S溶液,若出现黑色沉淀,说明四氨合铜离子能解离出铜离子
方案二 取适量深蓝色溶液,滴加稀硫酸,若出现深蓝色褪去,说明四氨合铜离子能解离出氨气分子
再探配位键
方案一对应的实验现象:出现黑色沉淀
方案二对应的实验现象:先产生沉淀,后沉淀溶解,
溶液颜色明显变浅
再探配位键
配离子也存在解离平衡
取适量深蓝色溶液,加入无水乙醇
深蓝色晶体为[Cu(NH3)4]SO4·H2O
[Cu(NH3)4]SO4在水中能否电离?请给出依据
[Cu(NH3)4]SO4 = [Cu(NH3)4]2++SO42-
制取配合物
Cu(NH3)4
SO4·H2O
内界
外界
对于配合物,外界在水溶液中易电离,但内界却难电离。
二.配合物的组成
配位数
配体
中心离子/原子
配位原子
指出冰晶石Na3AlF6中的配离子,中心离子,配位体,
配位数,配位原子
配离子 AlF6-
中心离子 Al3+
配位体 F-
配位数 6
配位原子 F
配合物概念巩固
配合物往往是有颜色的,有些配合物呈现出特征颜色,
从而可以用于物质的检验
例如课本提到的SCN-与Fe3+结合呈现血红色。NH3与
Cu2+配位生成深蓝色的四氨合铜离子。
当然,也有不呈现颜色的,比如NH3与Ag+配位生成
无色的二氨合银离子
三.配合物的应用
葡萄糖的银镜反应为何用银氨溶液而不直接用硝酸银溶液?
[Ag(NH3)2]+ Ag++2NH3
Ag+被氨气包裹着,在其被葡萄糖还原成Ag时,Ag+缓慢析出,均匀分布,有序排列,从而形成光亮的银镜
三.配合物的应用
乙二胺H2N-CH2CH2-NH2能否代替氨水和银离子配位制备银镜?给出你的依据,若能,试比较它与氨水,哪个效果更好。
可以,氮原子上有孤电子对,可以形成配位键,由于有两个氮原子,乙二胺的配位效果更好
三.配合物的应用
序号 选用配体 银配合物稳定常数 反应条件 实验结果
1 氨水 [Ag(NH3)2]+ 1.6×107 60oC水浴 8min产生明显银镜
2 乙二胺 [Ag(en)2]+ 7.0×107 室温 30s产生明显银镜
三.配合物的应用
化学事实
结构模型
组成结构
实际应用
反应性能
获取证据
预测性质
设计实验
“物质结构与性质”模块的认识—实践模型
核心意识 合作意识 竞争意识
检验
完善
构建
解释
推测
小结
1.化合物NH3与BF3可以通过配位键形成NH3·BF3,在NH3·BF3中,______原子提供孤电子对,______原子接受电子对。
2.对于配合物[Co(NH3)3(H2O)Cl2]Cl,下列说法不正确的是( )
A.配位数为6
B.提供空轨道的为Co3+
C.配位体为N、O、ClD.若往1mol该配合物中加入足量硝酸酸化的AgNO3溶液,可得到
1molAgCl沉淀
C
N
B
小试牛刀
THANKS
FOR WATCHING
