2023-2024学年鲁科版高中化学选择性必修一 1.2.1化学能转化为电能--电池 课件(共24张PPT)
文档属性
| 名称 | 2023-2024学年鲁科版高中化学选择性必修一 1.2.1化学能转化为电能--电池 课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-04 17:25:28 | ||
图片预览







文档简介
(共24张PPT)
第一课时 原电池
第一章 第2节 化学能转化为电能——电池
1.通过理论分析与实验验证深入理解原电池的工作原理,建立原电池构成的认知模型,并能设计简单的原电池。
2.认识从简单原电池发展到带有盐桥的双液电池的过程变化,并能理解带有盐桥的双液电池的实用性。
学习目标
生活中的电池
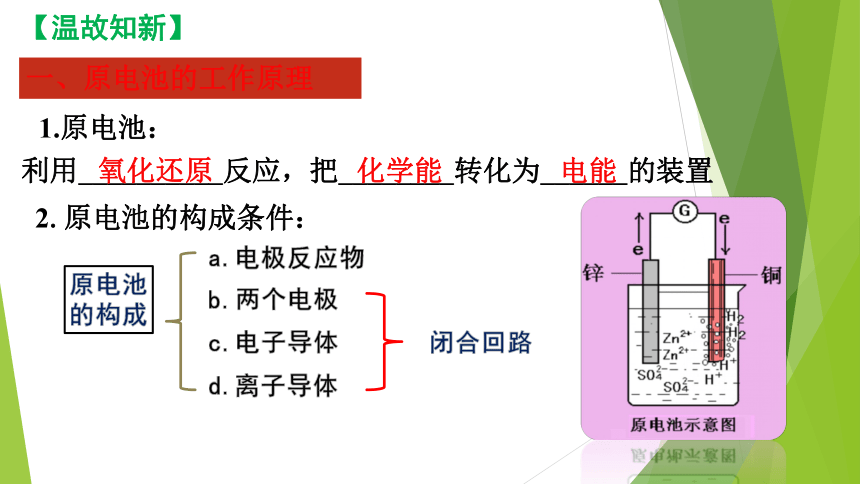
思考:原电池工作时装置中会发生哪些变化 如何去设计一个简单的原电池?
利用__________反应,把________转化为______的装置
一、原电池的工作原理
氧化还原
化学能
电能
【温故知新】
2.原电池的构成条件:
1.原电池:
原电池
的构成
a.电极反应物
b.两个电极
c.电子导体
d.离子导体
闭合回路
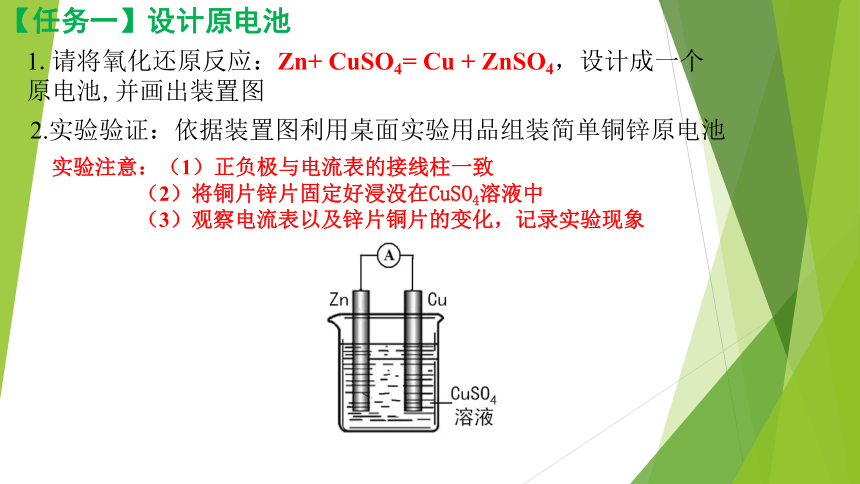
【任务一】设计原电池
2.实验验证:依据装置图利用桌面实验用品组装简单铜锌原电池
实验注意:(1)正负极与电流表的接线柱一致
(2)将铜片锌片固定好浸没在CuSO4溶液中
(3)观察电流表以及锌片铜片的变化,记录实验现象
1.请将氧化还原反应:Zn+ CuSO4= Cu + ZnSO4,设计成一个 原电池,并画出装置图
电流表指针偏转;
锌片溶解;
铜片上有红色固体析出;
思考:此原电池的工作原理是怎样的?
3.实验现象:
氧化
还原
4.分析原电池的构成及工作原理,写出电极反应式。
Zn - 2e- == Zn2+
负极:
Cu2+ + 2e- == Cu
正极:
Zn+Cu2+ == Zn2++Cu
总反应:
负极
正极
e-
e-
Zn2+
SO4
2-
【任务一】设计原电池
锌片表面附着了红色固体;
电流表指针发生回偏,电流迅速衰减
请再次观察锌片及电流表,你是否有新发现?
发现问题:
问题2:电流为什么出现衰减?
问题1:锌片表面附着的红色固体是什么?如何产生的?
铜单质
锌片和溶液中的铜离子直接反应
当锌片表面析出大量的铜之后,减小了锌片与溶液的接触面积,进而减缓了原电池反应的速率,电流出现衰减。
交流思考
思考:如何能避免这些缺陷?
Zn与CuSO4溶液
不直接接触
关键
如何改进?
【任务二】优化原电池设计
盐桥
氯化钾或硝酸铵饱和溶液的琼脂凝胶
琼胶的作用是防止U管中溶液流出。
盐桥中的离子能够定向移动。
盐桥将两个相互隔离的电解质溶液连接起来,传导电流。
【知识支持】
1.改进原电池装置
【任务二】优化原电池设计
双液原电池
单液原电池
2. 实验验证:依据装置图利用桌面实验用品组装铜锌双液原电池
实验注意:使用盐桥时先拔下两端的塞子
【任务二】优化原电池设计
3. 实验现象:
未插入盐桥前无明显现象;插入盐桥后,电流表指针发生偏转,锌片溶解,铜片表面有红色固体析出
思考:双液盐桥原电池的工作原理是怎样的?
负极:Zn-2e-=Zn2+(氧化反应)
正极:Cu2++2e-=Cu(还原反应)
总反应:Zn+Cu2+=Zn2++Cu
盐桥中离子的移动方向
K+(阳离子):正极
Cl-(阴离子):负极
4.分析双液原电池的构成及工作原理,写出电极反应式。
【小结】双液盐桥原电池的优点
双液电池Zn和Cu2+不直接接触,两个半反应在不同区域进行,
仅有化学能转化为电能
能量转化率高,
电流强度大,稳定,
持续时间长。
【迁移应用】
盐桥
Cu
C
CuCl2溶液
FeCl3溶液
G
将反应Cu+2FeCl3=2FeCl2+CuCl2 设计成双液盐桥原电池
画出装置图并写出电极反应式
根据氧化还原反应电子转移判断电极反应
根据电极反应确定合适的电极材料和电解质溶液
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
二、原电池的应用
1.加快氧化还原反应速率:
向锌与稀硫酸反应体系中加入少量CuSO4溶液
2.比较金属的活动性强弱:
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
3.设计原电池,提供能源; Fe+CuSO4=Cu+FeSO4
学习了本节课,你有哪些收获?
Zn+Cu2+=Zn2++Cu
Zn-2e-=Zn2+
Cu2++2e-=Cu
失电子氧化反应
得电子还原反应
电池反应
氧化还原反应
阴离子流向
阳离子移向
负极
正极
导
线
电极
反应式
电极反应
(半反应)
离
子
导
体
电子流出
电子流入
Zn
Cu
课堂小结
原电池的工作原理分析
【当堂检测】
1.表面介导电池(SMCS)是一种新型充电电池,该电池的电极材料为金属锂和氧化石墨烯。下列有关说法中不正确的是( )
A.放电时,氧化石墨烯作正极
B.放电时,负极电极反应式为 Li﹣e ═ Li+
C.放电时,该电池是将化学能转化为电能
D.放电时,电解质溶液中的Li+从正极迁移到负极
D
2.如图所示的装置中,在产生电流时,以下说法不正确的是( )
A.Fe是负极,C是正极
B.负极反应式为:Fe-3e-===Fe3+
C.内电路中阴离子移向FeCl2溶液
D.电流由石墨电极流向Fe电极
B
3.如图中,两电极上发生的电极反应为:a极:Cu2++2e-=Cu b极:Fe-2e-=Fe2+ 下列说法中不正确的是( )
A.该装置为原电池
B.a极上发生还原反应
C.电子由b→a
D.该过程中能量的转换一定是化学能全部转化为电能
D
4.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂 KNO3的U形管)构成一个原电池(如图)。下列有关该原电池的叙述中正确的是( )
①在外电路中,电子由铜电极流向银电极
②正极反应:Ag++e = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.①②④ C.②③ D.①③④
B
【课后作业】
1.自制简单水果双液原电池
2.完成课本P22页第5题
第一课时 原电池
第一章 第2节 化学能转化为电能——电池
1.通过理论分析与实验验证深入理解原电池的工作原理,建立原电池构成的认知模型,并能设计简单的原电池。
2.认识从简单原电池发展到带有盐桥的双液电池的过程变化,并能理解带有盐桥的双液电池的实用性。
学习目标
生活中的电池
思考:原电池工作时装置中会发生哪些变化 如何去设计一个简单的原电池?
利用__________反应,把________转化为______的装置
一、原电池的工作原理
氧化还原
化学能
电能
【温故知新】
2.原电池的构成条件:
1.原电池:
原电池
的构成
a.电极反应物
b.两个电极
c.电子导体
d.离子导体
闭合回路
【任务一】设计原电池
2.实验验证:依据装置图利用桌面实验用品组装简单铜锌原电池
实验注意:(1)正负极与电流表的接线柱一致
(2)将铜片锌片固定好浸没在CuSO4溶液中
(3)观察电流表以及锌片铜片的变化,记录实验现象
1.请将氧化还原反应:Zn+ CuSO4= Cu + ZnSO4,设计成一个 原电池,并画出装置图
电流表指针偏转;
锌片溶解;
铜片上有红色固体析出;
思考:此原电池的工作原理是怎样的?
3.实验现象:
氧化
还原
4.分析原电池的构成及工作原理,写出电极反应式。
Zn - 2e- == Zn2+
负极:
Cu2+ + 2e- == Cu
正极:
Zn+Cu2+ == Zn2++Cu
总反应:
负极
正极
e-
e-
Zn2+
SO4
2-
【任务一】设计原电池
锌片表面附着了红色固体;
电流表指针发生回偏,电流迅速衰减
请再次观察锌片及电流表,你是否有新发现?
发现问题:
问题2:电流为什么出现衰减?
问题1:锌片表面附着的红色固体是什么?如何产生的?
铜单质
锌片和溶液中的铜离子直接反应
当锌片表面析出大量的铜之后,减小了锌片与溶液的接触面积,进而减缓了原电池反应的速率,电流出现衰减。
交流思考
思考:如何能避免这些缺陷?
Zn与CuSO4溶液
不直接接触
关键
如何改进?
【任务二】优化原电池设计
盐桥
氯化钾或硝酸铵饱和溶液的琼脂凝胶
琼胶的作用是防止U管中溶液流出。
盐桥中的离子能够定向移动。
盐桥将两个相互隔离的电解质溶液连接起来,传导电流。
【知识支持】
1.改进原电池装置
【任务二】优化原电池设计
双液原电池
单液原电池
2. 实验验证:依据装置图利用桌面实验用品组装铜锌双液原电池
实验注意:使用盐桥时先拔下两端的塞子
【任务二】优化原电池设计
3. 实验现象:
未插入盐桥前无明显现象;插入盐桥后,电流表指针发生偏转,锌片溶解,铜片表面有红色固体析出
思考:双液盐桥原电池的工作原理是怎样的?
负极:Zn-2e-=Zn2+(氧化反应)
正极:Cu2++2e-=Cu(还原反应)
总反应:Zn+Cu2+=Zn2++Cu
盐桥中离子的移动方向
K+(阳离子):正极
Cl-(阴离子):负极
4.分析双液原电池的构成及工作原理,写出电极反应式。
【小结】双液盐桥原电池的优点
双液电池Zn和Cu2+不直接接触,两个半反应在不同区域进行,
仅有化学能转化为电能
能量转化率高,
电流强度大,稳定,
持续时间长。
【迁移应用】
盐桥
Cu
C
CuCl2溶液
FeCl3溶液
G
将反应Cu+2FeCl3=2FeCl2+CuCl2 设计成双液盐桥原电池
画出装置图并写出电极反应式
根据氧化还原反应电子转移判断电极反应
根据电极反应确定合适的电极材料和电解质溶液
负极: Cu - 2e- = Cu2+
正极: 2Fe3+ + 2e- = 2Fe2+
二、原电池的应用
1.加快氧化还原反应速率:
向锌与稀硫酸反应体系中加入少量CuSO4溶液
2.比较金属的活动性强弱:
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
3.设计原电池,提供能源; Fe+CuSO4=Cu+FeSO4
学习了本节课,你有哪些收获?
Zn+Cu2+=Zn2++Cu
Zn-2e-=Zn2+
Cu2++2e-=Cu
失电子氧化反应
得电子还原反应
电池反应
氧化还原反应
阴离子流向
阳离子移向
负极
正极
导
线
电极
反应式
电极反应
(半反应)
离
子
导
体
电子流出
电子流入
Zn
Cu
课堂小结
原电池的工作原理分析
【当堂检测】
1.表面介导电池(SMCS)是一种新型充电电池,该电池的电极材料为金属锂和氧化石墨烯。下列有关说法中不正确的是( )
A.放电时,氧化石墨烯作正极
B.放电时,负极电极反应式为 Li﹣e ═ Li+
C.放电时,该电池是将化学能转化为电能
D.放电时,电解质溶液中的Li+从正极迁移到负极
D
2.如图所示的装置中,在产生电流时,以下说法不正确的是( )
A.Fe是负极,C是正极
B.负极反应式为:Fe-3e-===Fe3+
C.内电路中阴离子移向FeCl2溶液
D.电流由石墨电极流向Fe电极
B
3.如图中,两电极上发生的电极反应为:a极:Cu2++2e-=Cu b极:Fe-2e-=Fe2+ 下列说法中不正确的是( )
A.该装置为原电池
B.a极上发生还原反应
C.电子由b→a
D.该过程中能量的转换一定是化学能全部转化为电能
D
4.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂 KNO3的U形管)构成一个原电池(如图)。下列有关该原电池的叙述中正确的是( )
①在外电路中,电子由铜电极流向银电极
②正极反应:Ag++e = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.①②④ C.②③ D.①③④
B
【课后作业】
1.自制简单水果双液原电池
2.完成课本P22页第5题
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
