化学人教版(2019)选择性必修1 3.2水的电离和溶液的pH(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2水的电离和溶液的pH(共20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 67.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-04 21:12:40 | ||
图片预览






文档简介
(共20张PPT)
水的电离和溶液的 pH
台湾海峡
日月潭
长江三峡
三峡大坝
“共抓大保护,不搞大开发。”
---习近平
水
的
电
离
和
溶
液
的
P
H
水的电离和溶液的 pH
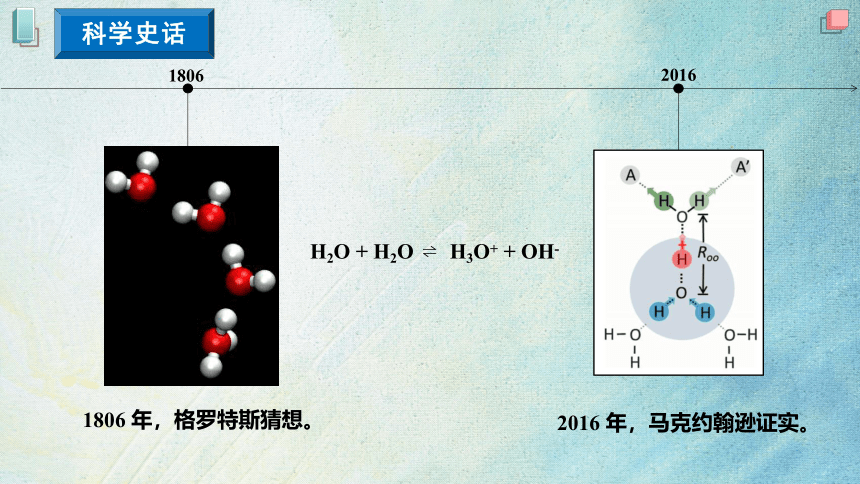
1806
2016
H3O+ + OH-
H2O + H2O
1806 年,格罗特斯猜想。
2016 年,马克约翰逊证实。
科学史话
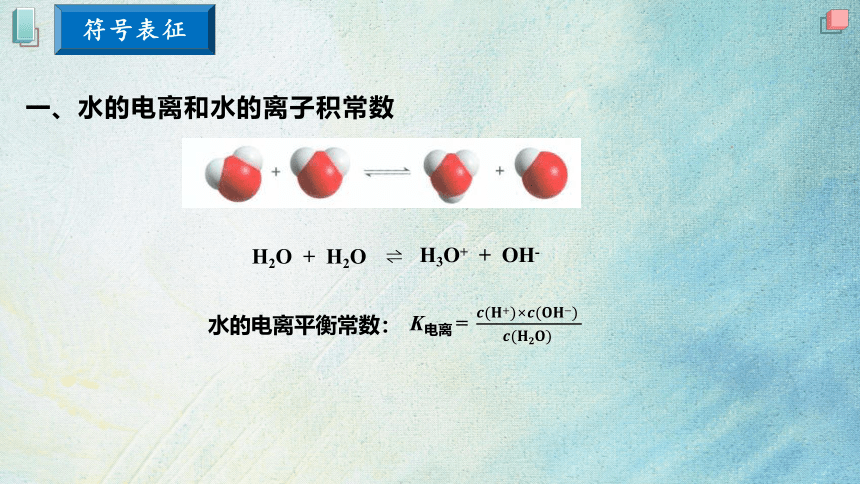
一、水的电离和水的离子积常数
H3O+ + OH-
H2O + H2O
水的电离平衡常数:
K电离 =
符号表征
【实验1】测量常温下纯水的 pH
实验仪器及用品:广泛 pH 试纸、表面皿、烧杯、玻璃棒等。
pH = - lg c(H+)
实验结论:常温下纯水的 pH 约为7。
微观探析一
探究常温下水的电离程度
操作步骤:将一小块 pH 试纸放在洁净、干燥的表面皿上,用玻璃棒蘸取纯水点在 pH 试纸中央,待试纸变色稳定后与标准比色卡对比并读数(精确到1)。
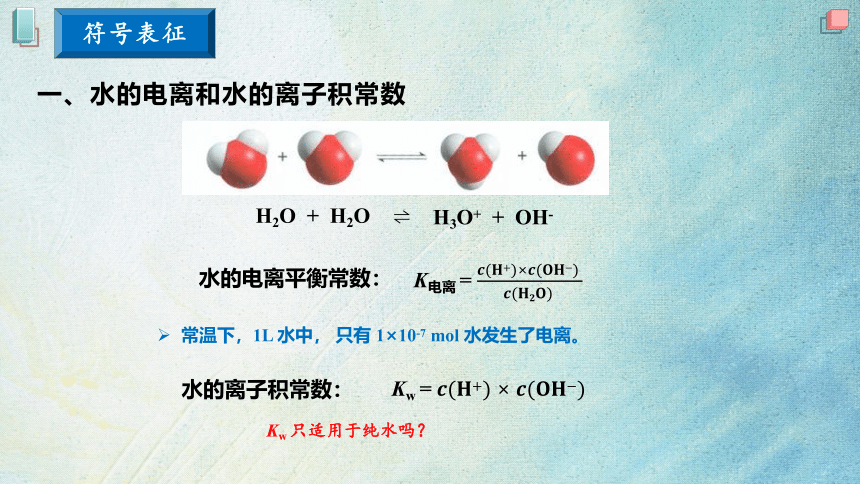
一、水的电离和水的离子积常数
H3O+ + OH-
H2O + H2O
常温下,1L 水中, 只有 1×10-7 mol 水发生了电离。
水的离子积常数:
水的电离平衡常数:
Kw 只适用于纯水吗?
K电离 =
Kw =
符号表征
1. 温度
H2O
H+ + OH-
二、影响水的电离平衡的因素
2. c(H+) 、c(OH-)
证据推理
【实验2】测定不同温度时蒸馏水的电导率
实验仪器及用品:温度传感器、电导率传感器、磁力加热搅拌器、烧杯等。
温度传感器
电导率传感器
微观探析二
温度对水的电离平衡的影响
实验结论:
升高温度,水的电离平衡 移动, Kw 。
实验现象:
随着温度的升高,蒸馏水的电导率呈 趋势。
正向
增大
增大
t / ℃ 0 10 20 25 40 50 90 100
Kw / 10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
微观探析二
温度对水的电离平衡的影响
【实验2】测定不同温度时蒸馏水的电导率
【实验3】测量常温时一定浓度的盐酸或 NaOH 溶液的 pH
实验仪器及用品:pH 计(精确度:0.1 ),滤纸,小烧杯等。
微观探析三
酸碱对水的电离平衡的影响程度
pH 计:又称酸度计,可用来精密测量溶液的 pH。
【实验3】测量常温时一定浓度的盐酸或 NaOH 溶液的 pH
编号 成分 浓度/ mol L-1 pH 溶液中 c(H+) /mol L-1 水电离的
c水(H+) = c水(OH-) /mol L-1
① NaOH溶液 0.01
② NaOH溶液 0.1
③ 盐酸 0.1
【问题1】向水中加入碱中 c(OH-) 浓度越大,对水电离的抑制程度 ;
越大
【问题2】向水中加入的酸中 c(H+) 或加入的碱中 c(OH-) 相等时,对水电离的抑制程度 ;
相等
12.0
13.0
1.0
1×10-12
1×10-13
1×10-1
1×10-12
1×10-13
1×10-13
微观探析三
酸碱对水的电离平衡的影响程度
微观探析三
酸碱对水的电离平衡的影响程度
【实验3】测量常温时一定浓度的盐酸或 NaOH 溶液的 pH
实验结论:
1.向水中加入的酸中 c(H+) 或碱中 c(OH-) 浓度越大,对水电离的抑制程度越大。
2.向水中加入的酸中 c(H+) 或加入的碱中 c(OH-) 相等时,对水电离的抑制程度相等。
3.Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
【问题1】只有酸溶液中才存在 H+,碱溶液中才存在 OH-,对吗?
【问题2】溶液的酸碱性由什么决定?
结合所学知识将表格补充完整:
【问题3】溶液的酸碱性能否根据 pH 判断?
迁移应用
温度 成分 浓度/mol L-1 c(H+)/mol L-1 c(OH-)/mol L-1 c(H+)和c(OH-)的大小比较 pH
25℃ 盐酸 0.01
NaOH溶液 0.01
NaCl溶液 0.01
60℃ 纯水 1×10-6.5
1×10-2
1×10-6.5
1×10-12
1×10-12
1×10-2
1×10-7
1×10-7
6.5
2.0
12.0
7.0
c(H+)>c(OH-)
c(H+)c(H+)=c(OH-)
c(H+)=c(OH-)
注意:根据pH判断溶液酸碱性必须考虑温度!
三、溶液的酸碱性
模型认知
溶液中 c(H+) 和 c(OH-) 的相对大小 pH (常温) 溶液的酸碱性
c(H+) > c(OH-) pH < 7 酸性
c(H+) = c(OH-) pH = 7 中性
c(H+) < c(OH-) pH > 7 碱性
四、pH 在生活生产中的应用
1.洗完头发后需要涂抹护发素,原因是什么?
2.苹果、薄荷最适宜生长的土壤的 pH 范围是多少?苹果树下适宜种薄荷吗?
护发素具有调节头发的 pH 使之达到适宜酸碱度的功能。
苹果:5~6.5,薄荷:7~8;不适宜。
拓展视野
水的电离和
水的离子积常数
科学史话
微观探析
影响水的电离平衡的因素
溶液的酸碱性
迁移应用
pH 在生活生产中的应用
拓展视野
知识建构
1. 将纯水加热到较高温度,水的离子积 (“增大”、“减小”或“不变”)、pH (“增大”、“减小”或“不变”),呈 (“酸性”、“中性”或“碱性”)。
2.常温时向水中加入少量固体 NaHSO4,水的电离平衡 (“正向”或“逆向”)移动,
c(H+) (“增大”、“减小”或“不变”),Kw (“增大”、“减小”或“不变”)
3.已知某温度下水的离子积常数为Kw,下列溶液一定呈酸性的是( )
A. c(OH-) < c(H+)的溶液 B. c(H+) <的溶液
C. 含H+的溶液 D. pH < 7的溶液
A
增大
减小
中性
逆向
增大
不变
巩固提升
完成教材 P68 第 1、2、3、6题
课后作业
水的电离和溶液的 pH
台湾海峡
日月潭
长江三峡
三峡大坝
“共抓大保护,不搞大开发。”
---习近平
水
的
电
离
和
溶
液
的
P
H
水的电离和溶液的 pH
1806
2016
H3O+ + OH-
H2O + H2O
1806 年,格罗特斯猜想。
2016 年,马克约翰逊证实。
科学史话
一、水的电离和水的离子积常数
H3O+ + OH-
H2O + H2O
水的电离平衡常数:
K电离 =
符号表征
【实验1】测量常温下纯水的 pH
实验仪器及用品:广泛 pH 试纸、表面皿、烧杯、玻璃棒等。
pH = - lg c(H+)
实验结论:常温下纯水的 pH 约为7。
微观探析一
探究常温下水的电离程度
操作步骤:将一小块 pH 试纸放在洁净、干燥的表面皿上,用玻璃棒蘸取纯水点在 pH 试纸中央,待试纸变色稳定后与标准比色卡对比并读数(精确到1)。
一、水的电离和水的离子积常数
H3O+ + OH-
H2O + H2O
常温下,1L 水中, 只有 1×10-7 mol 水发生了电离。
水的离子积常数:
水的电离平衡常数:
Kw 只适用于纯水吗?
K电离 =
Kw =
符号表征
1. 温度
H2O
H+ + OH-
二、影响水的电离平衡的因素
2. c(H+) 、c(OH-)
证据推理
【实验2】测定不同温度时蒸馏水的电导率
实验仪器及用品:温度传感器、电导率传感器、磁力加热搅拌器、烧杯等。
温度传感器
电导率传感器
微观探析二
温度对水的电离平衡的影响
实验结论:
升高温度,水的电离平衡 移动, Kw 。
实验现象:
随着温度的升高,蒸馏水的电导率呈 趋势。
正向
增大
增大
t / ℃ 0 10 20 25 40 50 90 100
Kw / 10-14 0.115 0.296 0.687 1.01 2.87 5.31 37.1 54.5
微观探析二
温度对水的电离平衡的影响
【实验2】测定不同温度时蒸馏水的电导率
【实验3】测量常温时一定浓度的盐酸或 NaOH 溶液的 pH
实验仪器及用品:pH 计(精确度:0.1 ),滤纸,小烧杯等。
微观探析三
酸碱对水的电离平衡的影响程度
pH 计:又称酸度计,可用来精密测量溶液的 pH。
【实验3】测量常温时一定浓度的盐酸或 NaOH 溶液的 pH
编号 成分 浓度/ mol L-1 pH 溶液中 c(H+) /mol L-1 水电离的
c水(H+) = c水(OH-) /mol L-1
① NaOH溶液 0.01
② NaOH溶液 0.1
③ 盐酸 0.1
【问题1】向水中加入碱中 c(OH-) 浓度越大,对水电离的抑制程度 ;
越大
【问题2】向水中加入的酸中 c(H+) 或加入的碱中 c(OH-) 相等时,对水电离的抑制程度 ;
相等
12.0
13.0
1.0
1×10-12
1×10-13
1×10-1
1×10-12
1×10-13
1×10-13
微观探析三
酸碱对水的电离平衡的影响程度
微观探析三
酸碱对水的电离平衡的影响程度
【实验3】测量常温时一定浓度的盐酸或 NaOH 溶液的 pH
实验结论:
1.向水中加入的酸中 c(H+) 或碱中 c(OH-) 浓度越大,对水电离的抑制程度越大。
2.向水中加入的酸中 c(H+) 或加入的碱中 c(OH-) 相等时,对水电离的抑制程度相等。
3.Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
【问题1】只有酸溶液中才存在 H+,碱溶液中才存在 OH-,对吗?
【问题2】溶液的酸碱性由什么决定?
结合所学知识将表格补充完整:
【问题3】溶液的酸碱性能否根据 pH 判断?
迁移应用
温度 成分 浓度/mol L-1 c(H+)/mol L-1 c(OH-)/mol L-1 c(H+)和c(OH-)的大小比较 pH
25℃ 盐酸 0.01
NaOH溶液 0.01
NaCl溶液 0.01
60℃ 纯水 1×10-6.5
1×10-2
1×10-6.5
1×10-12
1×10-12
1×10-2
1×10-7
1×10-7
6.5
2.0
12.0
7.0
c(H+)>c(OH-)
c(H+)
c(H+)=c(OH-)
注意:根据pH判断溶液酸碱性必须考虑温度!
三、溶液的酸碱性
模型认知
溶液中 c(H+) 和 c(OH-) 的相对大小 pH (常温) 溶液的酸碱性
c(H+) > c(OH-) pH < 7 酸性
c(H+) = c(OH-) pH = 7 中性
c(H+) < c(OH-) pH > 7 碱性
四、pH 在生活生产中的应用
1.洗完头发后需要涂抹护发素,原因是什么?
2.苹果、薄荷最适宜生长的土壤的 pH 范围是多少?苹果树下适宜种薄荷吗?
护发素具有调节头发的 pH 使之达到适宜酸碱度的功能。
苹果:5~6.5,薄荷:7~8;不适宜。
拓展视野
水的电离和
水的离子积常数
科学史话
微观探析
影响水的电离平衡的因素
溶液的酸碱性
迁移应用
pH 在生活生产中的应用
拓展视野
知识建构
1. 将纯水加热到较高温度,水的离子积 (“增大”、“减小”或“不变”)、pH (“增大”、“减小”或“不变”),呈 (“酸性”、“中性”或“碱性”)。
2.常温时向水中加入少量固体 NaHSO4,水的电离平衡 (“正向”或“逆向”)移动,
c(H+) (“增大”、“减小”或“不变”),Kw (“增大”、“减小”或“不变”)
3.已知某温度下水的离子积常数为Kw,下列溶液一定呈酸性的是( )
A. c(OH-) < c(H+)的溶液 B. c(H+) <的溶液
C. 含H+的溶液 D. pH < 7的溶液
A
增大
减小
中性
逆向
增大
不变
巩固提升
完成教材 P68 第 1、2、3、6题
课后作业
