第27讲 共价键 分子结构与性质(基础课)(共114张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第27讲 共价键 分子结构与性质(基础课)(共114张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-04 21:48:19 | ||
图片预览









文档简介
(共114张PPT)
第27讲 共价键 分子结构与性质(基础课)
第三部分 物质结构与性质
第五章 物质结构与性质
1.了解粒子间作用(共价键、配位键、分子间作用力等)的类型、特征与实质。了解共价键的极性与类型(σ键、π键)。 2.能结合分子结构特点判断分子的极性、手性,并据此解释分子的一些典型性质。 3.了解杂化轨道理论及杂化轨道类型,能结合杂化轨道理论、价层电子对互斥模型推测分子或离子的空间结构,能利用键参数(键能、键长、键角)解释简单分子的某些性质。 4.了解配合物、超分子的组成、结构、形成与应用。
知识点一 共价键的分类与键参数
必备知识梳理
关键能力训练
01
1.共价键的特征与分类
(1)特征:具有方向性和____性。如O与H形成___个O—H 共价键且共价键夹角为105°。
饱和
2
(2)共价键的常见分类
头碰头
σ
σ
π
σ
π
肩并肩
σ
σ
分类依据 类型 判断
形成共价键的电子对是否偏移 极性键 共用电子对________
非极性键 共用电子对__________
发生偏移
不发生偏移
2.共价键的键参数
(1)定义
①键能:气态分子中1 mol 化学键解离成气态原子所吸收的能量。
②键长:构成化学键的两个原子的核间距。
③键角:在多原子分子中,两个相邻共价键之间的夹角。
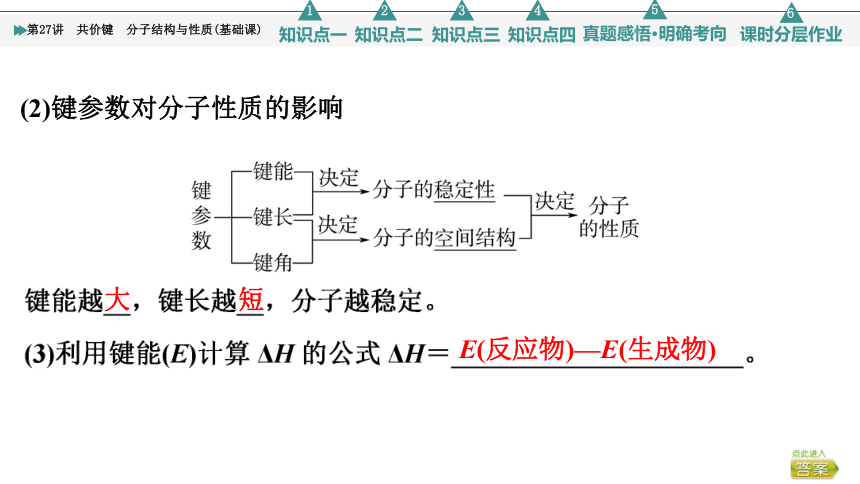
(2)键参数对分子性质的影响
大
短
E(反应物)—E(生成物)
1.判断正误(正确的打“√”,错误的打“×”)
(1)不存在H3、H2Cl和H3O分子说明共价键具有饱和性。( )
(2)所有σ键均具有方向性。( )
(3)从原子轨道重叠的角度来看,CO2分子中σ键与π键的个数比为1∶1。( )
(4)任何分子中的σ键都比π键稳定。( )
(5)H2O分子不是直线形而是V形说明共价键有方向性。( )
[答案] (1)√ (2)× (3)√ (4)× (5)√
共价键的分类及σ键、π键的计算
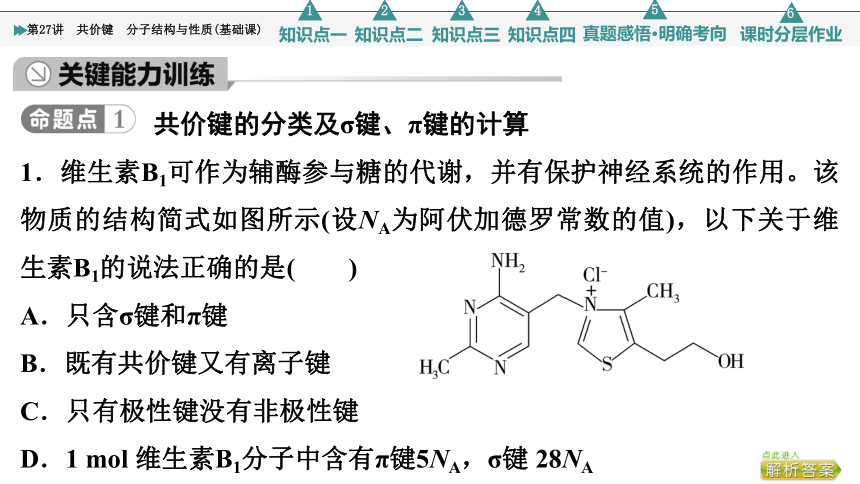
1.维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构简式如图所示(设NA为阿伏加德罗常数的值),以下关于维生素B1的说法正确的是( )
A.只含σ键和π键
B.既有共价键又有离子键
C.只有极性键没有非极性键
D.1 mol 维生素B1分子中含有π键5NA,σ键 28NA
B [由结构简式可知,分子中有单键和双键,所以存在σ键和π键,同时分子中还含有阴、阳离子,存在离子键,故A错误;根据A项分析,该物质既含有共价键又含有离子键,故B正确;由同种元素的原子形成的共价键为非极性键,由不同种元素的原子形成的共价键为极性键,该有机物中碳原子之间形成的为非极性键,故C错误;1 mol 维生素B1有36NA个σ键,故D错误。]
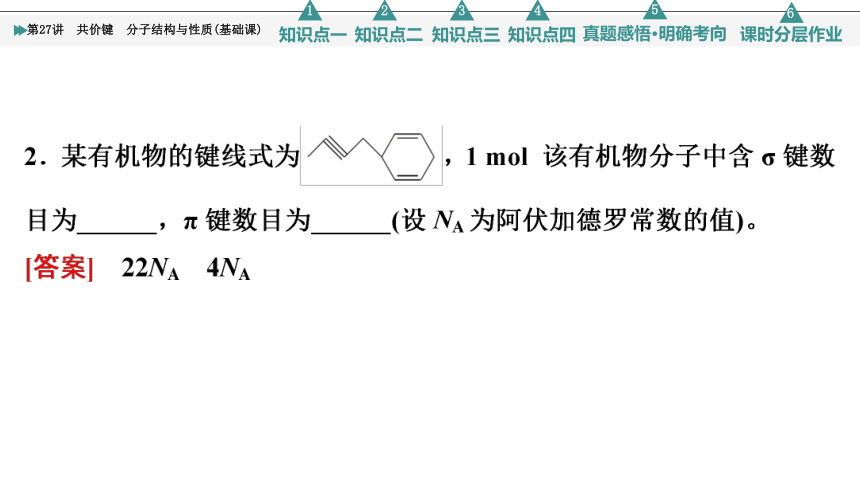
2.含碳元素的物质是化学世界中最庞大的家族,请填写下列空格(设NA为阿伏加德罗常数的值)。
(1)CH4中的化学键从形成过程来看,属于______(填“σ”或“π”)键,从其极性来看属于________键。
(2)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
(3)C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则1个C60分子中π键的数目为________。
[答案] (1)σ 极性 (2)1∶1 (3)30 (4)D (5)16NA (6)8NA 2NA
3.Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_________。
[答案] Ge的原子半径大,原子间形成的σ单键较长,p p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键
σ键、π键深化理解
(1)成键原子半径越大,π键越难形成,如Si、O难形成双键。
(2)σ键与π键由于原子轨道的重叠程度不同而导致了两者的稳定性不同,一般σ键比π键稳定,但N2中π键较稳定。
(3)配位键也属于σ键。
共价键的三个参数
键角比较的三种思维模板
(1)杂化类型不同,键角:sp>sp2>sp3。
4.下列说法正确的是( )
A.键角:BF3>CH4>H2O>NH3
B.分子或离子中键角:H2O<H3O+,NH3<NH
C.键能(作用能):氢键<范德华力<共价键
D.键长:C—H<N—H<O—H
5.已知几种共价键的键能如下:
下列说法错误的是( )
A.键能:N≡N>N===N>N—N
B.H(g)+Cl(g)===HCl(g) ΔH=-431.8 kJ·mol-1
C.H—N键能小于H—Cl键能,所以NH3的沸点高于HCl
D.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=-463.9 kJ·mol-1
C [A项,氮氮三键键长<氮氮双键键长<氮氮单键键长,键长越短,键能越大,所以键能:N≡N>N===N>N—N,正确;B项,H(g)+Cl(g)===HCl(g)的焓变为H—Cl键能的相反数,则ΔH=-431.8 kJ·mol-1,正确;C项,NH3的沸点高于HCl是由于NH3形成分子间氢键,而HCl不能,错误;D项,根据ΔH=E(反应物)-E(生成物),则2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=6E(H—N)+3E(Cl—Cl)-E(N≡N)-6E(H—Cl)=-463.9 kJ·mol-1,正确。]
6.比较下列分子中键角大小(用“>”或“<”表示)
(1)CO2________BCl3________CCl4
(2)H2S________PH3________SiH4
(3)NH3________PH3________AsH3
(4)PCl3________PBr3________PI3
[答案] (1)> > (2)< < (3)> > (4)< <
知识点二 配位化合物与超分子
02
必备知识梳理
关键能力训练
1.配位键和配合物
(1)配位键
①孤电子对:分子或离子中没有与其他原子共用的电子对。
②配位键:当共价键中共用的电子对是由其中一个原子或离子独自供给,另一原子或离子提供空轨道时,就形成配位键。即“电子对给予 接受”键。
③配位键的表示方法,如A→B:A表示____孤电子对的原子或离子,B表示接受电子对的原子或离子。
提供
(2)配位化合物
①概念:由________________与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物。
金属离子(或原子)
②配合物的组成
如[Cu(NH3)4]SO4
a.配体有孤电子对,如H2O、NH3、CO、F-、Cl-、CN-等。
b.中心原子或离子有空轨道,如Fe3+、Cu2+、Zn2+、Ag+等。
空轨道
孤电子对
配位数
NH3
当配体中有两种提供孤电子对的原子时,电负性小的为配位原子。如CO中的C,CN-中的C等。
Fe(SCN)3
3.超分子
(1)定义:由两种或两种以上的分子通过______________形成的分子聚集体。这里的分子也包含离子。
(2)特点:超分子这种分子聚集体,有的是有限的,有的是无限伸展的。
分子间相互作用
(3)应用
示例一:分离C60和C70
示例二:冠醚识别碱金属离子:冠醚与合适的碱金属离子形成超分子。
(4)特征:超分子的两特征分别为________和______。
分子识别
自组装
1.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法中正确的是( )
A.配体是Cl-和H2O,配位数是9
B.1 mol [TiCl(H2O)5]Cl2·H2O含有σ键的数目为12NA(设NA为阿伏加德罗常数的值)
C.内界和外界中Cl-的数目比是1∶2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
C [在[TiCl(H2O)5]Cl2·H2O中,中心离子是Ti3+,配体是Cl-、H2O,配位数为6,内界和外界的Cl-数目比是1∶2;配合物中,内界Cl-不与Ag+反应,外界中的Cl-与Ag+反应;1 mol [TiCl(H2O)5]Cl2·H2O含σ键数目为(6+5×2+2)NA=18NA,A、B、D错误。]
2.(1)(2020·山东等级考改编)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有___mol,该螯合物中N的杂化方式为______,配位原子是______,有______种配体。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为______,其中Fe的配位数为________。
(3)乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是______。
其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
(3)乙二胺中氮原子有孤对电子,Mg2+、Cu2+存在空轨道,两者易形成配位键。由于半径Cu2+>Mg2+、Cu2+的配位数比Mg2+大,故乙二胺与Cu2+形成的配合物更稳定。
3.配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银白色沉淀,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。上述配合物中,中心离子的配位数均为6。
请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3_____________________________________,
CoCl3·5NH3_____________________________________,
CoCl3·4NH3(绿色和紫色):_______________________。
[解析] 由题意知,四种配合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl、[Co(NH3)4Cl2]Cl。
[答案] [Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl
4.填表。
[答案] ①[Cu(CN)4]2- Cu2+ CN- 4 C ②[PtCl6]2- Pt4+ Cl- 6 Cl ③[Cd(NH3)4]2+ Cd2+ NH3 4 N ④[Fe(SCN)6]3- Fe3+ SCN- 6 S
知识点三 分子的空间结构
03
必备知识梳理
关键能力训练
1.价层电子对互斥模型及应用
(1)理论要点
①价层电子对在空间上彼此相距越远时,排斥力____,体系的能量越低。
②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角____。如H2O的键角____CH4的键角。
越小
越小
小于
(2)价层电子对的计算
当有孤电子对时,电子对空间结构与粒子空间结构不同,若有孤电子对,判断粒子空间结构时可省略孤电子对的空间。如NH3的电子对空间结构为四面体形,而分子空间结构为三角锥形。
(3)实例分析填表
直线形
直线形
平面
三角形
V形
四面体形
三角
锥形
V形
2.杂化轨道理论
(1)当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道的类型
1个s轨道
1个p轨道
180°
直线形
1个s轨道
2个p轨道
120°
平面三角形
1个s轨道
3个p轨道
109°28′
正四面体形
(3)实例分析
sp2
3
120°
平面
三角形
sp3
4
109°28′
正四面
体形
有机物中C、N、O的杂化类型判断
①含C有机物:2个σ键—sp,3个σ键—sp2,4个σ键—sp3。
②含N化合物:2个σ键—sp2,3个σ键—sp3。
③含O(S)化合物:2个σ键—sp3。
1.写出下列分子或离子的价层电子对数、粒子空间结构、中心原子杂化类型。
[答案] (1)2 直线形 sp (2)3 平面三角形 sp2 (3)4 三角锥形 sp3 (4)4 三角锥形 sp3 (5)4 正四面体形 sp3
1.(2022·茂名模拟)氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子的空间结构为平面三角形,则其阳离子的空间结构和阳离子中氮的杂化方式为( )
A.直线形 sp杂化
B.V形 sp2杂化
C.三角锥形 sp3杂化
D.平面三角形 sp2杂化
2.(1)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式。
(2)SOCl2的空间结构为________,中心原子杂化类型为________。
3.(1)CuSO4稀溶液中存在[Cu(H2O)6]2+,[Cu(H2O)6]2+的空间结构为_______;下列对[Cu(H2O)6]2+中Cu2+杂化方式推断合理的是_____(填标号)。
A.sp3 B.sp3d
C.sp3d2 D.dsp2
(2)Cu2+可形成[Cu(en)2NH3](BF4)2,其中en代表H2N—CH2—CH2—NH2。该化合物分子中,VSEPR模型为四面体的非金属原子共有________个。
[答案] (1)八面体形 C (2)11
4.SiCl4可发生水解反应,机理如下:
(1)机理中涉及的物质中Si的杂化类型有________。
(2)机理中中间体Si原子的价层电子对空间结构为________(填字母)。
a.正四面体 b.三角双锥 c.正八面体
[答案] (1)sp3、sp3d (2)b
中心原子杂化类型5种判断方法
(1)根据杂化轨道的空间结构
①直线形—sp,②平面三角形—sp2,③四面体形—sp3,④三角双锥—sp3d,⑤正八面体—sp3d2,⑥平面四边形—sp2d。
(2)根据杂化轨道间的夹角
①109°28′—sp3,②120°—sp2,③180°—sp。
知识点四 分子间作用力与分子性质
04
必备知识梳理
关键能力训练
1.分子间作用力
(1)概念:物质分子之间____存在的相互作用力,称为分子间作用力。
(2)分类:分子间作用力最常见的是________和____。
(3)强弱:范德华力__氢键__化学键。
普遍
范德华力
氢键
<
<
(4)范德华力:范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点越高,硬度越大。一般来说,__________相似的物质,随着____________的增加,范德华力逐渐____;分子的极性越大,范德华力也越大。
组成和结构
相对分子质量
增大
(5)氢键
①形成:已经与__________的原子形成共价键的______与另一个__________的原子之间形成的作用力,称为氢键。
②表示方法:X—H…Y—。
a.X、Y为电负性很大的原子,一般为N、O、F三种元素的原子。
b.X、Y可以相同,也可以不同。
电负性很大
氢原子
电负性很大
③特征:具有一定的饱和性和方向性。如在冰中每个H2O分子周围四面体的4个方向形成4个氢键。
分子内
升高
2.分子的性质
(1)分子的极性
(2)分子的溶解性
①“相似相溶”的规律:非极性溶质一般能溶于__________,极性溶质一般能溶于________。
如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好,如NH3极易溶于水。
非极性溶剂
极性溶剂
②“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶(C2H5OH和H2O中的羟基相近),而戊醇在水中的溶解度明显减小。
③分子与H2O反应,也能促进分子在水中的溶解,如SO2、NO2。
(3)分子的手性
①手性异构:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为____,却在三维空间里________的现象。
②手性分子:有__________的分子叫做手性分子。
③手性碳原子:在有机物分子中,连有____不同基团的碳原子。含有
镜像
不能叠合
手性异构体
四个
(4)分子的酸性——利用键极性判断酸性
①R—COOH的酸性强弱
a.R—极性越大,吸引电子能力越强,—COOH中—OH极性越大,越易电离,酸性越强。如F3C—COOH>Cl3C—COOH>Cl2CHCOOH>ClCH2COOH>CH3COOH。
b.烃基(R—)为推电子基团,烃基越长推电子效应越大,—COOH中—OH极性越小,酸性越弱。如HCOOH>CH3COOH>CH3CH2COOH。
②无机含氧酸[(HO)mROn]的酸性强弱
(HO)mROn中n越大,R的化合价越高,吸引电子能力越强,—OH极性越大,酸性越强,如HClO<HClO2<HClO3<HClO4。
判断正误(正确的打“√”,错误的打“×”)
(1)任何分子间存在范德华力,任何含氢原子的分子间均存在氢键。( )
(2)氢键是特殊的分子间作用力,不是化学键。( )
(3)O3分子属于极性分子,分子中的共价键是极性键,中心氧原子是呈正电性的。( )
(4)非极性分子不含极性键,极性分子含极性键。( )
(5)F3CCOOH的酸性比Cl3CCOOH的强是因为F3C—极性比Cl3C—的极性大。( )
(6)由于水分子间存在氢键,故水分子很稳定。( )
[答案] (1)× (2)√ (3)√ (4)× (5)√ (6)×
分子间作用力及对物质性质的影响
1.(2022·厦门模拟)下列说法错误的是( )
A.甘油和水可以任意比例互溶的原因之一为甘油与水能形成分子间氢键
B.H2O的沸点高于HF,是因为前者的氢键作用较大
C.氢氟酸水溶液中氢键的类型有 F—H…F、F—H…O、O—H…F、O—H…O
B [甘油为丙三醇,因其能与水形成分子间氢键,故可与水以任意比例互溶,A正确;水的沸点比氢氟酸高,是因为等物质的量情况下,前者比后者含有的氢键数目多,但氢键作用力氢氟酸比较高,B错误;氢氟酸水溶液中共有两种不同的氢原子,可以分别与F、O原子形成氢键,故氢氟酸水溶液中氢键类型有四种,C正确;邻羟基苯甲醛易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,分子内氢键使分子熔点降低,分子间氢键使分子熔点升高,D正确。]
(3)有一类组成最简单的有机硅化合物叫硅烷。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________。
分子的极性、手性与酸性
3.(1)已知H2O2分子的结构如图所示,H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。
请完成下列问题:
①H2O2分子是含有________键和________键的________(填“极性”或“非极性”)分子。
②H2O2难溶于CS2,简要说明理由:________。
[答案] (1)①极性 非极性 极性 ②H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”的规律,H2O2难溶于CS2 (2)< HIO4分子中非羟基氧较多 (3)2
4.已知:三氟乙酸(CF3COOH)的酸性强于三氯乙酸(CCl3COOH)的酸性。下列对于该事实的解释不正确的是 ( )
A.CF3COOH的相对分子质量小于CCl3COOH的
B.氟的电负性强于氯的电负性
C.CF3COOH分子中的羟基更易电离
D.F—C的极性强于Cl—C的极性
[答案] A
5.下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.CCl4、CHCl3
[答案] B
分子极性的判断方法
(1)ABn型分子的空间结构与极性
(2)只含非极性键的分子一定是非极性分子,如H2、P4等,但O3中含极性键为极性分子。
(3)含极性键的双原子分子一定是极性分子,如HCl、CO等。
真题感悟·明确考向
05
1.(2022·辽宁选择性考试,T8)理论化学模拟得到一种N 离子,结构如图。下列关于该离子的说法错误的是( )
A.所有原子均满足8电子结构
B.N原子的杂化方式有2种
C.空间结构为四面体形
D.常温下不稳定
1
3
5
2
4
6
B [中心N原子为sp3杂化,与中心N原子直接相连的N原子为sp2杂化,与端位N原子直接相连的N原子为sp杂化,端位N原子为sp2杂化,则N原子的杂化方式有3种,B错误。]
1
3
5
2
4
6
2.(2021·山东等级考,T9)关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )
A.CH3OH为极性分子
B.N2H4空间结构为平面形
C.N2H4的沸点高于(CH3)2NNH2
D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
1
3
5
2
4
6
B [甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由极性键组成的极性分子,A正确;N2H4中N原子的杂化方式为sp3,不是平面形结构,B错误;N2H4分子中连接N原子的H原子数多,存在氢键的数目多,而偏二甲肼只有一端可以形成氢键,另一端的两个甲基基团比较大,影响了分子的排列,沸点较N2H4的低,C正确;CH3OH为四面体结构,—OH结构类似于水的结构,(CH3)2NNH2的结构简式为 ,两者分子中C、O、N杂化方式均为sp3,D正确。]
1
3
5
2
4
6
1
3
5
2
4
6
1
3
5
2
4
6
1
3
5
2
4
6
1
3
5
2
4
6
4.(2022·全国乙卷,T35节选)(1)一氯乙烯(C2H3Cl)分子中,C的一个__________杂化轨道与Cl的3px轨道形成C—Cl________键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键(Π)。
(2)一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是____________,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键越强;(ⅱ)__________。
2
3
4
1
5
6
2
3
4
1
5
6
[答案] (1)sp2 σ (2)一氯乙烷>一氯乙烯>一氯乙炔 Cl参与形成的大π键越多,形成的C—Cl键的键长越短
2
3
4
1
5
6
1
3
5
2
4
6
(3)(湖南选择性考试)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中σ键与π键的数目比为________;
②富马酸亚铁中各元素的电负性由大到小的顺序为________。
1
3
5
2
4
6
1
3
2
4
6
5
1
3
2
4
6
5
1
3
2
4
6
5
[答案] sp2、sp3 N>C>H 54
1
3
2
4
6
5
谢谢观看 THANK YOU!
第27讲 共价键 分子结构与性质(基础课)
第三部分 物质结构与性质
第五章 物质结构与性质
1.了解粒子间作用(共价键、配位键、分子间作用力等)的类型、特征与实质。了解共价键的极性与类型(σ键、π键)。 2.能结合分子结构特点判断分子的极性、手性,并据此解释分子的一些典型性质。 3.了解杂化轨道理论及杂化轨道类型,能结合杂化轨道理论、价层电子对互斥模型推测分子或离子的空间结构,能利用键参数(键能、键长、键角)解释简单分子的某些性质。 4.了解配合物、超分子的组成、结构、形成与应用。
知识点一 共价键的分类与键参数
必备知识梳理
关键能力训练
01
1.共价键的特征与分类
(1)特征:具有方向性和____性。如O与H形成___个O—H 共价键且共价键夹角为105°。
饱和
2
(2)共价键的常见分类
头碰头
σ
σ
π
σ
π
肩并肩
σ
σ
分类依据 类型 判断
形成共价键的电子对是否偏移 极性键 共用电子对________
非极性键 共用电子对__________
发生偏移
不发生偏移
2.共价键的键参数
(1)定义
①键能:气态分子中1 mol 化学键解离成气态原子所吸收的能量。
②键长:构成化学键的两个原子的核间距。
③键角:在多原子分子中,两个相邻共价键之间的夹角。
(2)键参数对分子性质的影响
大
短
E(反应物)—E(生成物)
1.判断正误(正确的打“√”,错误的打“×”)
(1)不存在H3、H2Cl和H3O分子说明共价键具有饱和性。( )
(2)所有σ键均具有方向性。( )
(3)从原子轨道重叠的角度来看,CO2分子中σ键与π键的个数比为1∶1。( )
(4)任何分子中的σ键都比π键稳定。( )
(5)H2O分子不是直线形而是V形说明共价键有方向性。( )
[答案] (1)√ (2)× (3)√ (4)× (5)√
共价键的分类及σ键、π键的计算
1.维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构简式如图所示(设NA为阿伏加德罗常数的值),以下关于维生素B1的说法正确的是( )
A.只含σ键和π键
B.既有共价键又有离子键
C.只有极性键没有非极性键
D.1 mol 维生素B1分子中含有π键5NA,σ键 28NA
B [由结构简式可知,分子中有单键和双键,所以存在σ键和π键,同时分子中还含有阴、阳离子,存在离子键,故A错误;根据A项分析,该物质既含有共价键又含有离子键,故B正确;由同种元素的原子形成的共价键为非极性键,由不同种元素的原子形成的共价键为极性键,该有机物中碳原子之间形成的为非极性键,故C错误;1 mol 维生素B1有36NA个σ键,故D错误。]
2.含碳元素的物质是化学世界中最庞大的家族,请填写下列空格(设NA为阿伏加德罗常数的值)。
(1)CH4中的化学键从形成过程来看,属于______(填“σ”或“π”)键,从其极性来看属于________键。
(2)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
(3)C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则1个C60分子中π键的数目为________。
[答案] (1)σ 极性 (2)1∶1 (3)30 (4)D (5)16NA (6)8NA 2NA
3.Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是_________。
[答案] Ge的原子半径大,原子间形成的σ单键较长,p p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键
σ键、π键深化理解
(1)成键原子半径越大,π键越难形成,如Si、O难形成双键。
(2)σ键与π键由于原子轨道的重叠程度不同而导致了两者的稳定性不同,一般σ键比π键稳定,但N2中π键较稳定。
(3)配位键也属于σ键。
共价键的三个参数
键角比较的三种思维模板
(1)杂化类型不同,键角:sp>sp2>sp3。
4.下列说法正确的是( )
A.键角:BF3>CH4>H2O>NH3
B.分子或离子中键角:H2O<H3O+,NH3<NH
C.键能(作用能):氢键<范德华力<共价键
D.键长:C—H<N—H<O—H
5.已知几种共价键的键能如下:
下列说法错误的是( )
A.键能:N≡N>N===N>N—N
B.H(g)+Cl(g)===HCl(g) ΔH=-431.8 kJ·mol-1
C.H—N键能小于H—Cl键能,所以NH3的沸点高于HCl
D.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=-463.9 kJ·mol-1
C [A项,氮氮三键键长<氮氮双键键长<氮氮单键键长,键长越短,键能越大,所以键能:N≡N>N===N>N—N,正确;B项,H(g)+Cl(g)===HCl(g)的焓变为H—Cl键能的相反数,则ΔH=-431.8 kJ·mol-1,正确;C项,NH3的沸点高于HCl是由于NH3形成分子间氢键,而HCl不能,错误;D项,根据ΔH=E(反应物)-E(生成物),则2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=6E(H—N)+3E(Cl—Cl)-E(N≡N)-6E(H—Cl)=-463.9 kJ·mol-1,正确。]
6.比较下列分子中键角大小(用“>”或“<”表示)
(1)CO2________BCl3________CCl4
(2)H2S________PH3________SiH4
(3)NH3________PH3________AsH3
(4)PCl3________PBr3________PI3
[答案] (1)> > (2)< < (3)> > (4)< <
知识点二 配位化合物与超分子
02
必备知识梳理
关键能力训练
1.配位键和配合物
(1)配位键
①孤电子对:分子或离子中没有与其他原子共用的电子对。
②配位键:当共价键中共用的电子对是由其中一个原子或离子独自供给,另一原子或离子提供空轨道时,就形成配位键。即“电子对给予 接受”键。
③配位键的表示方法,如A→B:A表示____孤电子对的原子或离子,B表示接受电子对的原子或离子。
提供
(2)配位化合物
①概念:由________________与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物。
金属离子(或原子)
②配合物的组成
如[Cu(NH3)4]SO4
a.配体有孤电子对,如H2O、NH3、CO、F-、Cl-、CN-等。
b.中心原子或离子有空轨道,如Fe3+、Cu2+、Zn2+、Ag+等。
空轨道
孤电子对
配位数
NH3
当配体中有两种提供孤电子对的原子时,电负性小的为配位原子。如CO中的C,CN-中的C等。
Fe(SCN)3
3.超分子
(1)定义:由两种或两种以上的分子通过______________形成的分子聚集体。这里的分子也包含离子。
(2)特点:超分子这种分子聚集体,有的是有限的,有的是无限伸展的。
分子间相互作用
(3)应用
示例一:分离C60和C70
示例二:冠醚识别碱金属离子:冠醚与合适的碱金属离子形成超分子。
(4)特征:超分子的两特征分别为________和______。
分子识别
自组装
1.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法中正确的是( )
A.配体是Cl-和H2O,配位数是9
B.1 mol [TiCl(H2O)5]Cl2·H2O含有σ键的数目为12NA(设NA为阿伏加德罗常数的值)
C.内界和外界中Cl-的数目比是1∶2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
C [在[TiCl(H2O)5]Cl2·H2O中,中心离子是Ti3+,配体是Cl-、H2O,配位数为6,内界和外界的Cl-数目比是1∶2;配合物中,内界Cl-不与Ag+反应,外界中的Cl-与Ag+反应;1 mol [TiCl(H2O)5]Cl2·H2O含σ键数目为(6+5×2+2)NA=18NA,A、B、D错误。]
2.(1)(2020·山东等级考改编)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物中通过螯合作用形成的配位键有___mol,该螯合物中N的杂化方式为______,配位原子是______,有______种配体。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为______,其中Fe的配位数为________。
(3)乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是______。
其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
(3)乙二胺中氮原子有孤对电子,Mg2+、Cu2+存在空轨道,两者易形成配位键。由于半径Cu2+>Mg2+、Cu2+的配位数比Mg2+大,故乙二胺与Cu2+形成的配合物更稳定。
3.配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银白色沉淀,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。上述配合物中,中心离子的配位数均为6。
请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3_____________________________________,
CoCl3·5NH3_____________________________________,
CoCl3·4NH3(绿色和紫色):_______________________。
[解析] 由题意知,四种配合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl、[Co(NH3)4Cl2]Cl。
[答案] [Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl
4.填表。
[答案] ①[Cu(CN)4]2- Cu2+ CN- 4 C ②[PtCl6]2- Pt4+ Cl- 6 Cl ③[Cd(NH3)4]2+ Cd2+ NH3 4 N ④[Fe(SCN)6]3- Fe3+ SCN- 6 S
知识点三 分子的空间结构
03
必备知识梳理
关键能力训练
1.价层电子对互斥模型及应用
(1)理论要点
①价层电子对在空间上彼此相距越远时,排斥力____,体系的能量越低。
②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角____。如H2O的键角____CH4的键角。
越小
越小
小于
(2)价层电子对的计算
当有孤电子对时,电子对空间结构与粒子空间结构不同,若有孤电子对,判断粒子空间结构时可省略孤电子对的空间。如NH3的电子对空间结构为四面体形,而分子空间结构为三角锥形。
(3)实例分析填表
直线形
直线形
平面
三角形
V形
四面体形
三角
锥形
V形
2.杂化轨道理论
(1)当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道的类型
1个s轨道
1个p轨道
180°
直线形
1个s轨道
2个p轨道
120°
平面三角形
1个s轨道
3个p轨道
109°28′
正四面体形
(3)实例分析
sp2
3
120°
平面
三角形
sp3
4
109°28′
正四面
体形
有机物中C、N、O的杂化类型判断
①含C有机物:2个σ键—sp,3个σ键—sp2,4个σ键—sp3。
②含N化合物:2个σ键—sp2,3个σ键—sp3。
③含O(S)化合物:2个σ键—sp3。
1.写出下列分子或离子的价层电子对数、粒子空间结构、中心原子杂化类型。
[答案] (1)2 直线形 sp (2)3 平面三角形 sp2 (3)4 三角锥形 sp3 (4)4 三角锥形 sp3 (5)4 正四面体形 sp3
1.(2022·茂名模拟)氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子的空间结构为平面三角形,则其阳离子的空间结构和阳离子中氮的杂化方式为( )
A.直线形 sp杂化
B.V形 sp2杂化
C.三角锥形 sp3杂化
D.平面三角形 sp2杂化
2.(1)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式。
(2)SOCl2的空间结构为________,中心原子杂化类型为________。
3.(1)CuSO4稀溶液中存在[Cu(H2O)6]2+,[Cu(H2O)6]2+的空间结构为_______;下列对[Cu(H2O)6]2+中Cu2+杂化方式推断合理的是_____(填标号)。
A.sp3 B.sp3d
C.sp3d2 D.dsp2
(2)Cu2+可形成[Cu(en)2NH3](BF4)2,其中en代表H2N—CH2—CH2—NH2。该化合物分子中,VSEPR模型为四面体的非金属原子共有________个。
[答案] (1)八面体形 C (2)11
4.SiCl4可发生水解反应,机理如下:
(1)机理中涉及的物质中Si的杂化类型有________。
(2)机理中中间体Si原子的价层电子对空间结构为________(填字母)。
a.正四面体 b.三角双锥 c.正八面体
[答案] (1)sp3、sp3d (2)b
中心原子杂化类型5种判断方法
(1)根据杂化轨道的空间结构
①直线形—sp,②平面三角形—sp2,③四面体形—sp3,④三角双锥—sp3d,⑤正八面体—sp3d2,⑥平面四边形—sp2d。
(2)根据杂化轨道间的夹角
①109°28′—sp3,②120°—sp2,③180°—sp。
知识点四 分子间作用力与分子性质
04
必备知识梳理
关键能力训练
1.分子间作用力
(1)概念:物质分子之间____存在的相互作用力,称为分子间作用力。
(2)分类:分子间作用力最常见的是________和____。
(3)强弱:范德华力__氢键__化学键。
普遍
范德华力
氢键
<
<
(4)范德华力:范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点越高,硬度越大。一般来说,__________相似的物质,随着____________的增加,范德华力逐渐____;分子的极性越大,范德华力也越大。
组成和结构
相对分子质量
增大
(5)氢键
①形成:已经与__________的原子形成共价键的______与另一个__________的原子之间形成的作用力,称为氢键。
②表示方法:X—H…Y—。
a.X、Y为电负性很大的原子,一般为N、O、F三种元素的原子。
b.X、Y可以相同,也可以不同。
电负性很大
氢原子
电负性很大
③特征:具有一定的饱和性和方向性。如在冰中每个H2O分子周围四面体的4个方向形成4个氢键。
分子内
升高
2.分子的性质
(1)分子的极性
(2)分子的溶解性
①“相似相溶”的规律:非极性溶质一般能溶于__________,极性溶质一般能溶于________。
如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好,如NH3极易溶于水。
非极性溶剂
极性溶剂
②“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶(C2H5OH和H2O中的羟基相近),而戊醇在水中的溶解度明显减小。
③分子与H2O反应,也能促进分子在水中的溶解,如SO2、NO2。
(3)分子的手性
①手性异构:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为____,却在三维空间里________的现象。
②手性分子:有__________的分子叫做手性分子。
③手性碳原子:在有机物分子中,连有____不同基团的碳原子。含有
镜像
不能叠合
手性异构体
四个
(4)分子的酸性——利用键极性判断酸性
①R—COOH的酸性强弱
a.R—极性越大,吸引电子能力越强,—COOH中—OH极性越大,越易电离,酸性越强。如F3C—COOH>Cl3C—COOH>Cl2CHCOOH>ClCH2COOH>CH3COOH。
b.烃基(R—)为推电子基团,烃基越长推电子效应越大,—COOH中—OH极性越小,酸性越弱。如HCOOH>CH3COOH>CH3CH2COOH。
②无机含氧酸[(HO)mROn]的酸性强弱
(HO)mROn中n越大,R的化合价越高,吸引电子能力越强,—OH极性越大,酸性越强,如HClO<HClO2<HClO3<HClO4。
判断正误(正确的打“√”,错误的打“×”)
(1)任何分子间存在范德华力,任何含氢原子的分子间均存在氢键。( )
(2)氢键是特殊的分子间作用力,不是化学键。( )
(3)O3分子属于极性分子,分子中的共价键是极性键,中心氧原子是呈正电性的。( )
(4)非极性分子不含极性键,极性分子含极性键。( )
(5)F3CCOOH的酸性比Cl3CCOOH的强是因为F3C—极性比Cl3C—的极性大。( )
(6)由于水分子间存在氢键,故水分子很稳定。( )
[答案] (1)× (2)√ (3)√ (4)× (5)√ (6)×
分子间作用力及对物质性质的影响
1.(2022·厦门模拟)下列说法错误的是( )
A.甘油和水可以任意比例互溶的原因之一为甘油与水能形成分子间氢键
B.H2O的沸点高于HF,是因为前者的氢键作用较大
C.氢氟酸水溶液中氢键的类型有 F—H…F、F—H…O、O—H…F、O—H…O
B [甘油为丙三醇,因其能与水形成分子间氢键,故可与水以任意比例互溶,A正确;水的沸点比氢氟酸高,是因为等物质的量情况下,前者比后者含有的氢键数目多,但氢键作用力氢氟酸比较高,B错误;氢氟酸水溶液中共有两种不同的氢原子,可以分别与F、O原子形成氢键,故氢氟酸水溶液中氢键类型有四种,C正确;邻羟基苯甲醛易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,分子内氢键使分子熔点降低,分子间氢键使分子熔点升高,D正确。]
(3)有一类组成最简单的有机硅化合物叫硅烷。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________。
分子的极性、手性与酸性
3.(1)已知H2O2分子的结构如图所示,H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。
请完成下列问题:
①H2O2分子是含有________键和________键的________(填“极性”或“非极性”)分子。
②H2O2难溶于CS2,简要说明理由:________。
[答案] (1)①极性 非极性 极性 ②H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”的规律,H2O2难溶于CS2 (2)< HIO4分子中非羟基氧较多 (3)2
4.已知:三氟乙酸(CF3COOH)的酸性强于三氯乙酸(CCl3COOH)的酸性。下列对于该事实的解释不正确的是 ( )
A.CF3COOH的相对分子质量小于CCl3COOH的
B.氟的电负性强于氯的电负性
C.CF3COOH分子中的羟基更易电离
D.F—C的极性强于Cl—C的极性
[答案] A
5.下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.CCl4、CHCl3
[答案] B
分子极性的判断方法
(1)ABn型分子的空间结构与极性
(2)只含非极性键的分子一定是非极性分子,如H2、P4等,但O3中含极性键为极性分子。
(3)含极性键的双原子分子一定是极性分子,如HCl、CO等。
真题感悟·明确考向
05
1.(2022·辽宁选择性考试,T8)理论化学模拟得到一种N 离子,结构如图。下列关于该离子的说法错误的是( )
A.所有原子均满足8电子结构
B.N原子的杂化方式有2种
C.空间结构为四面体形
D.常温下不稳定
1
3
5
2
4
6
B [中心N原子为sp3杂化,与中心N原子直接相连的N原子为sp2杂化,与端位N原子直接相连的N原子为sp杂化,端位N原子为sp2杂化,则N原子的杂化方式有3种,B错误。]
1
3
5
2
4
6
2.(2021·山东等级考,T9)关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )
A.CH3OH为极性分子
B.N2H4空间结构为平面形
C.N2H4的沸点高于(CH3)2NNH2
D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
1
3
5
2
4
6
B [甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由极性键组成的极性分子,A正确;N2H4中N原子的杂化方式为sp3,不是平面形结构,B错误;N2H4分子中连接N原子的H原子数多,存在氢键的数目多,而偏二甲肼只有一端可以形成氢键,另一端的两个甲基基团比较大,影响了分子的排列,沸点较N2H4的低,C正确;CH3OH为四面体结构,—OH结构类似于水的结构,(CH3)2NNH2的结构简式为 ,两者分子中C、O、N杂化方式均为sp3,D正确。]
1
3
5
2
4
6
1
3
5
2
4
6
1
3
5
2
4
6
1
3
5
2
4
6
1
3
5
2
4
6
4.(2022·全国乙卷,T35节选)(1)一氯乙烯(C2H3Cl)分子中,C的一个__________杂化轨道与Cl的3px轨道形成C—Cl________键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键(Π)。
(2)一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺序是____________,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C—Cl键越强;(ⅱ)__________。
2
3
4
1
5
6
2
3
4
1
5
6
[答案] (1)sp2 σ (2)一氯乙烷>一氯乙烯>一氯乙炔 Cl参与形成的大π键越多,形成的C—Cl键的键长越短
2
3
4
1
5
6
1
3
5
2
4
6
(3)(湖南选择性考试)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中σ键与π键的数目比为________;
②富马酸亚铁中各元素的电负性由大到小的顺序为________。
1
3
5
2
4
6
1
3
2
4
6
5
1
3
2
4
6
5
1
3
2
4
6
5
[答案] sp2、sp3 N>C>H 54
1
3
2
4
6
5
谢谢观看 THANK YOU!
同课章节目录
