安徽省桐城名校2023-2024学年高二上学期10月教学质量检测化学试题(含答案)
文档属性
| 名称 | 安徽省桐城名校2023-2024学年高二上学期10月教学质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 09:17:21 | ||
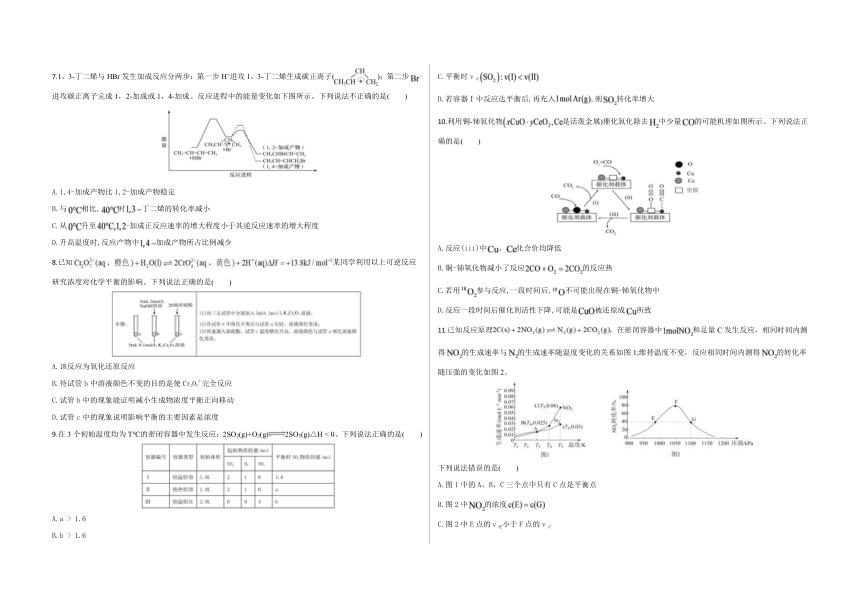
图片预览


文档简介
桐城名校2023-2024学年高二上学期10月教学质量检测
化学
(考试总分:100 分 考试时长: 90 分钟)
一、 单选题 (本题共计11小题,总分33分)
1.2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是( )
A.液氮—液氢 B.液氧—液氢 C.液态—肼 D.液氧—煤油
2.下列关于反应热的说法正确的是( )
A.,恒温恒压下达平衡后加入,上述反应增大
B.和反应的中和热,则稀和Ba(OH)2反应生成的反应热
C.一定条件下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为
D.a.b.,若a、b反应放热,则
3.下列选项正确的是( )
A.图①可表示的能量变化
B.图②中表示碳的燃烧热
C.实验的环境温度为,将物质的量浓度相等、体积分别为、的、溶液混合,测得混合液最高温度如图③所示(已知)
D.已知稳定性:,某反应由两步构成,反应过程中的能量变化曲线如图④所示
4.室温下,下列实验探究方案能达到探究目的的是( )
A.A B.B C.C D.D
5.一定量的气体在密闭容器中发生反应:,平衡时测得A的浓度为,保持温度不变,将容器的容积扩大到原来的2倍,再次达到平衡后,测得A的浓度降低为。下列有关判断正确的是( )
A.混合气体的相对平均分子量增大 B.
C.物质C的体积分数降低 D.物质B的转化率升高
6.一定条件下,通过下列反应可以制备特种陶瓷的原料:,该反应在某密闭容器中达到平衡。下列分析正确的是( )
A.恒温恒容时,充入CO气体,达到新平衡时增大
B.容积不变时,升高温度,混合气体的平均相对分子质量减小
C.恒温恒容时,分离出部分气体可提高的转化率
D.恒温时,增大压强平衡逆向移动,平衡常数减小
7.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。下列说法不正确的是( )
A.1,4-加成产物比1,2-加成产物稳定
B.与相比,时丁二烯的转化率减小
C.从升至-加成正反应速率的增大程度小于其逆反应速率的增大程度
D.升高温度时,反应产物中加成产物所占比例减少
8.已知:某同学利用以上可逆反应研究浓度对化学平衡的影响。下列说法正确的是( )
A.该反应为氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C.试管b中的现象能证明减小生成物浓度平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是浓度
9.在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g)△H < 0。下列说法正确的是( )
A.a > 1.6
B.b > 1.6
C.平衡时v正
D.若容器Ⅰ中反应达平衡后,再充入,则转化率增大
10.利用铜-铈氧化物是活泼金属)催化氧化除去中少量的可能机理如图所示。下列说法正确的是( )
A.反应(iii)中、化合价均降低
B.铜-铈氧化物减小了反应的反应热
C.若用参与反应,一段时间后,不可能出现在铜-铈氧化物中
D.反应一段时间后催化剂活性下降,可能是被还原成所致
11.已知反应原理,在密闭容器中和足量C发生反应,相同时间内测得的生成速率与的生成速率随温度变化的关系如图1;维持温度不变,反应相同时间内测得的转化率随压强的变化如图2。
下列说法错误的是( )
A.图1中的A、B、C三个点中只有C点是平衡点
B.图2中的浓度
C.图2中E点的v逆小于F点的v正
D.图2中平衡常数
二、 多选题 (本题共计3小题,总分12分)
12.在恒温恒容条件下,可逆反应,若随着温度升高(物质状态不发生改变),气体密度变大,则下列判断正确的是( )
A.A和C可以一个是固体、一个是液体
B.A和C可以都是气体
C.若A为气体,则正反应一定是放热反应
D.其他条件不变,平衡后压缩容器体积,B的浓度一定比原平衡大
13.利用甲烷可减少污染,反应原理如下:。时,将与的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示。
下列说法正确的是( )
A.c点时反应达平衡态
B.若,则产生的量:ab段 < bc段
C.a、b、c、d四点对应的平衡常数大小:
D.d点的正反应速率大于c点的逆反应速率
14.在起始时向恒容密闭容器中加入、及,发生反应:,测得平衡时气体体积分数与温度的关系如图所示(固体物质所占体积忽略不计),下列说法正确的是( )
A.该反应的正反应为放热反应
B.M点与N点H2的转化率之比为4:3
C.M点与N点的压强之比为15:16
D.若保持M点条件不变,再冲入H2、CO及H2O(g)各0.1mol,则达平衡前v(正) < v(逆)
三、 综合题 (本题共计3小题,总分44分)
15.(16分)Ⅰ.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。已知:达平衡后,若其他条件不变将容器体积缩小至原来一半,其气体平均摩尔质量不变。
(1)该反应的化学方程式可表示为_________________________________。
(2)下列条件的改变能减慢其反应速率的是_________(填序号)。
①降低温度
②增加X的物质的量
③保持压强不变,充入He使容器的体积增大
④保持容积不变,充入He使体系压强增大
Ⅱ.碳中和作为一种新型环保形式可推动全社会绿色发展。复合催化是工业合成甲醇,沸点的重要反应。在2L密闭容器中,充入和,在催化剂、的条件下发生反应。部分反应物和产物随时间变化如图所示:
(3)反应开始至末,以的浓度变化表示该反应的平均速率_____________。
(4)下列情况不能说明该反应达到化学平衡状态的是_________(填字母)。
Ⅲ.某校化学兴趣小组对、进行了深入的研究。
(5)该兴趣小组同学对反应进行了研究,保持其他条件不变,改变的物质的量,平衡时的体积分数变化情况如图所示。平衡时的体积分数a、b、c三点转化率由小到大的顺序为_______________;b点时的投料________________。
(6)向恒容密闭容器中通入一定量,发生反应,达到平衡后,降低温度,混合气体颜色变浅。
①若需要测定的相对分子质量,为了测定更准确,则需要的外界条件为_____________。
②该反应达到平衡时,向恒容密闭容器中通入一定量,则再次达到平衡时,的物质的量分数将_____________(填“升高”“不变”“降低”)。
A.
B.单位时间内消耗,同时生成
C.的物质的量保持不变
D.密闭容器中不发生变化时
E.密闭容器内气体压强不发生变化时
16.(13分)合理利用和转化、、、等污染性气体是环保领域的重要课题。
(1)已知的反应历程分两步:
①
②
一定温度下,反应达到平衡状态,该反应的平衡常数的表达式____________(用、、,反应①的活化能与反应②的活化能的大小关系为_________(填“ > ”“ < ”或“=”)。
(2)氢气可将还原为甲烷,反应为。
①ShyamKatte1等结合实验与计算机模拟结果,研究了在催化剂表面上与的反应历程,前三步历程如图所示,其中吸附在催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会________________(填“放出热量”或“吸收热量”);反应历程中最小能垒步骤的化学方程式为________________________。
②、分别与反应生成的与T的关系如图所示。容器中只发生反应Ⅰ,a点:(正)______________(填“大于”、“小于”或“等于”(逆)。时,容器中同时发生反应Ⅰ和反应,则的______________。
17.(16分)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应的_________。
(2)研究表明,合成氨反应在催化剂上可能通过图2机理进行表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为___________(填步骤前的标号),理由是_____________________________。
(3)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为、,另一种为、、。(物质的摩尔分数:)
①图中压强由小到大的顺序为______________________
②进料组成中含有惰性气体的图是___________,判断的理由是_________________。
③图3中,当、时,氮气的转化率___________。设为相对压力平衡常数,其表达式中,用相对分压(分压除以)代替分压进行计算。该温度时,反应的平衡常数___________(化为最简式)。
四、 实验题 (本题共计1小题,总分10分)
18.(10分)某同学设计实验探究丙酮碘化反应中,丙酮、、浓度对化学反应速率的影响。
已知:
(1)研究丙酮浓度对反应速率的影响,应选择的实验为_________和_________。
(2)实验④中,a=_________,加蒸馏水的目的是____________________________。
(3)计算实验③中,以表示的反应速率为_________(列出表达式)
(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和的浓度有关,而与的浓度无关,查阅资料发现丙酮碘化反应的历程为:
请依据反应历程,解释丙酮碘化反应速率与浓度无关的原因________________________。
答案
一、 单选题 (本题共计11小题,总分33分)
1.【答案】A
2.【答案】D
3.【答案】C
4.【答案】A
5.【答案】C
6.【答案】C
7.【答案】D
8.【答案】D
9.【答案】C
10.【答案】D
11.【答案】B
二、 多选题 (本题共计3小题,总分12分)
12.【答案】AC
13.【答案】CD
14.【答案】CD
三、 综合题 (本题共计3小题,总分44分)
15.(16分)【答案】Ⅰ.(1)
(2)①③
Ⅱ.(3)
(4)AC
Ⅲ.(5)abc 2:1
(6)①高温、低压 ②降低
16.(13分)(1) <
(2)①吸收热量 [或]
②小于 0
17.(16分)(1)-45
(2)(ii)
在化学反应中,最大的能垒为速率控制步骤,而断开化学键的步骤都属于能垒,由于的键能比键的大很多,因此,在上述反应机理中,速率控制步骤为(ii)。
(3)①
②图4
在相同温度和相同压强下,图4中平衡时氨的摩尔分数较小。在恒压下充入惰性气体Ar,反应混合物中各组分的浓度减小,各组分的分压也减小,化学平衡要朝气体分子数增大的方向移动,因此,充入惰性气体Ar不利于合成氨,进料组成中含有惰性气体Ar的图是图4。
③
四、 实验题 (本题共计1小题,总分10分)
18.(10分)(1)①和②
(2)1 使混合溶液的体积相等,保证丙酮溶液和碘溶液的起始浓度不变
(3)
(4)根据反应历程,丙酮与氢离子反应慢,则反应速率由的浓度决定,与碘的浓度无关
化学
(考试总分:100 分 考试时长: 90 分钟)
一、 单选题 (本题共计11小题,总分33分)
1.2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是( )
A.液氮—液氢 B.液氧—液氢 C.液态—肼 D.液氧—煤油
2.下列关于反应热的说法正确的是( )
A.,恒温恒压下达平衡后加入,上述反应增大
B.和反应的中和热,则稀和Ba(OH)2反应生成的反应热
C.一定条件下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为
D.a.b.,若a、b反应放热,则
3.下列选项正确的是( )
A.图①可表示的能量变化
B.图②中表示碳的燃烧热
C.实验的环境温度为,将物质的量浓度相等、体积分别为、的、溶液混合,测得混合液最高温度如图③所示(已知)
D.已知稳定性:,某反应由两步构成,反应过程中的能量变化曲线如图④所示
4.室温下,下列实验探究方案能达到探究目的的是( )
A.A B.B C.C D.D
5.一定量的气体在密闭容器中发生反应:,平衡时测得A的浓度为,保持温度不变,将容器的容积扩大到原来的2倍,再次达到平衡后,测得A的浓度降低为。下列有关判断正确的是( )
A.混合气体的相对平均分子量增大 B.
C.物质C的体积分数降低 D.物质B的转化率升高
6.一定条件下,通过下列反应可以制备特种陶瓷的原料:,该反应在某密闭容器中达到平衡。下列分析正确的是( )
A.恒温恒容时,充入CO气体,达到新平衡时增大
B.容积不变时,升高温度,混合气体的平均相对分子质量减小
C.恒温恒容时,分离出部分气体可提高的转化率
D.恒温时,增大压强平衡逆向移动,平衡常数减小
7.1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子();第二步进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。下列说法不正确的是( )
A.1,4-加成产物比1,2-加成产物稳定
B.与相比,时丁二烯的转化率减小
C.从升至-加成正反应速率的增大程度小于其逆反应速率的增大程度
D.升高温度时,反应产物中加成产物所占比例减少
8.已知:某同学利用以上可逆反应研究浓度对化学平衡的影响。下列说法正确的是( )
A.该反应为氧化还原反应
B.待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C.试管b中的现象能证明减小生成物浓度平衡正向移动
D.试管c中的现象说明影响平衡的主要因素是浓度
9.在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g)△H < 0。下列说法正确的是( )
A.a > 1.6
B.b > 1.6
C.平衡时v正
D.若容器Ⅰ中反应达平衡后,再充入,则转化率增大
10.利用铜-铈氧化物是活泼金属)催化氧化除去中少量的可能机理如图所示。下列说法正确的是( )
A.反应(iii)中、化合价均降低
B.铜-铈氧化物减小了反应的反应热
C.若用参与反应,一段时间后,不可能出现在铜-铈氧化物中
D.反应一段时间后催化剂活性下降,可能是被还原成所致
11.已知反应原理,在密闭容器中和足量C发生反应,相同时间内测得的生成速率与的生成速率随温度变化的关系如图1;维持温度不变,反应相同时间内测得的转化率随压强的变化如图2。
下列说法错误的是( )
A.图1中的A、B、C三个点中只有C点是平衡点
B.图2中的浓度
C.图2中E点的v逆小于F点的v正
D.图2中平衡常数
二、 多选题 (本题共计3小题,总分12分)
12.在恒温恒容条件下,可逆反应,若随着温度升高(物质状态不发生改变),气体密度变大,则下列判断正确的是( )
A.A和C可以一个是固体、一个是液体
B.A和C可以都是气体
C.若A为气体,则正反应一定是放热反应
D.其他条件不变,平衡后压缩容器体积,B的浓度一定比原平衡大
13.利用甲烷可减少污染,反应原理如下:。时,将与的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示。
下列说法正确的是( )
A.c点时反应达平衡态
B.若,则产生的量:ab段 < bc段
C.a、b、c、d四点对应的平衡常数大小:
D.d点的正反应速率大于c点的逆反应速率
14.在起始时向恒容密闭容器中加入、及,发生反应:,测得平衡时气体体积分数与温度的关系如图所示(固体物质所占体积忽略不计),下列说法正确的是( )
A.该反应的正反应为放热反应
B.M点与N点H2的转化率之比为4:3
C.M点与N点的压强之比为15:16
D.若保持M点条件不变,再冲入H2、CO及H2O(g)各0.1mol,则达平衡前v(正) < v(逆)
三、 综合题 (本题共计3小题,总分44分)
15.(16分)Ⅰ.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。已知:达平衡后,若其他条件不变将容器体积缩小至原来一半,其气体平均摩尔质量不变。
(1)该反应的化学方程式可表示为_________________________________。
(2)下列条件的改变能减慢其反应速率的是_________(填序号)。
①降低温度
②增加X的物质的量
③保持压强不变,充入He使容器的体积增大
④保持容积不变,充入He使体系压强增大
Ⅱ.碳中和作为一种新型环保形式可推动全社会绿色发展。复合催化是工业合成甲醇,沸点的重要反应。在2L密闭容器中,充入和,在催化剂、的条件下发生反应。部分反应物和产物随时间变化如图所示:
(3)反应开始至末,以的浓度变化表示该反应的平均速率_____________。
(4)下列情况不能说明该反应达到化学平衡状态的是_________(填字母)。
Ⅲ.某校化学兴趣小组对、进行了深入的研究。
(5)该兴趣小组同学对反应进行了研究,保持其他条件不变,改变的物质的量,平衡时的体积分数变化情况如图所示。平衡时的体积分数a、b、c三点转化率由小到大的顺序为_______________;b点时的投料________________。
(6)向恒容密闭容器中通入一定量,发生反应,达到平衡后,降低温度,混合气体颜色变浅。
①若需要测定的相对分子质量,为了测定更准确,则需要的外界条件为_____________。
②该反应达到平衡时,向恒容密闭容器中通入一定量,则再次达到平衡时,的物质的量分数将_____________(填“升高”“不变”“降低”)。
A.
B.单位时间内消耗,同时生成
C.的物质的量保持不变
D.密闭容器中不发生变化时
E.密闭容器内气体压强不发生变化时
16.(13分)合理利用和转化、、、等污染性气体是环保领域的重要课题。
(1)已知的反应历程分两步:
①
②
一定温度下,反应达到平衡状态,该反应的平衡常数的表达式____________(用、、,反应①的活化能与反应②的活化能的大小关系为_________(填“ > ”“ < ”或“=”)。
(2)氢气可将还原为甲烷,反应为。
①ShyamKatte1等结合实验与计算机模拟结果,研究了在催化剂表面上与的反应历程,前三步历程如图所示,其中吸附在催化剂表面用“·”标注,Ts表示过渡态。物质吸附在催化剂表面,形成过渡态的过程会________________(填“放出热量”或“吸收热量”);反应历程中最小能垒步骤的化学方程式为________________________。
②、分别与反应生成的与T的关系如图所示。容器中只发生反应Ⅰ,a点:(正)______________(填“大于”、“小于”或“等于”(逆)。时,容器中同时发生反应Ⅰ和反应,则的______________。
17.(16分)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应的_________。
(2)研究表明,合成氨反应在催化剂上可能通过图2机理进行表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为___________(填步骤前的标号),理由是_____________________________。
(3)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为、,另一种为、、。(物质的摩尔分数:)
①图中压强由小到大的顺序为______________________
②进料组成中含有惰性气体的图是___________,判断的理由是_________________。
③图3中,当、时,氮气的转化率___________。设为相对压力平衡常数,其表达式中,用相对分压(分压除以)代替分压进行计算。该温度时,反应的平衡常数___________(化为最简式)。
四、 实验题 (本题共计1小题,总分10分)
18.(10分)某同学设计实验探究丙酮碘化反应中,丙酮、、浓度对化学反应速率的影响。
已知:
(1)研究丙酮浓度对反应速率的影响,应选择的实验为_________和_________。
(2)实验④中,a=_________,加蒸馏水的目的是____________________________。
(3)计算实验③中,以表示的反应速率为_________(列出表达式)
(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和的浓度有关,而与的浓度无关,查阅资料发现丙酮碘化反应的历程为:
请依据反应历程,解释丙酮碘化反应速率与浓度无关的原因________________________。
答案
一、 单选题 (本题共计11小题,总分33分)
1.【答案】A
2.【答案】D
3.【答案】C
4.【答案】A
5.【答案】C
6.【答案】C
7.【答案】D
8.【答案】D
9.【答案】C
10.【答案】D
11.【答案】B
二、 多选题 (本题共计3小题,总分12分)
12.【答案】AC
13.【答案】CD
14.【答案】CD
三、 综合题 (本题共计3小题,总分44分)
15.(16分)【答案】Ⅰ.(1)
(2)①③
Ⅱ.(3)
(4)AC
Ⅲ.(5)abc 2:1
(6)①高温、低压 ②降低
16.(13分)(1) <
(2)①吸收热量 [或]
②小于 0
17.(16分)(1)-45
(2)(ii)
在化学反应中,最大的能垒为速率控制步骤,而断开化学键的步骤都属于能垒,由于的键能比键的大很多,因此,在上述反应机理中,速率控制步骤为(ii)。
(3)①
②图4
在相同温度和相同压强下,图4中平衡时氨的摩尔分数较小。在恒压下充入惰性气体Ar,反应混合物中各组分的浓度减小,各组分的分压也减小,化学平衡要朝气体分子数增大的方向移动,因此,充入惰性气体Ar不利于合成氨,进料组成中含有惰性气体Ar的图是图4。
③
四、 实验题 (本题共计1小题,总分10分)
18.(10分)(1)①和②
(2)1 使混合溶液的体积相等,保证丙酮溶液和碘溶液的起始浓度不变
(3)
(4)根据反应历程,丙酮与氢离子反应慢,则反应速率由的浓度决定,与碘的浓度无关
同课章节目录
