化学人教版(2019)必修第一册2.3.4溶液的配制(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.4溶液的配制(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 53.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 09:44:45 | ||
图片预览









文档简介
(共30张PPT)
第2章 海水中的重要元素——钠和氯
第3节 物质的量
第二课时 物质的量浓度
Learning goals
学习目标
2
1
本节重点
本节难点
溶液的配制
误差分析
公 式 背 记
n
=
NA
N
n
=
22.4
V
n
=
M
m
c B =
nB
V
V(溶液) =
m溶液
———
ρ溶液
c(浓)·V(浓) = c(稀)·V(稀)
c(混)·V(混)= c1·V1 + c2·V2
要精确配制 100mL 1.0mol·L-1 NaCl 溶液,
该如何配制?
提 出 问 题
认识 容量瓶
①标志:___________________
温度、容量、刻度线
②规格:
100 mL 、250 mL、500 mL、1000 mL
③用途:____________________________
配制一定物质的量浓度的溶液
容量瓶的5忌
5忌:
一忌用容量瓶溶解固体;
二忌用容量瓶稀释浓溶液;
三忌给容量瓶加热;
四忌把容量瓶当作反应容器;
五忌用容量瓶长期存放溶液。
容量瓶的选择
容量瓶的选择:“大而近”原则。
例如配制950 mL 1 mol·L-1NaCl溶液,
需要用1 000 mL的容量瓶,
计算NaCl的质量时也应按1 000 mL溶液来计算。
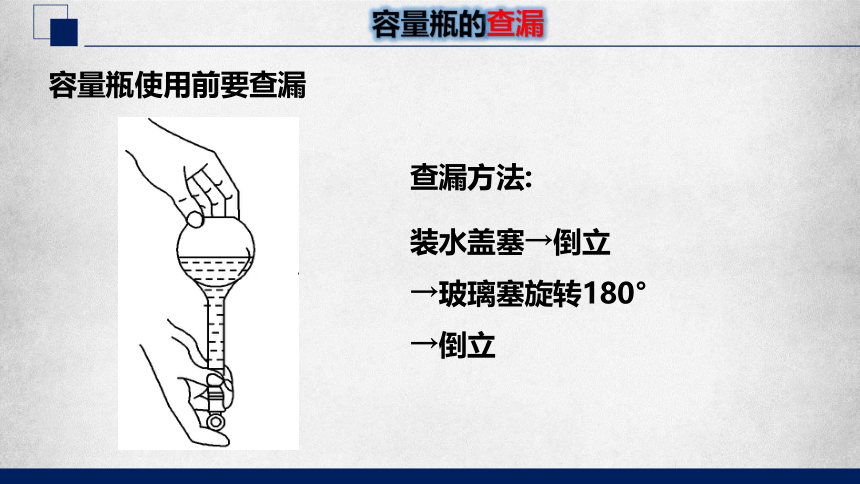
容量瓶的查漏
容量瓶使用前要查漏
容量瓶的查漏
容量瓶使用前要查漏
查漏方法:
装水盖塞→倒立
→玻璃塞旋转180°
→倒立
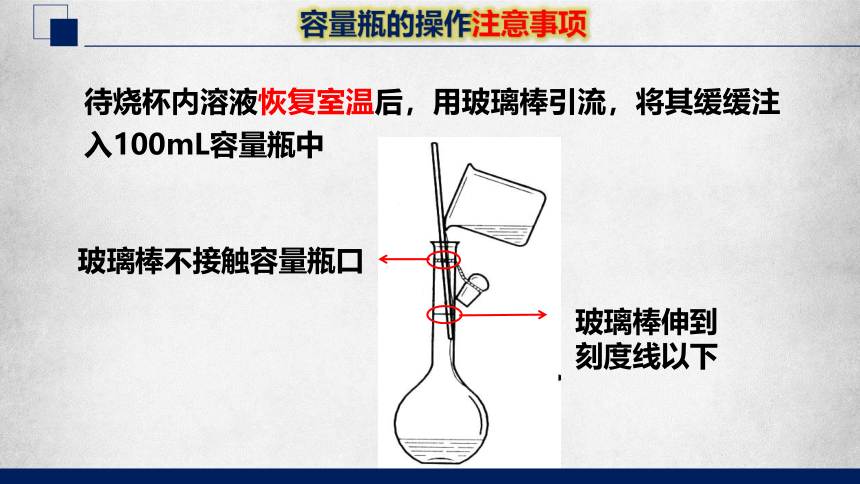
容量瓶的操作注意事项
待烧杯内溶液恢复室温后,用玻璃棒引流,将其缓缓注入100mL容量瓶中
玻璃棒伸到
刻度线以下
玻璃棒不接触容量瓶口
实验:配制100mL 1.00mol/L NaCl溶液
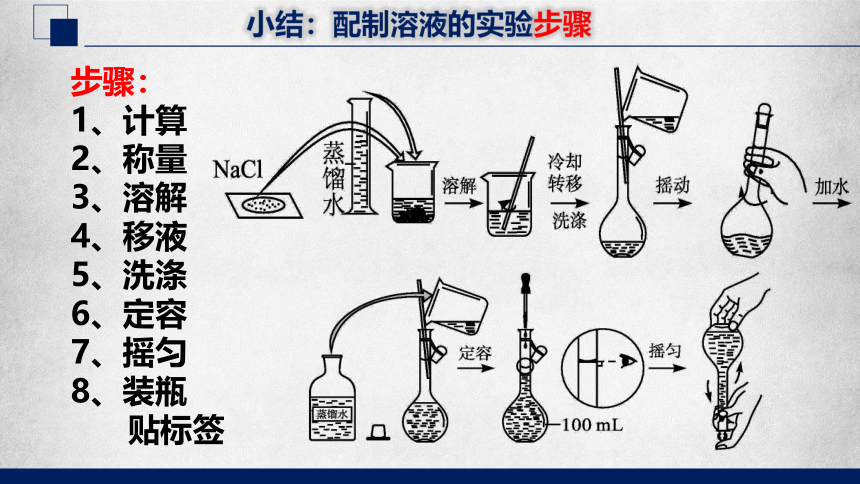
小结:配制溶液的实验步骤
步骤:
1、计算
2、称量
3、溶解
4、移液
5、洗涤
6、定容
7、摇匀
8、装瓶
贴标签
配制 100 mL 1.00 mol·L-1的 NaCl 溶液为例
1.实验步骤
思考:配置80mL 1.00mol/L的 NaCl 溶液,需要 mNaCl =
m(NaCl)= g
5.85
误差分析
cB=
nB
V
由于实验操作不当引起溶质或水的变化,会对cB造成误差。
(2) 使水 增大(或减小)的因素,导致cB偏小(或偏大)。
(1) 使溶质增大(或减小)的因素,导致cB偏大(或偏小)。
误 差 分 析
操作 溶质 水 c
称量前小烧杯内有水
用滤纸称量氢氧化钠
溶解或转移溶液时,使溶液漏洒
未洗涤烧杯和玻璃棒
1.操作不当引起的误差
不变
不变
无影响
减小
不变
偏小
减小
不变
不变
偏小
偏小
减小
cB=
nB
V
误 差 分 析
2.定量仪器操作不当引起的误差
操作 溶质 水 c
溶液未冷却至室温就注入容量瓶中并定容
定容摇匀后,液面下降,再加水
定容时,俯视刻度线
定容时,仰视刻度线
其他 ①用天平称量溶质时,若砝码生锈或沾有其他物质时,会多称量溶质
②药品中含有杂质,会少称量溶质
③容量瓶内有蒸馏水,未干燥
不变
不变
不变
不变
减小
减小
增大
增大
偏大
偏小
偏大
偏小
增大
不变
偏大
减小
不变
偏小
不变
不变
无影响
定容时仰视、俯视图示分析
水偏 ,
浓度偏 。
水偏 ,
浓度偏 。
俯视:水面在视线下方
仰视:水面在视线上方
多
小
少
大
1.在200mL NaOH溶液中含有20gNaOH,则NaOH的物质的量浓度为 。
2.5mol/L
课堂检测
2. 300mL 2mol·L-1的NaOH 溶液中溶有的NaOH的质量为 g
24
3.含有40g NaOH的浓度为5mol·L-1的溶液的体积为 mL
200
课堂检测
课堂检测
4.市售浓硫酸的浓度为18.4 mol·L-1,现需配制500 mL 1.50 mol/L的硫酸溶液,应需浓硫酸 毫升?
40.8
5.浓度为0.1 mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10 mL,这10 mL溶液中含有c(H+)为( )
A.0.5 mol·L-1 B.0.01 mol·L-1
C.0.02 mol·L-1 D.0.05 mol·L-1
D
课堂检测
6. 100 mL0.5 mol/LMgCl2 溶液和 200 mL1 mol/LNaCl 溶液混合后(忽略体积变化),溶液中Cl-的物质的量浓度为( )
A.0.5 mol/L B.0.75 mol/L
C.1 mol/L D.1.50 mol/L
C
溶质的质量
= 溶液的密度ρ×溶液的体积V×溶质的质量分数ω
= 物质的量浓度c×溶液的体积V×溶质的摩尔质量M
ρ · V · ω = c · V · M
c
=
ρω
M
物质的量浓度与质量分数的关系
注意单位换算
7.将5mL浓硫酸(质量分数为 98%,密度为1.84g / cm3)稀释为20 mL的稀硫酸。稀释后溶液的浓度为( )
A.4.6mol·L-1 B.0.46mol·L-1 C.24.5% D.46%
A
课堂检测
=18.4mol/L
物质的量浓度
物质的量
浓度
概念:单位体积的溶液里所含溶质B的物质的量。符号为CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度
的相关计算
溶液稀释:
c(浓)·V(浓) = c(稀)·V(稀)
溶液混合:
c1·V1 + c2·V2 = c(混)·V(混)
物质的量浓度
与质量分数的关系
c
=
ρω
M
课堂小结
学习评价
1.1mol·L-1硫酸溶液的含义是( )
A.1L水中含有1mol硫酸
B.1L溶液中含有1molH+
C.将98g硫酸溶于1L水所配成的溶液
D.从1L该溶液中取出500mL后,剩余溶液的浓度仍为1mol·L-1
D
2. 下列溶液中溶质的物质的量浓度为1 mol/L的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将NA个氨气分子通入1 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
D
学习评价
3.将4gNaOH溶解在100mL水中,稀释至1L后取出100mL,其物质的量浓度是( )
A.1mol/L B.0.1mol/L
C.10mol/L D.0.01mol/L
A
学习评价
4.下列各溶液中,Na+浓度最大的是( )
A.0.8L0.4mol/L的NaOH溶液
B.0.2L0.15mol/L的Na3PO4溶液
C.1L0.3mol/L的NaCl溶液
D.4L0.5mol/L的Na2CO3溶液
D
学习评价
第2章 海水中的重要元素——钠和氯
第3节 物质的量
第二课时 物质的量浓度
Learning goals
学习目标
2
1
本节重点
本节难点
溶液的配制
误差分析
公 式 背 记
n
=
NA
N
n
=
22.4
V
n
=
M
m
c B =
nB
V
V(溶液) =
m溶液
———
ρ溶液
c(浓)·V(浓) = c(稀)·V(稀)
c(混)·V(混)= c1·V1 + c2·V2
要精确配制 100mL 1.0mol·L-1 NaCl 溶液,
该如何配制?
提 出 问 题
认识 容量瓶
①标志:___________________
温度、容量、刻度线
②规格:
100 mL 、250 mL、500 mL、1000 mL
③用途:____________________________
配制一定物质的量浓度的溶液
容量瓶的5忌
5忌:
一忌用容量瓶溶解固体;
二忌用容量瓶稀释浓溶液;
三忌给容量瓶加热;
四忌把容量瓶当作反应容器;
五忌用容量瓶长期存放溶液。
容量瓶的选择
容量瓶的选择:“大而近”原则。
例如配制950 mL 1 mol·L-1NaCl溶液,
需要用1 000 mL的容量瓶,
计算NaCl的质量时也应按1 000 mL溶液来计算。
容量瓶的查漏
容量瓶使用前要查漏
容量瓶的查漏
容量瓶使用前要查漏
查漏方法:
装水盖塞→倒立
→玻璃塞旋转180°
→倒立
容量瓶的操作注意事项
待烧杯内溶液恢复室温后,用玻璃棒引流,将其缓缓注入100mL容量瓶中
玻璃棒伸到
刻度线以下
玻璃棒不接触容量瓶口
实验:配制100mL 1.00mol/L NaCl溶液
小结:配制溶液的实验步骤
步骤:
1、计算
2、称量
3、溶解
4、移液
5、洗涤
6、定容
7、摇匀
8、装瓶
贴标签
配制 100 mL 1.00 mol·L-1的 NaCl 溶液为例
1.实验步骤
思考:配置80mL 1.00mol/L的 NaCl 溶液,需要 mNaCl =
m(NaCl)= g
5.85
误差分析
cB=
nB
V
由于实验操作不当引起溶质或水的变化,会对cB造成误差。
(2) 使水 增大(或减小)的因素,导致cB偏小(或偏大)。
(1) 使溶质增大(或减小)的因素,导致cB偏大(或偏小)。
误 差 分 析
操作 溶质 水 c
称量前小烧杯内有水
用滤纸称量氢氧化钠
溶解或转移溶液时,使溶液漏洒
未洗涤烧杯和玻璃棒
1.操作不当引起的误差
不变
不变
无影响
减小
不变
偏小
减小
不变
不变
偏小
偏小
减小
cB=
nB
V
误 差 分 析
2.定量仪器操作不当引起的误差
操作 溶质 水 c
溶液未冷却至室温就注入容量瓶中并定容
定容摇匀后,液面下降,再加水
定容时,俯视刻度线
定容时,仰视刻度线
其他 ①用天平称量溶质时,若砝码生锈或沾有其他物质时,会多称量溶质
②药品中含有杂质,会少称量溶质
③容量瓶内有蒸馏水,未干燥
不变
不变
不变
不变
减小
减小
增大
增大
偏大
偏小
偏大
偏小
增大
不变
偏大
减小
不变
偏小
不变
不变
无影响
定容时仰视、俯视图示分析
水偏 ,
浓度偏 。
水偏 ,
浓度偏 。
俯视:水面在视线下方
仰视:水面在视线上方
多
小
少
大
1.在200mL NaOH溶液中含有20gNaOH,则NaOH的物质的量浓度为 。
2.5mol/L
课堂检测
2. 300mL 2mol·L-1的NaOH 溶液中溶有的NaOH的质量为 g
24
3.含有40g NaOH的浓度为5mol·L-1的溶液的体积为 mL
200
课堂检测
课堂检测
4.市售浓硫酸的浓度为18.4 mol·L-1,现需配制500 mL 1.50 mol/L的硫酸溶液,应需浓硫酸 毫升?
40.8
5.浓度为0.1 mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10 mL,这10 mL溶液中含有c(H+)为( )
A.0.5 mol·L-1 B.0.01 mol·L-1
C.0.02 mol·L-1 D.0.05 mol·L-1
D
课堂检测
6. 100 mL0.5 mol/LMgCl2 溶液和 200 mL1 mol/LNaCl 溶液混合后(忽略体积变化),溶液中Cl-的物质的量浓度为( )
A.0.5 mol/L B.0.75 mol/L
C.1 mol/L D.1.50 mol/L
C
溶质的质量
= 溶液的密度ρ×溶液的体积V×溶质的质量分数ω
= 物质的量浓度c×溶液的体积V×溶质的摩尔质量M
ρ · V · ω = c · V · M
c
=
ρω
M
物质的量浓度与质量分数的关系
注意单位换算
7.将5mL浓硫酸(质量分数为 98%,密度为1.84g / cm3)稀释为20 mL的稀硫酸。稀释后溶液的浓度为( )
A.4.6mol·L-1 B.0.46mol·L-1 C.24.5% D.46%
A
课堂检测
=18.4mol/L
物质的量浓度
物质的量
浓度
概念:单位体积的溶液里所含溶质B的物质的量。符号为CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度
的相关计算
溶液稀释:
c(浓)·V(浓) = c(稀)·V(稀)
溶液混合:
c1·V1 + c2·V2 = c(混)·V(混)
物质的量浓度
与质量分数的关系
c
=
ρω
M
课堂小结
学习评价
1.1mol·L-1硫酸溶液的含义是( )
A.1L水中含有1mol硫酸
B.1L溶液中含有1molH+
C.将98g硫酸溶于1L水所配成的溶液
D.从1L该溶液中取出500mL后,剩余溶液的浓度仍为1mol·L-1
D
2. 下列溶液中溶质的物质的量浓度为1 mol/L的是 ( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将NA个氨气分子通入1 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
D
学习评价
3.将4gNaOH溶解在100mL水中,稀释至1L后取出100mL,其物质的量浓度是( )
A.1mol/L B.0.1mol/L
C.10mol/L D.0.01mol/L
A
学习评价
4.下列各溶液中,Na+浓度最大的是( )
A.0.8L0.4mol/L的NaOH溶液
B.0.2L0.15mol/L的Na3PO4溶液
C.1L0.3mol/L的NaCl溶液
D.4L0.5mol/L的Na2CO3溶液
D
学习评价
