化学人教版(2019)选择性必修1 3.3.6离子浓度大小比较(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.6离子浓度大小比较(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 09:45:41 | ||
图片预览








文档简介
(共28张PPT)
溶液中粒子浓度大小的比较
学会比较溶液中离子浓度的大小
树立微弱意识,立足平衡观念
1.树立微弱意识
(1)电离平衡 建立电离过程是微弱的意识
弱电解质(弱酸、弱碱、水)的电离是微弱的,且水的电离能力远远小于弱酸和弱碱的电离能力。
(2)水解平衡 建立水解过程是微弱的意识
弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。
2.解决混合溶液中粒子浓度问题的整体思路
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
(1)一元弱酸溶液
如CH3COOH溶液:
(2)一元弱碱溶液
如NH3H2O溶液:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
溶质分子>显性离子>电离产物>隐性离子
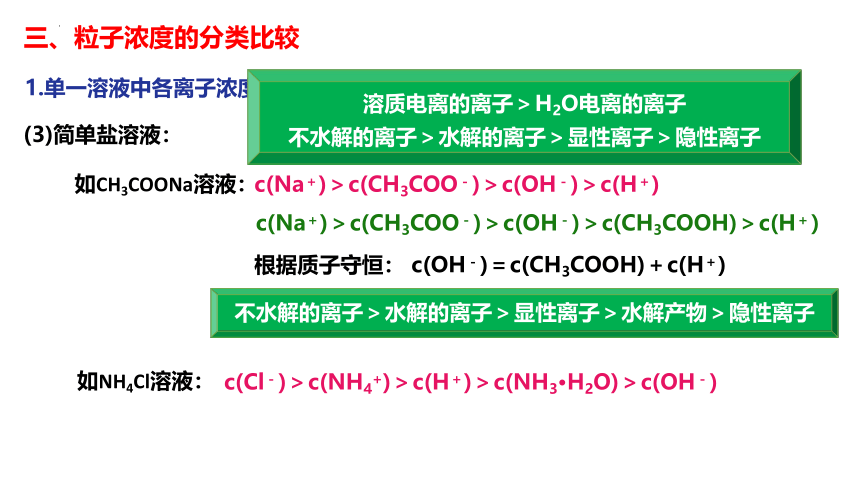
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
(3)简单盐溶液:
如CH3COONa溶液:
如NH4Cl溶液:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)
根据质子守恒: c(OH-)=c(CH3COOH)+c(H+)
c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O)>c(OH-)
不水解的离子>水解的离子>显性离子>水解产物>隐性离子
溶质电离的离子>H2O电离的离子
不水解的离子>水解的离子>显性离子>隐性离子
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
c(H2CO3)>c(H+)>c(HCO3-)>c(CO32-)>c(OH-)
(4)多元弱酸溶液:
如H2CO3溶液:
如H2S溶液:
c(H2S)>c(H+)>c(HS-)>c(S2-)>c(OH-)
弱酸分子>c(H+)>一级电离产物>二级电离产物>c(OH-)
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)>c(H+)
(5)多元弱酸的正盐溶液:
如Na2CO3溶液:
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
盐的水解程度>>水的电离程度
Na2SO3溶液:
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H2SO3)>c(H+)
不水解的离子>水解的离子>显性离子>一级水解产物>二级水解产物>隐性离子
Na2S溶液
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)>c(H+)
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
(6)多元弱酸酸式盐溶液
NaHCO3溶液
c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-)
NaHSO3溶液
c(Na+)>c(HSO3-) >c(H+)>c(SO32-)>c(OH-)>c(H2SO3)
HCO3-的水解程度>HCO3-电离程度
HSO3-的水解程度>HSO3-电离程度
三、粒子浓度的分类比较
2.不同溶液中同一离子浓度的比较——溶液中其他离子对该离子的影响。
(1)相同物质的量浓度的下列溶液中,c(CO32-) 由大到小的顺序为: ① Na2CO3 ② (NH4)2CO3 ③ H2CO3 ④ NaHCO3 ⑤ NH4HCO3
(2)相同物质的量浓度的下列溶液中,c(NH4+) 由大到小的顺序为: ① NH4HSO4 ②NH4Cl ③CH3COONH4 ④NH3·H2O ⑤ (NH4)2SO4
⑥ (NH4)2CO3 ⑦ NH4Al(SO4)2 ⑧ (NH4)2Fe(SO4)2
水电离出来的c(H+)[或c(OH-)]的判断
(1)常温下,①pH=4的HCl、 ②pH=10的NaOH溶液、 ③NaCl溶液、
④pH=4的NH4Cl溶液、 ⑤pH=10的Na2CO3溶液,
由水电离出的c(H+)[或c(OH-)]由大到小的顺序为____________________。
④=⑤>③>①=②
3.混合溶液中各离子浓度的比较 ——综合分析电离、水解等因素。
三、粒子浓度的分类比较
【互不反应的两溶液混合】
(1)等物质的量浓度的NH4Cl和NH3·H2O等体积混合
(2)等物质的量浓度的CH3COONa和CH3COOH等体积混合
(3)等物质的量浓度的CH3COONa和NaClO等体积混合 (4)等物质的量浓度的Na2CO3和NaHCO3等体积混合
三、粒子浓度的分类比较
3.混合溶液中各离子浓度的比较 ——综合分析电离、水解等因素。
【相互反应的两溶液混合】
0.1 mol/l 的HCl 与0.1 mol/l NH3·H2O等体积混合
0.1 mol/l 的HCl 与0.2 mol/l NH3·H2O等体积混合
0.1 mol/l 的NaOH与0.2 mol/l CH3COOH等体积混合
等物质的量浓度的NH4Cl和NaOH等体积混合
将pH=3的盐酸溶液和pH=11的氨水等体积混合
名师点拨
比较溶液中
粒子浓度关系
的解题流程
解题思路:
(1)单一溶液,先找清楚溶液中存在的电离、水解的有关离子方程式。(2)分清主要因素和次要因素。
(3)混合溶液,先分析清楚溶液中的溶质是什么,溶质之间的物质的量的关系,再充分利用假设思想。
下列各溶液中,粒子的物质的量浓度关系正确的是( )
C
将10 mL 0.1 mol/L氨水与6 mL 0.2 mol/L盐酸混合反应后,
溶液中离子浓度关系正确的是( )
A.c(Cl-)>c()>c(OH-)>c(H+)
B.c()>c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c()>c(H+)>c(OH-)
D.c(H+)>c(Cl-)>c()>c(OH-)
C
标准状况下,向3 mol·L-1的NaOH溶液100 mL中缓缓通入4.48 L CO2 气体,充分反应后溶液中离子浓度大小排列顺序正确的是( )
D
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的
NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
A
时,下列有关溶液中各微粒的物质的量浓度关系正确的是( )
A. 的 溶液:
B. 的 溶液:
C. 溶液:
D. 溶液:
B
室温下,下列溶液中粒子浓度关系正确的是( )
A. 溶液:
B. 溶液:
C. 溶液:
D. 和 混合溶液:
B
有四种混合溶液,分别由等体积0.1 mol/L 的2种溶液混合而成:
① CH3COONa 和HCl;② CH3COONa 与NaOH;③ CH3COONa 与NaCl;
④ CH3COONa 与 NaHCO3,下列各项排序正确的是( )A. pH :② > ③ > ④ > ① B. c(CH3COO-):② > ④ > ③ > ①C. 溶液中c(H+): ① > ③ > ② > ④ D. c(CH3COOH):① > ④ > ③ > ②
B
室温下,某实验小组的同学将 的一元酸 溶液和 的 溶液混合(忽略体积变化),实验数据如下表所示:
实验编号
① 10 10 9
② 10 7
下列判断一定正确的是( )
A. 实验①所得的混合溶液中:
B. 实验①所得的混合溶液中:
C. 实验②所得的混合溶液中:
D. 实验②所得的混合溶液中:
B
在 的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是( )
A. 水:
B. 盐酸:
C. 醋酸:
D. 氢氧化钠:
B
[2020·江苏卷,14]
室温下,将两种浓度均为 的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A. 混合溶液
B. 氨水 混合溶液
C. 混合溶液:
D. 混合溶液( 为二元弱酸):
AD
[2019·江苏,14]
室温下,反应 的平衡常数 。将 溶液和氨水按一定比例混合,可用于浸取废渣中的 。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A. 氨水:
B. 溶液
C. 氨水和 溶液等体积混合:
D. 氨水和 溶液等体积混合:
BD
[2019·全国Ⅲ卷,11]
设 为阿伏加德罗常数值。关于常温下 的 溶液,下列说法正确的是( )
A. 每升溶液中的 数目为
B.
C. 加水稀释使电离度增大,溶液 减小
D. 加入 固体,溶液酸性增强
B
[2019·天津理综,5]
某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( )
A. 曲线Ⅰ代表 溶液
B. 溶液中水的电离程度: 点 点
C
C. 从 点到 点,溶液中 保持不变(其中 分别代表相应的酸和酸根离子)
D. 相同体积 点的两溶液分别与 恰好中和后,溶液中 相同
溶液中粒子浓度大小的比较
学会比较溶液中离子浓度的大小
树立微弱意识,立足平衡观念
1.树立微弱意识
(1)电离平衡 建立电离过程是微弱的意识
弱电解质(弱酸、弱碱、水)的电离是微弱的,且水的电离能力远远小于弱酸和弱碱的电离能力。
(2)水解平衡 建立水解过程是微弱的意识
弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。
2.解决混合溶液中粒子浓度问题的整体思路
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
(1)一元弱酸溶液
如CH3COOH溶液:
(2)一元弱碱溶液
如NH3H2O溶液:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)
溶质分子>显性离子>电离产物>隐性离子
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
(3)简单盐溶液:
如CH3COONa溶液:
如NH4Cl溶液:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)
根据质子守恒: c(OH-)=c(CH3COOH)+c(H+)
c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O)>c(OH-)
不水解的离子>水解的离子>显性离子>水解产物>隐性离子
溶质电离的离子>H2O电离的离子
不水解的离子>水解的离子>显性离子>隐性离子
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
c(H2CO3)>c(H+)>c(HCO3-)>c(CO32-)>c(OH-)
(4)多元弱酸溶液:
如H2CO3溶液:
如H2S溶液:
c(H2S)>c(H+)>c(HS-)>c(S2-)>c(OH-)
弱酸分子>c(H+)>一级电离产物>二级电离产物>c(OH-)
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)>c(H+)
(5)多元弱酸的正盐溶液:
如Na2CO3溶液:
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
盐的水解程度>>水的电离程度
Na2SO3溶液:
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H2SO3)>c(H+)
不水解的离子>水解的离子>显性离子>一级水解产物>二级水解产物>隐性离子
Na2S溶液
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S)>c(H+)
三、粒子浓度的分类比较
1.单一溶液中各离子浓度的比较
(6)多元弱酸酸式盐溶液
NaHCO3溶液
c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-)
NaHSO3溶液
c(Na+)>c(HSO3-) >c(H+)>c(SO32-)>c(OH-)>c(H2SO3)
HCO3-的水解程度>HCO3-电离程度
HSO3-的水解程度>HSO3-电离程度
三、粒子浓度的分类比较
2.不同溶液中同一离子浓度的比较——溶液中其他离子对该离子的影响。
(1)相同物质的量浓度的下列溶液中,c(CO32-) 由大到小的顺序为: ① Na2CO3 ② (NH4)2CO3 ③ H2CO3 ④ NaHCO3 ⑤ NH4HCO3
(2)相同物质的量浓度的下列溶液中,c(NH4+) 由大到小的顺序为: ① NH4HSO4 ②NH4Cl ③CH3COONH4 ④NH3·H2O ⑤ (NH4)2SO4
⑥ (NH4)2CO3 ⑦ NH4Al(SO4)2 ⑧ (NH4)2Fe(SO4)2
水电离出来的c(H+)[或c(OH-)]的判断
(1)常温下,①pH=4的HCl、 ②pH=10的NaOH溶液、 ③NaCl溶液、
④pH=4的NH4Cl溶液、 ⑤pH=10的Na2CO3溶液,
由水电离出的c(H+)[或c(OH-)]由大到小的顺序为____________________。
④=⑤>③>①=②
3.混合溶液中各离子浓度的比较 ——综合分析电离、水解等因素。
三、粒子浓度的分类比较
【互不反应的两溶液混合】
(1)等物质的量浓度的NH4Cl和NH3·H2O等体积混合
(2)等物质的量浓度的CH3COONa和CH3COOH等体积混合
(3)等物质的量浓度的CH3COONa和NaClO等体积混合 (4)等物质的量浓度的Na2CO3和NaHCO3等体积混合
三、粒子浓度的分类比较
3.混合溶液中各离子浓度的比较 ——综合分析电离、水解等因素。
【相互反应的两溶液混合】
0.1 mol/l 的HCl 与0.1 mol/l NH3·H2O等体积混合
0.1 mol/l 的HCl 与0.2 mol/l NH3·H2O等体积混合
0.1 mol/l 的NaOH与0.2 mol/l CH3COOH等体积混合
等物质的量浓度的NH4Cl和NaOH等体积混合
将pH=3的盐酸溶液和pH=11的氨水等体积混合
名师点拨
比较溶液中
粒子浓度关系
的解题流程
解题思路:
(1)单一溶液,先找清楚溶液中存在的电离、水解的有关离子方程式。(2)分清主要因素和次要因素。
(3)混合溶液,先分析清楚溶液中的溶质是什么,溶质之间的物质的量的关系,再充分利用假设思想。
下列各溶液中,粒子的物质的量浓度关系正确的是( )
C
将10 mL 0.1 mol/L氨水与6 mL 0.2 mol/L盐酸混合反应后,
溶液中离子浓度关系正确的是( )
A.c(Cl-)>c()>c(OH-)>c(H+)
B.c()>c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c()>c(H+)>c(OH-)
D.c(H+)>c(Cl-)>c()>c(OH-)
C
标准状况下,向3 mol·L-1的NaOH溶液100 mL中缓缓通入4.48 L CO2 气体,充分反应后溶液中离子浓度大小排列顺序正确的是( )
D
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的
NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
A
时,下列有关溶液中各微粒的物质的量浓度关系正确的是( )
A. 的 溶液:
B. 的 溶液:
C. 溶液:
D. 溶液:
B
室温下,下列溶液中粒子浓度关系正确的是( )
A. 溶液:
B. 溶液:
C. 溶液:
D. 和 混合溶液:
B
有四种混合溶液,分别由等体积0.1 mol/L 的2种溶液混合而成:
① CH3COONa 和HCl;② CH3COONa 与NaOH;③ CH3COONa 与NaCl;
④ CH3COONa 与 NaHCO3,下列各项排序正确的是( )A. pH :② > ③ > ④ > ① B. c(CH3COO-):② > ④ > ③ > ①C. 溶液中c(H+): ① > ③ > ② > ④ D. c(CH3COOH):① > ④ > ③ > ②
B
室温下,某实验小组的同学将 的一元酸 溶液和 的 溶液混合(忽略体积变化),实验数据如下表所示:
实验编号
① 10 10 9
② 10 7
下列判断一定正确的是( )
A. 实验①所得的混合溶液中:
B. 实验①所得的混合溶液中:
C. 实验②所得的混合溶液中:
D. 实验②所得的混合溶液中:
B
在 的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是( )
A. 水:
B. 盐酸:
C. 醋酸:
D. 氢氧化钠:
B
[2020·江苏卷,14]
室温下,将两种浓度均为 的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是( )
A. 混合溶液
B. 氨水 混合溶液
C. 混合溶液:
D. 混合溶液( 为二元弱酸):
AD
[2019·江苏,14]
室温下,反应 的平衡常数 。将 溶液和氨水按一定比例混合,可用于浸取废渣中的 。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A. 氨水:
B. 溶液
C. 氨水和 溶液等体积混合:
D. 氨水和 溶液等体积混合:
BD
[2019·全国Ⅲ卷,11]
设 为阿伏加德罗常数值。关于常温下 的 溶液,下列说法正确的是( )
A. 每升溶液中的 数目为
B.
C. 加水稀释使电离度增大,溶液 减小
D. 加入 固体,溶液酸性增强
B
[2019·天津理综,5]
某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( )
A. 曲线Ⅰ代表 溶液
B. 溶液中水的电离程度: 点 点
C
C. 从 点到 点,溶液中 保持不变(其中 分别代表相应的酸和酸根离子)
D. 相同体积 点的两溶液分别与 恰好中和后,溶液中 相同
