3.4配合物与超分子 课件(30张PPT)
文档属性
| 名称 | 3.4配合物与超分子 课件(30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 10:13:29 | ||
图片预览







文档简介
(共30张PPT)
第四节 配合物与超分子
第三章 晶体结构与性质
【问题探讨】
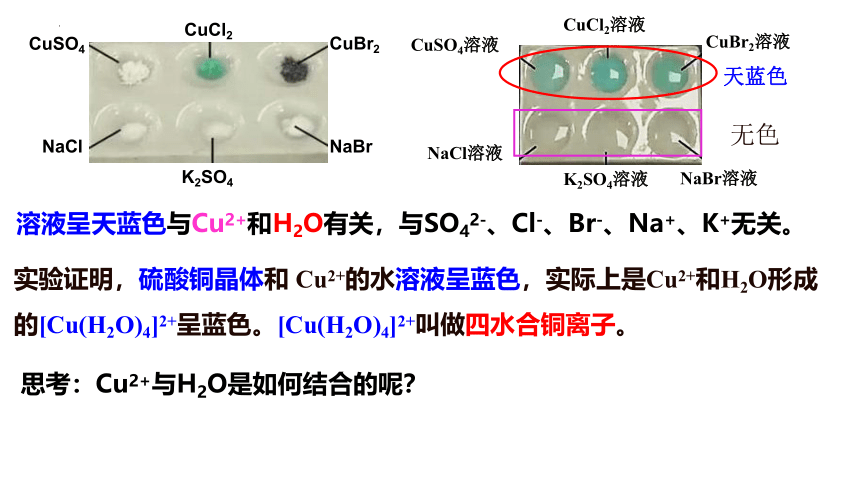
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
【实验探究】
【实验3-2】
固体 ①CuSO4 ②CuCl2 ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
颜色 白色 绿色 深褐色 白色 白色 白色
下表中的少量固体溶于足量的水中,观察实验现象
实验证明,硫酸铜晶体和 Cu2+的水溶液呈蓝色,实际上是Cu2+和H2O形成的[Cu(H2O)4]2+呈蓝色。[Cu(H2O)4]2+叫做四水合铜离子。
思考:Cu2+与H2O是如何结合的呢?
CuSO4溶液
CuCl2溶液
CuBr2溶液
K2SO4溶液
NaCl溶液
NaBr溶液
CuSO4
CuCl2
CuBr2
NaCl
K2SO4
NaBr
溶液呈天蓝色与Cu2+和H2O有关,与SO42-、Cl-、Br-、Na+、K+无关。
天蓝色
无色
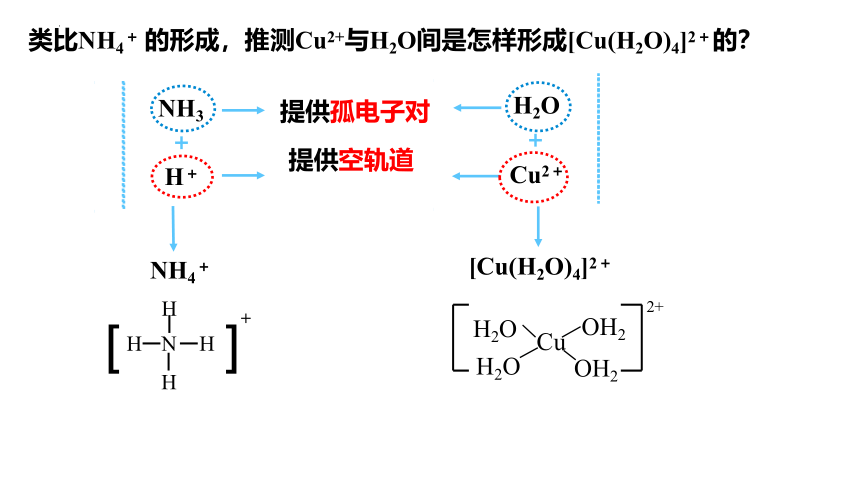
依据反应 NH3 +H+ =NH4 + ,讨论NH3是如何与H+形成NH4+的?
配位键:由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。实质上是一种特殊的共价键。
类比NH4+ 的形成,推测Cu2+与H2O间是怎样形成[Cu(H2O)4]2+的?
NH3
H+
NH4+
H2O
Cu2+
[Cu(H2O)4]2+
+
+
提供孤电子对
提供空轨道
Cu
OH2
H2O
H2O
2+
OH2
H
N
H
H
H
[ ]
+
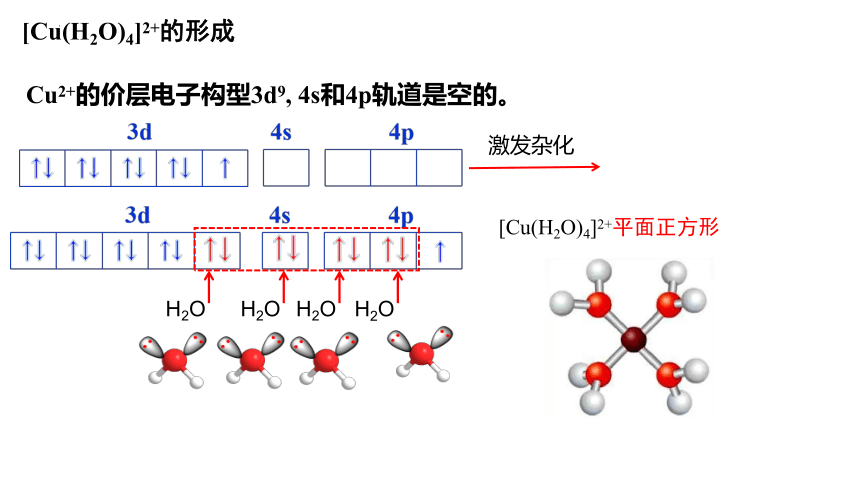
Cu2+的价层电子构型3d9, 4s和4p轨道是空的。
[Cu(H2O)4]2+的形成
激发杂化
H2O
H2O
H2O
H2O
[Cu(H2O)4]2+平面正方形
一、配合物
1、配位键
1)概念
2)形成条件
由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
①成键原子一方要有孤电子对
如 NH3、H2O、CO、有机胺等分子;卤离子 、OH-、CN-、SCN-等离子。
②成键原子另一方有空轨道
一般是过渡金属的原子或离子如:Fe3+、Cu2+、Zn2+、Ni2+、Co3+、Ni ;
还有H+、Al3+、B、Mg2+等主族元素
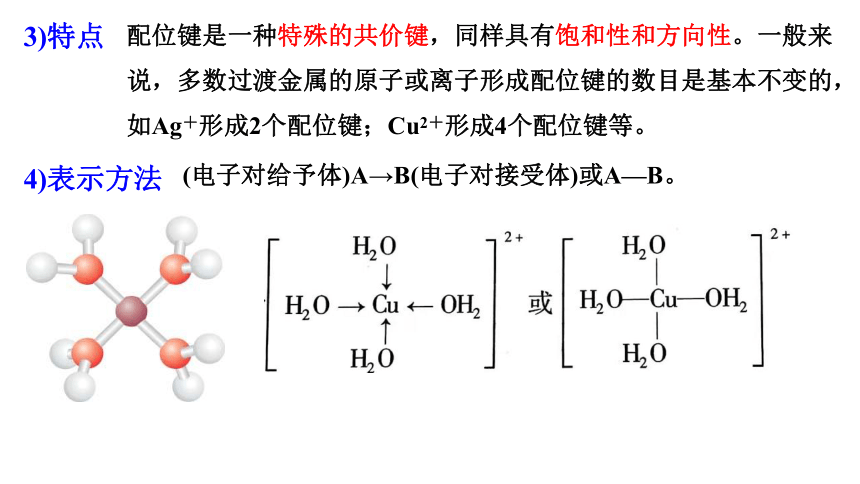
3)特点
配位键是一种特殊的共价键,同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
4)表示方法
(电子对给予体)A→B(电子对接受体)或A—B。
依据电子式,讨论NH3 、H2O与H+是如何形成NH4+ 、H3O+的?
空的1s轨道
孤电子对
··
O
··
×H
H×
·
·
H+
+
··
O
··
×H
H×
·
·
H
[ ]
+
H
N
H
H
H
[ ]
+
【思考与讨论】
[Cu(NH3)4]SO4
= [Cu(NH3)4]2+ + SO42-
配合物溶于水易电离为内界配离子和外界离子,内界配离子一般很稳定,不易电离。有些配合物不存在外界
2、配合物
1)
概
念
把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 配位键 结合形成的化合物称为配位化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等。
2)组成
①中心原子(离子):
提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。
②配位体:
含有孤电子对的分子或离子NH3 H2O CO Cl- SCN- CN-
③配位原子:
配位体中具有孤电子对原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子
④配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
⑤配离子的电荷:等于中心离子和配体总电荷的代数和,如:[Fe(SCN)6]3-
注意:
①有的配合物没有外界,如 Ni(CO)4 , Fe(CO)5等。
②NH4Cl中含配位键,但不是配位化合物。配合物一定含有配位键
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2 二氯化一氯·五氨合钴(Ⅱ)
Ni(CO)4 四羰基镍
【课堂练习】完成下表:
[Ag(NH3)2]+
[Fe(CN)6]3-
[Co(NH3)5Cl]2+
Ni(CO)4
OH-
K+
Cl-
无
Ag+
Fe3+
Co3+
Ni
NH3
CN-
NH3、Cl-
CO
2
6
6
4
Na3[AlF6]
六氟合铝(Ⅲ)酸钠
Na[Al(OH)4]
四羟基合铝(Ⅲ)酸钠
【实验3-3】
3、常见配合物的制备
①
②
③
反应①:Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
反应②:Cu(OH)2 + 4NH3= [Cu(NH3)4](OH)2
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
反应③:
更稳定。
【思考与讨论】
上述实验完成了 的转化,Cu2+与NH3形成的配位键和Cu2+与H2O形成的配位键哪个稳定?从结构角度解释。
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
因为H2O、NH3同为中性分子,但电负性N<O,N比O更容易给出孤对电子,与Cu2+形成的配位键更强。
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通常情况,较稳定的配合物可以转化为稳定性更强的配合物。
【实验3-4】
血红色溶液
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
实验步骤 实验现象 解释
在一定条件下, 配位键比较稳定,配离子不易发生电离。
写出K3[Fe(CN)6]的电离方程式
两滴
FeCl3(aq)
少量水
两滴
KSCN(aq)
两滴
K3[Fe(CN)6](aq)
少量水
两滴
KSCN(aq)
溶液变为
红色
生成 [Fe(SCN)n]3-n
(n = 1~6)
无明显现象
[Fe(CN)6]3-
很难电离出 Fe3+
K3[Fe(CN)6]=3K++ [Fe(CN)6]3-
配离子 [Fe(CN)6]3-的中心离子Fe3+、配体CN-、配位数6、 [Fe(CN)6]3-与Fe3+性质不一样
【实验活动】
简单离子和配离子的区别(104页实验2)
【实验3-5】
氨水
澄清
NaCl 溶液
少量
AgNO3 溶液
AgCl 沉淀
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3
[Ag(NH3)2]+
=
Ag++Cl -= AgCl ↓
AgCl + 2NH3 = [Ag(NH3)2]++Cl-
1)对溶解性的影响:一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
2)颜色的改变:当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
Al(OH)3 + NaOH = Na[Al(OH)4]
四羟基合铝酸钠
CuCl难溶于水,可溶于浓盐酸和氨水
4、配合物的形成对性质的影响
3)稳定性增强
①配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
②许多过渡金属元素的离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。
③当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
叶绿素
血红素
1)在生命体中的应用
叶绿素
血红蛋白
酶
维生素B12
钴配合物
含锌酶有80多种
维生素B12
5、配合物的应用
2)在医药中的应用
3)配合物与生物固氮
4)在生产生活中的应用
王水溶金
抗癌药物——顺铂
固氮酶
照相技术的定影
冰晶石Na3[AlF6]
热水瓶胆镀银[Ag(NH3)2]+
H[AuCl4]
顺-二氯二氨合铂又称顺铂
顺-二氨环丁羧酸铂又称卡铂
神奇的超分子,借分子间作用力形成复杂的组织结构
氢键是最强的分子间相互作用,很多分子可以通过氢键相互结合,形成具有固定组成的一个分子簇,这就是所谓的超分子。
核酸的双螺旋结构是靠氢键来保持的
二、超分子
1、定义
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体称为超分子。分子是广义的,包括离子。
2、超分子结构特点
分子层
分子团簇
分子长链
超分子是组成复杂的,有组织的分子聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性。
3、特性
(1)分子间相互作用:通过非共价键结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。
(2)分子聚集体大小:
有的是有限的 有的是无限伸展的
4、重要特征及其应用
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
①分离C60与C70
1)分子识别
O
O
O
O
O
O
O
O
O
15-冠-5 填充模型
15-冠-5 键线式
12-冠-4 球棍模型
14-冠-4 键线式
C 原子:2×4 = 8
O 原子:4
8 + 4 = 12
C 原子:2×5 = 10
O 原子:5
10 + 5 = 15
②冠醚识别碱金属离子
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
冠醚 冠醚空腔直径/pm 合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152) 15-冠-5 170~220 Na+(204) 18-冠-6 260~320 K+(276)、Rb+(304) 21-冠-7 340~430 Cs+(334) 表3-6 冠醚识别钾离子
18-冠-6–K+超分子
冠醚与金属阳离子通过配位作用相结合,不同大小的冠醚可以识别不同大小的碱金属离子。
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
2)超分子组装
烷基磺酸根离子在水中自组装为胶束
2020年,我国博士后王振元:潜心创新,成功开发出超分子生物催化技术,打破了国外巨头在化妆品高端原料市场的垄断地位。
超分子的未来发展:通过对超分子研究,人们可以模拟生物系统,复制出一些新材料,如:新催化剂、新药物、分子器件、生物传感器等功能材料。
第四节 配合物与超分子
第三章 晶体结构与性质
【问题探讨】
无水CuSO4固体是白色的,但CuSO4·5H2O晶体却是蓝色的,为什么呢?
CuSO4 CuSO4·5H2O
【实验探究】
【实验3-2】
固体 ①CuSO4 ②CuCl2 ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
颜色 白色 绿色 深褐色 白色 白色 白色
下表中的少量固体溶于足量的水中,观察实验现象
实验证明,硫酸铜晶体和 Cu2+的水溶液呈蓝色,实际上是Cu2+和H2O形成的[Cu(H2O)4]2+呈蓝色。[Cu(H2O)4]2+叫做四水合铜离子。
思考:Cu2+与H2O是如何结合的呢?
CuSO4溶液
CuCl2溶液
CuBr2溶液
K2SO4溶液
NaCl溶液
NaBr溶液
CuSO4
CuCl2
CuBr2
NaCl
K2SO4
NaBr
溶液呈天蓝色与Cu2+和H2O有关,与SO42-、Cl-、Br-、Na+、K+无关。
天蓝色
无色
依据反应 NH3 +H+ =NH4 + ,讨论NH3是如何与H+形成NH4+的?
配位键:由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。实质上是一种特殊的共价键。
类比NH4+ 的形成,推测Cu2+与H2O间是怎样形成[Cu(H2O)4]2+的?
NH3
H+
NH4+
H2O
Cu2+
[Cu(H2O)4]2+
+
+
提供孤电子对
提供空轨道
Cu
OH2
H2O
H2O
2+
OH2
H
N
H
H
H
[ ]
+
Cu2+的价层电子构型3d9, 4s和4p轨道是空的。
[Cu(H2O)4]2+的形成
激发杂化
H2O
H2O
H2O
H2O
[Cu(H2O)4]2+平面正方形
一、配合物
1、配位键
1)概念
2)形成条件
由一个原子单独提供孤电子对,另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。
①成键原子一方要有孤电子对
如 NH3、H2O、CO、有机胺等分子;卤离子 、OH-、CN-、SCN-等离子。
②成键原子另一方有空轨道
一般是过渡金属的原子或离子如:Fe3+、Cu2+、Zn2+、Ni2+、Co3+、Ni ;
还有H+、Al3+、B、Mg2+等主族元素
3)特点
配位键是一种特殊的共价键,同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
4)表示方法
(电子对给予体)A→B(电子对接受体)或A—B。
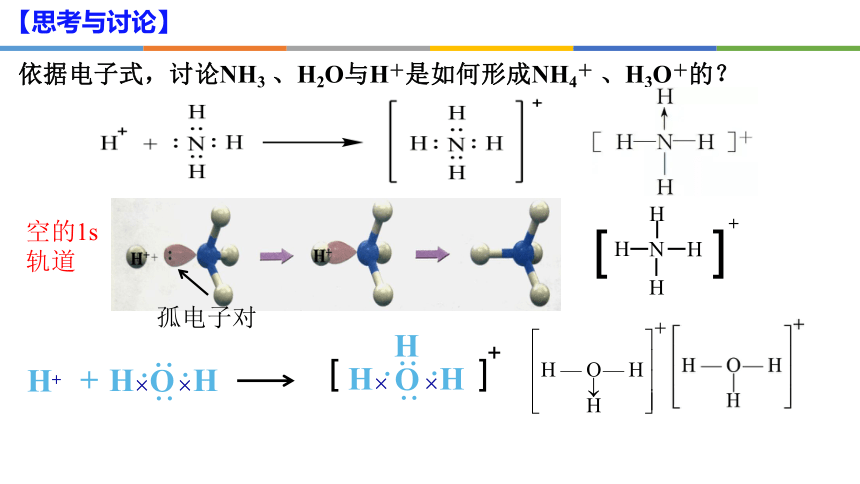
依据电子式,讨论NH3 、H2O与H+是如何形成NH4+ 、H3O+的?
空的1s轨道
孤电子对
··
O
··
×H
H×
·
·
H+
+
··
O
··
×H
H×
·
·
H
[ ]
+
H
N
H
H
H
[ ]
+
【思考与讨论】
[Cu(NH3)4]SO4
= [Cu(NH3)4]2+ + SO42-
配合物溶于水易电离为内界配离子和外界离子,内界配离子一般很稳定,不易电离。有些配合物不存在外界
2、配合物
1)
概
念
把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 配位键 结合形成的化合物称为配位化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等。
2)组成
①中心原子(离子):
提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。
②配位体:
含有孤电子对的分子或离子NH3 H2O CO Cl- SCN- CN-
③配位原子:
配位体中具有孤电子对原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子
④配位数:直接同中心原子配位的原子数目,一般是2、4、6、8
⑤配离子的电荷:等于中心离子和配体总电荷的代数和,如:[Fe(SCN)6]3-
注意:
①有的配合物没有外界,如 Ni(CO)4 , Fe(CO)5等。
②NH4Cl中含配位键,但不是配位化合物。配合物一定含有配位键
配合物 内界 外界 中心粒子 配位体 配位数
[Ag(NH3)2]OH 氢氧化二氨合银
K3[Fe(CN)6] 六氰合铁酸钾
[Co(NH3)5Cl]Cl2 二氯化一氯·五氨合钴(Ⅱ)
Ni(CO)4 四羰基镍
【课堂练习】完成下表:
[Ag(NH3)2]+
[Fe(CN)6]3-
[Co(NH3)5Cl]2+
Ni(CO)4
OH-
K+
Cl-
无
Ag+
Fe3+
Co3+
Ni
NH3
CN-
NH3、Cl-
CO
2
6
6
4
Na3[AlF6]
六氟合铝(Ⅲ)酸钠
Na[Al(OH)4]
四羟基合铝(Ⅲ)酸钠
【实验3-3】
3、常见配合物的制备
①
②
③
反应①:Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
反应②:Cu(OH)2 + 4NH3= [Cu(NH3)4](OH)2
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
反应③:
更稳定。
【思考与讨论】
上述实验完成了 的转化,Cu2+与NH3形成的配位键和Cu2+与H2O形成的配位键哪个稳定?从结构角度解释。
[Cu(H2O)4]2+
[Cu(NH3)4]2+
Cu(OH)2
因为H2O、NH3同为中性分子,但电负性N<O,N比O更容易给出孤对电子,与Cu2+形成的配位键更强。
配位键的强度有大有小,有的配合物较稳定,有的配合物较不稳定。通常情况,较稳定的配合物可以转化为稳定性更强的配合物。
【实验3-4】
血红色溶液
Fe3++nSCN- = [Fe(SCN)n]3-n
n = 1-6,随SCN-的浓度而异
利用硫氰化铁配离子等颜色,可用于鉴别溶液中存在Fe3+;
又由于硫氰化铁配离子的颜色极似血液,常被用于电影特技和魔术
实验步骤 实验现象 解释
在一定条件下, 配位键比较稳定,配离子不易发生电离。
写出K3[Fe(CN)6]的电离方程式
两滴
FeCl3(aq)
少量水
两滴
KSCN(aq)
两滴
K3[Fe(CN)6](aq)
少量水
两滴
KSCN(aq)
溶液变为
红色
生成 [Fe(SCN)n]3-n
(n = 1~6)
无明显现象
[Fe(CN)6]3-
很难电离出 Fe3+
K3[Fe(CN)6]=3K++ [Fe(CN)6]3-
配离子 [Fe(CN)6]3-的中心离子Fe3+、配体CN-、配位数6、 [Fe(CN)6]3-与Fe3+性质不一样
【实验活动】
简单离子和配离子的区别(104页实验2)
【实验3-5】
氨水
澄清
NaCl 溶液
少量
AgNO3 溶液
AgCl 沉淀
AgCl(s) Ag+(aq) + Cl-(aq)
+
2NH3
[Ag(NH3)2]+
=
Ag++Cl -= AgCl ↓
AgCl + 2NH3 = [Ag(NH3)2]++Cl-
1)对溶解性的影响:一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
2)颜色的改变:当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
Al(OH)3 + NaOH = Na[Al(OH)4]
四羟基合铝酸钠
CuCl难溶于水,可溶于浓盐酸和氨水
4、配合物的形成对性质的影响
3)稳定性增强
①配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
②许多过渡金属元素的离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。
③当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
叶绿素
血红素
1)在生命体中的应用
叶绿素
血红蛋白
酶
维生素B12
钴配合物
含锌酶有80多种
维生素B12
5、配合物的应用
2)在医药中的应用
3)配合物与生物固氮
4)在生产生活中的应用
王水溶金
抗癌药物——顺铂
固氮酶
照相技术的定影
冰晶石Na3[AlF6]
热水瓶胆镀银[Ag(NH3)2]+
H[AuCl4]
顺-二氯二氨合铂又称顺铂
顺-二氨环丁羧酸铂又称卡铂
神奇的超分子,借分子间作用力形成复杂的组织结构
氢键是最强的分子间相互作用,很多分子可以通过氢键相互结合,形成具有固定组成的一个分子簇,这就是所谓的超分子。
核酸的双螺旋结构是靠氢键来保持的
二、超分子
1、定义
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体称为超分子。分子是广义的,包括离子。
2、超分子结构特点
分子层
分子团簇
分子长链
超分子是组成复杂的,有组织的分子聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性。
3、特性
(1)分子间相互作用:通过非共价键结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。
(2)分子聚集体大小:
有的是有限的 有的是无限伸展的
4、重要特征及其应用
C60
C70
这个例子反映出来的超分子的特性被称为“分子识别”。
①分离C60与C70
1)分子识别
O
O
O
O
O
O
O
O
O
15-冠-5 填充模型
15-冠-5 键线式
12-冠-4 球棍模型
14-冠-4 键线式
C 原子:2×4 = 8
O 原子:4
8 + 4 = 12
C 原子:2×5 = 10
O 原子:5
10 + 5 = 15
②冠醚识别碱金属离子
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
冠醚 冠醚空腔直径/pm 合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152) 15-冠-5 170~220 Na+(204) 18-冠-6 260~320 K+(276)、Rb+(304) 21-冠-7 340~430 Cs+(334) 表3-6 冠醚识别钾离子
18-冠-6–K+超分子
冠醚与金属阳离子通过配位作用相结合,不同大小的冠醚可以识别不同大小的碱金属离子。
细胞外部
磷脂分子
双分子层
细胞质
疏水端
亲水端
亲水端
超分子组装的过程称为分子自组装(Molecular self-assembly),自组装过程(Self-organization)是使超分子产生高度有序的过程。
2)超分子组装
烷基磺酸根离子在水中自组装为胶束
2020年,我国博士后王振元:潜心创新,成功开发出超分子生物催化技术,打破了国外巨头在化妆品高端原料市场的垄断地位。
超分子的未来发展:通过对超分子研究,人们可以模拟生物系统,复制出一些新材料,如:新催化剂、新药物、分子器件、生物传感器等功能材料。
