专题8 有机化合物的获得与应用 检测题(含解析)2023-2024学年高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题8 有机化合物的获得与应用 检测题(含解析)2023-2024学年高一下学期化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 317.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 14:01:13 | ||
图片预览




文档简介
专题8《有机化合物的获得与应用》检测题
一、单选题
1.下列物质属于合成高分子材料的是
A.水泥 B.钛合金 C.食品保鲜膜 D.乙醇
2.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,最符合原子经济性要求的是(反应均在一定条件下进行)( )
A.+C2H5Cl+HCl
B.+C2H5OH+H2O
C.+CH2=CH2
D.+NaH+NaBr
3.下列反应中,属于加成反应的是
A.乙烯与氢气反应生成乙烷 B.乙醇与氧气反应生成二氧化碳和水
C.乙醇与钠反应生成乙醇钠和氢气 D.苯和浓硝酸反应生成硝基苯和水
4.下列化学用语表达正确的是
A.高氯酸根离子:ClO- B.干冰的分子式:H2O
C.乙烯的结构简式:CH2=CH2 D.乙醇的结构简式:C2H6O
5.变量控制是科学研究的重要方法。相同质量的碳酸钙与足量盐酸分别在下列条件下发生反应,化学反应速率最大的是
选项 碳酸钙的状态 实验温度/
A 粉末 20
B 粉末 40
C 块状 20
D 块状 40
A.A B.B C.C D.D
6.在体积不变的容器中加入一定量的碳和水蒸气,在一定条件下发生反应:。下列说法正确的是
A.若容器内压强不再改变,则该反应达到平衡状态
B.选用合适的催化剂,可使反应物完全转化
C.达到平衡后,水蒸气和一氧化碳的浓度相等
D.达到平衡后,生成氢气的速率为零
7.乙酰水杨酸(阿司匹林)的结构如图,下列说法中错误的
A.阿司匹林有镇痛、解热的功效
B.乙酰水杨酸分子中含有羧基官能团
C.乙酰水杨酸可发生酯化反应和水解反应
D.乙酰水杨酸是一种不饱和烃
8.下列措施对增大反应速率明显有效的是( )
A.在用H2和N2工业合成NH3时,降低温度 B.将铝片改为铝粉,做铝与氧气反应的实验
C.K2SO4与BaCl2在溶液中反应时,增大压强 D.Fe与稀硫酸反应制取氢气时,改用浓硫酸
9.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若c(HI)由0.1mol/L 降到0.06mol/L时,需要20s,那么c(HI)由0.06mol/L 降到0.04mol/L时,所需反应的时间为
A.等于10s B.大于10 s C.小于10 s D.以上答案都不正确
10.在一个恒容容器中充入N2(g)和H2(g),一定条件下发生反应N2(g)+3H2(g)2NH3(g),若温度保持不变,下列说法正确的是( )
A.容器中的压强始终保持不变
B.反应达到限度后N2(g)和H2(g)的物质的量之比一定为1:3
C.正、逆反应速率相等时各物质质量不再变化
D.当充入足够N2(g)后,H2(g)会全部转化
11.法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2Cl2、丙烷、戊醇、苯,下列说法不正确的是
A.丙烷没有同分异构体
B.丙烯能使溴水褪色
C.戊醇与乙醇含有相同官能团,所以性质相似
D.苯分子中6个碳原子间是单双键交替结构
12.下列由实验得出的结论正确的是
选项 实验 结论
A 将乙醛滴入溴水中,溶液褪色 褪色原因是发生了加成反应
B 向淀粉溶液中加入硫酸溶液,加热后滴入几滴氢氧化铜悬浊液,再加热到沸腾,未出现红色物质 淀粉未水解
C 向鸡蛋清的溶液中加入饱和硫酸钠溶液产生沉淀 硫酸钠可使蛋白质变性
D 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 发生加成反应生成的1,2 -二溴乙烷无色、可溶于四氯化碳
A.A B.B C.C D.D
13.表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol甲基中所含有的电子数为
B.标准状况下,2.24L己烷所含有的碳原子数为
C.5.6g铁与足量氯气反应转移电子数为
D.和在浓硫酸作用下反应生成的酯分子数为
14.在C(s)+CO2(g)2CO(g)反应中可使反应速率增大的措施是
①减小容器体积增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
A.①③⑤ B.②④ C.①③ D.③⑤
15.化学与生产、生活密切相关,下列说法不正确的是
A.聚乙烯塑料可用作食品袋、餐具、地膜等
B.苯可用作洗涤剂、有机溶剂、消毒剂、染料等
C.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯
D.生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物
二、填空题
16.有下列烃的衍生物中:①溴乙烷②苯酚③乙醛④乙酸⑤乙酸乙酯。
(1)能与新制氢氧化铜反应生成砖红色沉淀的是__________;(填序号)
(2)能与碳酸氢钠溶液反应放出二氧化碳的是__________;(填序号)
(3)在一定条件下能发生消去反应的是__________;(填序号)
(4)常温下能与浓溴水发生反应生成白色沉淀的是__________;(填序号)
(5)在一定条件能发生水解反应的是__________;(填序号)
(6)写出由④生成⑤反应的化学方程式__________;反应类型是__________ 。
17.回答下列问题
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,配制溶液的物质的量浓度会___________(填“偏大”“偏小”或“不变”)。
(2)除去二氧化碳气体中的氯化氢杂质,选用的试剂是___________(填“NaOH溶液”或“饱和NaHCO3溶液”)。
(3)实验室制取氯气时,可用___________作干燥剂(填“浓硫酸”或“碱石灰”)。
(4)已知I2与H2发生反应:I2(g)+H2(g)2HI(g)。一定条件下,将1mol I2和1mol H2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。用I2表示该反应的化学反应速率是___________mol·L 1·min 1。
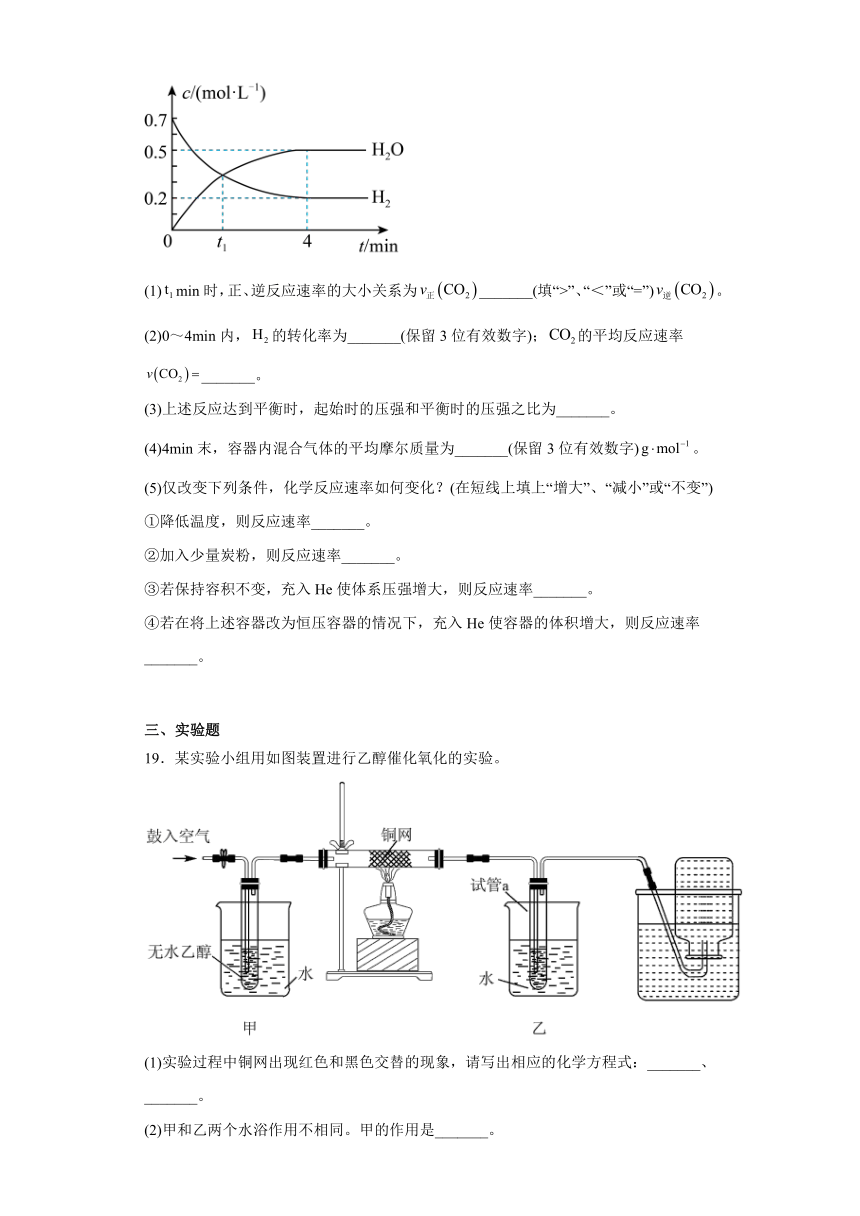
18.在催化剂作用下,氢气可以还原,其反应为一定温度下,向容积为2L的恒容密闭容器中加入1mol并充入一定量的氢气,反应过程中和水蒸气的浓度与时间的关系如图所示。
(1)min时,正、逆反应速率的大小关系为_______(填“>”、“<”或“=”)。
(2)0~4min内,的转化率为_______(保留3位有效数字);的平均反应速率_______。
(3)上述反应达到平衡时,起始时的压强和平衡时的压强之比为_______。
(4)4min末,容器内混合气体的平均摩尔质量为_______(保留3位有效数字)。
(5)仅改变下列条件,化学反应速率如何变化?(在短线上填上“增大”、“减小”或“不变”)
①降低温度,则反应速率_______。
②加入少量炭粉,则反应速率_______。
③若保持容积不变,充入He使体系压强增大,则反应速率_______。
④若在将上述容器改为恒压容器的情况下,充入He使容器的体积增大,则反应速率_______。
三、实验题
19.某实验小组用如图装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:_______、_______。
(2)甲和乙两个水浴作用不相同。甲的作用是_______。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是_______。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,要除去该物质,可在混合液中加入_______(填标号)。然后,再通过_______(填试验操作名称)即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
20.实验室制取乙酸乙酯的装置如图所示。请回答:
(1)写出乙酸的结构简式:_______。
(2)A装置中加入药品时,要先加入_______。
(3)B装置中的导管不能深入液面以下的原因是:_______。
(4)B中应该盛放的药品是_______,它起到的作用有:_______(写出一条即可)。
(5)该实验的原理是(用方程式表示):_______。
21.取甲、乙两支试管,各加入4mL 0.01mol/L的酸性KMnO4溶液,向甲试管中加入2mL 0.1mol/L H2C2O4溶液;向乙试管中加入2mL 0.2mol/L H2C2O4(草酸)溶液。充分振荡试管,静置。
(1)该实验是研究__________对反应速率的影响,试管中均会出现的现象是:__________________________ ;所需时间较短的试管是:________ (填“甲”或“乙”),得出的结论是:_______________________________________________。
(2)酸性KMO4溶液的配制是向KMnO4溶液中加入H2SO4进行酸化,而不能用盐酸酸化,试用化学方程式表示原因: ___________________________________;
(3)写出酸性KMnO4溶液与草酸反应的离子方程式:________________________。
(4)在上面的实验中,两支试管中转移电子数:甲____乙(填 “>”、 “=”或 “<” ),乙试管转移电子的物质的量:_________mol。
四、计算题
22.常温下,1L含甲烷9.5%(体积分数)的空气遇火充分反应(空气中含甲烷的体积分数9.5%时,刚好完全反应),恢复到常温时,气体最终的体积为___________。
试卷第2页,共6页
参考答案:
1.C
【详解】A.水泥是传统硅酸盐材料,属于无机非金属材料,A错误;
B.钛合金属于金属材料,B错误;
C.食品保鲜膜是一种塑料包装制品,有三大种类:聚乙烯、聚氯乙烯和聚偏二氯乙烯,属于合成高分子材料,C正确;
D.乙醇的相对分子质量小,是小分子有机化合物,D错误;
答案选C。
2.C
【分析】原子利用率为100%,即反应物全部转化为最终产物,生成物只有一种。
【详解】AB.产物有两种,不符合“绿色化学”的思想,故AB错误;
C.反应物中原子全部转化为产物,且产物只有一种,符合“绿色化学”的思想,故C正确;
D.产物有两种,不符合“绿色化学”的思想,故D错误。
综上所述,答案为C。
3.A
【详解】A.乙烯含有碳碳双键,与氢气发生加成反应生成乙烷,所以此反应属于加成反应,故选A项;
B.乙醇与氧气反应生成二氧化碳和水,此反应为氧化反应,故B项不选;
C.乙醇与钠反应生成乙醇钠和氢气,属于置换反应,不符合加成反应概念,故C项不选;
D.苯和浓硝酸反应生成硝基苯和水,为取代反应,故D项不选;
答案为A。
4.C
【详解】A.高氯酸根是+7价的Cl的含氧酸根,表示为,A错误;
B.干冰是二氧化碳的固体,分子式为:CO2,B错误;
C.乙烯含有碳碳双键,其结构简式为:CH2=CH2,C正确;
D.乙醇的分子式为:C2H6O,而结构简式为:CH3CH2OH,D错误;
答案选C。
5.B
【详解】相同质量的碳酸钙与足量0.5mol L-1盐酸反应,反应物相同,接触面积越大,温度越高,反应速率越快,所以开始阶段化学反应速率最大的是粉末状碳酸钙,温度为40℃,故选B。
6.A
【详解】A.该反应为气体体积增大的反应,且容器的体积不变,随着反应的进行,容器内压强逐渐增大,当压强不再改变时,反应达到平衡状态,A正确;
B.催化剂可以改变反应速率,但是并不能提高反应物的转化率使其完全转化,B错误;
C.达到平衡时,水蒸气和一氧化碳的浓度不一定相等,这与反应温度、初始加入的水蒸气的量等有关,C错误;
D.化学平衡是一种动态的平衡,达到平衡时,生成氢气的速率不为零,D错误;
故答案选A。
7.D
【详解】A.阿司匹林有镇痛、解热的功效,是世界上应用最广泛的解热、镇痛和抗炎药,A正确;
B.该分子中含有羧基-COOH和酯基,B正确;
C.该分子中含有羧基,可生酯化反应,该分子中含有酯基可发生水解反应,C正确;
D.烃是指只含有C、H两种元素的有机化合物,而该分子中还含有O元素,属于烃的衍生物,D错误;
故选D。
8.B
【详解】
A.降低温度,活化分子数减小,有效碰撞次数减小,反应速率减慢,故A不选;
B.做铝与氧气反应的实验时,将铝片改为铝粉,增大固体接触面积,反应速率加快,故B选;
C.压强对在溶液中进行的化学反应的反应速率无影响,故C不选;
D.将稀硫酸改用浓硫酸后,Fe发生钝化,不能制得氢气,故D不选;
答案选B。
9.B
【详解】c(HI)由0.1mol/L降低到0.06mol/L时,需要20s,即浓度减少0.04mol/L需要20s、平均速率为 ;则c(HI)由0.06mol/L 降到0.04mol/L,假设速率不变,则需要,但浓度越小,化学反应速率越小,需要的时间就长,所以需要时间大于10s;
答案选B。
10.C
【详解】A.观察化学方程式可知,该反应进行中气体分子总数减少,混合气体的总物质的量减小,容器内气体的压强逐渐减小,故A错误;
B.若开始时充入的N2和H2的物质的量之比是1:3,则平衡时N2和H2的物质的量之比一定是1:3;若开始时充入的N2和H2的物质的量之比不是1:3,则平衡时N2和H2的物质的量之比一定不是1:3,故B错误;
C.正、逆反应速率相等时,反应达到平衡状态,各物质的质量不再发生变化,故C正确;
D.因为N2(g)+3H2(g)2NH3(g)是可逆反应,当充入足够N2(g)后,平衡向右移动,但不可能使H2(g)全部转化,故D错误;
答案为C。
11.D
【详解】A.丙烷的分子式为C3H8,其结构只有CH3CH2CH3一种,故不存在同分异构体,A正确;
B.丙烯能与Br2发生加成反应,从而使溴水褪色,B正确;
C.戊醇和乙醇官能团均为羟基,互为同系物,性质相似,C正确;
D.由于苯不能使KMnO4溶液褪色,说明苯中不存在碳碳双键,其碳碳之间的键是介于碳碳单键和碳碳双键之间特殊的键,D错误;
故答案选D。
12.D
【详解】A.乙醛滴入溴水中,溶液褪色,原因为溴水为强氧化剂,乙醛被溴水氧化生成乙酸,A错误;
B.应在碱性溶液中检验葡萄糖,该选项水解后未加碱至碱性,操作不合理,无法得知结论,B错误;
C.向鸡蛋清的溶液中加入饱和硫酸钠溶液,发生盐析,析出沉淀后加水可溶解,C错误;
D.将乙烯通入溴的四氯化碳溶液中,会发生加成反应,生成 1,2-二溴乙烷,为无色液体,可溶于四氯化碳,溶液最终变为无色透明,D正确;
故答案选D。
13.A
【详解】A.1个甲基中含有9个电子,1mol甲基中所含有的电子数为,故A正确;
B.标准状况下,己烷不是气体,无法计算其物质的量,故B错误;
C.铁与足量氯气反应生成氯化铁,5.6g铁的物质的量为0.1mol,故5.6g铁与足量氯气反应转移电子数为,故C错误;
D.酯化反应为可逆反应,1mol和2mol在浓硫酸作用下反应生成的酯的分子数小于,故D错误;
故答案选A。
14.C
【详解】①减小容器体积,增大压强,反应速率加快,故①符合题意;
②C是固体,增加C的量,不影响反应速率,故②不符合题意;
③恒容下通入CO2,CO2浓度增大,反应速率加快,故③符合题意;
④恒压下充入N2,体积增大,参加反应的气体的浓度减小,反应速率减小,故④不符合题意;
⑤恒容下充入N2,参加反应的气体的浓度不变,反应速率不变,故⑤不符合题意;
能使反应速率增大的措施是①③,答案选C。
15.D
【详解】A. 聚乙烯塑料耐化学腐蚀,耐寒,可用作食品袋、餐具、地膜等,A项正确;
B. 苯是重要的化工原料,也是重要的有机溶剂,可用作洗涤剂、有机溶剂、消毒剂、染料等,B项正确;
C. 乙醇易被氧化生成乙酸,乙酸和乙醇在一定条件下反应生成具有香味的乙酸乙酯,C项正确;
D. 生物柴油的主要成分为酯类,含碳、氢、氧元素,属于烃的衍生物的混合物,石油分馏所得的柴油是碳氢化合物的混合物,D项错误;
答案选D。
16.(1)③
(2)④
(3)①
(4)②
(5)①⑤
(6) CH3COOH+C2H5OH CH3COOC2H5+H2O 取代反应或酯化反应
【详解】(1)能使新制氢氧化铜反应生成沉淀的物质含有-CHO。答案为③;
(2)能与碳酸氢钠反应产生二氧化碳的物质呈酸性。答案为④;
(3)能发生消去反应的物质有醇类、卤代烃类。答案为①;
(4)能与溴水产生白色沉淀为酚类物质。答案为②;
(5)能发生水解的有机物有卤代烃、多糖、蛋白质、酯类物质等。答案为①⑤;
(6)④→⑤反应,应该为羧酸和醇发生酯化反应,从官能团来看可以是羧酸的羟基被-OC2H5取代。所以该反应为取代反应。答案为;取代反应或酯化反应。
17.(1)偏小
(2)饱和NaHCO3溶液
(3)浓硫酸
(4)0.12
【解析】(1)
配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,会导致溶液体积偏大,则浓度偏小,故答案为:偏小;
(2)
CO2和HCl均为酸性气体,均能与NaOH溶液反应,而CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2,故除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液,故答案为:饱和NaHCO3溶液;
(3)
氯气是酸性气体,应选酸性干燥剂来干燥氯气,故答案为:浓硫酸;
(4)
用I2表示该反应的化学反应速率是。
18.(1)>
(2) 71.4% 0.0625
(3)24:19
(4)21.5
(5) 减小 不变 不变 减小
【详解】(1)因为min时化学反应没有达到平衡,反应仍然向正反应方向进行,所以正反应速率大于逆反应速率,即>。
(2)根据图象分析,0~4min内的浓度变化量为转化率为;在4min内的浓度变化量为0.25,则4min内的平均反应速率为。
(3)根据题意可知,起始时通入的氢气的物质的量为1.4mol和1molCO2共2.4mol,根据三段式
达到平衡时气体的总物质的量为1.9mol,恒温恒容条件下,压强之比等于物质的量之比为24:19。
(4)平衡时气体的总物质的量为1.9mol,平均摩尔质量。
(5)①降低温度,则反应速率减小。
②炭粉为固体,则反应速率不变。
③若保持容积不变,充入He使体系压强增大,反应物生成物的浓度不变,则反应速率不变。
④若在将上述容器改为恒压容器的情况下,充入He使容器的体积增大,反应物生成物的浓度减小,则反应速率减小。
19.(1)
(2)加热使乙醇挥发
(3)乙醛、乙醇和水
(4) C 蒸馏
【解析】(1)
Cu网在空气中加热时生成黑色CuO,反应式为;黑色氧化铜被乙醇还原为红色的Cu,反应式为;;
(2)
甲处水浴作用是加热使得乙醇挥发产生蒸气;
(3)
乙处冰水作用是冷凝反应生成的混合产物成为液体,主要成分有乙醛、乙醇和水;
(4)
a处能使紫色石蕊变红的物质为CH3COOH,利用NaHCO3与之反应,然后蒸馏出乙醛即可分离除去,故答案选C,操作为蒸馏。
20.(1)CH3COOH
(2)乙醇
(3)防止发生倒吸
(4) 饱和碳酸钠溶液 中和乙酸或溶解乙醇或降低乙酸乙酯的溶解度;
(5)
【分析】本实验为利用乙酸与乙醇在浓硫酸和加热条件下生成乙酸乙酯,且用饱和碳酸钠溶液收集乙酸乙酯。
【详解】(1)乙酸的结构简式为CH3COOH;
(2)因为乙酸比乙醇昂贵,所以实验中乙醇过量,为防止乙酸挥发,最后加入乙酸,浓硫酸密度大于乙醇,所以应该先加入乙醇,然后缓缓加入浓硫酸,同时用玻璃棒搅拌,冷却后加入乙酸;
(3)乙醇和乙酸易溶于水,实验中注意长导管不能伸入B试管液面以下,否则B试管中的液体倒吸进入A试管,发生倒吸现象;
(4)由于乙酸乙酯在饱和碳酸钠溶液中溶解度较小,且碳酸钠能够中和乙酸、溶解乙醇,便于混合液分层,则B中应该盛放的药品是饱和碳酸钠溶液;它起到的作用有中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度;
(5)酯化反应的本质为酸脱羟基,醇脱氢,本实验是利用乙酸与乙醇反应生成乙酸乙酯和水,其反应方程式为。
21. 浓度 褪色 乙 反应物浓度越大,速率越大 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 2MnO+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O = 2×10-4
【详解】(1)由于甲、乙两个试管中加入的酸性高锰酸钾溶液的浓度、体积相同,但两试管中加入的草酸的浓度不同但体积相同,故该实验探究的是浓度对反应速率的影响;由于酸性高锰酸钾溶液可以和草酸反应,故两个试管中都会出现紫色褪色的现象,但由于两试管中加入的草酸浓度不同,故乙试管中高锰酸钾颜色褪去的时间较短;由此可以得出的结论是反应物浓度越大,速率越大,故答案为:浓度、褪色、乙、反应物浓度越大,速率越大;
(2)高锰酸钾溶液具有强氧化性,可以和HCl反应生成Cl2,故不能用盐酸酸化,反应的化学方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;
(3)酸性高锰酸钾溶液和草酸反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,故反应的离子方程式为:2MnO+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,故答案为:2MnO+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
(4)由于高锰酸钾少量而草酸过量,反应过程中高锰酸钾可以完全反应,故两个试管中转移电子的数目相同,试管中高锰酸钾的锰元素的物质的量n=4×10-3L×0.01mol/L=4×10-5mol,每个Mn又转移5个电子变成Mn2+,乙试管共转移电子的物质的量n=5×4×10-5mol=2×10-4mol,故答案为:=、2×10-4。
22.0.81L
【详解】甲烷燃烧的化学方程式为,空气中含甲烷9.5%(体积分数)时,刚好完全反应,恢复到常温时,水为液态,1体积甲烷燃烧,消耗2体积氧气,生成1体积二氧化碳,所以1体积甲烷燃烧,气体体积减小2体积,气体最终的体积为
一、单选题
1.下列物质属于合成高分子材料的是
A.水泥 B.钛合金 C.食品保鲜膜 D.乙醇
2.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,最符合原子经济性要求的是(反应均在一定条件下进行)( )
A.+C2H5Cl+HCl
B.+C2H5OH+H2O
C.+CH2=CH2
D.+NaH+NaBr
3.下列反应中,属于加成反应的是
A.乙烯与氢气反应生成乙烷 B.乙醇与氧气反应生成二氧化碳和水
C.乙醇与钠反应生成乙醇钠和氢气 D.苯和浓硝酸反应生成硝基苯和水
4.下列化学用语表达正确的是
A.高氯酸根离子:ClO- B.干冰的分子式:H2O
C.乙烯的结构简式:CH2=CH2 D.乙醇的结构简式:C2H6O
5.变量控制是科学研究的重要方法。相同质量的碳酸钙与足量盐酸分别在下列条件下发生反应,化学反应速率最大的是
选项 碳酸钙的状态 实验温度/
A 粉末 20
B 粉末 40
C 块状 20
D 块状 40
A.A B.B C.C D.D
6.在体积不变的容器中加入一定量的碳和水蒸气,在一定条件下发生反应:。下列说法正确的是
A.若容器内压强不再改变,则该反应达到平衡状态
B.选用合适的催化剂,可使反应物完全转化
C.达到平衡后,水蒸气和一氧化碳的浓度相等
D.达到平衡后,生成氢气的速率为零
7.乙酰水杨酸(阿司匹林)的结构如图,下列说法中错误的
A.阿司匹林有镇痛、解热的功效
B.乙酰水杨酸分子中含有羧基官能团
C.乙酰水杨酸可发生酯化反应和水解反应
D.乙酰水杨酸是一种不饱和烃
8.下列措施对增大反应速率明显有效的是( )
A.在用H2和N2工业合成NH3时,降低温度 B.将铝片改为铝粉,做铝与氧气反应的实验
C.K2SO4与BaCl2在溶液中反应时,增大压强 D.Fe与稀硫酸反应制取氢气时,改用浓硫酸
9.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若c(HI)由0.1mol/L 降到0.06mol/L时,需要20s,那么c(HI)由0.06mol/L 降到0.04mol/L时,所需反应的时间为
A.等于10s B.大于10 s C.小于10 s D.以上答案都不正确
10.在一个恒容容器中充入N2(g)和H2(g),一定条件下发生反应N2(g)+3H2(g)2NH3(g),若温度保持不变,下列说法正确的是( )
A.容器中的压强始终保持不变
B.反应达到限度后N2(g)和H2(g)的物质的量之比一定为1:3
C.正、逆反应速率相等时各物质质量不再变化
D.当充入足够N2(g)后,H2(g)会全部转化
11.法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2Cl2、丙烷、戊醇、苯,下列说法不正确的是
A.丙烷没有同分异构体
B.丙烯能使溴水褪色
C.戊醇与乙醇含有相同官能团,所以性质相似
D.苯分子中6个碳原子间是单双键交替结构
12.下列由实验得出的结论正确的是
选项 实验 结论
A 将乙醛滴入溴水中,溶液褪色 褪色原因是发生了加成反应
B 向淀粉溶液中加入硫酸溶液,加热后滴入几滴氢氧化铜悬浊液,再加热到沸腾,未出现红色物质 淀粉未水解
C 向鸡蛋清的溶液中加入饱和硫酸钠溶液产生沉淀 硫酸钠可使蛋白质变性
D 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 发生加成反应生成的1,2 -二溴乙烷无色、可溶于四氯化碳
A.A B.B C.C D.D
13.表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol甲基中所含有的电子数为
B.标准状况下,2.24L己烷所含有的碳原子数为
C.5.6g铁与足量氯气反应转移电子数为
D.和在浓硫酸作用下反应生成的酯分子数为
14.在C(s)+CO2(g)2CO(g)反应中可使反应速率增大的措施是
①减小容器体积增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
A.①③⑤ B.②④ C.①③ D.③⑤
15.化学与生产、生活密切相关,下列说法不正确的是
A.聚乙烯塑料可用作食品袋、餐具、地膜等
B.苯可用作洗涤剂、有机溶剂、消毒剂、染料等
C.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯
D.生物柴油和石油分馏所得的柴油都是碳氢化合物组成的混合物
二、填空题
16.有下列烃的衍生物中:①溴乙烷②苯酚③乙醛④乙酸⑤乙酸乙酯。
(1)能与新制氢氧化铜反应生成砖红色沉淀的是__________;(填序号)
(2)能与碳酸氢钠溶液反应放出二氧化碳的是__________;(填序号)
(3)在一定条件下能发生消去反应的是__________;(填序号)
(4)常温下能与浓溴水发生反应生成白色沉淀的是__________;(填序号)
(5)在一定条件能发生水解反应的是__________;(填序号)
(6)写出由④生成⑤反应的化学方程式__________;反应类型是__________ 。
17.回答下列问题
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,配制溶液的物质的量浓度会___________(填“偏大”“偏小”或“不变”)。
(2)除去二氧化碳气体中的氯化氢杂质,选用的试剂是___________(填“NaOH溶液”或“饱和NaHCO3溶液”)。
(3)实验室制取氯气时,可用___________作干燥剂(填“浓硫酸”或“碱石灰”)。
(4)已知I2与H2发生反应:I2(g)+H2(g)2HI(g)。一定条件下,将1mol I2和1mol H2充入1L的密闭容器中,5min后测得I2的物质的量为0.4mol。用I2表示该反应的化学反应速率是___________mol·L 1·min 1。
18.在催化剂作用下,氢气可以还原,其反应为一定温度下,向容积为2L的恒容密闭容器中加入1mol并充入一定量的氢气,反应过程中和水蒸气的浓度与时间的关系如图所示。
(1)min时,正、逆反应速率的大小关系为_______(填“>”、“<”或“=”)。
(2)0~4min内,的转化率为_______(保留3位有效数字);的平均反应速率_______。
(3)上述反应达到平衡时,起始时的压强和平衡时的压强之比为_______。
(4)4min末,容器内混合气体的平均摩尔质量为_______(保留3位有效数字)。
(5)仅改变下列条件,化学反应速率如何变化?(在短线上填上“增大”、“减小”或“不变”)
①降低温度,则反应速率_______。
②加入少量炭粉,则反应速率_______。
③若保持容积不变,充入He使体系压强增大,则反应速率_______。
④若在将上述容器改为恒压容器的情况下,充入He使容器的体积增大,则反应速率_______。
三、实验题
19.某实验小组用如图装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:_______、_______。
(2)甲和乙两个水浴作用不相同。甲的作用是_______。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是_______。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,要除去该物质,可在混合液中加入_______(填标号)。然后,再通过_______(填试验操作名称)即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
20.实验室制取乙酸乙酯的装置如图所示。请回答:
(1)写出乙酸的结构简式:_______。
(2)A装置中加入药品时,要先加入_______。
(3)B装置中的导管不能深入液面以下的原因是:_______。
(4)B中应该盛放的药品是_______,它起到的作用有:_______(写出一条即可)。
(5)该实验的原理是(用方程式表示):_______。
21.取甲、乙两支试管,各加入4mL 0.01mol/L的酸性KMnO4溶液,向甲试管中加入2mL 0.1mol/L H2C2O4溶液;向乙试管中加入2mL 0.2mol/L H2C2O4(草酸)溶液。充分振荡试管,静置。
(1)该实验是研究__________对反应速率的影响,试管中均会出现的现象是:__________________________ ;所需时间较短的试管是:________ (填“甲”或“乙”),得出的结论是:_______________________________________________。
(2)酸性KMO4溶液的配制是向KMnO4溶液中加入H2SO4进行酸化,而不能用盐酸酸化,试用化学方程式表示原因: ___________________________________;
(3)写出酸性KMnO4溶液与草酸反应的离子方程式:________________________。
(4)在上面的实验中,两支试管中转移电子数:甲____乙(填 “>”、 “=”或 “<” ),乙试管转移电子的物质的量:_________mol。
四、计算题
22.常温下,1L含甲烷9.5%(体积分数)的空气遇火充分反应(空气中含甲烷的体积分数9.5%时,刚好完全反应),恢复到常温时,气体最终的体积为___________。
试卷第2页,共6页
参考答案:
1.C
【详解】A.水泥是传统硅酸盐材料,属于无机非金属材料,A错误;
B.钛合金属于金属材料,B错误;
C.食品保鲜膜是一种塑料包装制品,有三大种类:聚乙烯、聚氯乙烯和聚偏二氯乙烯,属于合成高分子材料,C正确;
D.乙醇的相对分子质量小,是小分子有机化合物,D错误;
答案选C。
2.C
【分析】原子利用率为100%,即反应物全部转化为最终产物,生成物只有一种。
【详解】AB.产物有两种,不符合“绿色化学”的思想,故AB错误;
C.反应物中原子全部转化为产物,且产物只有一种,符合“绿色化学”的思想,故C正确;
D.产物有两种,不符合“绿色化学”的思想,故D错误。
综上所述,答案为C。
3.A
【详解】A.乙烯含有碳碳双键,与氢气发生加成反应生成乙烷,所以此反应属于加成反应,故选A项;
B.乙醇与氧气反应生成二氧化碳和水,此反应为氧化反应,故B项不选;
C.乙醇与钠反应生成乙醇钠和氢气,属于置换反应,不符合加成反应概念,故C项不选;
D.苯和浓硝酸反应生成硝基苯和水,为取代反应,故D项不选;
答案为A。
4.C
【详解】A.高氯酸根是+7价的Cl的含氧酸根,表示为,A错误;
B.干冰是二氧化碳的固体,分子式为:CO2,B错误;
C.乙烯含有碳碳双键,其结构简式为:CH2=CH2,C正确;
D.乙醇的分子式为:C2H6O,而结构简式为:CH3CH2OH,D错误;
答案选C。
5.B
【详解】相同质量的碳酸钙与足量0.5mol L-1盐酸反应,反应物相同,接触面积越大,温度越高,反应速率越快,所以开始阶段化学反应速率最大的是粉末状碳酸钙,温度为40℃,故选B。
6.A
【详解】A.该反应为气体体积增大的反应,且容器的体积不变,随着反应的进行,容器内压强逐渐增大,当压强不再改变时,反应达到平衡状态,A正确;
B.催化剂可以改变反应速率,但是并不能提高反应物的转化率使其完全转化,B错误;
C.达到平衡时,水蒸气和一氧化碳的浓度不一定相等,这与反应温度、初始加入的水蒸气的量等有关,C错误;
D.化学平衡是一种动态的平衡,达到平衡时,生成氢气的速率不为零,D错误;
故答案选A。
7.D
【详解】A.阿司匹林有镇痛、解热的功效,是世界上应用最广泛的解热、镇痛和抗炎药,A正确;
B.该分子中含有羧基-COOH和酯基,B正确;
C.该分子中含有羧基,可生酯化反应,该分子中含有酯基可发生水解反应,C正确;
D.烃是指只含有C、H两种元素的有机化合物,而该分子中还含有O元素,属于烃的衍生物,D错误;
故选D。
8.B
【详解】
A.降低温度,活化分子数减小,有效碰撞次数减小,反应速率减慢,故A不选;
B.做铝与氧气反应的实验时,将铝片改为铝粉,增大固体接触面积,反应速率加快,故B选;
C.压强对在溶液中进行的化学反应的反应速率无影响,故C不选;
D.将稀硫酸改用浓硫酸后,Fe发生钝化,不能制得氢气,故D不选;
答案选B。
9.B
【详解】c(HI)由0.1mol/L降低到0.06mol/L时,需要20s,即浓度减少0.04mol/L需要20s、平均速率为 ;则c(HI)由0.06mol/L 降到0.04mol/L,假设速率不变,则需要,但浓度越小,化学反应速率越小,需要的时间就长,所以需要时间大于10s;
答案选B。
10.C
【详解】A.观察化学方程式可知,该反应进行中气体分子总数减少,混合气体的总物质的量减小,容器内气体的压强逐渐减小,故A错误;
B.若开始时充入的N2和H2的物质的量之比是1:3,则平衡时N2和H2的物质的量之比一定是1:3;若开始时充入的N2和H2的物质的量之比不是1:3,则平衡时N2和H2的物质的量之比一定不是1:3,故B错误;
C.正、逆反应速率相等时,反应达到平衡状态,各物质的质量不再发生变化,故C正确;
D.因为N2(g)+3H2(g)2NH3(g)是可逆反应,当充入足够N2(g)后,平衡向右移动,但不可能使H2(g)全部转化,故D错误;
答案为C。
11.D
【详解】A.丙烷的分子式为C3H8,其结构只有CH3CH2CH3一种,故不存在同分异构体,A正确;
B.丙烯能与Br2发生加成反应,从而使溴水褪色,B正确;
C.戊醇和乙醇官能团均为羟基,互为同系物,性质相似,C正确;
D.由于苯不能使KMnO4溶液褪色,说明苯中不存在碳碳双键,其碳碳之间的键是介于碳碳单键和碳碳双键之间特殊的键,D错误;
故答案选D。
12.D
【详解】A.乙醛滴入溴水中,溶液褪色,原因为溴水为强氧化剂,乙醛被溴水氧化生成乙酸,A错误;
B.应在碱性溶液中检验葡萄糖,该选项水解后未加碱至碱性,操作不合理,无法得知结论,B错误;
C.向鸡蛋清的溶液中加入饱和硫酸钠溶液,发生盐析,析出沉淀后加水可溶解,C错误;
D.将乙烯通入溴的四氯化碳溶液中,会发生加成反应,生成 1,2-二溴乙烷,为无色液体,可溶于四氯化碳,溶液最终变为无色透明,D正确;
故答案选D。
13.A
【详解】A.1个甲基中含有9个电子,1mol甲基中所含有的电子数为,故A正确;
B.标准状况下,己烷不是气体,无法计算其物质的量,故B错误;
C.铁与足量氯气反应生成氯化铁,5.6g铁的物质的量为0.1mol,故5.6g铁与足量氯气反应转移电子数为,故C错误;
D.酯化反应为可逆反应,1mol和2mol在浓硫酸作用下反应生成的酯的分子数小于,故D错误;
故答案选A。
14.C
【详解】①减小容器体积,增大压强,反应速率加快,故①符合题意;
②C是固体,增加C的量,不影响反应速率,故②不符合题意;
③恒容下通入CO2,CO2浓度增大,反应速率加快,故③符合题意;
④恒压下充入N2,体积增大,参加反应的气体的浓度减小,反应速率减小,故④不符合题意;
⑤恒容下充入N2,参加反应的气体的浓度不变,反应速率不变,故⑤不符合题意;
能使反应速率增大的措施是①③,答案选C。
15.D
【详解】A. 聚乙烯塑料耐化学腐蚀,耐寒,可用作食品袋、餐具、地膜等,A项正确;
B. 苯是重要的化工原料,也是重要的有机溶剂,可用作洗涤剂、有机溶剂、消毒剂、染料等,B项正确;
C. 乙醇易被氧化生成乙酸,乙酸和乙醇在一定条件下反应生成具有香味的乙酸乙酯,C项正确;
D. 生物柴油的主要成分为酯类,含碳、氢、氧元素,属于烃的衍生物的混合物,石油分馏所得的柴油是碳氢化合物的混合物,D项错误;
答案选D。
16.(1)③
(2)④
(3)①
(4)②
(5)①⑤
(6) CH3COOH+C2H5OH CH3COOC2H5+H2O 取代反应或酯化反应
【详解】(1)能使新制氢氧化铜反应生成沉淀的物质含有-CHO。答案为③;
(2)能与碳酸氢钠反应产生二氧化碳的物质呈酸性。答案为④;
(3)能发生消去反应的物质有醇类、卤代烃类。答案为①;
(4)能与溴水产生白色沉淀为酚类物质。答案为②;
(5)能发生水解的有机物有卤代烃、多糖、蛋白质、酯类物质等。答案为①⑤;
(6)④→⑤反应,应该为羧酸和醇发生酯化反应,从官能团来看可以是羧酸的羟基被-OC2H5取代。所以该反应为取代反应。答案为;取代反应或酯化反应。
17.(1)偏小
(2)饱和NaHCO3溶液
(3)浓硫酸
(4)0.12
【解析】(1)
配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,会导致溶液体积偏大,则浓度偏小,故答案为:偏小;
(2)
CO2和HCl均为酸性气体,均能与NaOH溶液反应,而CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2,故除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液,故答案为:饱和NaHCO3溶液;
(3)
氯气是酸性气体,应选酸性干燥剂来干燥氯气,故答案为:浓硫酸;
(4)
用I2表示该反应的化学反应速率是。
18.(1)>
(2) 71.4% 0.0625
(3)24:19
(4)21.5
(5) 减小 不变 不变 减小
【详解】(1)因为min时化学反应没有达到平衡,反应仍然向正反应方向进行,所以正反应速率大于逆反应速率,即>。
(2)根据图象分析,0~4min内的浓度变化量为转化率为;在4min内的浓度变化量为0.25,则4min内的平均反应速率为。
(3)根据题意可知,起始时通入的氢气的物质的量为1.4mol和1molCO2共2.4mol,根据三段式
达到平衡时气体的总物质的量为1.9mol,恒温恒容条件下,压强之比等于物质的量之比为24:19。
(4)平衡时气体的总物质的量为1.9mol,平均摩尔质量。
(5)①降低温度,则反应速率减小。
②炭粉为固体,则反应速率不变。
③若保持容积不变,充入He使体系压强增大,反应物生成物的浓度不变,则反应速率不变。
④若在将上述容器改为恒压容器的情况下,充入He使容器的体积增大,反应物生成物的浓度减小,则反应速率减小。
19.(1)
(2)加热使乙醇挥发
(3)乙醛、乙醇和水
(4) C 蒸馏
【解析】(1)
Cu网在空气中加热时生成黑色CuO,反应式为;黑色氧化铜被乙醇还原为红色的Cu,反应式为;;
(2)
甲处水浴作用是加热使得乙醇挥发产生蒸气;
(3)
乙处冰水作用是冷凝反应生成的混合产物成为液体,主要成分有乙醛、乙醇和水;
(4)
a处能使紫色石蕊变红的物质为CH3COOH,利用NaHCO3与之反应,然后蒸馏出乙醛即可分离除去,故答案选C,操作为蒸馏。
20.(1)CH3COOH
(2)乙醇
(3)防止发生倒吸
(4) 饱和碳酸钠溶液 中和乙酸或溶解乙醇或降低乙酸乙酯的溶解度;
(5)
【分析】本实验为利用乙酸与乙醇在浓硫酸和加热条件下生成乙酸乙酯,且用饱和碳酸钠溶液收集乙酸乙酯。
【详解】(1)乙酸的结构简式为CH3COOH;
(2)因为乙酸比乙醇昂贵,所以实验中乙醇过量,为防止乙酸挥发,最后加入乙酸,浓硫酸密度大于乙醇,所以应该先加入乙醇,然后缓缓加入浓硫酸,同时用玻璃棒搅拌,冷却后加入乙酸;
(3)乙醇和乙酸易溶于水,实验中注意长导管不能伸入B试管液面以下,否则B试管中的液体倒吸进入A试管,发生倒吸现象;
(4)由于乙酸乙酯在饱和碳酸钠溶液中溶解度较小,且碳酸钠能够中和乙酸、溶解乙醇,便于混合液分层,则B中应该盛放的药品是饱和碳酸钠溶液;它起到的作用有中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度;
(5)酯化反应的本质为酸脱羟基,醇脱氢,本实验是利用乙酸与乙醇反应生成乙酸乙酯和水,其反应方程式为。
21. 浓度 褪色 乙 反应物浓度越大,速率越大 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 2MnO+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O = 2×10-4
【详解】(1)由于甲、乙两个试管中加入的酸性高锰酸钾溶液的浓度、体积相同,但两试管中加入的草酸的浓度不同但体积相同,故该实验探究的是浓度对反应速率的影响;由于酸性高锰酸钾溶液可以和草酸反应,故两个试管中都会出现紫色褪色的现象,但由于两试管中加入的草酸浓度不同,故乙试管中高锰酸钾颜色褪去的时间较短;由此可以得出的结论是反应物浓度越大,速率越大,故答案为:浓度、褪色、乙、反应物浓度越大,速率越大;
(2)高锰酸钾溶液具有强氧化性,可以和HCl反应生成Cl2,故不能用盐酸酸化,反应的化学方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O;
(3)酸性高锰酸钾溶液和草酸反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,故反应的离子方程式为:2MnO+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,故答案为:2MnO+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
(4)由于高锰酸钾少量而草酸过量,反应过程中高锰酸钾可以完全反应,故两个试管中转移电子的数目相同,试管中高锰酸钾的锰元素的物质的量n=4×10-3L×0.01mol/L=4×10-5mol,每个Mn又转移5个电子变成Mn2+,乙试管共转移电子的物质的量n=5×4×10-5mol=2×10-4mol,故答案为:=、2×10-4。
22.0.81L
【详解】甲烷燃烧的化学方程式为,空气中含甲烷9.5%(体积分数)时,刚好完全反应,恢复到常温时,水为液态,1体积甲烷燃烧,消耗2体积氧气,生成1体积二氧化碳,所以1体积甲烷燃烧,气体体积减小2体积,气体最终的体积为
