第2章 微粒间相互作用与物质性质 检测题 (含解析)2023-2024学年高二下学期化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章 微粒间相互作用与物质性质 检测题 (含解析)2023-2024学年高二下学期化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 690.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 14:07:40 | ||
图片预览


文档简介
第2章《微粒间相互作用与物质性质》检测题
一、单选题
1.是国际公认的绿色消毒剂,在光照下发生反应:,下列说法正确的是
A.是极性分子 B.是直线形分子
C.中的O是杂化 D.HCl气体分子之间存在氢键
2.下列分子的VSEPR模型与其空间立体构型一致的是
A. B. C. D.
3.高温、紫外线、X射线和γ射线等都可以使气体转化为等离子体。下列叙述中不涉及等离子体的是
A.日光灯和霓虹灯的灯管中 B.蜡烛的火焰中
C.流星的尾部 D.南极的冰山中
4.下列现象与氢键有关的是:
①HF的熔、沸点比HCl的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HF、都极易溶于水
⑤接近水的沸点的水蒸气的相对分子质量的测定值比按化学式计算出来的相对分子质量大一些
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
5.下列化学用语表示不正确的是
A B C D
分子的球棍模型 丁醛的键线式 核内有33个中子的Fe原子 甲基的电子式
A.A B.B C.C D.D
6.下列分子中存在键的是
A. B. C. D.
7.下列各项比较中前者大于(或强于)后者的是
A.在水中的溶解度和在水中的溶解度
B.在水中的溶解度和在中的溶解度
C.与形成共价键的极性和与形成共价键的极性
D.在水中的溶解度和在水中的溶解度
8.下列化合物全部以共用电子对成键的是
A.H2O B.MgCl2 C.NaOH D.NH4Cl
9.下列能级中轨道数为5的是
A.s B.p C.d D.f
10.已知冰醋酸能与氯气在碘催化下发生反应:。对实验过程进行监测,发现过程中出现了键,下列有关说法错误的是
A.实验中键的产生,可通过红外光谱结果证明
B. 键比键更易形成,且键能更大
C.中存在键
D.的酸性比强
11.下列各组都是由极性键构成的极性分子的是
A.丙烯和 B.和 C.和 D.和
12.下列推测不合理的是
A.在足量中燃烧生成和
B.与结构具有相似性
C.同温同浓度下,酸性:
D.能被双氧水溶液氧化成
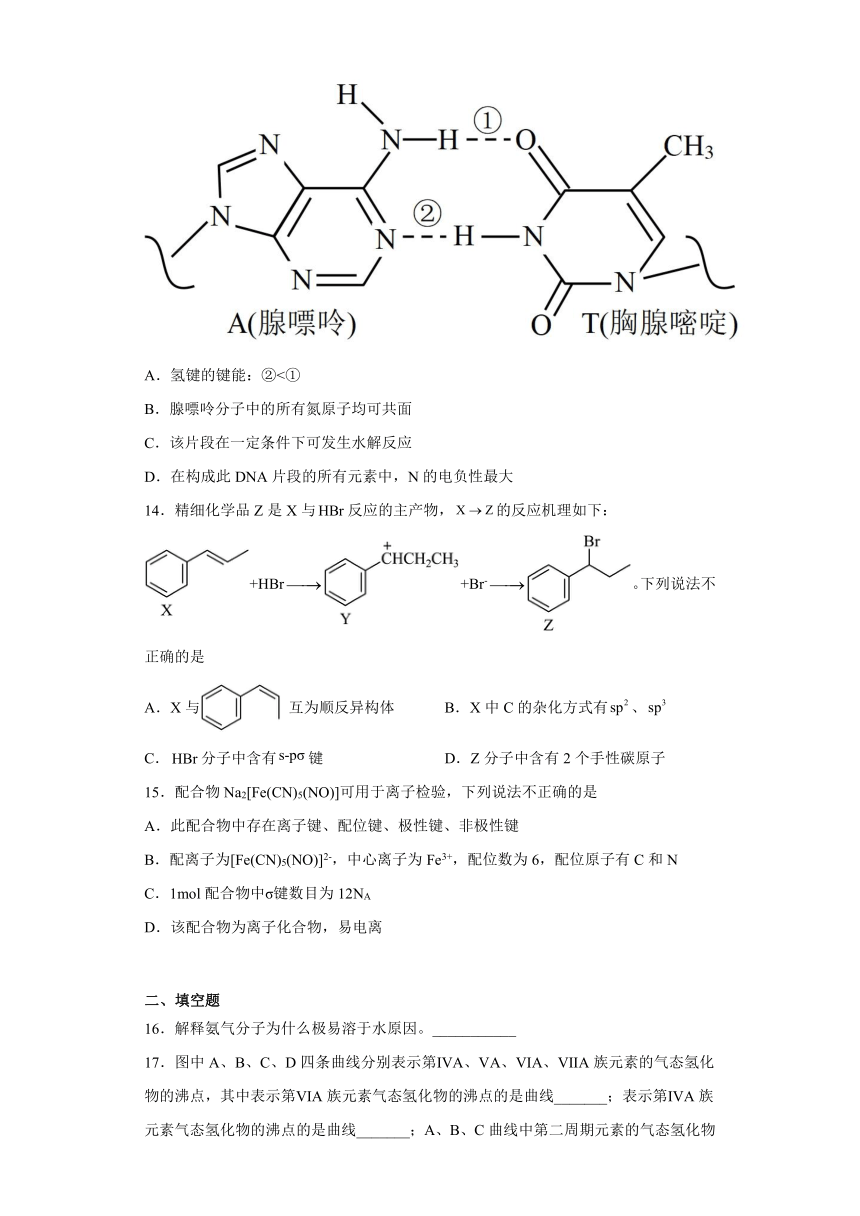
13.某DNA分子的片段如图所示。下列关于该片段的说法错误的是
A.氢键的键能:②<①
B.腺嘌呤分子中的所有氮原子均可共面
C.该片段在一定条件下可发生水解反应
D.在构成此DNA片段的所有元素中,N的电负性最大
14.精细化学品Z是X与反应的主产物,的反应机理如下:+HBr+Br-。下列说法不正确的是
A.X与 互为顺反异构体 B.X中C的杂化方式有、
C.分子中含有键 D.Z分子中含有2个手性碳原子
15.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A.此配合物中存在离子键、配位键、极性键、非极性键
B.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
C.1mol配合物中σ键数目为12NA
D.该配合物为离子化合物,易电离
二、填空题
16.解释氨气分子为什么极易溶于水原因。___________
17.图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示第ⅥA族元素气态氢化物的沸点的是曲线_______;表示第ⅣA族元素气态氢化物的沸点的是曲线_______;A、B、C曲线中第二周期元素的气态氢化物的沸点显著高于第三周期元素气态氢化物的沸点,其原因是_______。
18.好奇心是科学发展的内在动力一。P2O3 和P2O5是两种经典的化合物,其分子结构已经确定。自然而然会有如下问题:是否存在磷氧原子比介于二者之间的化合物?由此出发,化学家合成并证实了这些中间化合物的存在。
(1)写出这些中间化合物的分子式____。
(2)画出其中具有2重旋转轴的分子的结构图。根据键长不同,将P-O键分组并用阿拉伯数字标出(键长相同的用同一个数字标识)____。比较键角∠O-P(V)-O和∠O-P(III)-O的大小____。
(3)NH3分子独立存在时H-N-H键角为106.7°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____。
三、实验题
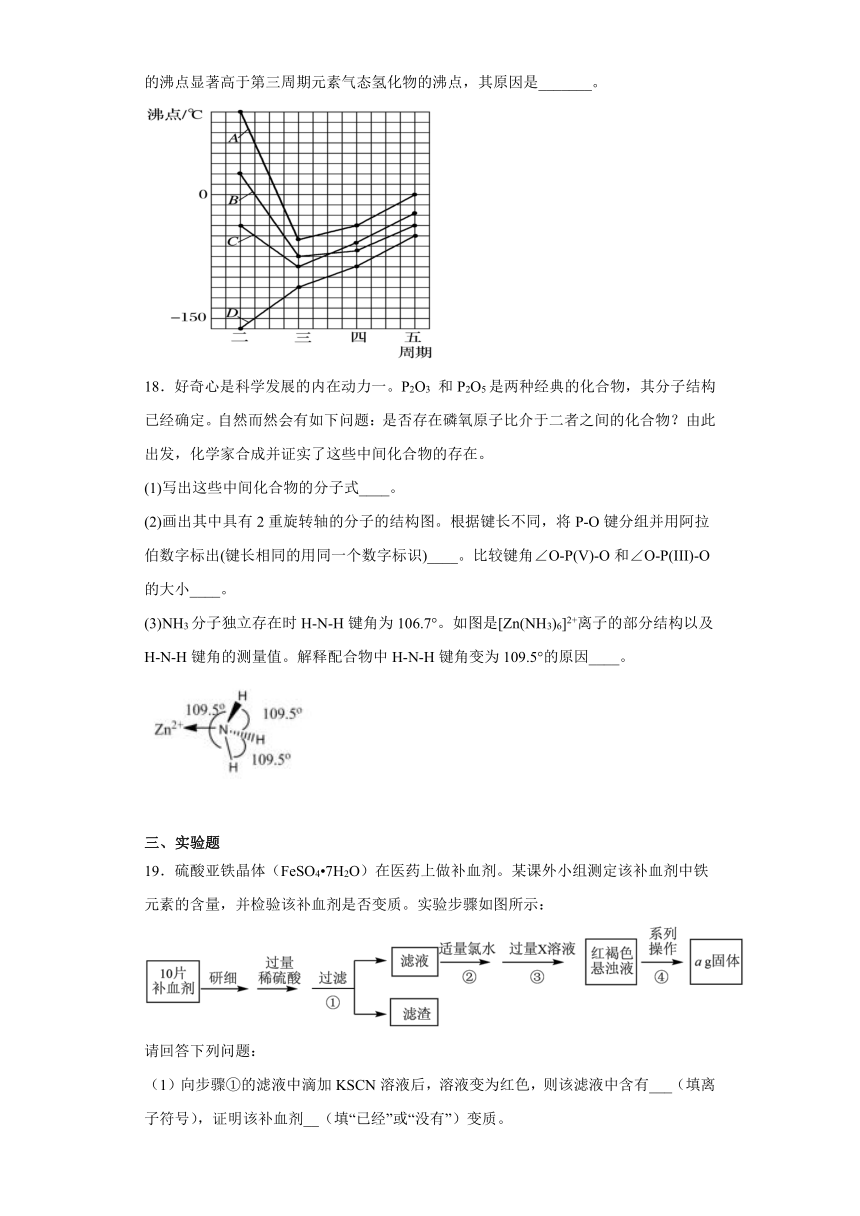
19.硫酸亚铁晶体(FeSO4 7H2O)在医药上做补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如图所示:
请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后,溶液变为红色,则该滤液中含有___(填离子符号),证明该补血剂__(填“已经”或“没有”)变质。
(2)步骤②中反应的离子方程式:___。
(3)步骤③中反应的离子方程式:___。
(4)步骤④中一系列的操作步骤;过滤、__、灼烧、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为__g。(用含a的代数式表示)
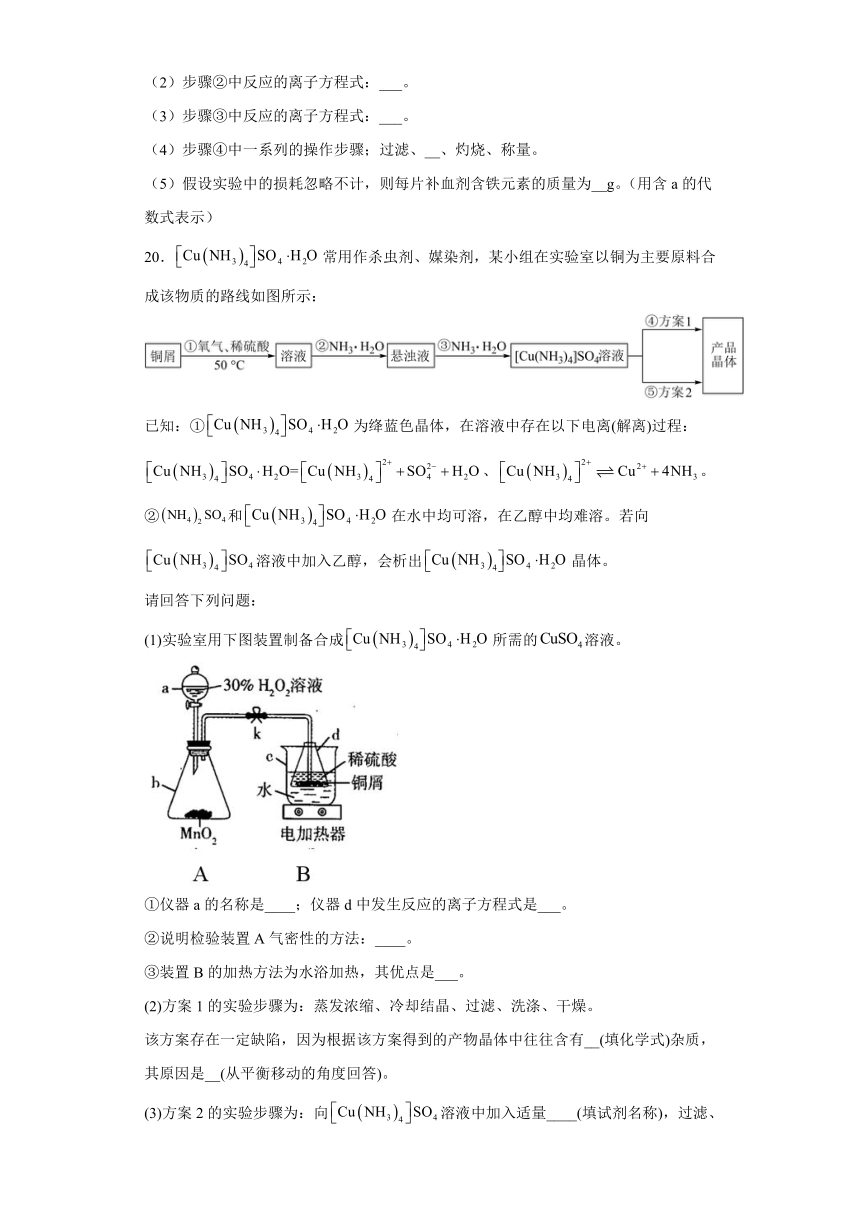
20.常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
已知:①为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
、。
②和在水中均可溶,在乙醇中均难溶。若向溶液中加入乙醇,会析出晶体。
请回答下列问题:
(1)实验室用下图装置制备合成所需的溶液。
①仪器a的名称是____;仪器d中发生反应的离子方程式是___。
②说明检验装置A气密性的方法:____。
③装置B的加热方法为水浴加热,其优点是___。
(2)方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有__(填化学式)杂质,其原因是__(从平衡移动的角度回答)。
(3)方案2的实验步骤为:向溶液中加入适量____(填试剂名称),过滤、洗涤、干燥。
(4)方案1、2中步骤均有过滤、洗涤、干燥。
①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:
减压过滤法相对于普通过滤法的优点为____(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是____。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
试卷第2页,共6页
参考答案:
1.A
【详解】A.为四面体形分子,但正负电荷中心不重合,是极性分子,A正确;
B.二氧化氯中氯原子的价层电子对数为,1个电子占据一个轨道,所以价层电子对数为4,进行sp3杂化,去掉孤电子对,形成V形,不是直线形分子,B错误;
C.水中氧原子的价层电子对为,为杂化,C错误;
D.氯原子不属于电负性大的原子,不能形成氢键,D错误;
故选A。
2.B
【详解】A.分子中N原子价层电子对个数=键个数+孤电子对个数=3+(5-31)=4,VSEPR模型为正四面体结构;含有一个孤电子对,所以其空间立体构型为三角锥形,VSEPR模型与其空间立体构型不一致,故A错误;
B.分子中C原子价层电子对个数=键个数+孤电子对个数=4+(4-41)=4,VSEPR模型为正四面体结构;中心原子不含孤电子对,所以其空间立体构型为正四面体结构,VSEPR模型与其空间立体构型一致,故B正确;
C.分子中O原子价层电子对个数=键个数+孤电子对个数=2+(6-21)=4,VSEPR模型为正四面体结构;含有2个孤电子对,实际空间立体构型为V形,VSEPR模型与其空间立体构型不一致,故C错误;
D.分子中S原子价层电子对个数=键个数+孤电子对个数=2+(6-22)=3,VSEPR模型为平面三角形;含有一个孤电子对,实际空间立体构型为V形,VSEPR模型与其空间立体构型不一致,故D错误;
答案选B。
3.D
【详解】高温下存在等离子体,日光灯、霓虹灯、蜡烛、流星都能形成高温环境。
故答案选D。
4.B
【详解】①HF中分子之间存在氢键,则HF的熔、沸点比HCl的高,故①与氢键有关;
②小分子的醇、羧酸与水分子之间能形成氢键,则可以和水以任意比互溶,故②与氢键有关;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③与氢键有关;
④HF、氨气与水分子都是极性分子,HF、氨气与水分子间存在氢键,所以HF、氨气极易溶于水,故④与氢键有关;
⑤接近水的沸点的水蒸气的相对分子质量测定值比用化学式H2O计算出来的相对分子质量大一些,其主要原因是接近水的沸点的水蒸气中水分子间因氢键而形成了“缔合分子”,故⑤与氢键有关;
⑥水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,故⑥与氢键无关;
故选:B。
5.C
【详解】A.分子的球棍模型 ,A正确;
B.丁醛的键线式为 ,B正确;
C.铁的原子序数为26,核内有33个中子的Fe,质量数=质子数+中子数=59,应表示为,C错误;
D.甲基中碳原子的外围电子数为7,电子式为: ,D正确;
故答案选C。
6.D
【分析】单键均为σ键,双键为一个σ键一个π键,三键为一个σ键2个π键;
【详解】A.中只存在碳氢、碳碳单键,故不存在π键,A不符合题意;
B.NH3中只存在N-H单键,故不存在π键,B不符合题意;
C.H2中只存在H-H单键,故不存在π键, C不符合题意;
D.N2中只存在N≡N三键,为一个σ键2个π键, D符合题意;
故选D。
7.D
【详解】A.不溶于水,极易溶于水,A错误;
B.I2是非极性分子,水是极性分子,是非极性分子,根据相似相溶原理,在水中的溶解度小于在中的溶解度,B错误;
C.的非金属性小于,所以与形成共价键的极性比与形成共价键的极性弱,C错误;
D.是极性分子,是非极性分子,水是极性分子,根据相似相溶原理可知在水中的溶解度较大,D正确;
故选D。
8.A
【详解】A.H2O中O与H之间都是共价键,故A符合题意;
B.MgCl2中Mg2+与Cl-之间为离子键,故B不符合题意;
C.NaOH中Na+与OH-之间为离子键,故C不符合题意;
D.NH4Cl中NH与Cl-之间为离子键,故D不符合题意;
故选A。
9.C
【详解】s能级有1个原子轨道,p能级有3个原子轨道,d能级有5个原子轨道,f能级有7个原子轨道,则能级中轨道数为5的是d能级。故选:C。
10.B
【详解】A.红外光谱可用于确定化学键类型,故A正确;
B.I原子半径大于Cl,因此键长比键长要长,键长越长键能越小,故B错误;
C.羧基中C原子采用杂化,羧基相连的碳原子采用杂化,两碳原子之间形成键,故C正确;
D.Cl原子的电负性大于H,导致中O-H键的极性大于中O-H键,更易电离出氢,酸性强于,故D正确;
故选:B。
11.C
【详解】A.丙烯中存在碳碳非极性键和碳氢极性键,属于极性分子,中只存在碳氧极性键,属于非极性分子,A不选;
B.中只存在碳氯极性键,属于非极性分子,中只存在氢硫极性键,属于极性分子,B不选;
C.中只存在氢氧极性键,属于极性分子,中只存在氮氢极性键,属于极性分子,C选;
D.中存在氧氧非极性键和氢氧极性键,属于极性分子,中只存在碳硫极性键,属于非极性分子,D不选;
故选:C。
【点睛】以极性键结合的双原子分子一定为极性分子;以极性键结合的多原子分子可能是极性分子,也可能是非极性分子,若空间结构对称,正、负电荷的重心重合,则为非极性分子,反之则为极性分子。
12.A
【详解】A.在足量中燃烧生成和,S不会直接被氧气氧化为SO3,A项错误;
B.与互为等电子体,均为V形,B项正确;
C.氯的电负性大于溴,碳氯键的极性大于碳溴键,相同浓度下,酸性由强到弱的顺序为:,C项正确;
D.氯化亚砜中S的化合价是+4,具有还原性,能被H2O2氧化,产物是硫酸,发生反应的方程式:SOCl2 + H2O2 + H2O = H2SO4 + 2 HCl,D项正确;
答案选A。
13.D
【详解】A.O比N对电子的吸引能力强,则氢键的强度:①>②,A正确;
B.由图中结构可知,腺嘌呤分子中间含2个N原子的杂环是类似于苯环的结构,其余三个N原子类似于苯环上的氢原子,故腺嘌呤分子中的所有氮原子均可共面,B正确;
C.该物质中含肽键,可发生水解反应,C正确;
D.在构成此DNA片段的所有元素即H、C、N、O四种,其中O的电负性最大,D错误;
故答案为:D。
14.D
【详解】A.X与 互为顺反异构体,故A正确;
B. 中单键碳原子为,双键碳原子为,故B正确;
C.HBr分子中的共价键是H原子的1s轨道与Br原子的4p轨道形成的键,故C正确;
D.Z分子中含有的手性碳原子如图 ,含有1个手性碳原子,故D错误;
故选D。
15.A
【详解】A.Na+与Fe(CN)5(NO)]2-存在离子键,NO、CN-与Fe3+形成配位键,碳氮之间、氮氧之间存在极性共价键,但不存在非极性键,A错误;
B.此配合物的配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,提供空轨道,NO、CN-与Fe3+形成配位键,配位数为6,C和N有孤对电子,作为配位原子,B正确;
C.配位键也属于σ键,配体CN-中含有1个σ键、NO中含有1个σ键,1mol配合物中σ键数目为(6+1×5+1)NA=12NA,C正确;
D.配合物Na2[Fe(CN)5(NO)]为离子化合物,能电离出Na+与Fe(CN)5(NO)]2-,D正确;
答案选A。
16.NH3与H2O间能形成氢键,且都是极性分子,所以NH3极易溶于水。氨气,低级醇、醛、酮等分子都与水分子形成氢键,均可溶于水
【解析】略
17. A D 它们分子间形成的氢键使物质的沸点升高
【详解】同一主族元素氢化物中,氢化物的沸点随着原子序数增大而呈增大趋势,但含有氢键的氢化物熔沸点最高;同一周期元素氢化物中,含有氢键的氢化物沸点较高,第二周期元素氢化物中水的沸点最高,所以表示ⅥA族元素气态氢化物沸点的是A曲线;ⅣA族元素气态氢化物中都不含氢键,其沸点随着相对分子质量增大而增大,所以表示第ⅣA族元素气态氢化物的沸点的曲线是D;由于A、B、C曲线中第二周期元素的气态氢化物分子间形成的氢键使物质的沸点升高,而第三周期元素气态氢化物都不含氢键,因此A、B、C曲线中第二周期元素的气态氢化物的沸点显著高于第三周期元素气态氢化物的沸点。
18. P4O7,P4O8,P4O9 ∠O-P(V)-O大于∠O-P(III)-O 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故H-N-H键角变大。
【解析】略
19. Fe3+ 已经 2Fe2++Cl2=2Fe3++2Cl- Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3 H2O=Fe(OH)3↓+3NH) 洗涤冷却至室温 0.07a
【详解】(1)向步骤①的滤液中滴加KSCN溶液后,溶液变为红色,说明该滤液中含有,该补血剂已变质;
(2)氯水具有氧化性,酸性条件下能将氧化为,则步骤②中反应的离子方程式为;
(3)步骤③是将转化为沉淀,反应的离子方程式为或;
(4)步骤④中一系列操作的目的是将悬浊液最终转化为,需要先过滤、洗涤,然后灼烧使其转化为,冷却后称量的质量,即操作步骤为过滤、洗涤、灼烧、冷却至室温、称量;
(5)中铁元素的质量即为10片补血剂中铁元素的质量,所以每片补血剂含铁元素的质量为。
20. 分液漏斗 关闭止水夹k,从分液漏斗向锥形瓶中加水至在漏斗颈内形成一段水柱,停止加水,静置一段时间,若水柱没有下降,说明装置A的气密性良好 受热均匀,易于控制加热温度 或 蒸发浓缩过程中挥发,使平衡,向右移动,发生水解生成或 乙醇 AC B
【详解】(1)①仪器a为分液漏斗;仪器d中,铜单质在酸性条件下被氧化为,相应的离子方程式为;
②检验装置A气密性的方法为:关闭止水夹k,从分液漏斗向锥形瓶中加水至在漏斗颈内形成一段水柱,停止加水,静置一段时间,若水柱没有下降,说明装置A的气密性良好;③由于水具有较大的比热容,加热或冷却过程中温度的变化较为缓慢,所以水浴加热具有易于控制温度的优点,且能够使被加热物质均匀受热;
(2)该方案存在明显缺陷,因为得到的产物晶体中往往含有或杂质,因为在蒸发浓缩过程中挥发,使平衡,向右移动,发生水解生成或;
(3)根据题给信息②可知,加入的试剂应为乙醇;
(4)①减压过滤可加快过滤速度,并使沉淀比较干燥,因为胶状沉淀易穿透滤纸,沉淀颗粒太小易在滤纸上形成一层密实的沉淀,溶液不易透过,所以减压过滤不宜过滤胶状沉淀和颗粒太小的沉淀,A、C项正确;
②晶体易溶于水,难溶于乙醇等,所以可选用乙醇和水的混合液,不能选用蒸馏水;若用饱和硫酸铵溶液洗涤,则会在晶体表面残留有硫酸铵杂质,达不到洗涤的目的
一、单选题
1.是国际公认的绿色消毒剂,在光照下发生反应:,下列说法正确的是
A.是极性分子 B.是直线形分子
C.中的O是杂化 D.HCl气体分子之间存在氢键
2.下列分子的VSEPR模型与其空间立体构型一致的是
A. B. C. D.
3.高温、紫外线、X射线和γ射线等都可以使气体转化为等离子体。下列叙述中不涉及等离子体的是
A.日光灯和霓虹灯的灯管中 B.蜡烛的火焰中
C.流星的尾部 D.南极的冰山中
4.下列现象与氢键有关的是:
①HF的熔、沸点比HCl的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④HF、都极易溶于水
⑤接近水的沸点的水蒸气的相对分子质量的测定值比按化学式计算出来的相对分子质量大一些
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
5.下列化学用语表示不正确的是
A B C D
分子的球棍模型 丁醛的键线式 核内有33个中子的Fe原子 甲基的电子式
A.A B.B C.C D.D
6.下列分子中存在键的是
A. B. C. D.
7.下列各项比较中前者大于(或强于)后者的是
A.在水中的溶解度和在水中的溶解度
B.在水中的溶解度和在中的溶解度
C.与形成共价键的极性和与形成共价键的极性
D.在水中的溶解度和在水中的溶解度
8.下列化合物全部以共用电子对成键的是
A.H2O B.MgCl2 C.NaOH D.NH4Cl
9.下列能级中轨道数为5的是
A.s B.p C.d D.f
10.已知冰醋酸能与氯气在碘催化下发生反应:。对实验过程进行监测,发现过程中出现了键,下列有关说法错误的是
A.实验中键的产生,可通过红外光谱结果证明
B. 键比键更易形成,且键能更大
C.中存在键
D.的酸性比强
11.下列各组都是由极性键构成的极性分子的是
A.丙烯和 B.和 C.和 D.和
12.下列推测不合理的是
A.在足量中燃烧生成和
B.与结构具有相似性
C.同温同浓度下,酸性:
D.能被双氧水溶液氧化成
13.某DNA分子的片段如图所示。下列关于该片段的说法错误的是
A.氢键的键能:②<①
B.腺嘌呤分子中的所有氮原子均可共面
C.该片段在一定条件下可发生水解反应
D.在构成此DNA片段的所有元素中,N的电负性最大
14.精细化学品Z是X与反应的主产物,的反应机理如下:+HBr+Br-。下列说法不正确的是
A.X与 互为顺反异构体 B.X中C的杂化方式有、
C.分子中含有键 D.Z分子中含有2个手性碳原子
15.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A.此配合物中存在离子键、配位键、极性键、非极性键
B.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
C.1mol配合物中σ键数目为12NA
D.该配合物为离子化合物,易电离
二、填空题
16.解释氨气分子为什么极易溶于水原因。___________
17.图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示第ⅥA族元素气态氢化物的沸点的是曲线_______;表示第ⅣA族元素气态氢化物的沸点的是曲线_______;A、B、C曲线中第二周期元素的气态氢化物的沸点显著高于第三周期元素气态氢化物的沸点,其原因是_______。
18.好奇心是科学发展的内在动力一。P2O3 和P2O5是两种经典的化合物,其分子结构已经确定。自然而然会有如下问题:是否存在磷氧原子比介于二者之间的化合物?由此出发,化学家合成并证实了这些中间化合物的存在。
(1)写出这些中间化合物的分子式____。
(2)画出其中具有2重旋转轴的分子的结构图。根据键长不同,将P-O键分组并用阿拉伯数字标出(键长相同的用同一个数字标识)____。比较键角∠O-P(V)-O和∠O-P(III)-O的大小____。
(3)NH3分子独立存在时H-N-H键角为106.7°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____。
三、实验题
19.硫酸亚铁晶体(FeSO4 7H2O)在医药上做补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如图所示:
请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后,溶液变为红色,则该滤液中含有___(填离子符号),证明该补血剂__(填“已经”或“没有”)变质。
(2)步骤②中反应的离子方程式:___。
(3)步骤③中反应的离子方程式:___。
(4)步骤④中一系列的操作步骤;过滤、__、灼烧、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为__g。(用含a的代数式表示)
20.常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
已知:①为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
、。
②和在水中均可溶,在乙醇中均难溶。若向溶液中加入乙醇,会析出晶体。
请回答下列问题:
(1)实验室用下图装置制备合成所需的溶液。
①仪器a的名称是____;仪器d中发生反应的离子方程式是___。
②说明检验装置A气密性的方法:____。
③装置B的加热方法为水浴加热,其优点是___。
(2)方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有__(填化学式)杂质,其原因是__(从平衡移动的角度回答)。
(3)方案2的实验步骤为:向溶液中加入适量____(填试剂名称),过滤、洗涤、干燥。
(4)方案1、2中步骤均有过滤、洗涤、干燥。
①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:
减压过滤法相对于普通过滤法的优点为____(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是____。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
试卷第2页,共6页
参考答案:
1.A
【详解】A.为四面体形分子,但正负电荷中心不重合,是极性分子,A正确;
B.二氧化氯中氯原子的价层电子对数为,1个电子占据一个轨道,所以价层电子对数为4,进行sp3杂化,去掉孤电子对,形成V形,不是直线形分子,B错误;
C.水中氧原子的价层电子对为,为杂化,C错误;
D.氯原子不属于电负性大的原子,不能形成氢键,D错误;
故选A。
2.B
【详解】A.分子中N原子价层电子对个数=键个数+孤电子对个数=3+(5-31)=4,VSEPR模型为正四面体结构;含有一个孤电子对,所以其空间立体构型为三角锥形,VSEPR模型与其空间立体构型不一致,故A错误;
B.分子中C原子价层电子对个数=键个数+孤电子对个数=4+(4-41)=4,VSEPR模型为正四面体结构;中心原子不含孤电子对,所以其空间立体构型为正四面体结构,VSEPR模型与其空间立体构型一致,故B正确;
C.分子中O原子价层电子对个数=键个数+孤电子对个数=2+(6-21)=4,VSEPR模型为正四面体结构;含有2个孤电子对,实际空间立体构型为V形,VSEPR模型与其空间立体构型不一致,故C错误;
D.分子中S原子价层电子对个数=键个数+孤电子对个数=2+(6-22)=3,VSEPR模型为平面三角形;含有一个孤电子对,实际空间立体构型为V形,VSEPR模型与其空间立体构型不一致,故D错误;
答案选B。
3.D
【详解】高温下存在等离子体,日光灯、霓虹灯、蜡烛、流星都能形成高温环境。
故答案选D。
4.B
【详解】①HF中分子之间存在氢键,则HF的熔、沸点比HCl的高,故①与氢键有关;
②小分子的醇、羧酸与水分子之间能形成氢键,则可以和水以任意比互溶,故②与氢键有关;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③与氢键有关;
④HF、氨气与水分子都是极性分子,HF、氨气与水分子间存在氢键,所以HF、氨气极易溶于水,故④与氢键有关;
⑤接近水的沸点的水蒸气的相对分子质量测定值比用化学式H2O计算出来的相对分子质量大一些,其主要原因是接近水的沸点的水蒸气中水分子间因氢键而形成了“缔合分子”,故⑤与氢键有关;
⑥水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,故⑥与氢键无关;
故选:B。
5.C
【详解】A.分子的球棍模型 ,A正确;
B.丁醛的键线式为 ,B正确;
C.铁的原子序数为26,核内有33个中子的Fe,质量数=质子数+中子数=59,应表示为,C错误;
D.甲基中碳原子的外围电子数为7,电子式为: ,D正确;
故答案选C。
6.D
【分析】单键均为σ键,双键为一个σ键一个π键,三键为一个σ键2个π键;
【详解】A.中只存在碳氢、碳碳单键,故不存在π键,A不符合题意;
B.NH3中只存在N-H单键,故不存在π键,B不符合题意;
C.H2中只存在H-H单键,故不存在π键, C不符合题意;
D.N2中只存在N≡N三键,为一个σ键2个π键, D符合题意;
故选D。
7.D
【详解】A.不溶于水,极易溶于水,A错误;
B.I2是非极性分子,水是极性分子,是非极性分子,根据相似相溶原理,在水中的溶解度小于在中的溶解度,B错误;
C.的非金属性小于,所以与形成共价键的极性比与形成共价键的极性弱,C错误;
D.是极性分子,是非极性分子,水是极性分子,根据相似相溶原理可知在水中的溶解度较大,D正确;
故选D。
8.A
【详解】A.H2O中O与H之间都是共价键,故A符合题意;
B.MgCl2中Mg2+与Cl-之间为离子键,故B不符合题意;
C.NaOH中Na+与OH-之间为离子键,故C不符合题意;
D.NH4Cl中NH与Cl-之间为离子键,故D不符合题意;
故选A。
9.C
【详解】s能级有1个原子轨道,p能级有3个原子轨道,d能级有5个原子轨道,f能级有7个原子轨道,则能级中轨道数为5的是d能级。故选:C。
10.B
【详解】A.红外光谱可用于确定化学键类型,故A正确;
B.I原子半径大于Cl,因此键长比键长要长,键长越长键能越小,故B错误;
C.羧基中C原子采用杂化,羧基相连的碳原子采用杂化,两碳原子之间形成键,故C正确;
D.Cl原子的电负性大于H,导致中O-H键的极性大于中O-H键,更易电离出氢,酸性强于,故D正确;
故选:B。
11.C
【详解】A.丙烯中存在碳碳非极性键和碳氢极性键,属于极性分子,中只存在碳氧极性键,属于非极性分子,A不选;
B.中只存在碳氯极性键,属于非极性分子,中只存在氢硫极性键,属于极性分子,B不选;
C.中只存在氢氧极性键,属于极性分子,中只存在氮氢极性键,属于极性分子,C选;
D.中存在氧氧非极性键和氢氧极性键,属于极性分子,中只存在碳硫极性键,属于非极性分子,D不选;
故选:C。
【点睛】以极性键结合的双原子分子一定为极性分子;以极性键结合的多原子分子可能是极性分子,也可能是非极性分子,若空间结构对称,正、负电荷的重心重合,则为非极性分子,反之则为极性分子。
12.A
【详解】A.在足量中燃烧生成和,S不会直接被氧气氧化为SO3,A项错误;
B.与互为等电子体,均为V形,B项正确;
C.氯的电负性大于溴,碳氯键的极性大于碳溴键,相同浓度下,酸性由强到弱的顺序为:,C项正确;
D.氯化亚砜中S的化合价是+4,具有还原性,能被H2O2氧化,产物是硫酸,发生反应的方程式:SOCl2 + H2O2 + H2O = H2SO4 + 2 HCl,D项正确;
答案选A。
13.D
【详解】A.O比N对电子的吸引能力强,则氢键的强度:①>②,A正确;
B.由图中结构可知,腺嘌呤分子中间含2个N原子的杂环是类似于苯环的结构,其余三个N原子类似于苯环上的氢原子,故腺嘌呤分子中的所有氮原子均可共面,B正确;
C.该物质中含肽键,可发生水解反应,C正确;
D.在构成此DNA片段的所有元素即H、C、N、O四种,其中O的电负性最大,D错误;
故答案为:D。
14.D
【详解】A.X与 互为顺反异构体,故A正确;
B. 中单键碳原子为,双键碳原子为,故B正确;
C.HBr分子中的共价键是H原子的1s轨道与Br原子的4p轨道形成的键,故C正确;
D.Z分子中含有的手性碳原子如图 ,含有1个手性碳原子,故D错误;
故选D。
15.A
【详解】A.Na+与Fe(CN)5(NO)]2-存在离子键,NO、CN-与Fe3+形成配位键,碳氮之间、氮氧之间存在极性共价键,但不存在非极性键,A错误;
B.此配合物的配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,提供空轨道,NO、CN-与Fe3+形成配位键,配位数为6,C和N有孤对电子,作为配位原子,B正确;
C.配位键也属于σ键,配体CN-中含有1个σ键、NO中含有1个σ键,1mol配合物中σ键数目为(6+1×5+1)NA=12NA,C正确;
D.配合物Na2[Fe(CN)5(NO)]为离子化合物,能电离出Na+与Fe(CN)5(NO)]2-,D正确;
答案选A。
16.NH3与H2O间能形成氢键,且都是极性分子,所以NH3极易溶于水。氨气,低级醇、醛、酮等分子都与水分子形成氢键,均可溶于水
【解析】略
17. A D 它们分子间形成的氢键使物质的沸点升高
【详解】同一主族元素氢化物中,氢化物的沸点随着原子序数增大而呈增大趋势,但含有氢键的氢化物熔沸点最高;同一周期元素氢化物中,含有氢键的氢化物沸点较高,第二周期元素氢化物中水的沸点最高,所以表示ⅥA族元素气态氢化物沸点的是A曲线;ⅣA族元素气态氢化物中都不含氢键,其沸点随着相对分子质量增大而增大,所以表示第ⅣA族元素气态氢化物的沸点的曲线是D;由于A、B、C曲线中第二周期元素的气态氢化物分子间形成的氢键使物质的沸点升高,而第三周期元素气态氢化物都不含氢键,因此A、B、C曲线中第二周期元素的气态氢化物的沸点显著高于第三周期元素气态氢化物的沸点。
18. P4O7,P4O8,P4O9 ∠O-P(V)-O大于∠O-P(III)-O 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与键对电子间的排斥作用变为键对电子间的排斥,排斥减弱,故H-N-H键角变大。
【解析】略
19. Fe3+ 已经 2Fe2++Cl2=2Fe3++2Cl- Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3 H2O=Fe(OH)3↓+3NH) 洗涤冷却至室温 0.07a
【详解】(1)向步骤①的滤液中滴加KSCN溶液后,溶液变为红色,说明该滤液中含有,该补血剂已变质;
(2)氯水具有氧化性,酸性条件下能将氧化为,则步骤②中反应的离子方程式为;
(3)步骤③是将转化为沉淀,反应的离子方程式为或;
(4)步骤④中一系列操作的目的是将悬浊液最终转化为,需要先过滤、洗涤,然后灼烧使其转化为,冷却后称量的质量,即操作步骤为过滤、洗涤、灼烧、冷却至室温、称量;
(5)中铁元素的质量即为10片补血剂中铁元素的质量,所以每片补血剂含铁元素的质量为。
20. 分液漏斗 关闭止水夹k,从分液漏斗向锥形瓶中加水至在漏斗颈内形成一段水柱,停止加水,静置一段时间,若水柱没有下降,说明装置A的气密性良好 受热均匀,易于控制加热温度 或 蒸发浓缩过程中挥发,使平衡,向右移动,发生水解生成或 乙醇 AC B
【详解】(1)①仪器a为分液漏斗;仪器d中,铜单质在酸性条件下被氧化为,相应的离子方程式为;
②检验装置A气密性的方法为:关闭止水夹k,从分液漏斗向锥形瓶中加水至在漏斗颈内形成一段水柱,停止加水,静置一段时间,若水柱没有下降,说明装置A的气密性良好;③由于水具有较大的比热容,加热或冷却过程中温度的变化较为缓慢,所以水浴加热具有易于控制温度的优点,且能够使被加热物质均匀受热;
(2)该方案存在明显缺陷,因为得到的产物晶体中往往含有或杂质,因为在蒸发浓缩过程中挥发,使平衡,向右移动,发生水解生成或;
(3)根据题给信息②可知,加入的试剂应为乙醇;
(4)①减压过滤可加快过滤速度,并使沉淀比较干燥,因为胶状沉淀易穿透滤纸,沉淀颗粒太小易在滤纸上形成一层密实的沉淀,溶液不易透过,所以减压过滤不宜过滤胶状沉淀和颗粒太小的沉淀,A、C项正确;
②晶体易溶于水,难溶于乙醇等,所以可选用乙醇和水的混合液,不能选用蒸馏水;若用饱和硫酸铵溶液洗涤,则会在晶体表面残留有硫酸铵杂质,达不到洗涤的目的
