4.3金属的腐蚀与防护 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.3金属的腐蚀与防护 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 | 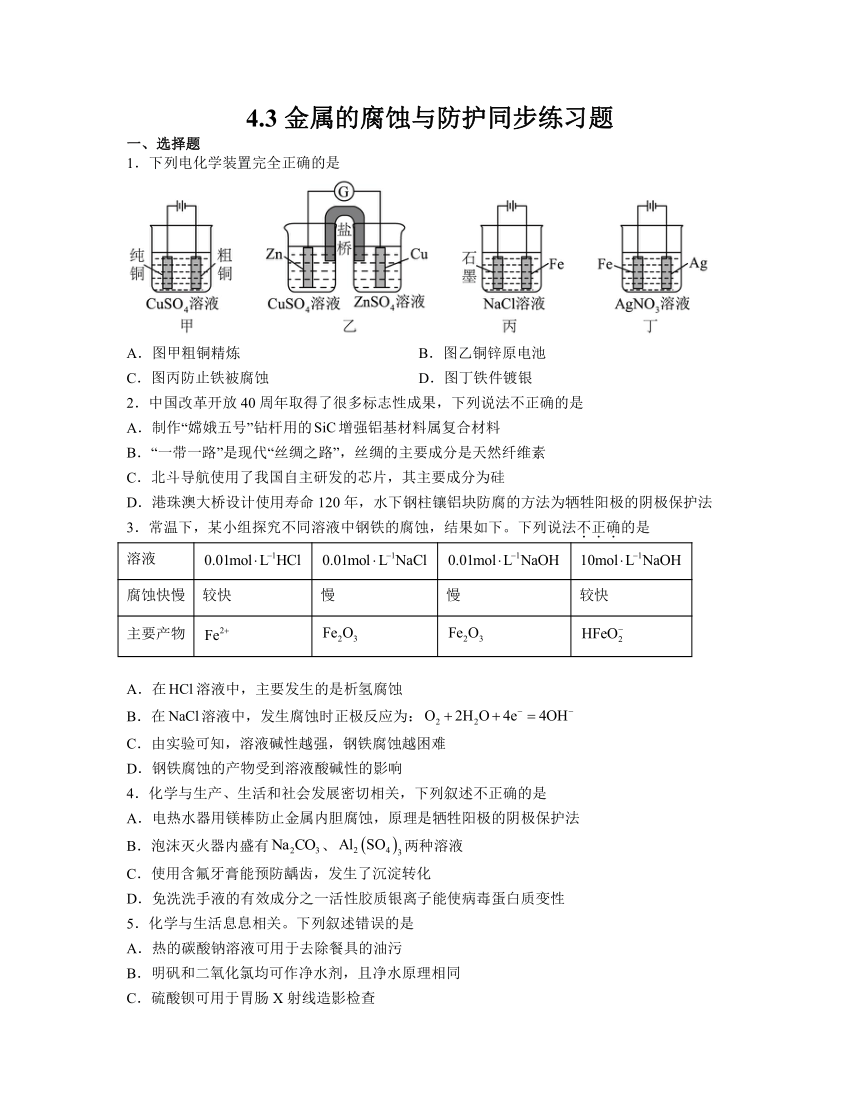 | |
| 格式 | docx | ||
| 文件大小 | 247.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 14:15:10 | ||
图片预览


文档简介
4.3金属的腐蚀与防护同步练习题
一、选择题
1.下列电化学装置完全正确的是
A.图甲粗铜精炼 B.图乙铜锌原电池
C.图丙防止铁被腐蚀 D.图丁铁件镀银
2.中国改革开放40周年取得了很多标志性成果,下列说法不正确的是
A.制作“嫦娥五号”钻杆用的增强铝基材料属复合材料
B.“一带一路”是现代“丝绸之路”,丝绸的主要成分是天然纤维素
C.北斗导航使用了我国自主研发的芯片,其主要成分为硅
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
3.常温下,某小组探究不同溶液中钢铁的腐蚀,结果如下。下列说法不正确的是
溶液
腐蚀快慢 较快 慢 慢 较快
主要产物
A.在溶液中,主要发生的是析氢腐蚀
B.在溶液中,发生腐蚀时正极反应为:
C.由实验可知,溶液碱性越强,钢铁腐蚀越困难
D.钢铁腐蚀的产物受到溶液酸碱性的影响
4.化学与生产、生活和社会发展密切相关,下列叙述不正确的是
A.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
B.泡沫灭火器内盛有、两种溶液
C.使用含氟牙膏能预防龋齿,发生了沉淀转化
D.免洗洗手液的有效成分之一活性胶质银离子能使病毒蛋白质变性
5.化学与生活息息相关。下列叙述错误的是
A.热的碳酸钠溶液可用于去除餐具的油污
B.明矾和二氧化氯均可作净水剂,且净水原理相同
C.硫酸钡可用于胃肠X射线造影检查
D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
6.下表中化学活动和化学原理相符合的是
选项 化学活动 化学原理
A 酒精与“84”消毒液混合 由于两种物质都有杀菌消毒作用,混合后可增强杀灭新型冠状病毒效果
B 在海轮外壳上镶入铜块 形成原电池,可减缓船体的腐蚀速率
C 炼铁高炉中碳在高温下还原铁矿石中的铁 利用碳单质的还原性将铁还原出来
D 将煤进行气化和液化 变为液体和气体燃料,可变为清洁能源
A.A B.B C.C D.D
7.下列有关说法正确的是
A.钢铁发生电化学腐蚀的负极反应式:
B.用Pt电极电解一定量的稀硫酸溶液,电解一段时间后溶液的PH值不变
C.电解精炼铜时,电解质溶液中均保持不变
D.金属Cu无论在酸性条件下,还是在碱性条件下发生的都是吸氧腐蚀
8.NA代表阿伏加德罗常数的值,下列叙述错误的是
A.0.5mol SF4分子中含有共用电子对数为2NA
B.4.6g C2H6O分子中,C—O共价键数为0.1NA
C.1L pH=2的醋酸溶液中,H+的数目为0.01NA
D.电镀铜时,当阳极质量减少64g时,电路中通过的电子数为2NA
二、非选择题
9.按要求完成:
(1)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,溶液中的c(OH-)约为_______mol·L-1;0.1 mol ·L-1的(NH4)2SO3溶液显________(填“酸”“碱性”或“中性”)。
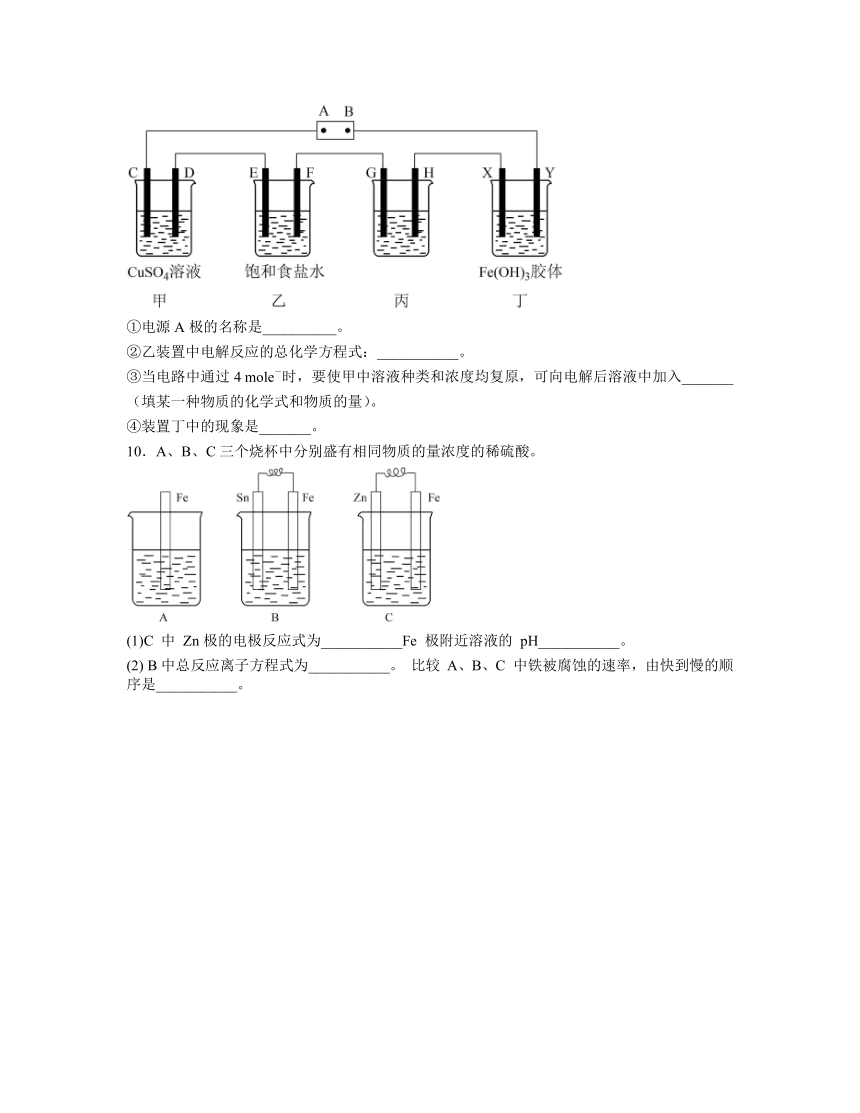
(2)某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙中电解质溶液含溶质均为1 mol。将电源接通后,向乙中滴入酚猷溶液,在F极附近显红色。试回答下列问题:
①电源A极的名称是__________。
②乙装置中电解反应的总化学方程式:___________。
③当电路中通过4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入_______(填某一种物质的化学式和物质的量)。
④装置丁中的现象是_______。
10.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)C 中 Zn极的电极反应式为___________Fe 极附近溶液的 pH___________。
(2) B中总反应离子方程式为___________。 比较 A、B、C 中铁被腐蚀的速率,由快到慢的顺序是___________。
【参考答案】
一、选择题
1.C
解析:A.图甲粗铜精炼,粗铜应该作阳极,纯铜作阴极,故A错误;
B.图乙铜锌原电池,锌电极下面应该是硫酸锌溶液,铜电极下面应该是硫酸铜溶液,故B错误;
C.图丙防止铁被腐蚀,该方法是外加电流的阴极保护法,要保护的金属作电解池的阴极,故C正确;
D.图丁铁件镀银,镀件(Fe)作阴极,镀层金属(Ag)做阳极,故D错误。
综上所述,答案为C。
2.B
解析:A.是一种新型无机非金属材料,增强铝基材料属复合材料,故A正确。
B.丝绸的主要成分是蛋白质,故B错误;
C.芯片主要成分为硅,故C正确;
D.水下钢柱镶铝块防腐,铝连接在钢铁上,铝比铁活泼,因此利用牺牲阳极的阴极保护法,故D正确。
综上所述,答案为B。
3.C
解析:A.在溶液中,酸性条件下,主要发生的是析氢腐蚀,故A正确;
B.在溶液中,发生吸氧腐蚀,正极反应为:,故B正确;
C.中腐蚀速度快,说明溶液碱性越强,钢铁腐蚀越容易,故C错误;
D.不同pH条件下,钢铁腐蚀的产物不同,受到溶液酸碱性的影响,故D正确;
故答案选C。
4.B
解析:A.电热水器用镁棒防止金属内胆腐蚀,利用原电池原理,镁做负极,铁做正极被保护,原理是牺牲阳极的阴极保护法,A选项正确;
B.泡沫灭火器内盛有NaHCO3、两种溶液,B选项错误;
C.使用含氟牙膏能预防龋齿,发生了沉淀转化:,C选项正确;
D.免洗洗手液的有效成分之一活性胶质银离子能使病毒蛋白质变性,失去生理活性,D选项正确;
答案选B。
5.B
解析:A. 碳酸钠溶液呈碱性,油脂在碱性条件下水解,热的碳酸钠溶液水解后碱性增强,去油污效果好,A正确;
B.明矾净水原理是硫酸铝钾溶液中含有铝离子,铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性净水,能吸附水中的固体悬浮物并使之沉降;二氧化氯因具有强氧化性能杀菌消毒,故在进行水处理时,二者的原理不同,B错误;
C.硫酸钡不溶于酸,故可用于胃肠X射线造影检查,C正确;
D.镁比铁活泼作负极,铁作正极被保护,电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法,D正确;
故选B。
6.D
解析:A.酒精和84消毒液混合物会产生氯气,不仅降低消毒效率,且污染环境,A错误;
B.在海轮外壳上镶入铜块,形成原电池,但是铜做正极被保护,钢铁作负极,会被加速腐蚀,故B错误;
C.炼铁高炉中碳在高温下与氧气反应生成CO,CO再将铁从矿石中还原出来,C错误;
D.将煤进行气化和液化之后,得到了综合利用,除去了S、N等有害元素,使之成为更加清洁的能源氢气、CO、甲醇等,D正确。
故选D。
7.D
解析:A.钢铁腐蚀时铁失去电子生成亚铁离子,A项错误;
B.电解稀硫酸实际是电解水,电解一段时间后硫酸的浓度增大,B项错误;
C.电解精炼铜时开始时阳极是其他比铜活泼的金属失去电子进入溶液中,阴极是铜离子得到电子生成铜,故电解质溶液中的铜离子浓度稍微减少,C项错误;
D.铜的活动性比氢弱,不能发生析氢腐蚀,D项正确。
故选D。
8.B
解析:A.1分子SF4中含有4对共用电子对,0.5mol SF4分子中含有共用电子对数为2NA,故A正确;
B.4.6g C2H6O 的物质的量为0.1mol,可能为乙醇分子,C—O共价键数为0.1NA,可能为甲醚分子,C—O共价键数为0.2NA,故B错误;
C.1LpH=2的醋酸溶液中c()=0.01mol/L,的物质的量为0.01mol,数目为0.01NA,故C正确;
D.电镀铜时,镀层金属铜为阳极,减少64g,即1molCu,转移,故D正确;
故答案为B。
二、非选择题
9. 6×10-3 碱性 正极 2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑ 1mol Cu(OH)2 X极附近红褐色不断变浅,Y极附近红褐色不断加深
【分析】根据电离平衡常数计算氢氧根浓度,再根据相对强弱来判断酸碱性;电源接通后,向乙中滴入酚猷溶液,在F极附近显红色,说明F极为阴极,D、F、H、Y都为阴极,C、E、G、X都为阳极,则A为正极,B为负极。
解析:⑴已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,,溶液中的;由于Kb=1.8×10-5 > Ka2=6.2×10-8,碱电离程度大于亚硫酸第二步电离,因此0.1 mol·L-1的(NH4)2SO3溶液,显碱性;故答案为:6×10-3;碱性。
⑵①根据前面分析得出电源A极的名称是正极;故答案为:正极。
②乙装置中电解反应的总化学方程式:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑;故答案为:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑。
③当电路中通过4 mole-时,阳极产生氧气,4 mole-— O2,因此生成了1mol氧气,阴极先生成铜单质,根据Cu2+— 2mole- — Cu,1mol铜离子得到了2mol电子,生成1mol铜单质,铜离子反应完后,还有氢离子得电子,根据电子守恒,说明氢离子得到2mol电子,根据2H+— 2mole- — H2,因此生成了1mol氢气,因此整个电解过程生成1mol铜、1mol氧气、1mol氢气,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入1mol Cu(OH)2;故答案为:1mol Cu(OH)2。
④氢氧化铁胶体粒子带正电,因此不断的向阴极区域移动,装置丁中的现象是X极附近红褐色不断变浅,Y极附近红褐色不断加深;故答案为:X极附近红褐色不断变浅,Y极附近红褐色不断加深。
10. Zn - 2e- = Zn2+ 增大 Fe + 2H+ = Fe2+ + H2↑ B > A > C
【分析】根据B中形成Sn Fe原电池,Fe比Sn活泼,则Sn为正极发生还原反应;根据C中形成Zn Fe原电池,总反应为Zn+2H+=Zn2++H2↑,电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,据此解答。
解析:(1)C中锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn 2e =Zn2+,Fe为原电池的正极,发生反应:2H++2e =H2↑,Fe附近的溶液中氢离子浓度减小,pH值增大,故答案为:Zn 2e =Zn2+;增大;
(2)B中形成Sn Fe原电池,Fe比Sn活泼,Fe为负极,Sn为正极,总反应为:Fe+2H+=Fe2++H2↑;A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,所以A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C;
故答案为:Fe+2H+=Fe2++H2↑;B>A>C
一、选择题
1.下列电化学装置完全正确的是
A.图甲粗铜精炼 B.图乙铜锌原电池
C.图丙防止铁被腐蚀 D.图丁铁件镀银
2.中国改革开放40周年取得了很多标志性成果,下列说法不正确的是
A.制作“嫦娥五号”钻杆用的增强铝基材料属复合材料
B.“一带一路”是现代“丝绸之路”,丝绸的主要成分是天然纤维素
C.北斗导航使用了我国自主研发的芯片,其主要成分为硅
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
3.常温下,某小组探究不同溶液中钢铁的腐蚀,结果如下。下列说法不正确的是
溶液
腐蚀快慢 较快 慢 慢 较快
主要产物
A.在溶液中,主要发生的是析氢腐蚀
B.在溶液中,发生腐蚀时正极反应为:
C.由实验可知,溶液碱性越强,钢铁腐蚀越困难
D.钢铁腐蚀的产物受到溶液酸碱性的影响
4.化学与生产、生活和社会发展密切相关,下列叙述不正确的是
A.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
B.泡沫灭火器内盛有、两种溶液
C.使用含氟牙膏能预防龋齿,发生了沉淀转化
D.免洗洗手液的有效成分之一活性胶质银离子能使病毒蛋白质变性
5.化学与生活息息相关。下列叙述错误的是
A.热的碳酸钠溶液可用于去除餐具的油污
B.明矾和二氧化氯均可作净水剂,且净水原理相同
C.硫酸钡可用于胃肠X射线造影检查
D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
6.下表中化学活动和化学原理相符合的是
选项 化学活动 化学原理
A 酒精与“84”消毒液混合 由于两种物质都有杀菌消毒作用,混合后可增强杀灭新型冠状病毒效果
B 在海轮外壳上镶入铜块 形成原电池,可减缓船体的腐蚀速率
C 炼铁高炉中碳在高温下还原铁矿石中的铁 利用碳单质的还原性将铁还原出来
D 将煤进行气化和液化 变为液体和气体燃料,可变为清洁能源
A.A B.B C.C D.D
7.下列有关说法正确的是
A.钢铁发生电化学腐蚀的负极反应式:
B.用Pt电极电解一定量的稀硫酸溶液,电解一段时间后溶液的PH值不变
C.电解精炼铜时,电解质溶液中均保持不变
D.金属Cu无论在酸性条件下,还是在碱性条件下发生的都是吸氧腐蚀
8.NA代表阿伏加德罗常数的值,下列叙述错误的是
A.0.5mol SF4分子中含有共用电子对数为2NA
B.4.6g C2H6O分子中,C—O共价键数为0.1NA
C.1L pH=2的醋酸溶液中,H+的数目为0.01NA
D.电镀铜时,当阳极质量减少64g时,电路中通过的电子数为2NA
二、非选择题
9.按要求完成:
(1)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,溶液中的c(OH-)约为_______mol·L-1;0.1 mol ·L-1的(NH4)2SO3溶液显________(填“酸”“碱性”或“中性”)。
(2)某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙中电解质溶液含溶质均为1 mol。将电源接通后,向乙中滴入酚猷溶液,在F极附近显红色。试回答下列问题:
①电源A极的名称是__________。
②乙装置中电解反应的总化学方程式:___________。
③当电路中通过4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入_______(填某一种物质的化学式和物质的量)。
④装置丁中的现象是_______。
10.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)C 中 Zn极的电极反应式为___________Fe 极附近溶液的 pH___________。
(2) B中总反应离子方程式为___________。 比较 A、B、C 中铁被腐蚀的速率,由快到慢的顺序是___________。
【参考答案】
一、选择题
1.C
解析:A.图甲粗铜精炼,粗铜应该作阳极,纯铜作阴极,故A错误;
B.图乙铜锌原电池,锌电极下面应该是硫酸锌溶液,铜电极下面应该是硫酸铜溶液,故B错误;
C.图丙防止铁被腐蚀,该方法是外加电流的阴极保护法,要保护的金属作电解池的阴极,故C正确;
D.图丁铁件镀银,镀件(Fe)作阴极,镀层金属(Ag)做阳极,故D错误。
综上所述,答案为C。
2.B
解析:A.是一种新型无机非金属材料,增强铝基材料属复合材料,故A正确。
B.丝绸的主要成分是蛋白质,故B错误;
C.芯片主要成分为硅,故C正确;
D.水下钢柱镶铝块防腐,铝连接在钢铁上,铝比铁活泼,因此利用牺牲阳极的阴极保护法,故D正确。
综上所述,答案为B。
3.C
解析:A.在溶液中,酸性条件下,主要发生的是析氢腐蚀,故A正确;
B.在溶液中,发生吸氧腐蚀,正极反应为:,故B正确;
C.中腐蚀速度快,说明溶液碱性越强,钢铁腐蚀越容易,故C错误;
D.不同pH条件下,钢铁腐蚀的产物不同,受到溶液酸碱性的影响,故D正确;
故答案选C。
4.B
解析:A.电热水器用镁棒防止金属内胆腐蚀,利用原电池原理,镁做负极,铁做正极被保护,原理是牺牲阳极的阴极保护法,A选项正确;
B.泡沫灭火器内盛有NaHCO3、两种溶液,B选项错误;
C.使用含氟牙膏能预防龋齿,发生了沉淀转化:,C选项正确;
D.免洗洗手液的有效成分之一活性胶质银离子能使病毒蛋白质变性,失去生理活性,D选项正确;
答案选B。
5.B
解析:A. 碳酸钠溶液呈碱性,油脂在碱性条件下水解,热的碳酸钠溶液水解后碱性增强,去油污效果好,A正确;
B.明矾净水原理是硫酸铝钾溶液中含有铝离子,铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性净水,能吸附水中的固体悬浮物并使之沉降;二氧化氯因具有强氧化性能杀菌消毒,故在进行水处理时,二者的原理不同,B错误;
C.硫酸钡不溶于酸,故可用于胃肠X射线造影检查,C正确;
D.镁比铁活泼作负极,铁作正极被保护,电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法,D正确;
故选B。
6.D
解析:A.酒精和84消毒液混合物会产生氯气,不仅降低消毒效率,且污染环境,A错误;
B.在海轮外壳上镶入铜块,形成原电池,但是铜做正极被保护,钢铁作负极,会被加速腐蚀,故B错误;
C.炼铁高炉中碳在高温下与氧气反应生成CO,CO再将铁从矿石中还原出来,C错误;
D.将煤进行气化和液化之后,得到了综合利用,除去了S、N等有害元素,使之成为更加清洁的能源氢气、CO、甲醇等,D正确。
故选D。
7.D
解析:A.钢铁腐蚀时铁失去电子生成亚铁离子,A项错误;
B.电解稀硫酸实际是电解水,电解一段时间后硫酸的浓度增大,B项错误;
C.电解精炼铜时开始时阳极是其他比铜活泼的金属失去电子进入溶液中,阴极是铜离子得到电子生成铜,故电解质溶液中的铜离子浓度稍微减少,C项错误;
D.铜的活动性比氢弱,不能发生析氢腐蚀,D项正确。
故选D。
8.B
解析:A.1分子SF4中含有4对共用电子对,0.5mol SF4分子中含有共用电子对数为2NA,故A正确;
B.4.6g C2H6O 的物质的量为0.1mol,可能为乙醇分子,C—O共价键数为0.1NA,可能为甲醚分子,C—O共价键数为0.2NA,故B错误;
C.1LpH=2的醋酸溶液中c()=0.01mol/L,的物质的量为0.01mol,数目为0.01NA,故C正确;
D.电镀铜时,镀层金属铜为阳极,减少64g,即1molCu,转移,故D正确;
故答案为B。
二、非选择题
9. 6×10-3 碱性 正极 2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑ 1mol Cu(OH)2 X极附近红褐色不断变浅,Y极附近红褐色不断加深
【分析】根据电离平衡常数计算氢氧根浓度,再根据相对强弱来判断酸碱性;电源接通后,向乙中滴入酚猷溶液,在F极附近显红色,说明F极为阴极,D、F、H、Y都为阴极,C、E、G、X都为阳极,则A为正极,B为负极。
解析:⑴已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,若忽略氨水浓度的变化,,溶液中的;由于Kb=1.8×10-5 > Ka2=6.2×10-8,碱电离程度大于亚硫酸第二步电离,因此0.1 mol·L-1的(NH4)2SO3溶液,显碱性;故答案为:6×10-3;碱性。
⑵①根据前面分析得出电源A极的名称是正极;故答案为:正极。
②乙装置中电解反应的总化学方程式:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑;故答案为:2NaCl + 2H2O 2NaOH + H2↑ +Cl2↑。
③当电路中通过4 mole-时,阳极产生氧气,4 mole-— O2,因此生成了1mol氧气,阴极先生成铜单质,根据Cu2+— 2mole- — Cu,1mol铜离子得到了2mol电子,生成1mol铜单质,铜离子反应完后,还有氢离子得电子,根据电子守恒,说明氢离子得到2mol电子,根据2H+— 2mole- — H2,因此生成了1mol氢气,因此整个电解过程生成1mol铜、1mol氧气、1mol氢气,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入1mol Cu(OH)2;故答案为:1mol Cu(OH)2。
④氢氧化铁胶体粒子带正电,因此不断的向阴极区域移动,装置丁中的现象是X极附近红褐色不断变浅,Y极附近红褐色不断加深;故答案为:X极附近红褐色不断变浅,Y极附近红褐色不断加深。
10. Zn - 2e- = Zn2+ 增大 Fe + 2H+ = Fe2+ + H2↑ B > A > C
【分析】根据B中形成Sn Fe原电池,Fe比Sn活泼,则Sn为正极发生还原反应;根据C中形成Zn Fe原电池,总反应为Zn+2H+=Zn2++H2↑,电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,据此解答。
解析:(1)C中锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn 2e =Zn2+,Fe为原电池的正极,发生反应:2H++2e =H2↑,Fe附近的溶液中氢离子浓度减小,pH值增大,故答案为:Zn 2e =Zn2+;增大;
(2)B中形成Sn Fe原电池,Fe比Sn活泼,Fe为负极,Sn为正极,总反应为:Fe+2H+=Fe2++H2↑;A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,所以A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C;
故答案为:Fe+2H+=Fe2++H2↑;B>A>C
