第14讲 金属材料与金属矿物的开发利用(基础课)(共71张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第14讲 金属材料与金属矿物的开发利用(基础课)(共71张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 18:28:24 | ||
图片预览











文档简介
(共71张PPT)
第14讲 金属材料与金属矿物的开发利用(基础课)
第二部分 元素及其化合物
第三章 金属及其化合物
1.了解合金及其常见金属材料的应用。 2.了解铝、镁、铜及其重要化合物的主要性质与应用。 3.了解常见金属的冶炼方法和海水提镁。
知识点一 金属材料与金属矿物的开发利用
必备知识梳理
关键能力训练
01
1.合金
(1)概念:合金是指两种或两种以上的金属(或______________)熔合而成的具有__________的物质。
(2)性能:合金具有许多优良的物理、化学或机械性能。
①熔点:一般比它的各成分金属的____;
②硬度和强度:一般比它的各成分金属的____。
金属与非金属
金属特性
低
大
①合金是混合物,合金的物理性质相比于成分金属有所改变,但合金中各成分金属的化学性质不变。
②并非所有的金属都能相互熔合形成合金,若一种金属的熔点高于另一种金属的沸点,则二者不能形成合金。
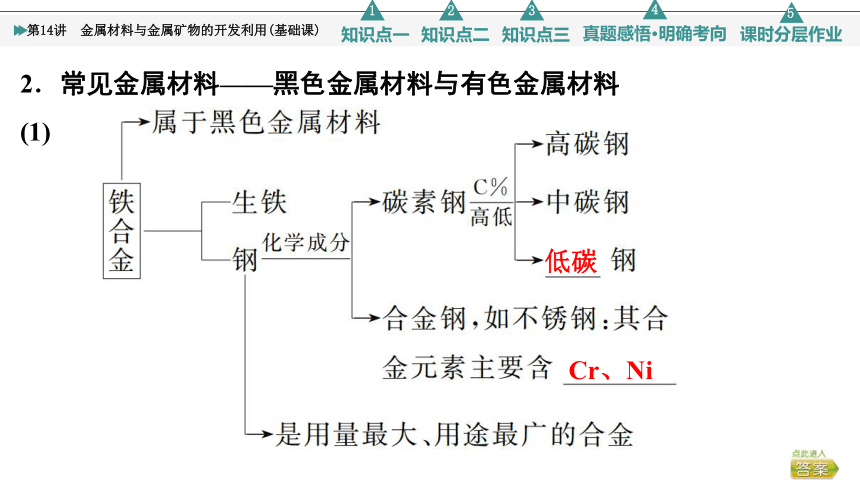
2.常见金属材料——黑色金属材料与有色金属材料
(1)
低碳
Cr、Ni
(2)铝合金:密度小,强度高,塑性好,易于加工,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
(3)新型合金
②其他:钛合金、耐热合金、形状记忆合金等。
合金钢也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能。如超级钢就是含Mn 10%、C 0.47%、Al 2%、V 0.7%的合金钢,强度很大。
3.金属矿物的开发利用
(1)金属在自然界中的存在形式
化合物
(2)金属冶炼的实质
Mn++ne-===M
①使金属化合物中的金属离子____电子还原为金属单质。
②化合态转化为游离态。
得
(3)金属的常见冶炼方法
①电解法
焦炭、CO、H2、Al
(4)合理开发利用金属矿物的主要途径
①提高金属矿物的利用率,②开发环保高效的金属冶炼方法,③防止金属的腐蚀,④加强废旧金属的回收和再利用,⑤使用其他材料代替金属材料,等等。
①金属冶炼与金属活动性的关系:
②冶炼Mg时电解熔融MgCl2而不电解熔融MgO,原因是MgO的熔点高,熔融时会耗费更多能源,增加生产成本。
③冶炼Al时只能电解熔融Al2O3而不能电解熔融AlCl3,原因是AlCl3是共价化合物,熔融态不导电;加入冰晶石(Na3AlF6)的目的是降低Al2O3的熔化温度。
1.下列关于铝锂合金的认识不正确的是( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
D [合金的熔点比它的各成分金属的熔点低,硬度大于其成分金属,A正确;合金的性质与各成分金属的含量有关,所以改变原料的配比,可以制得性能不同的铝锂合金,B正确;铝锂合金具有金属材料的一些通性,有金属光泽,可导电导热,C正确;合金的熔点比它的各成分金属的熔点低,硬度大于其成分金属,所以铝锂合金的性质与各成分金属的性质不完全相同,D错误。]
2.(2022·南京模拟)不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
A.钒、铬、锰、铁等难熔金属通常采用铝热反应法炼制
B.铝及其合金是生产、生活中广泛使用的材料,因为铝的冶炼方法比较简单
C.由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质
D.炼铁时加入的焦炭除了提供热量外,还用来制还原剂一氧化碳
D [A项,铁通常用CO还原法炼制,错误;B项,是因为Al有良好的性能,才被广泛使用,错误;C项,氯化铝是共价化合物,熔融时不导电,工业上用电解氧化铝方法制取铝,错误;D项,高炉炼铁中焦炭的作用为与氧气反应产生热量和制还原剂一氧化碳,正确。]
3.明代《天工开物》记载“火法”冶炼锌:“每炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
D.该冶炼锌的方法属于热还原法
A [由题意可知,倭铅是指金属锌,不是混合物,故A错误;煤炭的主要成分是碳,反应中碳作还原剂,故B、C、D均正确。]
4.明末科学家宋应星出版的《天工开物》中记载了有关“五金”的内容:“……黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间……贸迁有无,……”,下列解释正确的是( )
A.明代使用的釜、鬵一类的炊具都属于青铜合金
B.添加了铬、镍的不锈钢菜刀和农具使用后即使不保养,也不会生锈
C.金属的另一个用途就是铸成钱币作为贸易交往中的流通手段
D.黑铁在空气中发生的腐蚀主要是化学腐蚀
C [明代使用的釜、鬵一类的炊具都属于铁合金,故A错误;不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,不锈钢不容易生锈,家里用的农具是铁合金,如果没及时洗干净后晾干,铁能与氧气、水同时接触,容易发生电化学腐蚀,容易生锈,故B错误;金属可以用来铸成钱币作为贸易交往中的流通手段,故C正确;生铁的腐蚀主要是析氢腐蚀和吸氧腐蚀,属于电化学腐蚀,故D错误。]
知识点二 铝、镁及其化合物
02
必备知识梳理
关键能力训练
一、铝及其化合物
1.铝的存在与主要性质
(1)铝的结构和存在
铝位于元素周期表__________________,原子结构示意图为_______。铝元素在地壳中含量丰富,仅次于________。自然界中的铝全部以______态存在。
第三周期第ⅢA族
氧、硅
化合
(2)铝的主要化学性质
2Al+6H+===2Al3++3H2↑
③Al与碱液(NaOH):_______________________________________。
④Al与CuSO4溶液:_________________________________________。
⑤铝热反应
a.原理:利用Al的______性较强,高温下把金属氧化物中的金属置换出来。
b.应用:冶炼难熔金属,如Cr、Mn、V、W、Cu、Fe等;金属焊接,如野外焊接钢轨等。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2Al+3CuSO4===3Cu+Al2(SO4)3
还原
2.铝的重要化合物
(1)铝的氧化物(Al2O3)——两性氧化物
①两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
②Al2O3的两性表现
Al2O3+6H+===2Al3++3H2O
(2)铝的氢氧化物[Al(OH)3]——两性氢氧化物
①两性氢氧化物:与酸或强碱均能反应生成盐和水的氢氧化物。
②Al(OH)3的两性表现
Al(OH)3+3H+===Al3++3H2O
(3)铝盐——明矾
①化学式为________________________,为复盐。
②电离方程式为KAl(SO4)2===K++Al3++2SO
③应用:净水,净水原理为明矾电离出的Al3+在水中水解生成________________,吸附水中悬浮物而沉淀,使水净化,其离子方程式为_________________________________________。
KAl(SO4)2·12H2O
Al(OH)3胶体
(4)偏铝酸盐——偏铝酸钠
①向NaAlO2溶液中滴加盐酸至过量,反应现象为先生成白色沉淀,然后沉淀又逐渐溶解至消失,反应的有关离子方程式为_______________
____________________________________________________________。
②向NaAlO2溶液中通入少量CO2,反应的离子方程式为_____________
___________________________________。
二、镁及其化合物
1.镁的性质
(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性。
(2)化学性质(写出有关反应的化学方程式或离子方程式)
②_______________________
③______________________________
④Mg+2H+===Mg2++H2↑
2.镁的重要化合物[MgO和Mg(OH)2]
MgO和Mg(OH)2均难溶于水,不与水反应,均与H+反应,常用于除去含Mg2+溶液中的杂质Fe3+。
3MgO+3H2O+2Fe3+===2Fe(OH)3+3Mg2+
3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+
1.下列除去杂质的方法不正确的是 ( )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
B [Al(OH)3不溶于氨水,故向含少量Al3+的Fe3+溶液中加过量氨水,Fe3+、Al3+均转化为氢氧化物沉淀达不到除杂的目的,B项不正确。]
2.利用菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程如图,下列说法正确的是( )
A.“酸浸”时溶液中有电子转移
B.“氧化”时用稀硝酸代替更好
C.沉淀混合物为MgO、Al(OH)3和Fe(OH)3
D.电解MgCl2溶液可得到金属镁
C [A.“酸浸”时没有化合价变化,无电子转移,错误;B.用稀HNO3代替时会产生污染气体NO,错误;D.电解MgCl2溶液不能得到金属镁,错误。]
3.(2022·石家庄月考)明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如图所示。下列叙述错误的是( )
A.合理处理易拉罐有利于环境保护和资源再利用
B.从易拉罐中可回收的金属元素有Al、Fe
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用NaHSO4代替NaHCO3
D [NaHSO4电离出的H+能溶解Al(OH)3,不能得到Al(OH)3,D错误。]
知识点三 铜及其化合物
03
必备知识梳理
关键能力训练
1.铜的主要性质(写出有关反应的化学方程式或离子方程式)
①_______________________________________________。
③与氧化性酸反应
a.与浓硫酸共热:
_____________________________________________;
b.与稀硝酸反应:
__________________________________________________;
c.与浓硝酸反应:
_________________________________________________。
2Cu+O2+H2O+CO2===Cu2(OH)2CO3
④与某些盐溶液反应
a.与硝酸银溶液反应:_______________________________;
b.与FeCl3溶液反应:___________________________________。
Cu+2Ag+===2Ag+Cu2+
Cu+2Fe3+===2Fe2++Cu2+
2.铜的重要化合物的性质及应用
(1)氧化物
①CuO:____色难溶于水的固体,可以与酸反应,可以用H2、CO、Al还原出Cu。
②Cu2O:______色难溶于水的固体,与一般酸反应为Cu2O+2H+===Cu+Cu2++H2O,遇到HNO3发生氧化反应生成Cu2+。
黑
砖红
(2)氢氧化铜——____色难溶物,是一种弱碱。
蓝
Cu(OH)2+2H+===Cu2++2H2O
(3)铜盐
①Cu2(OH)2CO3
Cu2(OH)2CO3的名称为____________,呈____色,是铜锈的主要成
分,受热易分解的方程式为_____________________________________
②CuSO4
a.CuSO4·5H2O为蓝色晶体,俗称____________。
受热或遇浓硫酸,蓝色晶体变为白色粉末。
b.无水CuSO4遇水变____色(生成CuSO4·5H2O),可作为____或________的检验试剂。
碱式碳酸铜
绿
蓝矾或胆矾
蓝
水
水蒸气
③铜盐的毒性
铜盐溶液有毒,主要是因为铜离子能与蛋白质作用,使蛋白质变性失去生理活性,因此人们利用这一性质用__________________配成了波尔多液,用来杀灭植物的病菌。
胆矾、熟石灰、水
判断正误(正确的打“√”,错误的打“×”)
(1)铁、铜在潮湿的空气中均易形成金属氧化物。( )
(2)无水CuSO4既可检验水蒸气的存在又可作干燥剂。( )
(3)Cu2O在高温下比CuO稳定的原因是Cu2O中Cu+的3d轨道电子全充满。( )
(4)Cu2O在一般酸中可发生自身氧化还原反应。( )
(5)Cu与Fe3+反应说明Cu的还原性比Fe的强。( )
(6)Cu2O溶于稀HNO3反应为3Cu2O+2NO +14H+===6Cu2++2NO↑+7H2O。( )
(7)Cu(OH)2溶于氨水生成[Cu(NH3)4]2+。( )
(8)CuSO4·5H2O呈蓝色是因为存在[Cu(H2O)4]2+。( )
[答案] (1)× (2)× (3)√ (4)√ (5)× (6)√ (7)√ (8)√
探究铜及其化合物的性质
1.某同学对Cu的常见化合物的性质进行实验探究,探究的问题和过程如下:
(1)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1 000 ℃以上完全分解成砖红色的Cu2O粉末,该实验说明:在高温条件下,+1价Cu比+2价Cu更________(填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子方程式为______________________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更______(填“稳定”或“不稳定”)。
③向Cu2O中加适量稀硝酸,反应的离子方程式为________________。
(2)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→_____→_____→_____→_____→_____→_____→h。
①实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生反应的化学方程式为______________。
②装置C中的球形装置的作用是_____________。
涉及铜及其化合物的化工流程
2.工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如图所示:
下列有关说法不正确的是( )
A.“过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3
B.通入的气体A可以是O2或Cl2
C.通入气体A之前的混合溶液中存在的阳离子是Fe2+、Cu2+、H+
D.将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜
B [通入的气体A不可以是Cl2,否则引入Cl-杂质,B错误。]
3.工业上以黄铜矿(主要成分是CuFeS2,含有少量SiO2)为主要原料制备CuCl的主要流程如下:
(1)溶液A中含有硫酸铜、硫酸铁,则在一定条件下黄铜矿与稀硫酸、氧气发生反应的化学方程式为__________________。
(2)沉淀D为_______________(填化学式)。
(3)加过量CuO调pH的目的是__________。
(4)若“①”处不加浓盐酸,此处的反应会较快停止,原因是____________。
(5)“②”中的系列操作是_____________,过滤,用________洗涤,真空干燥。
(6)向溶液B中加入NaCl、NaHSO3,加热,也可生成CuCl,则该反应的离子方程式是____________________。
[解析]
废铜利用的一般流程模板
真题感悟·明确考向
04
1.下列说法正确的是________(填序号)。
①(2022·广东选择性考试)技术人员开发高端耐腐蚀镀铝钢板涉及的化学知识为铝能形成致密氧化膜
②(2022·辽宁选择性考试)冬奥会“同心”金属奖牌属于合金材料
③(2022·海南等级考)MgCl2溶液中滴加NaOH溶液至过量,产生白色沉淀后沉淀消失
④(2022·全国乙卷)青铜和黄铜是不同结构的单质铜
[答案] ①②
1
3
5
2
4
2.(2021·河北选择性考试,T1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
1
3
5
2
4
C [A.钢是含碳量低的铁合金,正确;B.钢的硬度和脆性与含碳量有关,随着含碳量的增大而增大,正确;C.由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,错误;D.赤铁矿的主要成分是Fe2O3,可用于冶炼铁,正确。]
1
3
5
2
4
3.(2021·湖北选择性考试,T2)“乌铜走银”是我国非物质文化遗产之一。该工艺将部分氧化的银丝镶嵌于铜器表面,艺人用手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪。下列叙述错误的是 ( )
A.铜的金属活动性大于银
B.通过揉搓可提供电解质溶液
C.银丝可长时间保持光亮
D.用铝丝代替银丝铜也会变黑
D [铜的活动性比铝弱,氧化铝不能被铜还原为单质铝,因此铜不会变黑,D项错误。]
1
3
5
2
4
4.(2021·湖南选择性考试,T6)一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是 ( )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2 MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
2
3
4
1
5
2
3
4
1
5
D [A.物质X的作用是使Mg2+转化为Mg(OH)2,工业上常采用CaO,发生CaO+H2O===Ca(OH)2,Ca(OH)2+Mg2+===Mg(OH)2+Ca2+,A正确;B.Mg是较活泼金属,工业上常用电解熔融MgCl2制备金属镁,B正确;C.由图可知“氯化”过程反应物为MgO、氯气、C,生成物之一为MgCl2,C在高温下能将二氧化碳还原为CO,则“气体”为CO,反应方程式为MgO+C+Cl2 MgCl2+CO,C正确;D.“煅烧”后得到MgO,MgO和盐酸反应得到MgCl2溶液,由于MgCl2在溶液中水解为氢氧化镁和HCl,将所得溶液加热蒸发HCl会逸出,MgCl2水解平衡正向移动,得到氢氧化镁,得不到无水MgCl2,D错误。]
5.(Ⅰ)(2022·海南等级考)胆矾(CuSO4·5H2O)是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾。流程如下。
回答问题:
1
3
5
2
4
回答问题:
(1)步骤①的目的是___________________________。
(2)步骤②中,若仅用浓H2SO4溶解固体B,将生成________(填化学式)污染环境。
(3)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的化学方程式为________。
(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是__________。
(Ⅱ)(2022·全国乙卷)长期存放的CuSO4·5H2O中,会出现少量的白色固体,原因是______________________。
1
3
5
2
4
[答案] (Ⅰ)(1)除油污 (2)SO2
(3)Cu+H2O2+H2SO4(稀)===CuSO4+2H2O
(4)防止CuSO4·5H2O溶于水,减少损失
(Ⅱ)CuSO4·5H2O失去结晶水生成白色无水CuSO4
1
3
5
2
4
谢谢观看 THANK YOU!
第14讲 金属材料与金属矿物的开发利用(基础课)
第二部分 元素及其化合物
第三章 金属及其化合物
1.了解合金及其常见金属材料的应用。 2.了解铝、镁、铜及其重要化合物的主要性质与应用。 3.了解常见金属的冶炼方法和海水提镁。
知识点一 金属材料与金属矿物的开发利用
必备知识梳理
关键能力训练
01
1.合金
(1)概念:合金是指两种或两种以上的金属(或______________)熔合而成的具有__________的物质。
(2)性能:合金具有许多优良的物理、化学或机械性能。
①熔点:一般比它的各成分金属的____;
②硬度和强度:一般比它的各成分金属的____。
金属与非金属
金属特性
低
大
①合金是混合物,合金的物理性质相比于成分金属有所改变,但合金中各成分金属的化学性质不变。
②并非所有的金属都能相互熔合形成合金,若一种金属的熔点高于另一种金属的沸点,则二者不能形成合金。
2.常见金属材料——黑色金属材料与有色金属材料
(1)
低碳
Cr、Ni
(2)铝合金:密度小,强度高,塑性好,易于加工,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
(3)新型合金
②其他:钛合金、耐热合金、形状记忆合金等。
合金钢也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能。如超级钢就是含Mn 10%、C 0.47%、Al 2%、V 0.7%的合金钢,强度很大。
3.金属矿物的开发利用
(1)金属在自然界中的存在形式
化合物
(2)金属冶炼的实质
Mn++ne-===M
①使金属化合物中的金属离子____电子还原为金属单质。
②化合态转化为游离态。
得
(3)金属的常见冶炼方法
①电解法
焦炭、CO、H2、Al
(4)合理开发利用金属矿物的主要途径
①提高金属矿物的利用率,②开发环保高效的金属冶炼方法,③防止金属的腐蚀,④加强废旧金属的回收和再利用,⑤使用其他材料代替金属材料,等等。
①金属冶炼与金属活动性的关系:
②冶炼Mg时电解熔融MgCl2而不电解熔融MgO,原因是MgO的熔点高,熔融时会耗费更多能源,增加生产成本。
③冶炼Al时只能电解熔融Al2O3而不能电解熔融AlCl3,原因是AlCl3是共价化合物,熔融态不导电;加入冰晶石(Na3AlF6)的目的是降低Al2O3的熔化温度。
1.下列关于铝锂合金的认识不正确的是( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
D [合金的熔点比它的各成分金属的熔点低,硬度大于其成分金属,A正确;合金的性质与各成分金属的含量有关,所以改变原料的配比,可以制得性能不同的铝锂合金,B正确;铝锂合金具有金属材料的一些通性,有金属光泽,可导电导热,C正确;合金的熔点比它的各成分金属的熔点低,硬度大于其成分金属,所以铝锂合金的性质与各成分金属的性质不完全相同,D错误。]
2.(2022·南京模拟)不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
A.钒、铬、锰、铁等难熔金属通常采用铝热反应法炼制
B.铝及其合金是生产、生活中广泛使用的材料,因为铝的冶炼方法比较简单
C.由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质
D.炼铁时加入的焦炭除了提供热量外,还用来制还原剂一氧化碳
D [A项,铁通常用CO还原法炼制,错误;B项,是因为Al有良好的性能,才被广泛使用,错误;C项,氯化铝是共价化合物,熔融时不导电,工业上用电解氧化铝方法制取铝,错误;D项,高炉炼铁中焦炭的作用为与氧气反应产生热量和制还原剂一氧化碳,正确。]
3.明代《天工开物》记载“火法”冶炼锌:“每炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
D.该冶炼锌的方法属于热还原法
A [由题意可知,倭铅是指金属锌,不是混合物,故A错误;煤炭的主要成分是碳,反应中碳作还原剂,故B、C、D均正确。]
4.明末科学家宋应星出版的《天工开物》中记载了有关“五金”的内容:“……黄金美者,其值去黑铁(生铁)一万六千倍,然使釜、鬵(xín,一种炊具)、斤(这里指菜刀、镰刀、锄头等)、斧不呈效于日用之间……贸迁有无,……”,下列解释正确的是( )
A.明代使用的釜、鬵一类的炊具都属于青铜合金
B.添加了铬、镍的不锈钢菜刀和农具使用后即使不保养,也不会生锈
C.金属的另一个用途就是铸成钱币作为贸易交往中的流通手段
D.黑铁在空气中发生的腐蚀主要是化学腐蚀
C [明代使用的釜、鬵一类的炊具都属于铁合金,故A错误;不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,不锈钢不容易生锈,家里用的农具是铁合金,如果没及时洗干净后晾干,铁能与氧气、水同时接触,容易发生电化学腐蚀,容易生锈,故B错误;金属可以用来铸成钱币作为贸易交往中的流通手段,故C正确;生铁的腐蚀主要是析氢腐蚀和吸氧腐蚀,属于电化学腐蚀,故D错误。]
知识点二 铝、镁及其化合物
02
必备知识梳理
关键能力训练
一、铝及其化合物
1.铝的存在与主要性质
(1)铝的结构和存在
铝位于元素周期表__________________,原子结构示意图为_______。铝元素在地壳中含量丰富,仅次于________。自然界中的铝全部以______态存在。
第三周期第ⅢA族
氧、硅
化合
(2)铝的主要化学性质
2Al+6H+===2Al3++3H2↑
③Al与碱液(NaOH):_______________________________________。
④Al与CuSO4溶液:_________________________________________。
⑤铝热反应
a.原理:利用Al的______性较强,高温下把金属氧化物中的金属置换出来。
b.应用:冶炼难熔金属,如Cr、Mn、V、W、Cu、Fe等;金属焊接,如野外焊接钢轨等。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2Al+3CuSO4===3Cu+Al2(SO4)3
还原
2.铝的重要化合物
(1)铝的氧化物(Al2O3)——两性氧化物
①两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
②Al2O3的两性表现
Al2O3+6H+===2Al3++3H2O
(2)铝的氢氧化物[Al(OH)3]——两性氢氧化物
①两性氢氧化物:与酸或强碱均能反应生成盐和水的氢氧化物。
②Al(OH)3的两性表现
Al(OH)3+3H+===Al3++3H2O
(3)铝盐——明矾
①化学式为________________________,为复盐。
②电离方程式为KAl(SO4)2===K++Al3++2SO
③应用:净水,净水原理为明矾电离出的Al3+在水中水解生成________________,吸附水中悬浮物而沉淀,使水净化,其离子方程式为_________________________________________。
KAl(SO4)2·12H2O
Al(OH)3胶体
(4)偏铝酸盐——偏铝酸钠
①向NaAlO2溶液中滴加盐酸至过量,反应现象为先生成白色沉淀,然后沉淀又逐渐溶解至消失,反应的有关离子方程式为_______________
____________________________________________________________。
②向NaAlO2溶液中通入少量CO2,反应的离子方程式为_____________
___________________________________。
二、镁及其化合物
1.镁的性质
(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性。
(2)化学性质(写出有关反应的化学方程式或离子方程式)
②_______________________
③______________________________
④Mg+2H+===Mg2++H2↑
2.镁的重要化合物[MgO和Mg(OH)2]
MgO和Mg(OH)2均难溶于水,不与水反应,均与H+反应,常用于除去含Mg2+溶液中的杂质Fe3+。
3MgO+3H2O+2Fe3+===2Fe(OH)3+3Mg2+
3Mg(OH)2+2Fe3+===2Fe(OH)3+3Mg2+
1.下列除去杂质的方法不正确的是 ( )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
B [Al(OH)3不溶于氨水,故向含少量Al3+的Fe3+溶液中加过量氨水,Fe3+、Al3+均转化为氢氧化物沉淀达不到除杂的目的,B项不正确。]
2.利用菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程如图,下列说法正确的是( )
A.“酸浸”时溶液中有电子转移
B.“氧化”时用稀硝酸代替更好
C.沉淀混合物为MgO、Al(OH)3和Fe(OH)3
D.电解MgCl2溶液可得到金属镁
C [A.“酸浸”时没有化合价变化,无电子转移,错误;B.用稀HNO3代替时会产生污染气体NO,错误;D.电解MgCl2溶液不能得到金属镁,错误。]
3.(2022·石家庄月考)明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如图所示。下列叙述错误的是( )
A.合理处理易拉罐有利于环境保护和资源再利用
B.从易拉罐中可回收的金属元素有Al、Fe
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用NaHSO4代替NaHCO3
D [NaHSO4电离出的H+能溶解Al(OH)3,不能得到Al(OH)3,D错误。]
知识点三 铜及其化合物
03
必备知识梳理
关键能力训练
1.铜的主要性质(写出有关反应的化学方程式或离子方程式)
①_______________________________________________。
③与氧化性酸反应
a.与浓硫酸共热:
_____________________________________________;
b.与稀硝酸反应:
__________________________________________________;
c.与浓硝酸反应:
_________________________________________________。
2Cu+O2+H2O+CO2===Cu2(OH)2CO3
④与某些盐溶液反应
a.与硝酸银溶液反应:_______________________________;
b.与FeCl3溶液反应:___________________________________。
Cu+2Ag+===2Ag+Cu2+
Cu+2Fe3+===2Fe2++Cu2+
2.铜的重要化合物的性质及应用
(1)氧化物
①CuO:____色难溶于水的固体,可以与酸反应,可以用H2、CO、Al还原出Cu。
②Cu2O:______色难溶于水的固体,与一般酸反应为Cu2O+2H+===Cu+Cu2++H2O,遇到HNO3发生氧化反应生成Cu2+。
黑
砖红
(2)氢氧化铜——____色难溶物,是一种弱碱。
蓝
Cu(OH)2+2H+===Cu2++2H2O
(3)铜盐
①Cu2(OH)2CO3
Cu2(OH)2CO3的名称为____________,呈____色,是铜锈的主要成
分,受热易分解的方程式为_____________________________________
②CuSO4
a.CuSO4·5H2O为蓝色晶体,俗称____________。
受热或遇浓硫酸,蓝色晶体变为白色粉末。
b.无水CuSO4遇水变____色(生成CuSO4·5H2O),可作为____或________的检验试剂。
碱式碳酸铜
绿
蓝矾或胆矾
蓝
水
水蒸气
③铜盐的毒性
铜盐溶液有毒,主要是因为铜离子能与蛋白质作用,使蛋白质变性失去生理活性,因此人们利用这一性质用__________________配成了波尔多液,用来杀灭植物的病菌。
胆矾、熟石灰、水
判断正误(正确的打“√”,错误的打“×”)
(1)铁、铜在潮湿的空气中均易形成金属氧化物。( )
(2)无水CuSO4既可检验水蒸气的存在又可作干燥剂。( )
(3)Cu2O在高温下比CuO稳定的原因是Cu2O中Cu+的3d轨道电子全充满。( )
(4)Cu2O在一般酸中可发生自身氧化还原反应。( )
(5)Cu与Fe3+反应说明Cu的还原性比Fe的强。( )
(6)Cu2O溶于稀HNO3反应为3Cu2O+2NO +14H+===6Cu2++2NO↑+7H2O。( )
(7)Cu(OH)2溶于氨水生成[Cu(NH3)4]2+。( )
(8)CuSO4·5H2O呈蓝色是因为存在[Cu(H2O)4]2+。( )
[答案] (1)× (2)× (3)√ (4)√ (5)× (6)√ (7)√ (8)√
探究铜及其化合物的性质
1.某同学对Cu的常见化合物的性质进行实验探究,探究的问题和过程如下:
(1)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1 000 ℃以上完全分解成砖红色的Cu2O粉末,该实验说明:在高温条件下,+1价Cu比+2价Cu更________(填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子方程式为______________________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更______(填“稳定”或“不稳定”)。
③向Cu2O中加适量稀硝酸,反应的离子方程式为________________。
(2)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→_____→_____→_____→_____→_____→_____→h。
①实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生反应的化学方程式为______________。
②装置C中的球形装置的作用是_____________。
涉及铜及其化合物的化工流程
2.工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如图所示:
下列有关说法不正确的是( )
A.“过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3
B.通入的气体A可以是O2或Cl2
C.通入气体A之前的混合溶液中存在的阳离子是Fe2+、Cu2+、H+
D.将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜
B [通入的气体A不可以是Cl2,否则引入Cl-杂质,B错误。]
3.工业上以黄铜矿(主要成分是CuFeS2,含有少量SiO2)为主要原料制备CuCl的主要流程如下:
(1)溶液A中含有硫酸铜、硫酸铁,则在一定条件下黄铜矿与稀硫酸、氧气发生反应的化学方程式为__________________。
(2)沉淀D为_______________(填化学式)。
(3)加过量CuO调pH的目的是__________。
(4)若“①”处不加浓盐酸,此处的反应会较快停止,原因是____________。
(5)“②”中的系列操作是_____________,过滤,用________洗涤,真空干燥。
(6)向溶液B中加入NaCl、NaHSO3,加热,也可生成CuCl,则该反应的离子方程式是____________________。
[解析]
废铜利用的一般流程模板
真题感悟·明确考向
04
1.下列说法正确的是________(填序号)。
①(2022·广东选择性考试)技术人员开发高端耐腐蚀镀铝钢板涉及的化学知识为铝能形成致密氧化膜
②(2022·辽宁选择性考试)冬奥会“同心”金属奖牌属于合金材料
③(2022·海南等级考)MgCl2溶液中滴加NaOH溶液至过量,产生白色沉淀后沉淀消失
④(2022·全国乙卷)青铜和黄铜是不同结构的单质铜
[答案] ①②
1
3
5
2
4
2.(2021·河北选择性考试,T1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
1
3
5
2
4
C [A.钢是含碳量低的铁合金,正确;B.钢的硬度和脆性与含碳量有关,随着含碳量的增大而增大,正确;C.由题意可知,生铁熔化灌入熟铁,再锻打成钢,说明生铁的熔点低于熟铁,错误;D.赤铁矿的主要成分是Fe2O3,可用于冶炼铁,正确。]
1
3
5
2
4
3.(2021·湖北选择性考试,T2)“乌铜走银”是我国非物质文化遗产之一。该工艺将部分氧化的银丝镶嵌于铜器表面,艺人用手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪。下列叙述错误的是 ( )
A.铜的金属活动性大于银
B.通过揉搓可提供电解质溶液
C.银丝可长时间保持光亮
D.用铝丝代替银丝铜也会变黑
D [铜的活动性比铝弱,氧化铝不能被铜还原为单质铝,因此铜不会变黑,D项错误。]
1
3
5
2
4
4.(2021·湖南选择性考试,T6)一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是 ( )
A.物质X常选用生石灰
B.工业上常用电解熔融MgCl2制备金属镁
C.“氯化”过程中发生的反应为MgO+C+Cl2 MgCl2+CO
D.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
2
3
4
1
5
2
3
4
1
5
D [A.物质X的作用是使Mg2+转化为Mg(OH)2,工业上常采用CaO,发生CaO+H2O===Ca(OH)2,Ca(OH)2+Mg2+===Mg(OH)2+Ca2+,A正确;B.Mg是较活泼金属,工业上常用电解熔融MgCl2制备金属镁,B正确;C.由图可知“氯化”过程反应物为MgO、氯气、C,生成物之一为MgCl2,C在高温下能将二氧化碳还原为CO,则“气体”为CO,反应方程式为MgO+C+Cl2 MgCl2+CO,C正确;D.“煅烧”后得到MgO,MgO和盐酸反应得到MgCl2溶液,由于MgCl2在溶液中水解为氢氧化镁和HCl,将所得溶液加热蒸发HCl会逸出,MgCl2水解平衡正向移动,得到氢氧化镁,得不到无水MgCl2,D错误。]
5.(Ⅰ)(2022·海南等级考)胆矾(CuSO4·5H2O)是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾。流程如下。
回答问题:
1
3
5
2
4
回答问题:
(1)步骤①的目的是___________________________。
(2)步骤②中,若仅用浓H2SO4溶解固体B,将生成________(填化学式)污染环境。
(3)步骤②中,在H2O2存在下Cu溶于稀H2SO4,反应的化学方程式为________。
(4)经步骤④得到的胆矾,不能用水洗涤的主要原因是__________。
(Ⅱ)(2022·全国乙卷)长期存放的CuSO4·5H2O中,会出现少量的白色固体,原因是______________________。
1
3
5
2
4
[答案] (Ⅰ)(1)除油污 (2)SO2
(3)Cu+H2O2+H2SO4(稀)===CuSO4+2H2O
(4)防止CuSO4·5H2O溶于水,减少损失
(Ⅱ)CuSO4·5H2O失去结晶水生成白色无水CuSO4
1
3
5
2
4
谢谢观看 THANK YOU!
同课章节目录
