第15讲 无机化工流程的解题策略(能力课)(共60张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第15讲 无机化工流程的解题策略(能力课)(共60张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 18:47:55 | ||
图片预览







文档简介
(共60张PPT)
第15讲 无机化工流程的解题策略(能力课)
第二部分 元素及其化合物
第三章 金属及其化合物
1.以化工流程为载体掌握物质的性质、转化反应和反应条件的控制及产率的提高措施等。 2.以化工流程为载体掌握物质的分离、提纯原理、方法和仪器、操作等。
环节一 明确试题模式 建立思维模型
01
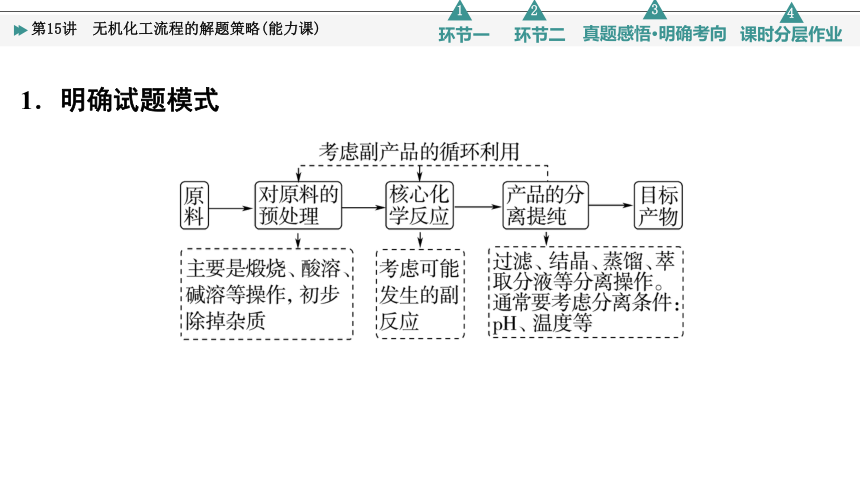
1.明确试题模式
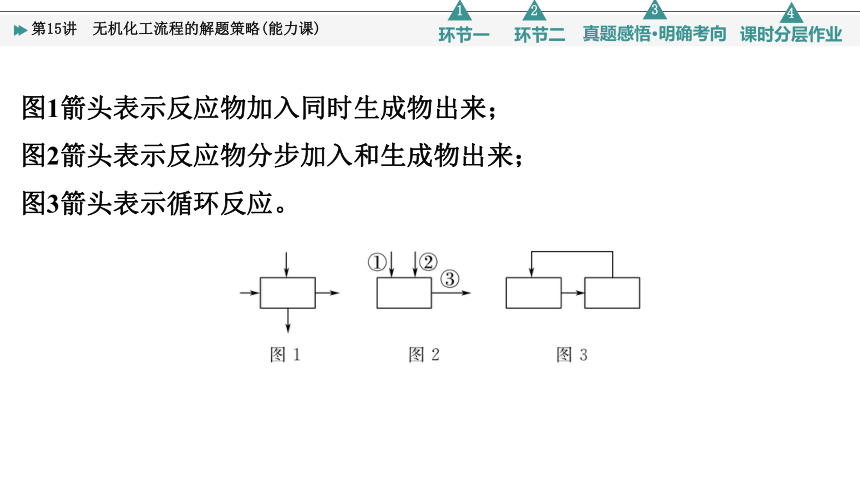
图1箭头表示反应物加入同时生成物出来;
图2箭头表示反应物分步加入和生成物出来;
图3箭头表示循环反应。
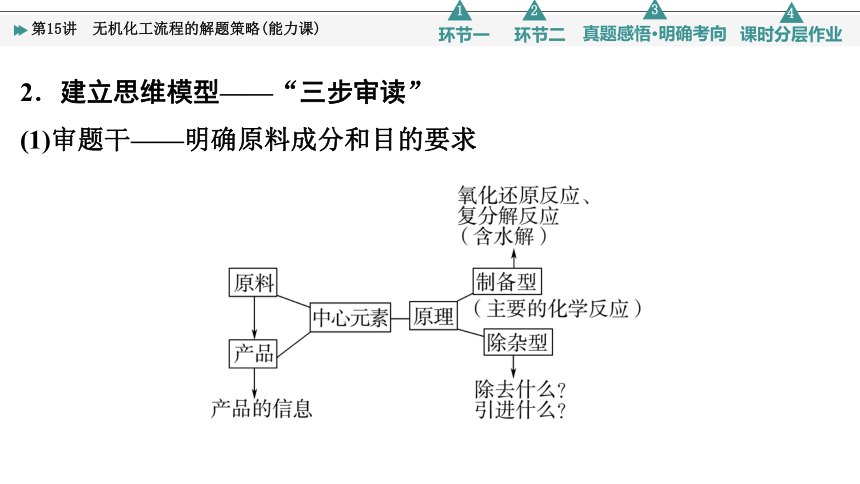
2.建立思维模型——“三步审读”
(1)审题干——明确原料成分和目的要求
(2)审流程——明确各步转化原理和目的
①看箭头:进入的是原料(即反应物);出去的是生成物(包括主产物和副产物)。
②看三线:主线主产品、分支副产品、回头为循环。
③找信息:明确反应条件和分离提纯方法。
④关注所加物质的可能作用:参与反应、提供反应氛围、满足定量要求。
(3)审问题——明确答什么
①防止答非所问:要看清题目要求,按要求答题。
②规范表述:回答问题要准确全面,注意语言表达的规范性,特别是化学用语表示要准确、规范。
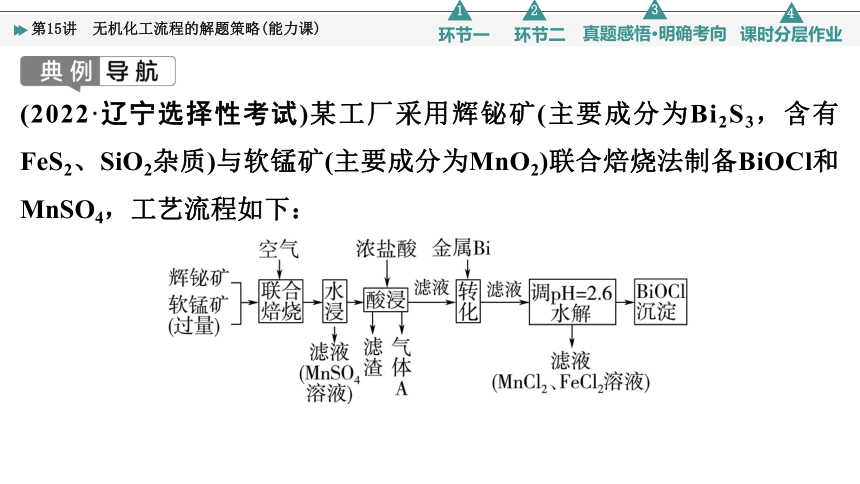
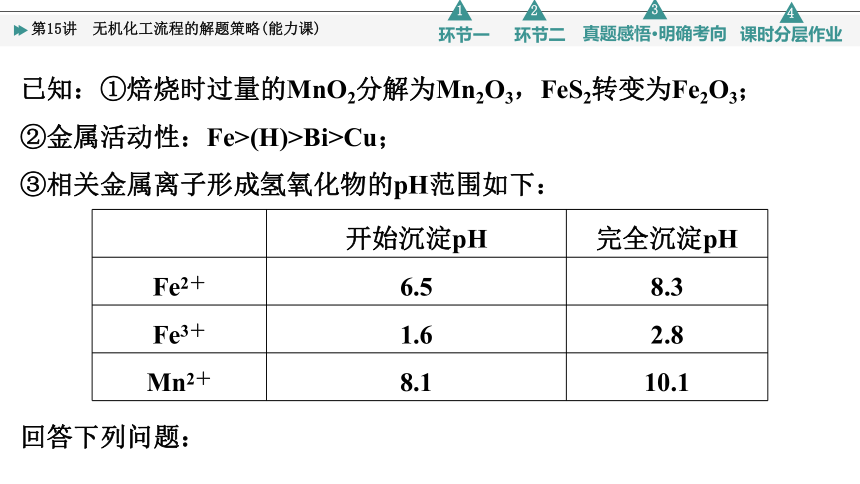
(2022·辽宁选择性考试)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为______。
a.进一步粉碎矿石
b.鼓入适当过量的空气
c.降低焙烧温度
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为______________。
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出Bi3+和Mn2+;②________________。
(4)滤渣的主要成分为________(填化学式)。
(5)生成气体A的离子方程式为_____________________。
(6)加入金属Bi的目的是________________________。
【三步审读】
[答案] (1)ab (2)2Bi2S3+9O2 2Bi2O3+6SO2 (3)抑制金属离子水解 (4)SiO2 (5)Mn2O3+6H++2Cl-===2Mn2++Cl2↑+3H2O (6)将Fe3+转化为Fe2+
流程分析三方法
首尾分析法 线型工艺流程(从原料到产品为一条龙的生产工序)试题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),找出原料与产品之间的关系,弄清原料转化为产品的基本原理和生产过程中除杂、分离、提纯产品工艺,然后再结合题设问题,逐一推敲解答
分段分析法 用同样的原材料生产两种或两种以上产品(包括副产品)的工艺流程题,用分段分析法找到解题的切入点
交叉分析法 有些化工生产选用多组原材料,先合成一种或几种中间产品,再用中间产品与部分其他原材料反应生产所需的主流产品,这就需将提供的工艺流程图结合常见化合物的制取原理划分成几条生产流水线,然后上下交叉分析
环节二 分类突破方法 提升解题能力
02
以分离提纯为主体的化工流程
1.原料的预处理
(1)溶解:通常用酸溶,如用硫酸、盐酸等。
水浸 与水接触发生反应或溶解
浸出 固体加水(酸)溶解得到离子
酸浸 在酸溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去
浸出率 固体溶解后,离子在溶液中的含量的多少
(2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
增大矿石物质的浸出率的措施有:搅拌、加热、升温,增大浸出液的浓度,粉碎矿石增大固液接触面积,延长浸出时间。
2.常用的分离方法
过滤 分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法
萃取 利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,包括液—液萃取和固—液萃取,如用CCl4或苯萃取溴水中的溴
分液 利用分液漏斗将两种互不混溶的液体分离开的操作,如分离油水
蒸发 结晶 提取溶解度随温度变化不大或受热稳定的溶质,如NaCl
蒸发浓 缩冷却 结晶 提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等
蒸馏或 分馏 分离沸点不同且互溶的液体混合物,如分离乙醇和甘油
冷却法 利用气体液化的特点分离气体,如合成氨工业采用冷却法分离混合气体中的氨气
3.分离、提纯的深化
(1)特定洗涤目的
冰水洗涤 的目的 洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗
乙醇洗涤 的目的 降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗,得到较干燥的产物
减压过 滤(抽滤) 加快过滤速率,使沉淀更干燥
晶体的干燥:要得到干燥的晶体,常见的干燥方法有自然晾干、滤纸吸干、在干燥器中干燥、烘干(适用于热稳定性较好的物质)。
(2)调节溶液pH分离提纯
①控制溶液的酸、碱性使其中某些金属离子形成氢氧化物沉淀。
物质 开始沉淀时pH 沉淀完全时pH
Fe(OH)3 1.5 3.7
Fe(OH)2 7.6 9.6
Mn(OH)2 8.3 9.8
若要除去Mn2+溶液中含有的Fe2+、Fe3+,可先用氧化剂把Fe2+氧化为Fe3+,再调节溶液的pH在3.7≤pH<8.3。
②调节pH所需的物质应能与H+反应,使溶液pH增大;不引入新杂质。例如:要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等物质来调节溶液的pH。
(2022·广东选择性考试,T18节选)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是________。
(2)“过滤1”前,用NaOH溶液调pH至______的范围内,该过程中Al3+发生反应的离子方程式为_______________。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于________mol·L-1(保留两位有效数字)。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是_____________。
②“操作X”的过程为:先________,再固液分离。
(5)该工艺中,可再生循环利用的物质有________________(写化学式)。
[解析] 由流程可知,该类矿(含铁、铝等元素)加入酸化MgSO4溶液浸取,得到浸取液中含有RE3+、Mg2+、Fe2+、Fe3+、Al3+、SO 等离子,经氧化调pH使Fe3+、Al3+形成沉淀,经过滤除去,滤液1中含有RE3+、Mg2+、SO 等离子,加入月桂酸钠,使RE3+形成(C11H23COO)3RE沉淀,滤液2主要含有MgSO4溶液,可循环利用,滤饼加盐酸,经加热搅拌溶解后,再冷却结晶,析出月桂酸,再固液分离得到RECl3溶液。
(2)由表中数据可知,Al3+沉淀完全的pH为4.7,而RE3+开始沉淀的pH为6.2~7.4,所以为保证Fe3+、Al3+沉淀完全,且RE3+不沉淀,要用NaOH溶液调pH至4.7≤pH<6.2的范围内,该过程中Al3+发生反应的离子方程式为Al3++3OH-===Al(OH)3↓。(3)滤液2中Mg2+浓度为2.7 g·L-1,即0.112 5 mol/L,根据Ksp[(C11H23COO)2Mg]=c(Mg2+)·
c2(C11H23COO-),若要加入月桂酸钠后只生成(C11H23COO)3RE,而不产生(C11H23COO)2Mg,则c(C11H23COO-)<
(4)①加热搅拌使滤饼和盐酸充分混合,增大接触面积,加快反应速率。②月桂酸的熔点为44 ℃,55 ℃时其为液态,固液分离前,需先冷却至月桂酸呈固态后再过滤。(5)滤液2是Na2SO4和MgSO4的混合液,将其酸化后可以在浸取环节中循环利用。
[答案] (1)Fe2+ (2)4.7≤pH<6.2 Al3++3OH-===Al(OH)3↓ (3)4.0×10-4 (4)加热搅拌可加快反应速率 冷却结晶 (5)MgSO4
1.(2022·威海模拟)碲被誉为现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁。工业上从某电镀污泥(含有Cu2Te、Cr2O3以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
已知:①沉淀时c(Cr3+)与pH的关系
c(Cr3+) pH
开始沉淀 10-1 mol·L-1 3.68
沉淀完全 10-5 mol·L-1 5
②溶解度
回答下列问题:
溶解度 K2Cr2O7 NaCl
100 ℃ 95.1 g 39.8 g
25 ℃ 4.6 g 36 g
(1)“煅烧”时气体与固体原料逆流而行,目的是______________;“煅烧”时Cr2O3发生反应的化学方程式为______________。
(2)金在________(填操作单元名称)过程中回收。已知浸出液中含有TeOSO4,每得到128 g碲,理论上消耗0.8 mol·L-1 Na2SO3溶液的体积为________L。
(3)根据相关物质溶解度特点分析“操作a”的步骤:向Na2Cr2O7溶液中加入KCl固体,________(填操作名称,下同),使NaCl结晶析出后________,再________得到K2Cr2O7晶体。
[解析] 结合题中信息,电镀污泥经过煅烧后Cr2O3转变为Na2CrO4,水浸酸化后转变为Na2Cr2O7,加入KCl固体蒸发浓缩趁热过滤,分离出氯化钠固体,滤液经过冷却结晶得到Na2Cr2O7固体;Cu和Te元素转变为CuO和TeO2,Au不被氧化,水浸后与Na2CrO4分离进入沉渣中,稀硫酸处理沉渣得到产品a,为Au;浸出液中含CuSO4和TeOSO4,电解沉积得到产品b,为Cu;TeOSO4溶液中加亚硫酸钠进行还原得到粗Te,离子方程式为:TeO2++2SO +H2O===Te↓+2SO +2H+。
(2)金在煅烧和酸浸过程均不参与反应,酸浸后以滤渣形式脱离体系,故金在酸浸过程中回收。浸出液中含有TeOSO4,加入亚硫酸钠进行还原,离子方程式为:TeO2++2SO +H2O===Te↓+2SO +2H+,每得到128 g碲(物质的量为1 mol),消耗Na2SO3的物质的量为2 mol,当Na2SO3的浓度为0.8 mol/L时,理论上消耗该溶液的体积为2.5 L。(3)向Na2Cr2O7溶液中加入KCl固体,氯化钠固体的溶解度随温度变化较小,经过加热蒸发或蒸发浓缩使NaCl结晶析出,NaCl结晶析出后趁热过滤,滤液中的主要溶质为K2Cr2O7,K2Cr2O7的溶解度随温度变化较大,再将滤液冷却结晶得到K2Cr2O7晶体。
[答案] (1)使气体与固体充分混合,使反应物充分反应 2Cr2O3+3O2+8NaOH 4Na2CrO4+4H2O (2)酸浸 2.5 (3)加热蒸发或蒸发浓缩 趁热过滤 将滤液冷却结晶
以物质制备为主体的化工流程
1.物质制备过程的控制条件
(1)控制体系的环境氛围
①需要在酸性气流中干燥FeCl3、AlCl3、MgCl2等含水晶体,抑制水解并带走因分解产生的水蒸气。
②营造还原性氛围,防止还原性物质被氧化。如加入铁粉防止Fe2+被氧化。
③加入氧化剂进行氧化。如加入绿色氧化剂H2O2将Fe2+氧化为Fe3+,绿色氧化剂H2O2的优点:不引入新杂质,对环境无污染。
(2)控制反应温度
①加热:加速溶解、加快反应速率或促进平衡向某个方向移动(如促进水解生成沉淀)。
②降温:防止某物质在某温度时会溶解或分解,或促进平衡向某个方向移动。
③控制温度在一定范围内,综合多方面因素考虑,如使反应速率不至于太慢、抑制或促进平衡移动、防止反应物分解、防止副反应发生、使催化剂的催化活性最高等。
④如题目中出现了包括产物在内的各种物质的溶解度信息,则要根据它们溶解度随温度升高而改变的情况,寻找合适的结晶分离方法。
2.从对反应速率和平衡转化率的影响综合控制条件
(1)使催化剂的活性达到最高:如工业合成氨或SO2的催化氧化反应,选择的温度是500 ℃左右,原因之一就是这样可使催化剂的活性达到最高。
(2)对于一些工艺来说,降温或减压都可以减少能源成本,降低对设备的要求,达到绿色化学的目的。
(2021·湖南选择性考试,T17)Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为________。
(2)为提高“水浸”效率,可采取的措施有_________________(至少写两条)。
(3)滤渣Ⅲ的主要成分是________(填化学式)。
(4)加入絮凝剂的目的是__________________。
(5)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为_______________,常温下加入的NH4HCO3溶液呈________(填“酸性”“碱性”或“中性”)(已知:NH3·H2O的Kb=1.75×10-5,H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)。
(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO 和H2O,该反应的化学方程式为_____________________。
[解析] 焙烧浓硫酸和独居石的混合物、水浸,CePO4转化为Ce2(SO4)3和H3PO4,SiO2与硫酸不反应,Al2O3转化为Al2(SO4)3,Fe2O3转化为Fe2(SO4)3,CaF2转化为CaSO4和HF,酸性废气含HF;后过滤,滤渣Ⅰ为SiO2和磷酸钙、FePO4,滤液主要含H3PO4、Ce2(SO4)3、Al2(SO4)3、Fe2(SO4)3,加氯化铁溶液除磷,滤渣Ⅱ为FePO4;聚沉将铁离子、铝离子转化为沉淀,过滤除去,滤渣Ⅲ主要为氢氧化铝,还含氢氧化铁;加碳酸氢铵沉铈得Ce2(CO3)3·nH2O。
2.(2022·衡水模拟)NaBiO3(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是Bi2S3,含少量SiO2、Cu2S、FeS2等杂质)为原料制备铋酸钠的流程如下:
请回答下列问题:
(1)Cu元素位于元素周期表第________周期第________族。用硝酸替代“盐酸,NaClO3”也可以实现“酸浸”,从环保角度考虑,存在的缺点是__________________________。
(2)检验“酸浸”液中是否含Fe2+,可选择的试剂是________(填标号)。
A.KSCN溶液
B.K3[Fe(CN)6]溶液
C.KSCN溶液和双氧水
(3)“除铁”的离子方程式为_____________________。
(4)“除铜”中涉及的离子方程式为__________________。
(5)“氧化”的化学方程式为_______________。
[解析] 本实验由辉铋矿粉加入盐酸、NaClO3溶解原材料,将铁氧化成三价铁,除去浸渣,滤液中加入CuO调节pH除去Fe3+,加入过量氨水除去铜,所得固体中加入NaOH、Cl2氧化得到NaBiO3。
[答案] (1)四 ⅠB 产生大气污染物NOx
(2)B
(3)3CuO+2Fe3++3H2O===2Fe(OH)3+3Cu2+
(4)Cu2++4NH3·H2O===[Cu(NH3)4]2++4H2O,Bi3++3NH3·H2O===Bi(OH)3↓+3NH
(5)Bi(OH)3+3NaOH+Cl2===NaBiO3+2NaCl+3H2O
真题感悟·明确考向
03
(2022·全国甲卷,T26)硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
回答下列问题:
离子 Fe3+ Zn2+ Cu2+ Fe2+ Mg2+
Ksp 4.0× 10-38 6.7× 10-17 2.2× 10-20 8.0× 10-16 1.8×
10-11
(1)菱锌矿焙烧生成氧化锌的化学方程式为_____________。
(2)为了提高锌的浸取效果,可采取的措施有_____________、________________。
(3)加入物质X调溶液pH=5,最适宜使用的X是________(填标号)。
A.NH3·H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是________、________、________。
(4)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为_________。
(5)滤液②中加入锌粉的目的是________________。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是__________________、________________。
[解析] 由题干信息,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物,结合流程图分析,菱锌矿焙烧,主要发生反应ZnCO3 ZnO+CO2↑,再加入H2SO4酸浸,得到含Zn2+、Ca2+、Mg2+、Fe2+、Fe3+、Cu2+的溶液,加入物质X调节pH=5,结合表格数据,过滤得到Fe(OH)3、CaSO4、SiO2的滤渣①,滤液①中主要含有Zn2+、Cu2+、Mg2+、Ca2+、Fe2+,再向滤液①中加入KMnO4溶液氧化Fe2+,过滤得到Fe(OH)3和MnO2的滤渣②,滤液②中加入锌粉,发生反应Zn+Cu2+===Zn2++Cu,过滤后得到滤渣③为Cu,再向滤液③中加入HF脱钙镁,过滤得到滤渣④为CaF2、MgF2,滤液④为ZnSO4溶液,经一系列处理得到ZnSO4·7H2O。(3)当沉淀完全时(离子浓度小于10-5 mol/L),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH)3,又CaSO4是微溶物,SiO2不溶于酸,故滤渣①的主要成分是Fe(OH)3、CaSO4、SiO2。
[答案] (1)ZnCO3 ZnO+CO2↑ (2)适当升高浸取时的反应温度 将焙烧后的产物碾碎,增大接触面积、适当增大硫酸的浓度等 (3)B Fe(OH)3 CaSO4 SiO2 (4)3Fe2++MnO +7H2O===3Fe(OH)3↓+MnO2↓+5H+ (5)除去Cu2+ (6)CaSO4 MgSO4
谢谢观看 THANK YOU!
第15讲 无机化工流程的解题策略(能力课)
第二部分 元素及其化合物
第三章 金属及其化合物
1.以化工流程为载体掌握物质的性质、转化反应和反应条件的控制及产率的提高措施等。 2.以化工流程为载体掌握物质的分离、提纯原理、方法和仪器、操作等。
环节一 明确试题模式 建立思维模型
01
1.明确试题模式
图1箭头表示反应物加入同时生成物出来;
图2箭头表示反应物分步加入和生成物出来;
图3箭头表示循环反应。
2.建立思维模型——“三步审读”
(1)审题干——明确原料成分和目的要求
(2)审流程——明确各步转化原理和目的
①看箭头:进入的是原料(即反应物);出去的是生成物(包括主产物和副产物)。
②看三线:主线主产品、分支副产品、回头为循环。
③找信息:明确反应条件和分离提纯方法。
④关注所加物质的可能作用:参与反应、提供反应氛围、满足定量要求。
(3)审问题——明确答什么
①防止答非所问:要看清题目要求,按要求答题。
②规范表述:回答问题要准确全面,注意语言表达的规范性,特别是化学用语表示要准确、规范。
(2022·辽宁选择性考试)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为______。
a.进一步粉碎矿石
b.鼓入适当过量的空气
c.降低焙烧温度
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为______________。
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出Bi3+和Mn2+;②________________。
(4)滤渣的主要成分为________(填化学式)。
(5)生成气体A的离子方程式为_____________________。
(6)加入金属Bi的目的是________________________。
【三步审读】
[答案] (1)ab (2)2Bi2S3+9O2 2Bi2O3+6SO2 (3)抑制金属离子水解 (4)SiO2 (5)Mn2O3+6H++2Cl-===2Mn2++Cl2↑+3H2O (6)将Fe3+转化为Fe2+
流程分析三方法
首尾分析法 线型工艺流程(从原料到产品为一条龙的生产工序)试题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),找出原料与产品之间的关系,弄清原料转化为产品的基本原理和生产过程中除杂、分离、提纯产品工艺,然后再结合题设问题,逐一推敲解答
分段分析法 用同样的原材料生产两种或两种以上产品(包括副产品)的工艺流程题,用分段分析法找到解题的切入点
交叉分析法 有些化工生产选用多组原材料,先合成一种或几种中间产品,再用中间产品与部分其他原材料反应生产所需的主流产品,这就需将提供的工艺流程图结合常见化合物的制取原理划分成几条生产流水线,然后上下交叉分析
环节二 分类突破方法 提升解题能力
02
以分离提纯为主体的化工流程
1.原料的预处理
(1)溶解:通常用酸溶,如用硫酸、盐酸等。
水浸 与水接触发生反应或溶解
浸出 固体加水(酸)溶解得到离子
酸浸 在酸溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去
浸出率 固体溶解后,离子在溶液中的含量的多少
(2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
增大矿石物质的浸出率的措施有:搅拌、加热、升温,增大浸出液的浓度,粉碎矿石增大固液接触面积,延长浸出时间。
2.常用的分离方法
过滤 分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法
萃取 利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,包括液—液萃取和固—液萃取,如用CCl4或苯萃取溴水中的溴
分液 利用分液漏斗将两种互不混溶的液体分离开的操作,如分离油水
蒸发 结晶 提取溶解度随温度变化不大或受热稳定的溶质,如NaCl
蒸发浓 缩冷却 结晶 提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等
蒸馏或 分馏 分离沸点不同且互溶的液体混合物,如分离乙醇和甘油
冷却法 利用气体液化的特点分离气体,如合成氨工业采用冷却法分离混合气体中的氨气
3.分离、提纯的深化
(1)特定洗涤目的
冰水洗涤 的目的 洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗
乙醇洗涤 的目的 降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗,得到较干燥的产物
减压过 滤(抽滤) 加快过滤速率,使沉淀更干燥
晶体的干燥:要得到干燥的晶体,常见的干燥方法有自然晾干、滤纸吸干、在干燥器中干燥、烘干(适用于热稳定性较好的物质)。
(2)调节溶液pH分离提纯
①控制溶液的酸、碱性使其中某些金属离子形成氢氧化物沉淀。
物质 开始沉淀时pH 沉淀完全时pH
Fe(OH)3 1.5 3.7
Fe(OH)2 7.6 9.6
Mn(OH)2 8.3 9.8
若要除去Mn2+溶液中含有的Fe2+、Fe3+,可先用氧化剂把Fe2+氧化为Fe3+,再调节溶液的pH在3.7≤pH<8.3。
②调节pH所需的物质应能与H+反应,使溶液pH增大;不引入新杂质。例如:要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等物质来调节溶液的pH。
(2022·广东选择性考试,T18节选)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是________。
(2)“过滤1”前,用NaOH溶液调pH至______的范围内,该过程中Al3+发生反应的离子方程式为_______________。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于________mol·L-1(保留两位有效数字)。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是_____________。
②“操作X”的过程为:先________,再固液分离。
(5)该工艺中,可再生循环利用的物质有________________(写化学式)。
[解析] 由流程可知,该类矿(含铁、铝等元素)加入酸化MgSO4溶液浸取,得到浸取液中含有RE3+、Mg2+、Fe2+、Fe3+、Al3+、SO 等离子,经氧化调pH使Fe3+、Al3+形成沉淀,经过滤除去,滤液1中含有RE3+、Mg2+、SO 等离子,加入月桂酸钠,使RE3+形成(C11H23COO)3RE沉淀,滤液2主要含有MgSO4溶液,可循环利用,滤饼加盐酸,经加热搅拌溶解后,再冷却结晶,析出月桂酸,再固液分离得到RECl3溶液。
(2)由表中数据可知,Al3+沉淀完全的pH为4.7,而RE3+开始沉淀的pH为6.2~7.4,所以为保证Fe3+、Al3+沉淀完全,且RE3+不沉淀,要用NaOH溶液调pH至4.7≤pH<6.2的范围内,该过程中Al3+发生反应的离子方程式为Al3++3OH-===Al(OH)3↓。(3)滤液2中Mg2+浓度为2.7 g·L-1,即0.112 5 mol/L,根据Ksp[(C11H23COO)2Mg]=c(Mg2+)·
c2(C11H23COO-),若要加入月桂酸钠后只生成(C11H23COO)3RE,而不产生(C11H23COO)2Mg,则c(C11H23COO-)<
(4)①加热搅拌使滤饼和盐酸充分混合,增大接触面积,加快反应速率。②月桂酸的熔点为44 ℃,55 ℃时其为液态,固液分离前,需先冷却至月桂酸呈固态后再过滤。(5)滤液2是Na2SO4和MgSO4的混合液,将其酸化后可以在浸取环节中循环利用。
[答案] (1)Fe2+ (2)4.7≤pH<6.2 Al3++3OH-===Al(OH)3↓ (3)4.0×10-4 (4)加热搅拌可加快反应速率 冷却结晶 (5)MgSO4
1.(2022·威海模拟)碲被誉为现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁。工业上从某电镀污泥(含有Cu2Te、Cr2O3以及少量的Au)中提取粗碲,同时获得副产品重铬酸钾、金属铜和金的工艺流程如图所示。
已知:①沉淀时c(Cr3+)与pH的关系
c(Cr3+) pH
开始沉淀 10-1 mol·L-1 3.68
沉淀完全 10-5 mol·L-1 5
②溶解度
回答下列问题:
溶解度 K2Cr2O7 NaCl
100 ℃ 95.1 g 39.8 g
25 ℃ 4.6 g 36 g
(1)“煅烧”时气体与固体原料逆流而行,目的是______________;“煅烧”时Cr2O3发生反应的化学方程式为______________。
(2)金在________(填操作单元名称)过程中回收。已知浸出液中含有TeOSO4,每得到128 g碲,理论上消耗0.8 mol·L-1 Na2SO3溶液的体积为________L。
(3)根据相关物质溶解度特点分析“操作a”的步骤:向Na2Cr2O7溶液中加入KCl固体,________(填操作名称,下同),使NaCl结晶析出后________,再________得到K2Cr2O7晶体。
[解析] 结合题中信息,电镀污泥经过煅烧后Cr2O3转变为Na2CrO4,水浸酸化后转变为Na2Cr2O7,加入KCl固体蒸发浓缩趁热过滤,分离出氯化钠固体,滤液经过冷却结晶得到Na2Cr2O7固体;Cu和Te元素转变为CuO和TeO2,Au不被氧化,水浸后与Na2CrO4分离进入沉渣中,稀硫酸处理沉渣得到产品a,为Au;浸出液中含CuSO4和TeOSO4,电解沉积得到产品b,为Cu;TeOSO4溶液中加亚硫酸钠进行还原得到粗Te,离子方程式为:TeO2++2SO +H2O===Te↓+2SO +2H+。
(2)金在煅烧和酸浸过程均不参与反应,酸浸后以滤渣形式脱离体系,故金在酸浸过程中回收。浸出液中含有TeOSO4,加入亚硫酸钠进行还原,离子方程式为:TeO2++2SO +H2O===Te↓+2SO +2H+,每得到128 g碲(物质的量为1 mol),消耗Na2SO3的物质的量为2 mol,当Na2SO3的浓度为0.8 mol/L时,理论上消耗该溶液的体积为2.5 L。(3)向Na2Cr2O7溶液中加入KCl固体,氯化钠固体的溶解度随温度变化较小,经过加热蒸发或蒸发浓缩使NaCl结晶析出,NaCl结晶析出后趁热过滤,滤液中的主要溶质为K2Cr2O7,K2Cr2O7的溶解度随温度变化较大,再将滤液冷却结晶得到K2Cr2O7晶体。
[答案] (1)使气体与固体充分混合,使反应物充分反应 2Cr2O3+3O2+8NaOH 4Na2CrO4+4H2O (2)酸浸 2.5 (3)加热蒸发或蒸发浓缩 趁热过滤 将滤液冷却结晶
以物质制备为主体的化工流程
1.物质制备过程的控制条件
(1)控制体系的环境氛围
①需要在酸性气流中干燥FeCl3、AlCl3、MgCl2等含水晶体,抑制水解并带走因分解产生的水蒸气。
②营造还原性氛围,防止还原性物质被氧化。如加入铁粉防止Fe2+被氧化。
③加入氧化剂进行氧化。如加入绿色氧化剂H2O2将Fe2+氧化为Fe3+,绿色氧化剂H2O2的优点:不引入新杂质,对环境无污染。
(2)控制反应温度
①加热:加速溶解、加快反应速率或促进平衡向某个方向移动(如促进水解生成沉淀)。
②降温:防止某物质在某温度时会溶解或分解,或促进平衡向某个方向移动。
③控制温度在一定范围内,综合多方面因素考虑,如使反应速率不至于太慢、抑制或促进平衡移动、防止反应物分解、防止副反应发生、使催化剂的催化活性最高等。
④如题目中出现了包括产物在内的各种物质的溶解度信息,则要根据它们溶解度随温度升高而改变的情况,寻找合适的结晶分离方法。
2.从对反应速率和平衡转化率的影响综合控制条件
(1)使催化剂的活性达到最高:如工业合成氨或SO2的催化氧化反应,选择的温度是500 ℃左右,原因之一就是这样可使催化剂的活性达到最高。
(2)对于一些工艺来说,降温或减压都可以减少能源成本,降低对设备的要求,达到绿色化学的目的。
(2021·湖南选择性考试,T17)Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如下:
回答下列问题:
(1)铈的某种核素含有58个质子和80个中子,该核素的符号为________。
(2)为提高“水浸”效率,可采取的措施有_________________(至少写两条)。
(3)滤渣Ⅲ的主要成分是________(填化学式)。
(4)加入絮凝剂的目的是__________________。
(5)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为_______________,常温下加入的NH4HCO3溶液呈________(填“酸性”“碱性”或“中性”)(已知:NH3·H2O的Kb=1.75×10-5,H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11)。
(6)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO 和H2O,该反应的化学方程式为_____________________。
[解析] 焙烧浓硫酸和独居石的混合物、水浸,CePO4转化为Ce2(SO4)3和H3PO4,SiO2与硫酸不反应,Al2O3转化为Al2(SO4)3,Fe2O3转化为Fe2(SO4)3,CaF2转化为CaSO4和HF,酸性废气含HF;后过滤,滤渣Ⅰ为SiO2和磷酸钙、FePO4,滤液主要含H3PO4、Ce2(SO4)3、Al2(SO4)3、Fe2(SO4)3,加氯化铁溶液除磷,滤渣Ⅱ为FePO4;聚沉将铁离子、铝离子转化为沉淀,过滤除去,滤渣Ⅲ主要为氢氧化铝,还含氢氧化铁;加碳酸氢铵沉铈得Ce2(CO3)3·nH2O。
2.(2022·衡水模拟)NaBiO3(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是Bi2S3,含少量SiO2、Cu2S、FeS2等杂质)为原料制备铋酸钠的流程如下:
请回答下列问题:
(1)Cu元素位于元素周期表第________周期第________族。用硝酸替代“盐酸,NaClO3”也可以实现“酸浸”,从环保角度考虑,存在的缺点是__________________________。
(2)检验“酸浸”液中是否含Fe2+,可选择的试剂是________(填标号)。
A.KSCN溶液
B.K3[Fe(CN)6]溶液
C.KSCN溶液和双氧水
(3)“除铁”的离子方程式为_____________________。
(4)“除铜”中涉及的离子方程式为__________________。
(5)“氧化”的化学方程式为_______________。
[解析] 本实验由辉铋矿粉加入盐酸、NaClO3溶解原材料,将铁氧化成三价铁,除去浸渣,滤液中加入CuO调节pH除去Fe3+,加入过量氨水除去铜,所得固体中加入NaOH、Cl2氧化得到NaBiO3。
[答案] (1)四 ⅠB 产生大气污染物NOx
(2)B
(3)3CuO+2Fe3++3H2O===2Fe(OH)3+3Cu2+
(4)Cu2++4NH3·H2O===[Cu(NH3)4]2++4H2O,Bi3++3NH3·H2O===Bi(OH)3↓+3NH
(5)Bi(OH)3+3NaOH+Cl2===NaBiO3+2NaCl+3H2O
真题感悟·明确考向
03
(2022·全国甲卷,T26)硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
回答下列问题:
离子 Fe3+ Zn2+ Cu2+ Fe2+ Mg2+
Ksp 4.0× 10-38 6.7× 10-17 2.2× 10-20 8.0× 10-16 1.8×
10-11
(1)菱锌矿焙烧生成氧化锌的化学方程式为_____________。
(2)为了提高锌的浸取效果,可采取的措施有_____________、________________。
(3)加入物质X调溶液pH=5,最适宜使用的X是________(填标号)。
A.NH3·H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是________、________、________。
(4)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为_________。
(5)滤液②中加入锌粉的目的是________________。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是__________________、________________。
[解析] 由题干信息,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物,结合流程图分析,菱锌矿焙烧,主要发生反应ZnCO3 ZnO+CO2↑,再加入H2SO4酸浸,得到含Zn2+、Ca2+、Mg2+、Fe2+、Fe3+、Cu2+的溶液,加入物质X调节pH=5,结合表格数据,过滤得到Fe(OH)3、CaSO4、SiO2的滤渣①,滤液①中主要含有Zn2+、Cu2+、Mg2+、Ca2+、Fe2+,再向滤液①中加入KMnO4溶液氧化Fe2+,过滤得到Fe(OH)3和MnO2的滤渣②,滤液②中加入锌粉,发生反应Zn+Cu2+===Zn2++Cu,过滤后得到滤渣③为Cu,再向滤液③中加入HF脱钙镁,过滤得到滤渣④为CaF2、MgF2,滤液④为ZnSO4溶液,经一系列处理得到ZnSO4·7H2O。(3)当沉淀完全时(离子浓度小于10-5 mol/L),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH)3,又CaSO4是微溶物,SiO2不溶于酸,故滤渣①的主要成分是Fe(OH)3、CaSO4、SiO2。
[答案] (1)ZnCO3 ZnO+CO2↑ (2)适当升高浸取时的反应温度 将焙烧后的产物碾碎,增大接触面积、适当增大硫酸的浓度等 (3)B Fe(OH)3 CaSO4 SiO2 (4)3Fe2++MnO +7H2O===3Fe(OH)3↓+MnO2↓+5H+ (5)除去Cu2+ (6)CaSO4 MgSO4
谢谢观看 THANK YOU!
同课章节目录
