第17讲 卤族元素与海水提取溴和碘(基础课)(共38张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第17讲 卤族元素与海水提取溴和碘(基础课)(共38张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 19:22:45 | ||
图片预览










文档简介
(共38张PPT)
第17讲 卤族元素与海水提取溴和碘(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.了解卤素的相似性和递变性,了解卤素单质及其化合物的特性。 2.掌握卤素离子(Cl-、Br-、I-)的检验方法。 3.了解海水提溴、碘的化工流程及原理。 4.了解沉淀法除去粗盐中的杂质离子。
知识点一 卤族元素及卤素离子检验
必备知识梳理
关键能力训练
01
1.卤素的性质
(1)卤素单质的相似性
卤素原子核外最外层电子数均为7,易得到电子,表现非金属性。
FeI2
HX+HXO
X-+XO-+H2O
(2)卤素的递变性
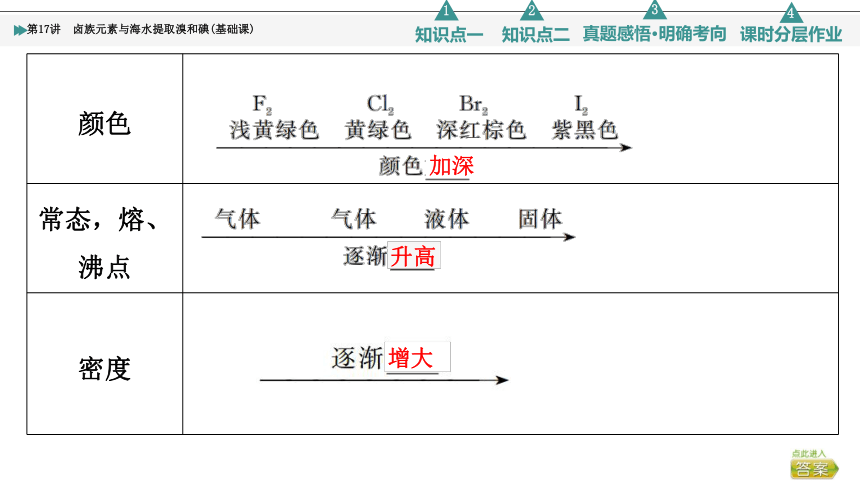
卤素(F→I)的电子层依次增多,原子半径逐渐增大,非金属性逐渐减弱。
颜色
常态,熔、沸点
密度
加深
升高
增大
水溶性
氧化性
还原性 (X-或HX)
减弱
增强
(3)卤素及其化合物的特性
氧化
溴 ①Br2是________色液体,易______。盛溴的试剂瓶中加水,进行水封,保存液溴时不能用______塞
②Br2易溶于有机溶剂,CCl4、汽油可作Br2的萃取剂
③AgBr具有感光性,见光易分解,可用于制照相底片或感光纸
碘 ①I2遇淀粉变____色
②I2加热时易________
③I2易溶于有机溶剂
④食用盐中加入KIO3可用于补碘,防治甲状腺肿大
⑤AgI具有感光性,见光易分解,可用于人工降雨
深红棕
挥发
橡胶
蓝
升华
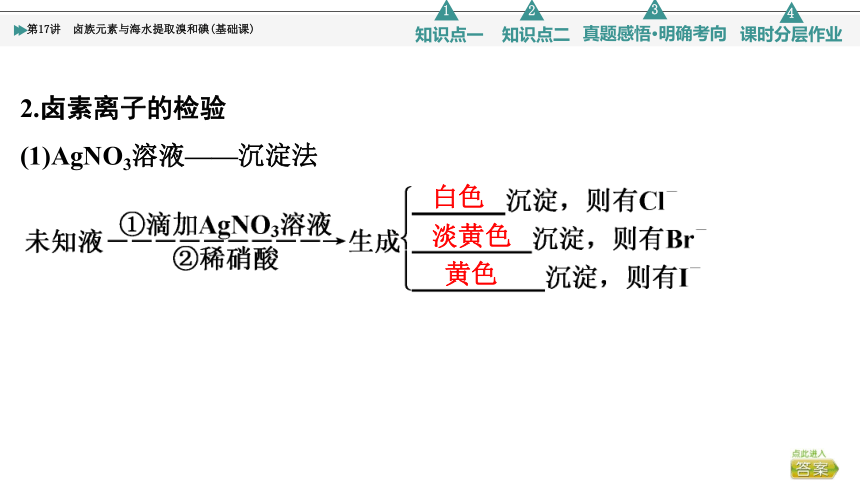
2.卤素离子的检验
(1)AgNO3溶液——沉淀法
白色
淡黄色
黄色
(2)置换——萃取法
Br-
I-
蓝色
判断正误(正确的打“√”,错误的打“×”)
(1)(2022·浙江1月选考)相同条件下,Br2与PBr3反应比Cl2与PBr3反应难。( )
(2)(2022·全国乙卷)向NaBr溶液中滴加过量氯水,再加入淀粉 KI溶液,溶液先变橙色,后变蓝色,证明氧化性:Cl2>Br2>I2。( )
(3)HF不能贮存在陶瓷或玻璃材料容器内。( )
(5)Cl、O元素形成的一种化合物可用于饮用水的消毒。( )
[答案] (1)√ (2)× (3)√ (4)× (5)√
1.下列有关卤素的说法错误的是( )
A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律
B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强
C.淀粉碘化钾溶液在空气中变蓝,反应原理用离子方程式表示为4I-+O2+2H2O===2I2+4OH-
D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
A [元素的非金属性强弱与其对应的氢化物溶液的酸性强弱无关,可根据其最高价氧化物对应的水化物的酸性强弱进行比较,A错误。]
2.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O
B [在F处,可能是未反应完的Cl2与KI发生反应置换出I2,使淀粉变蓝色,不能说明Br2的氧化性比I2强。]
3.(2022·邢台模拟)下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加少量水进行水封
B.能使润湿的淀粉 KI试纸变成蓝色的物质一定是Cl2
C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+
A [B.能使润湿的淀粉 KI试纸变蓝的物质可以是能氧化I-为I2的氧化剂如Cl2、O3、NO2等,错误;C.I2在CCl4中显紫色,错误;D项,该溶液可能含有SO ,错误。]
4.鉴别NaCl溶液、NaBr溶液、NaI溶液可以选用的试剂是 ( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯
④硝酸、AgNO3溶液 ⑤氯水、苯 ⑥CCl4、淀粉溶液
A.①②④ B.②③⑥
C.②④⑤ D.④⑤⑥
C [①无法鉴别三种溶液,③无法鉴别NaCl和NaBr溶液,⑥无法鉴别三种溶液。]
知识点二 海水中提取溴和碘
02
必备知识梳理
关键能力训练
1.海水中提取溴
(1)工艺流程
(2)基本步骤及主要反应
Cl2+2Br-===
Br2+2Cl-
Br2+SO2+
2H2O===2HBr+H2SO4
2.海水中提取碘
(1)海带中碘元素的检验
主反应离子方程式为_____________________________。
2I-+2H++H2O2===I2+2H2O
(2)海带中碘的提取
①化学原理(离子方程式)为_____________________。
②主要的物理原理:单质碘用________或苯萃取,分液后用______法将碘与有机溶剂分离。
2I-+Cl2===I2+2Cl-
CCl4
蒸馏
1.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可为Na2SO3饱和溶液
B.步骤Ⅲ的离子方程式:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L(标准状况下)
D.步骤Ⅳ包含萃取、分液和过滤
D [Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴强,可以通过置换反应制取Br2,B正确;步骤Ⅰ和步骤Ⅲ均使用Cl2,故制取1 mol Br2消耗2 mol Cl2,标准状况下体积为44.8 L,C正确;从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D错误。]
2.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的是 ( )
A.①中反应的离子方程式:2I-+H2O2===I2+2OH-
B.②中分液时含I2的CCl4溶液从分液漏斗下口放出
C.③中得到的上层溶液中含有I-
D.操作Z的名称是加热
BC [A.①中反应的离子方程式为2I-+H2O2+2H+===I2+2H2O,错误;D.I2加热时易升华,操作Z应为过滤,错误。]
真题感悟·明确考向
03
1.(2022·辽宁选择性考试,T6)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是( )
A.褪色原因为I2被Fe还原
B.液体分层后,上层呈紫红色
C.镀锌铁钉比镀锡铁钉更易生锈
D.溶液恢复棕色的原因为I-被氧化
1
3
2
D [A.Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,错误;B.液体分层后, I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,错误;C.若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,错误;D.漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,正确。]
1
3
2
2.(2022·浙江1月选考,T22)下列推测不合理的是( )
A.相同条件下,Br2与PBr3反应比Cl2与PCl3反应难
B.OPBrCl2与足量H2O作用生成2种酸
C.相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3
D.PBr3与足量C2H5OH作用可得到P(OC2H5)3
B [OPBrCl2与足量水作用可生成H3PO4、HBr、HCl三种酸。]
1
3
2
3.(2022·河北选择性考试,T4)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:
A.还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序
B.除杂工序中产生的滤渣可用煤油进行组分分离
C.中和工序中的化学反应为Li2CO3+2HBr===CO2↑+2LiBr+H2O
D.参与反应的n(Br2)∶n(BaS)∶n(H2SO4)为1∶1∶1
1
3
2
A [由流程可知,氢溴酸中含有少量的溴,加入硫化钡将溴还原生成溴化钡和硫,再加入硫酸除杂,得到的滤渣为硫酸钡和硫;加入碳酸锂进行中和,得到的溴化锂溶液经浓缩等操作后得到产品溴化锂。还原工序逸出的Br2用NaOH溶液吸收,吸收液中含有溴化钠和次溴酸钠等物质,若直接返回还原工序,则产品中会有一定量的溴化钠,导致产品的纯度降低,A错误。]
1
3
2
谢谢观看 THANK YOU!
第17讲 卤族元素与海水提取溴和碘(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.了解卤素的相似性和递变性,了解卤素单质及其化合物的特性。 2.掌握卤素离子(Cl-、Br-、I-)的检验方法。 3.了解海水提溴、碘的化工流程及原理。 4.了解沉淀法除去粗盐中的杂质离子。
知识点一 卤族元素及卤素离子检验
必备知识梳理
关键能力训练
01
1.卤素的性质
(1)卤素单质的相似性
卤素原子核外最外层电子数均为7,易得到电子,表现非金属性。
FeI2
HX+HXO
X-+XO-+H2O
(2)卤素的递变性
卤素(F→I)的电子层依次增多,原子半径逐渐增大,非金属性逐渐减弱。
颜色
常态,熔、沸点
密度
加深
升高
增大
水溶性
氧化性
还原性 (X-或HX)
减弱
增强
(3)卤素及其化合物的特性
氧化
溴 ①Br2是________色液体,易______。盛溴的试剂瓶中加水,进行水封,保存液溴时不能用______塞
②Br2易溶于有机溶剂,CCl4、汽油可作Br2的萃取剂
③AgBr具有感光性,见光易分解,可用于制照相底片或感光纸
碘 ①I2遇淀粉变____色
②I2加热时易________
③I2易溶于有机溶剂
④食用盐中加入KIO3可用于补碘,防治甲状腺肿大
⑤AgI具有感光性,见光易分解,可用于人工降雨
深红棕
挥发
橡胶
蓝
升华
2.卤素离子的检验
(1)AgNO3溶液——沉淀法
白色
淡黄色
黄色
(2)置换——萃取法
Br-
I-
蓝色
判断正误(正确的打“√”,错误的打“×”)
(1)(2022·浙江1月选考)相同条件下,Br2与PBr3反应比Cl2与PBr3反应难。( )
(2)(2022·全国乙卷)向NaBr溶液中滴加过量氯水,再加入淀粉 KI溶液,溶液先变橙色,后变蓝色,证明氧化性:Cl2>Br2>I2。( )
(3)HF不能贮存在陶瓷或玻璃材料容器内。( )
(5)Cl、O元素形成的一种化合物可用于饮用水的消毒。( )
[答案] (1)√ (2)× (3)√ (4)× (5)√
1.下列有关卤素的说法错误的是( )
A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律
B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强
C.淀粉碘化钾溶液在空气中变蓝,反应原理用离子方程式表示为4I-+O2+2H2O===2I2+4OH-
D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
A [元素的非金属性强弱与其对应的氢化物溶液的酸性强弱无关,可根据其最高价氧化物对应的水化物的酸性强弱进行比较,A错误。]
2.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O
B [在F处,可能是未反应完的Cl2与KI发生反应置换出I2,使淀粉变蓝色,不能说明Br2的氧化性比I2强。]
3.(2022·邢台模拟)下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加少量水进行水封
B.能使润湿的淀粉 KI试纸变成蓝色的物质一定是Cl2
C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+
A [B.能使润湿的淀粉 KI试纸变蓝的物质可以是能氧化I-为I2的氧化剂如Cl2、O3、NO2等,错误;C.I2在CCl4中显紫色,错误;D项,该溶液可能含有SO ,错误。]
4.鉴别NaCl溶液、NaBr溶液、NaI溶液可以选用的试剂是 ( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯
④硝酸、AgNO3溶液 ⑤氯水、苯 ⑥CCl4、淀粉溶液
A.①②④ B.②③⑥
C.②④⑤ D.④⑤⑥
C [①无法鉴别三种溶液,③无法鉴别NaCl和NaBr溶液,⑥无法鉴别三种溶液。]
知识点二 海水中提取溴和碘
02
必备知识梳理
关键能力训练
1.海水中提取溴
(1)工艺流程
(2)基本步骤及主要反应
Cl2+2Br-===
Br2+2Cl-
Br2+SO2+
2H2O===2HBr+H2SO4
2.海水中提取碘
(1)海带中碘元素的检验
主反应离子方程式为_____________________________。
2I-+2H++H2O2===I2+2H2O
(2)海带中碘的提取
①化学原理(离子方程式)为_____________________。
②主要的物理原理:单质碘用________或苯萃取,分液后用______法将碘与有机溶剂分离。
2I-+Cl2===I2+2Cl-
CCl4
蒸馏
1.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可为Na2SO3饱和溶液
B.步骤Ⅲ的离子方程式:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L(标准状况下)
D.步骤Ⅳ包含萃取、分液和过滤
D [Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴强,可以通过置换反应制取Br2,B正确;步骤Ⅰ和步骤Ⅲ均使用Cl2,故制取1 mol Br2消耗2 mol Cl2,标准状况下体积为44.8 L,C正确;从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D错误。]
2.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的是 ( )
A.①中反应的离子方程式:2I-+H2O2===I2+2OH-
B.②中分液时含I2的CCl4溶液从分液漏斗下口放出
C.③中得到的上层溶液中含有I-
D.操作Z的名称是加热
BC [A.①中反应的离子方程式为2I-+H2O2+2H+===I2+2H2O,错误;D.I2加热时易升华,操作Z应为过滤,错误。]
真题感悟·明确考向
03
1.(2022·辽宁选择性考试,T6)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是( )
A.褪色原因为I2被Fe还原
B.液体分层后,上层呈紫红色
C.镀锌铁钉比镀锡铁钉更易生锈
D.溶液恢复棕色的原因为I-被氧化
1
3
2
D [A.Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,错误;B.液体分层后, I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,错误;C.若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,错误;D.漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,正确。]
1
3
2
2.(2022·浙江1月选考,T22)下列推测不合理的是( )
A.相同条件下,Br2与PBr3反应比Cl2与PCl3反应难
B.OPBrCl2与足量H2O作用生成2种酸
C.相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3
D.PBr3与足量C2H5OH作用可得到P(OC2H5)3
B [OPBrCl2与足量水作用可生成H3PO4、HBr、HCl三种酸。]
1
3
2
3.(2022·河北选择性考试,T4)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:
A.还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序
B.除杂工序中产生的滤渣可用煤油进行组分分离
C.中和工序中的化学反应为Li2CO3+2HBr===CO2↑+2LiBr+H2O
D.参与反应的n(Br2)∶n(BaS)∶n(H2SO4)为1∶1∶1
1
3
2
A [由流程可知,氢溴酸中含有少量的溴,加入硫化钡将溴还原生成溴化钡和硫,再加入硫酸除杂,得到的滤渣为硫酸钡和硫;加入碳酸锂进行中和,得到的溴化锂溶液经浓缩等操作后得到产品溴化锂。还原工序逸出的Br2用NaOH溶液吸收,吸收液中含有溴化钠和次溴酸钠等物质,若直接返回还原工序,则产品中会有一定量的溴化钠,导致产品的纯度降低,A错误。]
1
3
2
谢谢观看 THANK YOU!
同课章节目录
