第20讲 氮及其化合物(基础课)(共76张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第20讲 氮及其化合物(基础课)(共76张PPT)-2024届高考化学一轮复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 00:00:00 | ||
图片预览










文档简介
(共76张PPT)
第20讲 氮及其化合物(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.掌握氮及其重要化合物(氧化物、硝酸、氨及铵盐)的主要性质及应用。 2.掌握NH3的实验室制法及其性质探究。
知识点一 氮及其氧化物 硝酸
必备知识梳理
关键能力训练
01
1.氮及其氧化物
(1)自然界中氮的存在和氮的固定
游离
化合
(2)N2的性质及应用
N2是一种无色、无味的气体,密度比空气略小,__溶于水,熔点、沸点比O2的__。N2的电子式为____________,结构式为______。分子结构稳定,化学性质稳定,可用作保护气。
难
低
∶N N∶
N≡N
氧化
氧化
还原
(3)氮的氧化物
①氮有多种价态氧化物,氮元素从+1价至+5价都有相应的氧化物,依次为____________________________________________,其中属于酸性氧化物的有______和______。
N2O、NO、N2O3、NO2(或N2O4)、N2O5
N2O3
N2O5
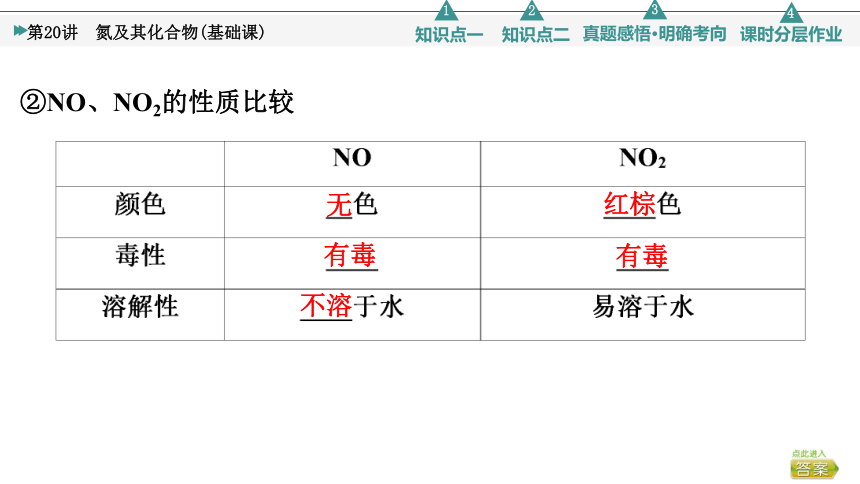
②NO、NO2的性质比较
无
红棕
有毒
有毒
不溶
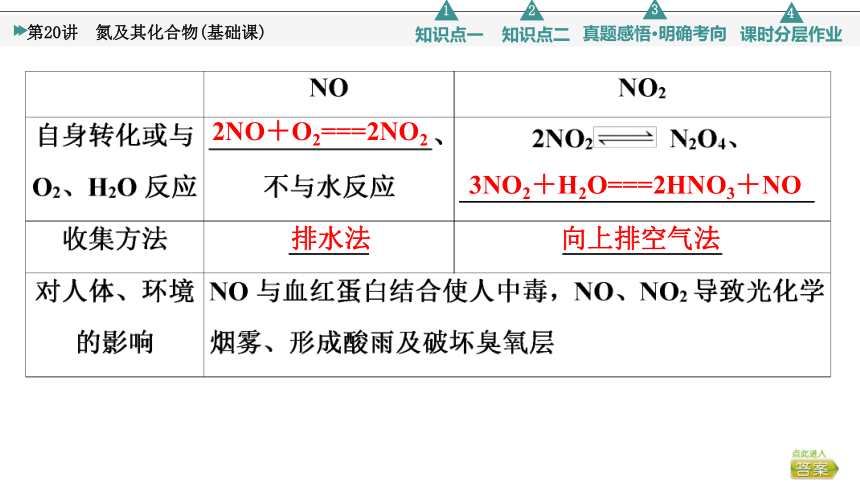
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
排水法
向上排空气法
①NO不能单独被NaOH溶液吸收;NO2可以被NaOH溶液吸收,其反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。NO2与NO按物质的量比1∶1混合与NaOH反应可被完全吸收:NO2+NO+2NaOH===2NaNO2+H2O。
②在催化剂、加热条件下,NOx与NH3反应生成N2与H2O,此方法可用于处理汽车尾气中的NOx。
易
刺激性
是HNO3分解生成的NO2溶于硝酸
中
存在棕色带有玻璃塞的试剂瓶中,置于阴凉处
(2)强氧化性
①与不活泼金属(Au、Pt、Ti除外)反应
稀硝酸与铜反应:___________________________________________。
浓硝酸与铜反应:__________________________________________。
②常温下,浓硝酸使________钝化,金属表面形成一层致密的氧化物保护膜,加热时浓硝酸与Fe、Al发生反应。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
Fe、Al
③与非金属反应
浓硝酸与C的反应:_________________________________________。
④与还原性化合物反应
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+、FeO等还原性物质。稀硝酸与SO2、Fe2+反应的离子方程式分别为_________________________
___________________、______________________________________。
①硝酸与金属反应时,HNO3的还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO;很稀的硝酸还原产物也可能为N2O、N2或NH4NO3。对于Cu与少量浓硝酸反应时,还原产物有NO2、N2O4、NO。
②王水:浓硝酸和浓盐酸按体积比为1∶3混合而成,可溶解Au、Pt等。
1.判断正误(正确的打“√”,错误的打“×”)
(1)N2―→NH3和NH3―→NO两步转化均为氮的固定。( )
(2)NO、NO2均可用排水法收集。( )
(3)NO2与H2O反应生成HNO3,故NO2为酸性氧化物。( )
(4)Zn与浓硝酸反应生成NO2,Zn与稀硝酸反应生成H2。( )
(5)含4 mol HNO3的浓硝酸与足量Cu充分反应,生成 2 mol NO2。( )
[答案] (1)× (2)× (3)× (4)× (5)×
2.写出下列反应的方程式。
(1)“雷雨发庄稼”的原理:______ (写化学方程式)。
(2)浓HNO3与足量铜反应:开始_______,后期_____(写离子方程式)。
氮及其重要化合物间的转化与性质探究
1.部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是( )
A.a可经催化氧化生成b
B.b为红棕色,可转化为c
C.密闭体系中,c存在2NO2 N2O4
D.d的溶液与Cu反应可生成b或c
2.(2022·石家庄模拟)空气中的氮气可通过人工固氮获得氨气,氨气是重要的化工原料,通过氨氧化法可制得硝酸,反应过程如图:
硝酸是一种强氧化性酸,制硝酸工业产生的尾气中含有氮氧化物(有毒),应处理后才能排放。下列说法不正确的是( )
A.常温下,浓硝酸可盛放在铝制或铁制容器中
B.BaSO3固体能溶于稀硝酸,生成Ba(NO3)2,放出SO2气体
C.工业上,当转化①的反应达到平衡时,需不断地从混合气体中分离出NH3,将未反应的原料气送回合成塔以提高原料的利用率
D.转化④中,当V(NO2)∶V(O2)=1∶1时,理论上NO2全部转化为HNO3
BD [B项,BaSO3被HNO3氧化,不能生成SO2,错误;D项,当V(NO2)∶V(O2)=4∶1时,理论上NO2全部转化为HNO3,错误。]
3.下列有关实验操作、现象和解释或结论都正确的是( )
实验操作 现象 解释或结论
① 过量的铁粉中加入稀硝酸,充分反应后,滴入KSCN溶液 溶液不呈红色 稀硝酸不能将Fe氧化为Fe3+
② 浓硝酸久置或光照 变黄色 HNO3不稳定易分解
③ Al箔插入稀硝酸中 无现象 Al箔表面被HNO3氧化,形成致密的氧化膜
④ 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 试纸先变红色 后褪色 浓硝酸具有酸性和强氧化性
A.①②
B.③④
C.②③④
D.②④
D [①中,过量的Fe又把Fe3+还原为Fe2+,错误;③中,Al与稀硝酸可以反应,不发生钝化,错误。]
4.对比分析下列实验所得结论正确的是( )
A.由①中收集的气体能使带火星的木条复燃可推断NO2能助燃
B.②中产生红棕色气体可以证明浓硝酸具有不稳定性
C.③中气体产物中有CO2能证明C能将浓硝酸还原
D.①②③中产生的气体通入足量水中后都无污染性气体产生
硝酸与金属反应的有关计算
守恒思想突破HNO3与金属反应的计算
(1)原子守恒法
HNO3与金属反应时,一部分HNO3起酸的作用,以NO 的形式存在于溶液中;一部分作为氧化剂转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
(2)得失电子守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
(3)电荷守恒法
HNO3过量时反应后溶液中(不考虑OH-)有:c(NO )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
5.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为______ L,NO2的体积为______L。
(2)参加反应的HNO3的物质的量是______。
(3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(2)根据原子(N)守恒可知:n(HNO3)=n(NO)+n(NO2)+2n(Cu2+)=1.52 mol。
(3)根据电荷守恒可知:反应后剩余的HNO3
n(HNO3)=n(H+)=aV×10-3 mol-0.51×2 mol
可求原有HNO3:n=(1.52+aV×10-3-0.51×2)mol=(aV×10-3+0.5)mol。
知识点二 氨和铵盐
02
必备知识梳理
关键能力训练
1.氨的性质
(1)氨的物理性质
无色、有______气味的气体,密度比空气的__,易____,液氨常作____剂,极易溶于水(常温常压下,体积比约为1∶700),可由____实验证明。
刺激性
小
液化
制冷
喷泉
(2)氨的化学性质
①与水的反应——氨水
氨溶于水呈碱性,用方程式表示为_______________________________
_______。
②氨气与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为产生____,将浓盐酸改为浓硝酸,也会出现相同的现象。化学方程式分别为________________________,__________________________。
但改为浓H2SO4时没有白烟。
白烟
HCl(浓)+NH3===NH4Cl
HNO3(浓)+NH3===NH4NO3
③NH3的还原性——氨的催化氧化
化学方程式为_________________________________。
该反应是工业制HNO3的基础。
①NH3与酸反应的实质是NH3+H+===NH,形成配位键,该反应不是中和反应。
②氨水与酸的反应为NH3·H2O+H+===NH+H2O,该反应为中和反应。
2.氨水的组成与性质
(1)组成:氨水的粒子成分:H2O、_____________________________,以溶解的NH3总量为溶质进行浓度计算。
②碱的通性
a.氨水使酚酞试剂变红,使紫色石蕊试液变蓝。
b.中和反应:与盐酸反应的离子方程式为________________________
_____。
c.与盐反应:与AlCl3反应的离子方程式为_______________________
_________________。
3.铵盐的性质
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3等,均属于离子化合物,绝大多数铵盐易溶于水。
(1)不稳定性——受热易分解
①NH4Cl受热分解:_____________________________。
②NH4HCO3受热分解:______________________________________。
(2)与碱反应:铵盐都可与碱溶液反应生成NH3·H2O(弱碱),加热生成NH3和H2O。
写出铵盐与强碱溶液反应的离子方程式:
①稀溶液不加热:__________________________。
②浓溶液或稀溶液加热:______________________________。
(3)“水解”——铵盐溶于水易水解,离子方程式:_________________
_______________,溶液水解呈__性。
酸
①铵盐受热易分解,但受热分解不一定生成NH3,如NH4NO3分解不一定生成NH3,因为高温分解生成HNO3氧化NH3。
②铵盐(NH )的检验:
4.氨气的实验室制法
(1)NH4Cl与Ca(OH)2共热制NH3
CaCl2+2NH3↑
+2H2O
碱石灰
下
降低NH3
与空气的对流速率
湿润的红色石蕊试纸
蓝
蘸有浓盐酸
白烟
吸收NH3,防止NH3逸
出,污染大气
①不能用NH4NO3代替NH4Cl,因为NH4NO3受热易爆炸。
②Ca(OH)2不能用KOH或NaOH代替,因两者易吸湿,易结块,不利于产生NH3,且高温下腐蚀试管。
③不能只用NH4Cl固体加热制取NH3,因为NH4Cl受热分解生成的NH3和HCl遇冷又化合成NH4Cl。
(6)NH4Cl受热分解生成NH3,可在实验室直接加热NH4Cl制NH3。( )
[答案] (1)× (2)× (3)× (4)× (5)× (6)×
氨与铵盐的性质
1.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A.将集满氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将pH=11的氨水稀释1 000倍,测得pH>8,说明NH3·H2O为弱碱
D [氨气极易溶于水生成氨水,所以将集满氨气的试管倒扣于水槽中,液体迅速充满试管,故A正确;常温下,pH=11的氨水中c(OH-)=10-3 mol·L-1,稀释1 000倍,测得pH>8,c(OH-)>10-6 mol·L-1,说明稀释时电离平衡正向移动,所以NH3·H2O为弱碱,故B正确;碳酸氢铵加热分解为氨气、二氧化碳和水,故C正确;氨气的催化氧化产物为NO,NO在锥形瓶口与氧气反应生成NO2,所以瓶口出现少量红棕色气体,故D错误。]
2.下列说法中正确的是( )
A.所有铵盐受热均可以分解,产物均有NH3
B.所有铵盐都易溶于水,所有铵盐中的氮均呈-3 价
C [A.NH4NO3受热分解不一定能得到NH3,错误;B.NH4NO3中氮有-3、+5两种化合价,错误;D.NH4Cl受热分解生成NH3和HCl,冷却NH3与HCl又生成NH4Cl,不是升华,错误。]
氨气的制备及性质探究
3.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→___(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
实验制取NH3时的注意事项
(1)干燥NH3不能选用CaCl2作干燥剂,因为CaCl2+8NH3===CaCl2·8NH3。
(2)NH3被水或溶液吸收时常使用以下防倒吸装置:
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2020·全国Ⅲ卷,T10)喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
1
3
2
选项 气体 溶液
A H2S 稀盐酸
B HCl 稀氨水
C NO 稀H2SO4
D CO2 饱和NaHCO3溶液
B [H2S与稀盐酸不反应,且在稀盐酸中的溶解度较小,向圆底烧瓶中挤入少量稀盐酸,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,A项错误;HCl能与稀氨水反应,向圆底烧瓶中挤入少量稀氨水会造成圆底烧瓶内气压明显减小,能形成喷泉,B项正确;NO与稀硫酸不反应,且在稀硫酸中的溶解度非常小,向圆底烧瓶中挤入稀硫酸,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,C项错误;CO2在饱和NaHCO3溶液中的溶解度较小,向圆底烧瓶中挤入饱和NaHCO3溶液,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,D项错误。]
1
3
2
2.(2022·广东选择性考试,T19节选)Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线:_____________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为________。
1
3
2
3.(2022·海南等级考,T17)磷酸氢二铵[(NH4)2HPO4]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备(NH4)2HPO4,装置如图所示(夹持和搅拌装置已省略)。
1
3
2
回答问题:
(1)实验室用NH4Cl(s)和Ca(OH)2(s)制备氨气的化学方程式为_______。
(2)现有浓H3PO4质量分数为85%,密度为1.7 g/mL。若实验需100 mL 1.7 mol/L的H3PO4溶液,则需浓H3PO4________mL(保留一位小数)。
(3)装置中活塞K2的作用为_______。实验过程中,当出现_______现象时,应及时关闭K1,打开K2。
1
3
2
(4)当溶液pH为8.0~9.0时,停止通NH3,即可制得(NH4)2HPO4溶液。若继续通入NH3,当pH>10.0时,溶液中OH-、________和________(填离子符号)浓度明显增加。
(5)若本实验不选用pH传感器,还可选用________作指示剂,当溶液颜色由________变为________时,停止通NH3。
1
3
2
[解析] (2)V×1.7 g/mL×85%=0.1 L×1.7 mol/L×98 g/mol,V≈11.5 mL。
(5)恰好生成(NH4)2HPO4时pH为8.0~9.0,该pH范围在酚酞的变色范围内,可以酚酞作为指示剂。
1
3
2
1
3
2
一定温度下,探究铜与稀硝酸反应,过程如图所示,下列说法不正确的是( )
谢谢观看 THANK YOU!
第20讲 氮及其化合物(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.掌握氮及其重要化合物(氧化物、硝酸、氨及铵盐)的主要性质及应用。 2.掌握NH3的实验室制法及其性质探究。
知识点一 氮及其氧化物 硝酸
必备知识梳理
关键能力训练
01
1.氮及其氧化物
(1)自然界中氮的存在和氮的固定
游离
化合
(2)N2的性质及应用
N2是一种无色、无味的气体,密度比空气略小,__溶于水,熔点、沸点比O2的__。N2的电子式为____________,结构式为______。分子结构稳定,化学性质稳定,可用作保护气。
难
低
∶N N∶
N≡N
氧化
氧化
还原
(3)氮的氧化物
①氮有多种价态氧化物,氮元素从+1价至+5价都有相应的氧化物,依次为____________________________________________,其中属于酸性氧化物的有______和______。
N2O、NO、N2O3、NO2(或N2O4)、N2O5
N2O3
N2O5
②NO、NO2的性质比较
无
红棕
有毒
有毒
不溶
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
排水法
向上排空气法
①NO不能单独被NaOH溶液吸收;NO2可以被NaOH溶液吸收,其反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。NO2与NO按物质的量比1∶1混合与NaOH反应可被完全吸收:NO2+NO+2NaOH===2NaNO2+H2O。
②在催化剂、加热条件下,NOx与NH3反应生成N2与H2O,此方法可用于处理汽车尾气中的NOx。
易
刺激性
是HNO3分解生成的NO2溶于硝酸
中
存在棕色带有玻璃塞的试剂瓶中,置于阴凉处
(2)强氧化性
①与不活泼金属(Au、Pt、Ti除外)反应
稀硝酸与铜反应:___________________________________________。
浓硝酸与铜反应:__________________________________________。
②常温下,浓硝酸使________钝化,金属表面形成一层致密的氧化物保护膜,加热时浓硝酸与Fe、Al发生反应。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
Fe、Al
③与非金属反应
浓硝酸与C的反应:_________________________________________。
④与还原性化合物反应
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+、FeO等还原性物质。稀硝酸与SO2、Fe2+反应的离子方程式分别为_________________________
___________________、______________________________________。
①硝酸与金属反应时,HNO3的还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO;很稀的硝酸还原产物也可能为N2O、N2或NH4NO3。对于Cu与少量浓硝酸反应时,还原产物有NO2、N2O4、NO。
②王水:浓硝酸和浓盐酸按体积比为1∶3混合而成,可溶解Au、Pt等。
1.判断正误(正确的打“√”,错误的打“×”)
(1)N2―→NH3和NH3―→NO两步转化均为氮的固定。( )
(2)NO、NO2均可用排水法收集。( )
(3)NO2与H2O反应生成HNO3,故NO2为酸性氧化物。( )
(4)Zn与浓硝酸反应生成NO2,Zn与稀硝酸反应生成H2。( )
(5)含4 mol HNO3的浓硝酸与足量Cu充分反应,生成 2 mol NO2。( )
[答案] (1)× (2)× (3)× (4)× (5)×
2.写出下列反应的方程式。
(1)“雷雨发庄稼”的原理:______ (写化学方程式)。
(2)浓HNO3与足量铜反应:开始_______,后期_____(写离子方程式)。
氮及其重要化合物间的转化与性质探究
1.部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是( )
A.a可经催化氧化生成b
B.b为红棕色,可转化为c
C.密闭体系中,c存在2NO2 N2O4
D.d的溶液与Cu反应可生成b或c
2.(2022·石家庄模拟)空气中的氮气可通过人工固氮获得氨气,氨气是重要的化工原料,通过氨氧化法可制得硝酸,反应过程如图:
硝酸是一种强氧化性酸,制硝酸工业产生的尾气中含有氮氧化物(有毒),应处理后才能排放。下列说法不正确的是( )
A.常温下,浓硝酸可盛放在铝制或铁制容器中
B.BaSO3固体能溶于稀硝酸,生成Ba(NO3)2,放出SO2气体
C.工业上,当转化①的反应达到平衡时,需不断地从混合气体中分离出NH3,将未反应的原料气送回合成塔以提高原料的利用率
D.转化④中,当V(NO2)∶V(O2)=1∶1时,理论上NO2全部转化为HNO3
BD [B项,BaSO3被HNO3氧化,不能生成SO2,错误;D项,当V(NO2)∶V(O2)=4∶1时,理论上NO2全部转化为HNO3,错误。]
3.下列有关实验操作、现象和解释或结论都正确的是( )
实验操作 现象 解释或结论
① 过量的铁粉中加入稀硝酸,充分反应后,滴入KSCN溶液 溶液不呈红色 稀硝酸不能将Fe氧化为Fe3+
② 浓硝酸久置或光照 变黄色 HNO3不稳定易分解
③ Al箔插入稀硝酸中 无现象 Al箔表面被HNO3氧化,形成致密的氧化膜
④ 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 试纸先变红色 后褪色 浓硝酸具有酸性和强氧化性
A.①②
B.③④
C.②③④
D.②④
D [①中,过量的Fe又把Fe3+还原为Fe2+,错误;③中,Al与稀硝酸可以反应,不发生钝化,错误。]
4.对比分析下列实验所得结论正确的是( )
A.由①中收集的气体能使带火星的木条复燃可推断NO2能助燃
B.②中产生红棕色气体可以证明浓硝酸具有不稳定性
C.③中气体产物中有CO2能证明C能将浓硝酸还原
D.①②③中产生的气体通入足量水中后都无污染性气体产生
硝酸与金属反应的有关计算
守恒思想突破HNO3与金属反应的计算
(1)原子守恒法
HNO3与金属反应时,一部分HNO3起酸的作用,以NO 的形式存在于溶液中;一部分作为氧化剂转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
(2)得失电子守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
(3)电荷守恒法
HNO3过量时反应后溶液中(不考虑OH-)有:c(NO )=c(H+)+nc(Mn+)(Mn+代表金属离子)。
5.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为______ L,NO2的体积为______L。
(2)参加反应的HNO3的物质的量是______。
(3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(2)根据原子(N)守恒可知:n(HNO3)=n(NO)+n(NO2)+2n(Cu2+)=1.52 mol。
(3)根据电荷守恒可知:反应后剩余的HNO3
n(HNO3)=n(H+)=aV×10-3 mol-0.51×2 mol
可求原有HNO3:n=(1.52+aV×10-3-0.51×2)mol=(aV×10-3+0.5)mol。
知识点二 氨和铵盐
02
必备知识梳理
关键能力训练
1.氨的性质
(1)氨的物理性质
无色、有______气味的气体,密度比空气的__,易____,液氨常作____剂,极易溶于水(常温常压下,体积比约为1∶700),可由____实验证明。
刺激性
小
液化
制冷
喷泉
(2)氨的化学性质
①与水的反应——氨水
氨溶于水呈碱性,用方程式表示为_______________________________
_______。
②氨气与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为产生____,将浓盐酸改为浓硝酸,也会出现相同的现象。化学方程式分别为________________________,__________________________。
但改为浓H2SO4时没有白烟。
白烟
HCl(浓)+NH3===NH4Cl
HNO3(浓)+NH3===NH4NO3
③NH3的还原性——氨的催化氧化
化学方程式为_________________________________。
该反应是工业制HNO3的基础。
①NH3与酸反应的实质是NH3+H+===NH,形成配位键,该反应不是中和反应。
②氨水与酸的反应为NH3·H2O+H+===NH+H2O,该反应为中和反应。
2.氨水的组成与性质
(1)组成:氨水的粒子成分:H2O、_____________________________,以溶解的NH3总量为溶质进行浓度计算。
②碱的通性
a.氨水使酚酞试剂变红,使紫色石蕊试液变蓝。
b.中和反应:与盐酸反应的离子方程式为________________________
_____。
c.与盐反应:与AlCl3反应的离子方程式为_______________________
_________________。
3.铵盐的性质
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3等,均属于离子化合物,绝大多数铵盐易溶于水。
(1)不稳定性——受热易分解
①NH4Cl受热分解:_____________________________。
②NH4HCO3受热分解:______________________________________。
(2)与碱反应:铵盐都可与碱溶液反应生成NH3·H2O(弱碱),加热生成NH3和H2O。
写出铵盐与强碱溶液反应的离子方程式:
①稀溶液不加热:__________________________。
②浓溶液或稀溶液加热:______________________________。
(3)“水解”——铵盐溶于水易水解,离子方程式:_________________
_______________,溶液水解呈__性。
酸
①铵盐受热易分解,但受热分解不一定生成NH3,如NH4NO3分解不一定生成NH3,因为高温分解生成HNO3氧化NH3。
②铵盐(NH )的检验:
4.氨气的实验室制法
(1)NH4Cl与Ca(OH)2共热制NH3
CaCl2+2NH3↑
+2H2O
碱石灰
下
降低NH3
与空气的对流速率
湿润的红色石蕊试纸
蓝
蘸有浓盐酸
白烟
吸收NH3,防止NH3逸
出,污染大气
①不能用NH4NO3代替NH4Cl,因为NH4NO3受热易爆炸。
②Ca(OH)2不能用KOH或NaOH代替,因两者易吸湿,易结块,不利于产生NH3,且高温下腐蚀试管。
③不能只用NH4Cl固体加热制取NH3,因为NH4Cl受热分解生成的NH3和HCl遇冷又化合成NH4Cl。
(6)NH4Cl受热分解生成NH3,可在实验室直接加热NH4Cl制NH3。( )
[答案] (1)× (2)× (3)× (4)× (5)× (6)×
氨与铵盐的性质
1.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A.将集满氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将pH=11的氨水稀释1 000倍,测得pH>8,说明NH3·H2O为弱碱
D [氨气极易溶于水生成氨水,所以将集满氨气的试管倒扣于水槽中,液体迅速充满试管,故A正确;常温下,pH=11的氨水中c(OH-)=10-3 mol·L-1,稀释1 000倍,测得pH>8,c(OH-)>10-6 mol·L-1,说明稀释时电离平衡正向移动,所以NH3·H2O为弱碱,故B正确;碳酸氢铵加热分解为氨气、二氧化碳和水,故C正确;氨气的催化氧化产物为NO,NO在锥形瓶口与氧气反应生成NO2,所以瓶口出现少量红棕色气体,故D错误。]
2.下列说法中正确的是( )
A.所有铵盐受热均可以分解,产物均有NH3
B.所有铵盐都易溶于水,所有铵盐中的氮均呈-3 价
C [A.NH4NO3受热分解不一定能得到NH3,错误;B.NH4NO3中氮有-3、+5两种化合价,错误;D.NH4Cl受热分解生成NH3和HCl,冷却NH3与HCl又生成NH4Cl,不是升华,错误。]
氨气的制备及性质探究
3.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→___(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
实验制取NH3时的注意事项
(1)干燥NH3不能选用CaCl2作干燥剂,因为CaCl2+8NH3===CaCl2·8NH3。
(2)NH3被水或溶液吸收时常使用以下防倒吸装置:
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2020·全国Ⅲ卷,T10)喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
1
3
2
选项 气体 溶液
A H2S 稀盐酸
B HCl 稀氨水
C NO 稀H2SO4
D CO2 饱和NaHCO3溶液
B [H2S与稀盐酸不反应,且在稀盐酸中的溶解度较小,向圆底烧瓶中挤入少量稀盐酸,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,A项错误;HCl能与稀氨水反应,向圆底烧瓶中挤入少量稀氨水会造成圆底烧瓶内气压明显减小,能形成喷泉,B项正确;NO与稀硫酸不反应,且在稀硫酸中的溶解度非常小,向圆底烧瓶中挤入稀硫酸,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,C项错误;CO2在饱和NaHCO3溶液中的溶解度较小,向圆底烧瓶中挤入饱和NaHCO3溶液,不能造成圆底烧瓶内气压明显减小,不能形成喷泉,D项错误。]
1
3
2
2.(2022·广东选择性考试,T19节选)Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线:_____________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为________。
1
3
2
3.(2022·海南等级考,T17)磷酸氢二铵[(NH4)2HPO4]常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备(NH4)2HPO4,装置如图所示(夹持和搅拌装置已省略)。
1
3
2
回答问题:
(1)实验室用NH4Cl(s)和Ca(OH)2(s)制备氨气的化学方程式为_______。
(2)现有浓H3PO4质量分数为85%,密度为1.7 g/mL。若实验需100 mL 1.7 mol/L的H3PO4溶液,则需浓H3PO4________mL(保留一位小数)。
(3)装置中活塞K2的作用为_______。实验过程中,当出现_______现象时,应及时关闭K1,打开K2。
1
3
2
(4)当溶液pH为8.0~9.0时,停止通NH3,即可制得(NH4)2HPO4溶液。若继续通入NH3,当pH>10.0时,溶液中OH-、________和________(填离子符号)浓度明显增加。
(5)若本实验不选用pH传感器,还可选用________作指示剂,当溶液颜色由________变为________时,停止通NH3。
1
3
2
[解析] (2)V×1.7 g/mL×85%=0.1 L×1.7 mol/L×98 g/mol,V≈11.5 mL。
(5)恰好生成(NH4)2HPO4时pH为8.0~9.0,该pH范围在酚酞的变色范围内,可以酚酞作为指示剂。
1
3
2
1
3
2
一定温度下,探究铜与稀硝酸反应,过程如图所示,下列说法不正确的是( )
谢谢观看 THANK YOU!
同课章节目录
