第23讲 常见气体制备方法及装置的研究(能力课)(共57张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第23讲 常见气体制备方法及装置的研究(能力课)(共57张PPT)-2024届高考化学一轮复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 00:00:00 | ||
图片预览





文档简介
(共57张PPT)
第23讲 常见气体制备方法及装置的研究(能力课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.掌握常见气体的制备原理、发生装置、净化装置、收集装置和尾气处理装置。 2.根据实验目的,灵活掌握仪器的组装和连接。 3.气体制备与性质探究实验装置分析与评价。
考点一 氯及其重要化合物
核心知能突破
关键能力训练
01
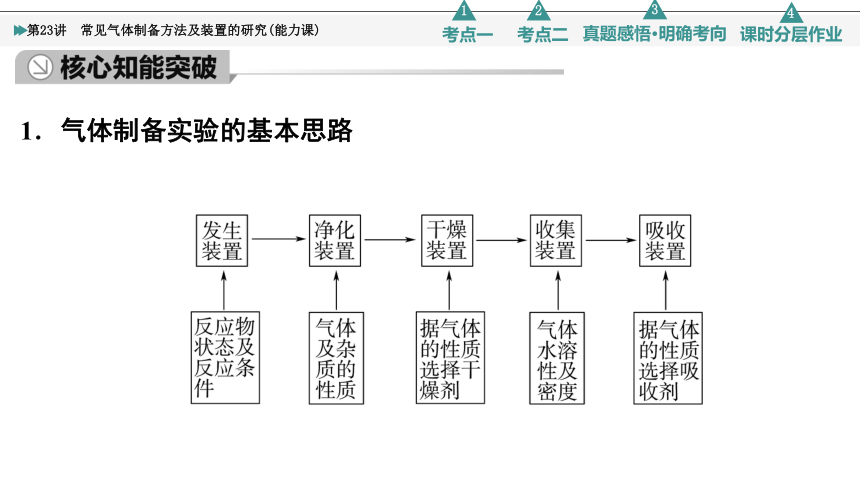
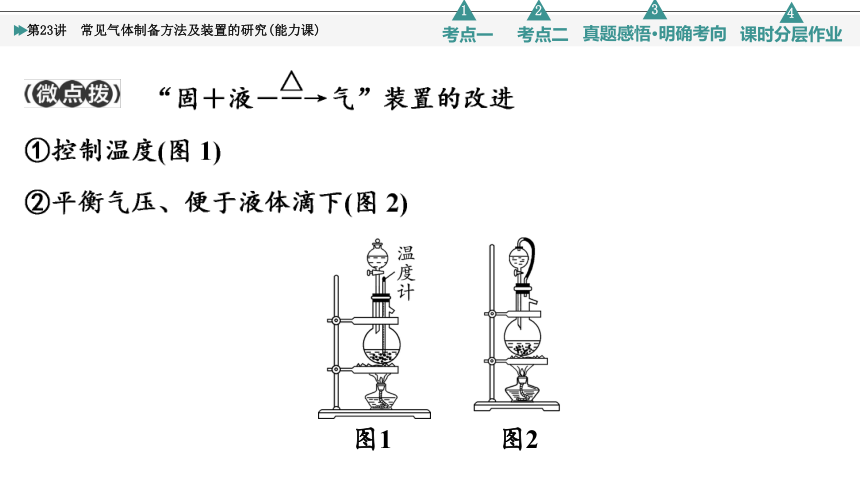
1.气体制备实验的基本思路
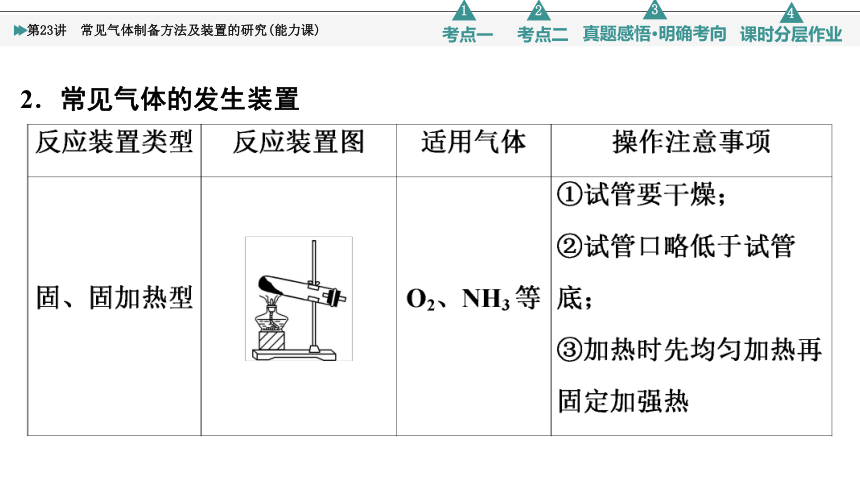
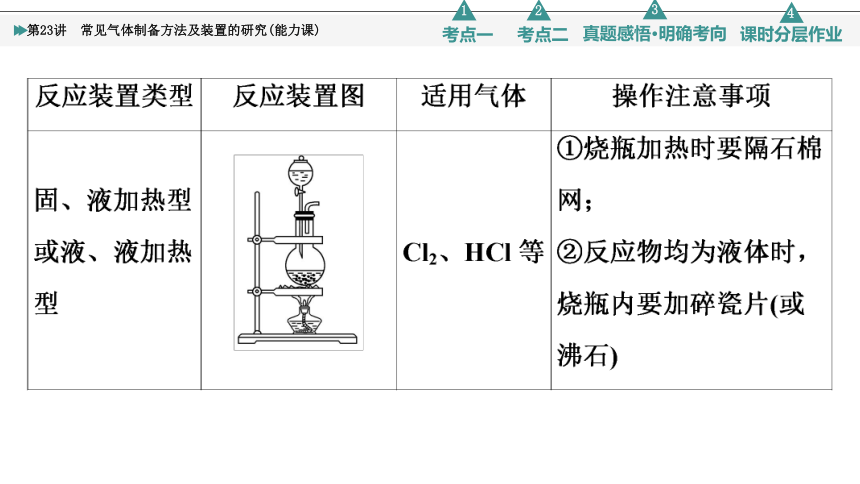
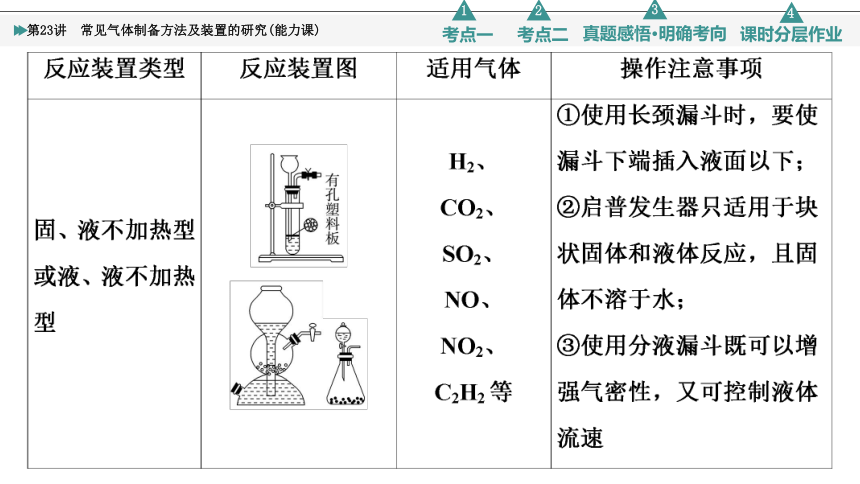
2.常见气体的发生装置
图1 图2
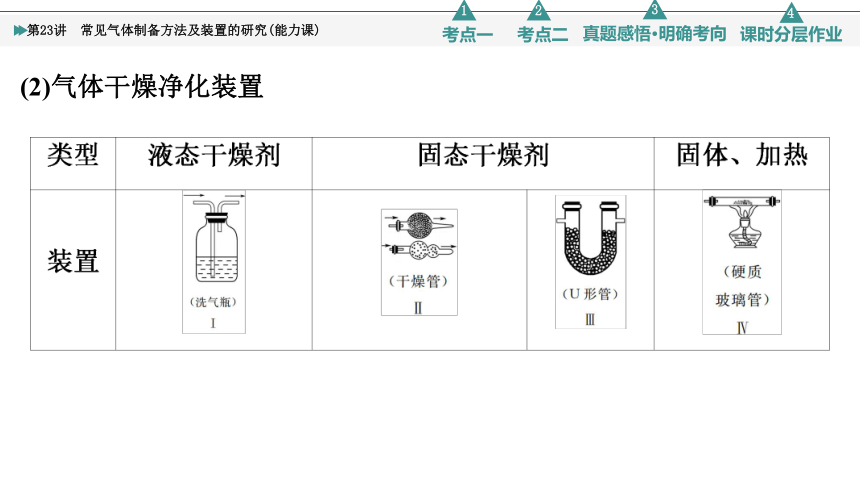
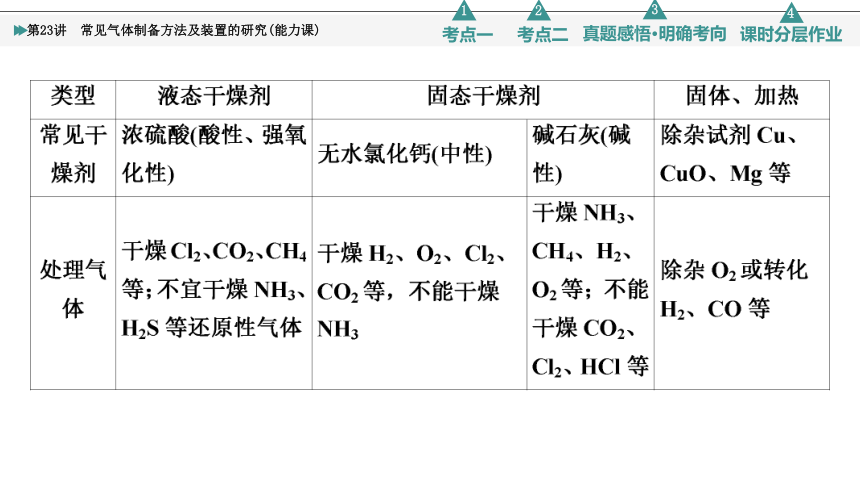
3.常见气体的净化(包含气体的干燥)
(1)除杂(净化)试剂选择:被净化气体和除杂试剂不发生溶解、氧化、还原或其他反应。即①不损失主体气体、②不引入新的杂质气体、③在密闭装置内进行、④先除易除的杂质气体。
(2)气体干燥净化装置
酸性干燥剂(浓硫酸、P2O5):不能干燥NH3等碱性气体;碱性干燥剂(碱石灰、NaOH、CaO):不能干燥SO2、Cl2等酸性气体;中性干燥剂(CaCl2):不能干燥NH3。
4.常见气体的收集方法
(1)排水法:收集难溶于水且不与水反应的气体,如O2、H2、N2、NO、CO、C2H4等。
(2)排液法:收集难溶于所选溶液的气体,如Cl2用排饱和食盐水法收集。
(3)向上排空气法:收集气体密度比空气大且相差较大又不与空气中成分反应的气体,如Cl2、CO2、NO2等。
(4)向下排空气法:收集气体密度比空气小且不与空气中成分反应的气体,如CH4、H2、NH3等。
①“万能收集瓶”的使用
②排液集气收集装置的创新
5.尾气处理的原因、方法及装置
(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。
(2)处理方法:一般使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施处理。
(3)尾气处理装置(Cl2尾气—b,CO、H2尾气—ac)
尾气吸收防倒吸装置
1.下列实验方案最合理的是( )
[答案] B
2.下列气体发生装置,当加入适当的块状固体和液体时不具有随开随关功能的是( )
、
[答案] D
3.水合肼(N2H4·H2O)是重要的氢能源稳定剂,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列装置和操作不能达到实验目的的是( )
A.在装置甲的圆底烧瓶中加入碱石灰制取NH3
B.用装置乙作为反应过程的安全瓶
C.制备水合肼时从装置丙的b口通入NH3
D.用装置丁吸收反应中过量的NH3
C [浓氨水遇碱放出氨气,在装置甲的圆底烧瓶中加入碱石灰可以制取NH3,故A正确;氨气极易溶于水,为防止倒吸,用装置乙作为反应过程的安全瓶,故B正确;氨气密度比空气小,为有利于氨气和NaClO溶液反应,制备水合肼时应从装置丙的a口通入NH3,故C错误;氨气会污染环境,用装置丁可以吸收反应中过量的NH3,并能防止倒吸,故D正确。]
4.下列实验装置或操作正确的是( )
B [氨气会和硫酸反应,所以不能用浓硫酸干燥氨气,A项错误;关闭弹簧夹,捂热烧瓶,若玻璃管中液面上升,则说明气密性良好,B项正确;使用长颈漏斗会导致生成的气体逸出,使测定结果偏小,C项错误;由于电石和饱和食盐水制备乙炔的反应剧烈,放出大量的热,不易控制等原因,不能使用启普发生器制备乙炔,D项错误。]
5.(2022·广州模拟)实验室制取SO2时,下列装置能达到实验目的的是( )
D [铜片与浓硫酸反应制备SO2需要加热,装置中缺少加热装置,A不符合题意;碱石灰为碱性干燥剂,会与SO2反应,不能用于干燥SO2,B不符合题意;SO2的密度比空气大,应使用向上排空气法收集,即从长导管进气,短导管出气,C不符合题意;SO2是酸性气体,可使用NaOH溶液吸收,用倒置的漏斗防止倒吸,D符合题意。]
知识点二 气体制备、性质探究综合实验的仪器连接
02
核心知能突破
关键能力训练
1.“仪器连接顺序”正确思维流程
2.接口连接三个细节
(1)净化装置应“长”进“短”出,如图1。
(2)量气装置应“短”进“长”出,如图2。
(3)干燥管应“粗”进“细”出,如图3。
3.防堵塞安全装置
实验室制取次磷酸钠。将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3,PH3与NaClO溶液反应也可生成次磷酸钠。
(1)利用以下装置制取次磷酸钠,正确的连接顺序是________(用小写字母表示)。
(2)装置C的作用为_______,装置D的作用为_______。
(3)装置B中发生反应的化学方程式为______。
[思路点拨] ①明确实验原理与目的
②明确各装置的可能作用
A.利用PH3与NaClO制NaH2PO2
B.利用P4与NaOH反应制PH3和NaH2PO2
C.防止倒吸或收集瓶
D.吸收尾气且防止倒吸
根据实验原理和目的,进行仪器连接
1.(2022·襄阳模拟)学习小组根据下述各装置制备NaN3。
查阅资料:
Ⅰ.氨基钠(NaNH2)熔点为208 ℃,易潮解和氧化;N2O有强氧化性,不与酸、碱反应;叠氮酸(HN3)不稳定,易分解爆炸。
回答下列问题:
(1)按气流方向,上述装置合理的连接顺序为________________(填仪器接口字母)。
(2)实验时E中生成SnO2·xH2O沉淀,反应的化学方程式为_____。
(3)C处充分反应后,停止加热,需继续进行的操作为_______,其目的为_____。
[解析] (1)由实验目的和原理知,A用于制备N2O,D用于吸收N2O中混有的HNO3和水蒸气,C用于制备NaN3,B用于防止E中水蒸气进入C中干扰实验,E用于尾气处理。则按气流方向,上述装置合理的连接顺序为afg(或gf)debch。
[答案] (1)afg(或gf)debch
(2)SnCl2+N2O+(x+1)H2O===SnO2·xH2O↓+N2+2HCl
(3)继续通入N2O至三颈瓶冷却后,关闭分液漏斗活塞 防止E中液体倒吸入B中
对实验综合连接装置的分析与评价
2.AlCl3是有机反应的重要催化剂。用下列装置制备AlCl3。
已知:实验室在常温下用KMnO4和浓盐酸反应制备Cl2。AlCl3易潮解,升华温度为178 ℃。
(1)图中明显错误的有________(填字母标号),修改后,进行实验。
a.1处 b.2处
c.3处 d.4处
(2)装置A中发生反应的离子方程式为_______。
(3)装置B的作用是_______。
若装置F中没有气体逸出,可能生成________种盐(填数字)。
[解析] (1)氯化铝易凝华,导出氯化铝的导管太细,易堵塞导管;氯化铝易潮解,装置F中饱和纯碱溶液中水易挥发进入装置E,使产品变质,共2处错误。(2)高锰酸钾与浓盐酸反应生成氯化钾、二氯化锰、氯气和水。(3)饱和食盐水用于除去氯气中少量氯化氢,否则氯化氢与铝反应生成氢气,氢气与氯气混合受热易发生事故。没有气体逸出,说明氯气与碳酸钠溶液反应,没有二氧化碳产生,即发生反应为2Na2CO3+Cl2+H2O===NaCl+2NaHCO3+NaClO,生成3种盐。
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·北京等级考,T10)利用如图所示装置(夹持装置略)进行实验,b中现象不能证明a中产物生成的是( )
1
3
2
1
3
2
a中反应 b中检测试剂及现象
A 浓HNO3分解生成NO2 淀粉 KI溶液变蓝
B Cu与浓H2SO4生成SO2 品红溶液褪色
C 浓NaOH与NH4Cl溶液生成NH3 酚酞溶液变红
D CH3CHBrCH3与NaOH乙醇溶液生成丙烯 溴水褪色
A [浓硝酸具有挥发性,挥发出的硝酸也能与碘化钾溶液反应生成遇淀粉溶液变蓝色的碘,则淀粉碘化钾溶液变蓝色不能说明浓硝酸分解生成二氧化氮,故A符合题意。]
1
3
2
2.(2021·全国乙卷,T8)在实验室采用如图装置制备气体,合理的是( )
1
3
2
选项 化学试剂 制备的气体
A Ca(OH)2+NH4Cl NH3
B MnO2+HCl(浓) Cl2
C MnO2+KClO3 O2
D NaCl+H2SO4(浓) HCl
C [氨气的密度小于空气,收集氨气需要用向下排空气法收集,A不合理;由题给装置图可知,该实验装置可用于固固加热型反应,而浓盐酸是液体,所以不能用该装置制备Cl2,B不合理;KClO3受热分解制备氧气属于固固加热型,且氧气密度大于空气,可用向上排空气法收集,C合理;浓硫酸是液体,所以不能用该装置制备HCl,D不合理。]
1
3
2
3.(2021·浙江7月选考)用下图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中做供氧剂。
1
3
2
请回答:
(1)装置A中盛放稀盐酸的仪器名称是______________。
(2)装置B的作用是_______。
(3)装置C中过氧化钠与二氧化碳反应的化学方程式是_______。
(4)装置D中盛放的试剂是______。
(5)当装置内气流平稳后开始用试管收集气体,该气体能______,
证明过氧化钠可做供氧剂。
1
3
2
[答案] (1)分液漏斗(或滴液漏斗) (2)除去CO2中的HCl (3)2Na2O2+2CO2===2Na2CO3+O2 (4)NaOH溶液 (5)使带火星的木条复燃
1
3
2
已知:①ClO2是一种易溶于水而难溶于有机溶剂的黄绿色气体,沸点为10.0 ℃,氧化性比氯气强;
②ClO2极易爆炸分解,若用空气、二氧化碳、氮气等气体稀释时,爆炸性降低;
③在干燥空气稀释条件下,可用干燥的氯气与亚氯酸钠(NaClO2)固体反应制备二氧化氯。
某化学课题小组在实验室用以下装置制备和收集ClO2。
(1)制备和收集ClO2时导管口的连接顺序为_________________。
(2)装置A中导管k的作用为_______。
(3)装置B中盛装NaClO2固体的仪器名称为______________;装置B中反应的化学方程式为_______。
(4)通入干燥空气的作用是______。
[解析] (1)由实验装置图可知,装置A中二氧化锰和浓盐酸共热制备氯气,氯气中混有挥发出的氯化氢气体,装置D中盛有的饱和食盐水能除去氯气中混有的氯化氢,装置C中盛有浓硫酸可用于干燥氯气,装置B中氯气与亚氯酸钠固体反应制备二氧化氯,装置E中碱石灰用于吸收尾气,防止污染环境,故导管口的连接顺序为a→d→e→c→b→m→n(或n→m)→g。
(2)装置A用于制取Cl2,为了防止因反应过于剧烈、烧瓶内压强增大使液体无法滴下,用导管k将分液漏斗与烧瓶连通,平衡体系的压强,确保浓盐酸能顺利滴下。
[答案] (1)a→d→e→c→b→m→n(或n→m)→g (2)平衡气压,使液体顺利滴下 (3)三颈烧瓶(三口烧瓶) Cl2+2NaClO2===2ClO2+2NaCl
(4)降低二氧化氯的浓度,减少其爆炸的可能性
谢谢观看 THANK YOU!
第23讲 常见气体制备方法及装置的研究(能力课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.掌握常见气体的制备原理、发生装置、净化装置、收集装置和尾气处理装置。 2.根据实验目的,灵活掌握仪器的组装和连接。 3.气体制备与性质探究实验装置分析与评价。
考点一 氯及其重要化合物
核心知能突破
关键能力训练
01
1.气体制备实验的基本思路
2.常见气体的发生装置
图1 图2
3.常见气体的净化(包含气体的干燥)
(1)除杂(净化)试剂选择:被净化气体和除杂试剂不发生溶解、氧化、还原或其他反应。即①不损失主体气体、②不引入新的杂质气体、③在密闭装置内进行、④先除易除的杂质气体。
(2)气体干燥净化装置
酸性干燥剂(浓硫酸、P2O5):不能干燥NH3等碱性气体;碱性干燥剂(碱石灰、NaOH、CaO):不能干燥SO2、Cl2等酸性气体;中性干燥剂(CaCl2):不能干燥NH3。
4.常见气体的收集方法
(1)排水法:收集难溶于水且不与水反应的气体,如O2、H2、N2、NO、CO、C2H4等。
(2)排液法:收集难溶于所选溶液的气体,如Cl2用排饱和食盐水法收集。
(3)向上排空气法:收集气体密度比空气大且相差较大又不与空气中成分反应的气体,如Cl2、CO2、NO2等。
(4)向下排空气法:收集气体密度比空气小且不与空气中成分反应的气体,如CH4、H2、NH3等。
①“万能收集瓶”的使用
②排液集气收集装置的创新
5.尾气处理的原因、方法及装置
(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。
(2)处理方法:一般使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施处理。
(3)尾气处理装置(Cl2尾气—b,CO、H2尾气—ac)
尾气吸收防倒吸装置
1.下列实验方案最合理的是( )
[答案] B
2.下列气体发生装置,当加入适当的块状固体和液体时不具有随开随关功能的是( )
、
[答案] D
3.水合肼(N2H4·H2O)是重要的氢能源稳定剂,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列装置和操作不能达到实验目的的是( )
A.在装置甲的圆底烧瓶中加入碱石灰制取NH3
B.用装置乙作为反应过程的安全瓶
C.制备水合肼时从装置丙的b口通入NH3
D.用装置丁吸收反应中过量的NH3
C [浓氨水遇碱放出氨气,在装置甲的圆底烧瓶中加入碱石灰可以制取NH3,故A正确;氨气极易溶于水,为防止倒吸,用装置乙作为反应过程的安全瓶,故B正确;氨气密度比空气小,为有利于氨气和NaClO溶液反应,制备水合肼时应从装置丙的a口通入NH3,故C错误;氨气会污染环境,用装置丁可以吸收反应中过量的NH3,并能防止倒吸,故D正确。]
4.下列实验装置或操作正确的是( )
B [氨气会和硫酸反应,所以不能用浓硫酸干燥氨气,A项错误;关闭弹簧夹,捂热烧瓶,若玻璃管中液面上升,则说明气密性良好,B项正确;使用长颈漏斗会导致生成的气体逸出,使测定结果偏小,C项错误;由于电石和饱和食盐水制备乙炔的反应剧烈,放出大量的热,不易控制等原因,不能使用启普发生器制备乙炔,D项错误。]
5.(2022·广州模拟)实验室制取SO2时,下列装置能达到实验目的的是( )
D [铜片与浓硫酸反应制备SO2需要加热,装置中缺少加热装置,A不符合题意;碱石灰为碱性干燥剂,会与SO2反应,不能用于干燥SO2,B不符合题意;SO2的密度比空气大,应使用向上排空气法收集,即从长导管进气,短导管出气,C不符合题意;SO2是酸性气体,可使用NaOH溶液吸收,用倒置的漏斗防止倒吸,D符合题意。]
知识点二 气体制备、性质探究综合实验的仪器连接
02
核心知能突破
关键能力训练
1.“仪器连接顺序”正确思维流程
2.接口连接三个细节
(1)净化装置应“长”进“短”出,如图1。
(2)量气装置应“短”进“长”出,如图2。
(3)干燥管应“粗”进“细”出,如图3。
3.防堵塞安全装置
实验室制取次磷酸钠。将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3,PH3与NaClO溶液反应也可生成次磷酸钠。
(1)利用以下装置制取次磷酸钠,正确的连接顺序是________(用小写字母表示)。
(2)装置C的作用为_______,装置D的作用为_______。
(3)装置B中发生反应的化学方程式为______。
[思路点拨] ①明确实验原理与目的
②明确各装置的可能作用
A.利用PH3与NaClO制NaH2PO2
B.利用P4与NaOH反应制PH3和NaH2PO2
C.防止倒吸或收集瓶
D.吸收尾气且防止倒吸
根据实验原理和目的,进行仪器连接
1.(2022·襄阳模拟)学习小组根据下述各装置制备NaN3。
查阅资料:
Ⅰ.氨基钠(NaNH2)熔点为208 ℃,易潮解和氧化;N2O有强氧化性,不与酸、碱反应;叠氮酸(HN3)不稳定,易分解爆炸。
回答下列问题:
(1)按气流方向,上述装置合理的连接顺序为________________(填仪器接口字母)。
(2)实验时E中生成SnO2·xH2O沉淀,反应的化学方程式为_____。
(3)C处充分反应后,停止加热,需继续进行的操作为_______,其目的为_____。
[解析] (1)由实验目的和原理知,A用于制备N2O,D用于吸收N2O中混有的HNO3和水蒸气,C用于制备NaN3,B用于防止E中水蒸气进入C中干扰实验,E用于尾气处理。则按气流方向,上述装置合理的连接顺序为afg(或gf)debch。
[答案] (1)afg(或gf)debch
(2)SnCl2+N2O+(x+1)H2O===SnO2·xH2O↓+N2+2HCl
(3)继续通入N2O至三颈瓶冷却后,关闭分液漏斗活塞 防止E中液体倒吸入B中
对实验综合连接装置的分析与评价
2.AlCl3是有机反应的重要催化剂。用下列装置制备AlCl3。
已知:实验室在常温下用KMnO4和浓盐酸反应制备Cl2。AlCl3易潮解,升华温度为178 ℃。
(1)图中明显错误的有________(填字母标号),修改后,进行实验。
a.1处 b.2处
c.3处 d.4处
(2)装置A中发生反应的离子方程式为_______。
(3)装置B的作用是_______。
若装置F中没有气体逸出,可能生成________种盐(填数字)。
[解析] (1)氯化铝易凝华,导出氯化铝的导管太细,易堵塞导管;氯化铝易潮解,装置F中饱和纯碱溶液中水易挥发进入装置E,使产品变质,共2处错误。(2)高锰酸钾与浓盐酸反应生成氯化钾、二氯化锰、氯气和水。(3)饱和食盐水用于除去氯气中少量氯化氢,否则氯化氢与铝反应生成氢气,氢气与氯气混合受热易发生事故。没有气体逸出,说明氯气与碳酸钠溶液反应,没有二氧化碳产生,即发生反应为2Na2CO3+Cl2+H2O===NaCl+2NaHCO3+NaClO,生成3种盐。
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·北京等级考,T10)利用如图所示装置(夹持装置略)进行实验,b中现象不能证明a中产物生成的是( )
1
3
2
1
3
2
a中反应 b中检测试剂及现象
A 浓HNO3分解生成NO2 淀粉 KI溶液变蓝
B Cu与浓H2SO4生成SO2 品红溶液褪色
C 浓NaOH与NH4Cl溶液生成NH3 酚酞溶液变红
D CH3CHBrCH3与NaOH乙醇溶液生成丙烯 溴水褪色
A [浓硝酸具有挥发性,挥发出的硝酸也能与碘化钾溶液反应生成遇淀粉溶液变蓝色的碘,则淀粉碘化钾溶液变蓝色不能说明浓硝酸分解生成二氧化氮,故A符合题意。]
1
3
2
2.(2021·全国乙卷,T8)在实验室采用如图装置制备气体,合理的是( )
1
3
2
选项 化学试剂 制备的气体
A Ca(OH)2+NH4Cl NH3
B MnO2+HCl(浓) Cl2
C MnO2+KClO3 O2
D NaCl+H2SO4(浓) HCl
C [氨气的密度小于空气,收集氨气需要用向下排空气法收集,A不合理;由题给装置图可知,该实验装置可用于固固加热型反应,而浓盐酸是液体,所以不能用该装置制备Cl2,B不合理;KClO3受热分解制备氧气属于固固加热型,且氧气密度大于空气,可用向上排空气法收集,C合理;浓硫酸是液体,所以不能用该装置制备HCl,D不合理。]
1
3
2
3.(2021·浙江7月选考)用下图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中做供氧剂。
1
3
2
请回答:
(1)装置A中盛放稀盐酸的仪器名称是______________。
(2)装置B的作用是_______。
(3)装置C中过氧化钠与二氧化碳反应的化学方程式是_______。
(4)装置D中盛放的试剂是______。
(5)当装置内气流平稳后开始用试管收集气体,该气体能______,
证明过氧化钠可做供氧剂。
1
3
2
[答案] (1)分液漏斗(或滴液漏斗) (2)除去CO2中的HCl (3)2Na2O2+2CO2===2Na2CO3+O2 (4)NaOH溶液 (5)使带火星的木条复燃
1
3
2
已知:①ClO2是一种易溶于水而难溶于有机溶剂的黄绿色气体,沸点为10.0 ℃,氧化性比氯气强;
②ClO2极易爆炸分解,若用空气、二氧化碳、氮气等气体稀释时,爆炸性降低;
③在干燥空气稀释条件下,可用干燥的氯气与亚氯酸钠(NaClO2)固体反应制备二氧化氯。
某化学课题小组在实验室用以下装置制备和收集ClO2。
(1)制备和收集ClO2时导管口的连接顺序为_________________。
(2)装置A中导管k的作用为_______。
(3)装置B中盛装NaClO2固体的仪器名称为______________;装置B中反应的化学方程式为_______。
(4)通入干燥空气的作用是______。
[解析] (1)由实验装置图可知,装置A中二氧化锰和浓盐酸共热制备氯气,氯气中混有挥发出的氯化氢气体,装置D中盛有的饱和食盐水能除去氯气中混有的氯化氢,装置C中盛有浓硫酸可用于干燥氯气,装置B中氯气与亚氯酸钠固体反应制备二氧化氯,装置E中碱石灰用于吸收尾气,防止污染环境,故导管口的连接顺序为a→d→e→c→b→m→n(或n→m)→g。
(2)装置A用于制取Cl2,为了防止因反应过于剧烈、烧瓶内压强增大使液体无法滴下,用导管k将分液漏斗与烧瓶连通,平衡体系的压强,确保浓盐酸能顺利滴下。
[答案] (1)a→d→e→c→b→m→n(或n→m)→g (2)平衡气压,使液体顺利滴下 (3)三颈烧瓶(三口烧瓶) Cl2+2NaClO2===2ClO2+2NaCl
(4)降低二氧化氯的浓度,减少其爆炸的可能性
谢谢观看 THANK YOU!
同课章节目录
