第16讲 氯及其化合物(基础课) 课件(49张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第16讲 氯及其化合物(基础课) 课件(49张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 19:30:45 | ||
图片预览











文档简介
(共49张PPT)
第16讲 氯及其化合物(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.了解氯及其重要化合物的性质、制备及应用。 2.掌握Cl2的实验室制法(包括所用试剂、原理、仪器和收集等)。 3.了解氯水的成分及其性质多重性。
知识点一 氯及其重要化合物
必备知识梳理
关键能力训练
01
一、氯气的性质及应用
1.物理性质
颜色 气味 毒性 密度 特性
______色 ________气味 ____毒 比空气____ ____液化
黄绿
刺激性
有
大
易
2.化学性质
(1)与金属、非金属单质反应——表现______性
氧化
①Cl2具有强氧化性,与变价金属反应时均生成高价态的金属氯化物,如FeCl2不能由两种相应的单质化合而成。
②纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,反应生成的气体是HCl,它在空气中与水蒸气结合呈白雾状;若加热或光照H2、Cl2的混合气体,会发生爆炸。
(2)与还原性化合物反应(写化学方程式或离子方程式)
2KI+Cl2===I2+2KCl
Cl2+SO2+2H2O===H2SO4+
2HCl
(3)Cl2参与的歧化反应——既作氧化剂又作还原剂
①与水反应——在25 ℃时,1体积的水可溶解约2体积的Cl2,但溶于水中的部分Cl2与水发生反应,其离子方程式为______________________
_________。
②与碱反应——制漂白剂(同时也是消毒剂)
a.制漂白液(有效成分NaClO)的离子方程式为_____________________
_____________。
b.制漂白粉[有效成分Ca(ClO)2]的化学方程式为___________________
____________________________。
Cl2+2OH-===Cl-+
ClO-+H2O
2Ca(OH)2+2Cl2
===CaCl2+Ca(ClO)2+2H2O
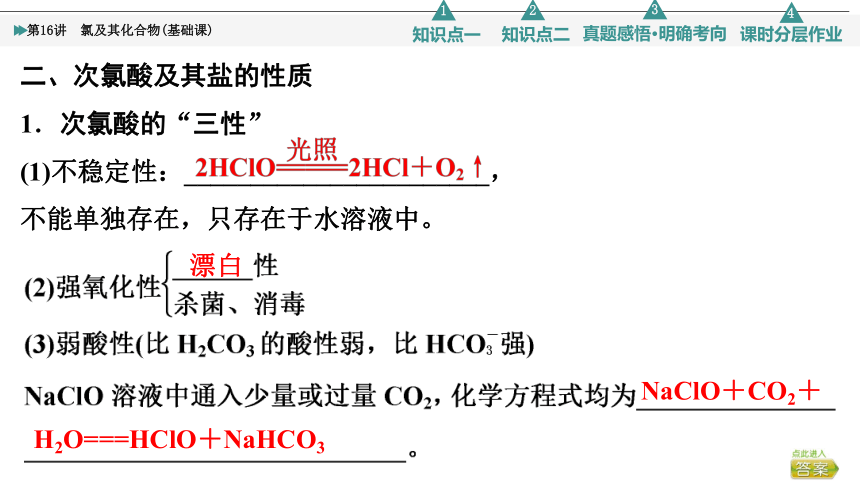
二、次氯酸及其盐的性质
1.次氯酸的“三性”
(1)不稳定性:_______________________,
不能单独存在,只存在于水溶液中。
漂白
NaClO+CO2+
H2O===HClO+NaHCO3
2.次氯酸盐的主要性质
(1)次氯酸盐[Ca(ClO)2、NaClO]的水溶液呈碱性,水解离子方程式为____________________________。
(2)与酸性物质作用生成具有强氧化性的________,作______剂和______剂。
次氯酸
消毒
漂白
Ca(ClO)2+CO2+H2O===CaCO3↓
+2HClO
①新制氯水应保存在棕色试剂瓶中并置于阴凉处。久置氯水变为稀盐酸,酸性变强。
②次氯酸盐的漂白原理是与物质反应生成强氧化性的HClO。
1.判断正误(正确的打“√”,错误的打“×”)
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2。( )
(2)氯气溶于水溶液呈酸性且可以导电,所以氯气是电解质。( )
(3)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5NA。( )
(4)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气。( )
(5)Cl2与任何物质反应时,Cl2只作氧化剂。( )
(6)工业制取漂白粉时可将Cl2通入石灰水中。( )
[答案] (1)× (2)× (3)× (4)√ (5)× (6)×
2.写出下列反应的离子方程式。
(1)Cl2通入H2S的水溶液中:____。
(2)Cl2通入Na2SO3溶液中:_____。
(3)Ca(ClO)2溶液中通入过量CO2:______。
[答案] (1)Cl2+H2S===S↓+2Cl-+2H+
(2)Cl2+SO+H2O===SO+2Cl-+2H+
(3)ClO-+CO2+H2O===HClO+HCO
1.下列有关氯及其化合物叙述错误的是( )
A.Cl2与非金属、金属化合时均表现氧化性
B.大量氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑
C.AlCl3、FeCl2、FeCl3均可通过化合反应制得
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D [FeCl2溶液中加氯水,主要是Cl2与Fe2+反应生成Fe3+,D错误。]
2.如图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。已知:2KMnO4+16HCl(浓)===2KCl+5Cl2↑+2MnCl2+8H2O。
向KMnO4晶体上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
下列有关说法正确的是 ( )
A.a处变蓝、b处变棕红,说明非金属性:Cl>Br>I
B.c处先变红后褪色,说明Cl2与H2O反应生成HCl
C.d处立即褪色,说明Cl2与H2O反应生成HClO
D.e处变红,说明Cl2与Fe2+反应生成Fe3+
D [Cl2分别与KI、NaBr作用生成I2、Br2,a处变蓝、b处变棕红,可证明氧化性:Cl2>I2、Cl2>Br2,无法证明I2与Br2氧化性的强弱,则无法证明非金属性:Cl>Br>I,A项错误;氯气与水发生反应Cl2+H2O H++Cl-+HClO,H+使试纸变红,HClO具有漂白性,可使试纸褪色,则c处先变红后褪色,能证明氯气与水反应生成了酸性物质和漂白性物质,B项错误;Cl2和氢氧化钠反应生成氯化钠、次氯酸钠和水,消耗了氢氧化钠,红色褪去,不能证明生成物是HClO,C项错误;Cl2将Fe2+氧化为Fe3+,试纸变为红色,D项正确。]
3.某研究性学习小组利用下列装置制备漂白粉,下列说法不正确的是( )
A.装置④中的X试剂为NaOH溶液
B.装置②中饱和食盐水的作用是除去Cl2中的HCl
C.装置③中的石灰乳可以用石灰水代替
D.制备漂白粉的反应是放热反应,温度较高时有副反应发生,可以将装置③放在冷水中
C [NaOH溶液用来吸收氯气,A项正确;饱和食盐水的作用是除去Cl2中的HCl,B项正确;由于石灰水中氢氧化钙的溶解度小,所以制备漂白粉时,用氯气和石灰乳反应,C项错误;制备漂白粉的反应是放热反应,将装置③放在冷水中可以减少副反应发生,D项正确。]
4.(1)“84”消毒液与75%酒精溶液的大量使用,在一定程度上抑制了某些病毒的扩散。“84”消毒液的有效成分是____________,能否与酒精溶液混合使用_____ (选填“能”或“否”),理由是________。
(2)漂白粉或漂粉精在购买时应注意的问题是______;理由是_______。
[答案] (1)NaClO 否 NaClO具有强氧化性,可以氧化酒精,同时可能生成Cl2 (2)生产日期、密封程度、是否结块等 漂白粉或漂粉精的有效成分为Ca(ClO)2,Ca(ClO)2在空气中易形成CaCO3和HClO,同时HClO光照射又易分解
知识点二 氯气的实验室制法及性质探究
02
必备知识梳理
关键能力训练
1.Cl2的实验室制法
(1)实验装置:
(2)反应原理:(写出上述制Cl2的化学方程式)
______________________________________________________。
(4)净化装置:
①除去Cl2中的HCl用饱和食盐水的原理是_________________________
_________________________;
②干燥Cl2可以用浓硫酸,也可以用P2O5或CaCl2,用P2O5或CaCl2时可用的仪器名称为________________。
(5)收集装置:Cl2可用向____排空气法,也可以用排____________法。
增大c(Cl-),减少Cl2与H2O
反应,即减少Cl2的溶解
干燥管或U形管
上
饱和食盐水
(6)尾气处理:Cl2有毒,一般用_________溶液吸收,其反应的离子方程式为________________________________。
一般不用澄清石灰水的理由是___________________________________
_______________。
(7)验满方法:将湿润的淀粉 KI试纸靠近盛Cl2的试剂瓶口,观察到试纸立即变____,则证明已集满;或将湿润的______________靠近盛Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
NaOH
Cl2+2OH-===Cl-+ClO-+H2O
Ca(OH)2微溶,Ca(OH)2的浓度较小,
吸收Cl2不完全
蓝
蓝色石蕊试纸
①用KMnO4、K2Cr2O7、KClO3、次氯酸盐等与浓盐酸在不加热的条件下可以制取Cl2。当浓盐酸反应变为稀盐酸时,反应停止。无论氧化剂KMnO4等是否过量,盐酸永远有剩余。
②洗气瓶除杂时从长管进短管出;干燥管除杂时从粗口进,细口出;U形管、玻璃管除杂无前后。
2.Cl2性质及应用探究模型
净化气体→干燥→干燥有色布条→湿润有色布条→FeCl2、KBr、NaI等溶液→干燥→Fe加热→隔离→尾气处理
①为了防止G中溶液倒吸,可在F、G之间连一个安全瓶。
②如果F中生成易水解或易潮解的氯化物,则F装置前后要有干燥装置。
判断正误(正确的打“√”,错误的打“×”)
(1)(2022·全国甲卷)漂白粉与盐酸可混合使用以提高消毒效果。( )
(2)(2022·浙江1月选考)足量的浓盐酸与8.7 g MnO2反应,转移电子的数目为0.4NA(设NA为阿伏加德罗常数的值)。( )
(3)(2021·湖南选择性考试)净化实验室制备的Cl2,可将气体依次通过盛有饱和NaCl溶液、浓H2SO4的洗气瓶。( )
(4)可用石灰乳吸收反应产生的Cl2制备漂白粉。( )
(5)用MnO2和浓盐酸制取Cl2的反应中,氧化剂与还原剂的物质的量之比为1∶4。( )
[答案] (1)× (2)× (3)√ (4)√ (5)×
1.四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是 ( )
A.②中应盛装浓H2SO4
B.冷凝管有冷凝、回流和导气的作用
C.③中的反应中,TiO2是氧化剂,炭粉是还原剂
D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置
C [已知四氯化钛极易水解,遇空气中的水蒸气即产生“白烟”,而制得的氯气中混有水蒸气,所以②中应盛装浓硫酸,故A正确;TiCl4的熔、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,故B正确;反应过程中钛的化合价不变,C项错误;因四氯化钛极易水解,所以应在装置④和⑤之间增加一个防止水蒸气进入④的装置,故D正确。]
2.三氯化碘(ICl3)在药物合成中用途非常广泛。已知ICl3的熔点为33 ℃,沸点为73 ℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
请回答下列问题:
(1)按照气流方向连接接口顺序为a→_______。
装置A中导管m的作用是________。
(2)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞,C中的现象为______________。
(3)氯气与单质碘需在温度稍低于70 ℃下反应,则装置E适宜的加热方式为_______。装置E中发生反应的化学方程式: ______________。
(4)该装置存在的明显缺陷是_________________________。
[答案] (1)d→e→b→c→g→h→f(接口b与c、g与h可互换) 使浓盐酸顺利滴下 (2)锥形瓶中液面下降,长颈漏斗中液面上升
有关实验装置或装置试剂作用的答题模板
真题感悟·明确考向
03
1.(2022·广东选择性考试,T8)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
D [氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,D装置不能达到实验目的。]
序号 物质a C中实验现象 通入Cl2前 通入Cl2后
Ⅰ 水 得到无色溶液 产生棕黑色沉淀,且放置后不发生变化
Ⅱ 5% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
Ⅲ 40% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)B中试剂是________。
(2)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为__________。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_______。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____,溶液绿色缓慢加深,原因是MnO2被________(填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③取Ⅱ中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是_____________(写离子方程式)。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:______。
[解析] 在装置A中HCl与KMnO4发生反应制取Cl2,由于盐酸具有挥发性,为排除HCl对Cl2性质的干扰,在装置B中盛有饱和NaCl溶液,除去Cl2中的杂质HCl,在装置C中通过改变溶液的pH,验证不同条件下Cl2与MnSO4反应,装置D是尾气处理装置,目的是除去多余Cl2,防止造成大气污染。
谢谢观看 THANK YOU!
第16讲 氯及其化合物(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.了解氯及其重要化合物的性质、制备及应用。 2.掌握Cl2的实验室制法(包括所用试剂、原理、仪器和收集等)。 3.了解氯水的成分及其性质多重性。
知识点一 氯及其重要化合物
必备知识梳理
关键能力训练
01
一、氯气的性质及应用
1.物理性质
颜色 气味 毒性 密度 特性
______色 ________气味 ____毒 比空气____ ____液化
黄绿
刺激性
有
大
易
2.化学性质
(1)与金属、非金属单质反应——表现______性
氧化
①Cl2具有强氧化性,与变价金属反应时均生成高价态的金属氯化物,如FeCl2不能由两种相应的单质化合而成。
②纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,反应生成的气体是HCl,它在空气中与水蒸气结合呈白雾状;若加热或光照H2、Cl2的混合气体,会发生爆炸。
(2)与还原性化合物反应(写化学方程式或离子方程式)
2KI+Cl2===I2+2KCl
Cl2+SO2+2H2O===H2SO4+
2HCl
(3)Cl2参与的歧化反应——既作氧化剂又作还原剂
①与水反应——在25 ℃时,1体积的水可溶解约2体积的Cl2,但溶于水中的部分Cl2与水发生反应,其离子方程式为______________________
_________。
②与碱反应——制漂白剂(同时也是消毒剂)
a.制漂白液(有效成分NaClO)的离子方程式为_____________________
_____________。
b.制漂白粉[有效成分Ca(ClO)2]的化学方程式为___________________
____________________________。
Cl2+2OH-===Cl-+
ClO-+H2O
2Ca(OH)2+2Cl2
===CaCl2+Ca(ClO)2+2H2O
二、次氯酸及其盐的性质
1.次氯酸的“三性”
(1)不稳定性:_______________________,
不能单独存在,只存在于水溶液中。
漂白
NaClO+CO2+
H2O===HClO+NaHCO3
2.次氯酸盐的主要性质
(1)次氯酸盐[Ca(ClO)2、NaClO]的水溶液呈碱性,水解离子方程式为____________________________。
(2)与酸性物质作用生成具有强氧化性的________,作______剂和______剂。
次氯酸
消毒
漂白
Ca(ClO)2+CO2+H2O===CaCO3↓
+2HClO
①新制氯水应保存在棕色试剂瓶中并置于阴凉处。久置氯水变为稀盐酸,酸性变强。
②次氯酸盐的漂白原理是与物质反应生成强氧化性的HClO。
1.判断正误(正确的打“√”,错误的打“×”)
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2。( )
(2)氯气溶于水溶液呈酸性且可以导电,所以氯气是电解质。( )
(3)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5NA。( )
(4)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气。( )
(5)Cl2与任何物质反应时,Cl2只作氧化剂。( )
(6)工业制取漂白粉时可将Cl2通入石灰水中。( )
[答案] (1)× (2)× (3)× (4)√ (5)× (6)×
2.写出下列反应的离子方程式。
(1)Cl2通入H2S的水溶液中:____。
(2)Cl2通入Na2SO3溶液中:_____。
(3)Ca(ClO)2溶液中通入过量CO2:______。
[答案] (1)Cl2+H2S===S↓+2Cl-+2H+
(2)Cl2+SO+H2O===SO+2Cl-+2H+
(3)ClO-+CO2+H2O===HClO+HCO
1.下列有关氯及其化合物叙述错误的是( )
A.Cl2与非金属、金属化合时均表现氧化性
B.大量氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑
C.AlCl3、FeCl2、FeCl3均可通过化合反应制得
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D [FeCl2溶液中加氯水,主要是Cl2与Fe2+反应生成Fe3+,D错误。]
2.如图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。已知:2KMnO4+16HCl(浓)===2KCl+5Cl2↑+2MnCl2+8H2O。
向KMnO4晶体上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
下列有关说法正确的是 ( )
A.a处变蓝、b处变棕红,说明非金属性:Cl>Br>I
B.c处先变红后褪色,说明Cl2与H2O反应生成HCl
C.d处立即褪色,说明Cl2与H2O反应生成HClO
D.e处变红,说明Cl2与Fe2+反应生成Fe3+
D [Cl2分别与KI、NaBr作用生成I2、Br2,a处变蓝、b处变棕红,可证明氧化性:Cl2>I2、Cl2>Br2,无法证明I2与Br2氧化性的强弱,则无法证明非金属性:Cl>Br>I,A项错误;氯气与水发生反应Cl2+H2O H++Cl-+HClO,H+使试纸变红,HClO具有漂白性,可使试纸褪色,则c处先变红后褪色,能证明氯气与水反应生成了酸性物质和漂白性物质,B项错误;Cl2和氢氧化钠反应生成氯化钠、次氯酸钠和水,消耗了氢氧化钠,红色褪去,不能证明生成物是HClO,C项错误;Cl2将Fe2+氧化为Fe3+,试纸变为红色,D项正确。]
3.某研究性学习小组利用下列装置制备漂白粉,下列说法不正确的是( )
A.装置④中的X试剂为NaOH溶液
B.装置②中饱和食盐水的作用是除去Cl2中的HCl
C.装置③中的石灰乳可以用石灰水代替
D.制备漂白粉的反应是放热反应,温度较高时有副反应发生,可以将装置③放在冷水中
C [NaOH溶液用来吸收氯气,A项正确;饱和食盐水的作用是除去Cl2中的HCl,B项正确;由于石灰水中氢氧化钙的溶解度小,所以制备漂白粉时,用氯气和石灰乳反应,C项错误;制备漂白粉的反应是放热反应,将装置③放在冷水中可以减少副反应发生,D项正确。]
4.(1)“84”消毒液与75%酒精溶液的大量使用,在一定程度上抑制了某些病毒的扩散。“84”消毒液的有效成分是____________,能否与酒精溶液混合使用_____ (选填“能”或“否”),理由是________。
(2)漂白粉或漂粉精在购买时应注意的问题是______;理由是_______。
[答案] (1)NaClO 否 NaClO具有强氧化性,可以氧化酒精,同时可能生成Cl2 (2)生产日期、密封程度、是否结块等 漂白粉或漂粉精的有效成分为Ca(ClO)2,Ca(ClO)2在空气中易形成CaCO3和HClO,同时HClO光照射又易分解
知识点二 氯气的实验室制法及性质探究
02
必备知识梳理
关键能力训练
1.Cl2的实验室制法
(1)实验装置:
(2)反应原理:(写出上述制Cl2的化学方程式)
______________________________________________________。
(4)净化装置:
①除去Cl2中的HCl用饱和食盐水的原理是_________________________
_________________________;
②干燥Cl2可以用浓硫酸,也可以用P2O5或CaCl2,用P2O5或CaCl2时可用的仪器名称为________________。
(5)收集装置:Cl2可用向____排空气法,也可以用排____________法。
增大c(Cl-),减少Cl2与H2O
反应,即减少Cl2的溶解
干燥管或U形管
上
饱和食盐水
(6)尾气处理:Cl2有毒,一般用_________溶液吸收,其反应的离子方程式为________________________________。
一般不用澄清石灰水的理由是___________________________________
_______________。
(7)验满方法:将湿润的淀粉 KI试纸靠近盛Cl2的试剂瓶口,观察到试纸立即变____,则证明已集满;或将湿润的______________靠近盛Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
NaOH
Cl2+2OH-===Cl-+ClO-+H2O
Ca(OH)2微溶,Ca(OH)2的浓度较小,
吸收Cl2不完全
蓝
蓝色石蕊试纸
①用KMnO4、K2Cr2O7、KClO3、次氯酸盐等与浓盐酸在不加热的条件下可以制取Cl2。当浓盐酸反应变为稀盐酸时,反应停止。无论氧化剂KMnO4等是否过量,盐酸永远有剩余。
②洗气瓶除杂时从长管进短管出;干燥管除杂时从粗口进,细口出;U形管、玻璃管除杂无前后。
2.Cl2性质及应用探究模型
净化气体→干燥→干燥有色布条→湿润有色布条→FeCl2、KBr、NaI等溶液→干燥→Fe加热→隔离→尾气处理
①为了防止G中溶液倒吸,可在F、G之间连一个安全瓶。
②如果F中生成易水解或易潮解的氯化物,则F装置前后要有干燥装置。
判断正误(正确的打“√”,错误的打“×”)
(1)(2022·全国甲卷)漂白粉与盐酸可混合使用以提高消毒效果。( )
(2)(2022·浙江1月选考)足量的浓盐酸与8.7 g MnO2反应,转移电子的数目为0.4NA(设NA为阿伏加德罗常数的值)。( )
(3)(2021·湖南选择性考试)净化实验室制备的Cl2,可将气体依次通过盛有饱和NaCl溶液、浓H2SO4的洗气瓶。( )
(4)可用石灰乳吸收反应产生的Cl2制备漂白粉。( )
(5)用MnO2和浓盐酸制取Cl2的反应中,氧化剂与还原剂的物质的量之比为1∶4。( )
[答案] (1)× (2)× (3)√ (4)√ (5)×
1.四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是 ( )
A.②中应盛装浓H2SO4
B.冷凝管有冷凝、回流和导气的作用
C.③中的反应中,TiO2是氧化剂,炭粉是还原剂
D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置
C [已知四氯化钛极易水解,遇空气中的水蒸气即产生“白烟”,而制得的氯气中混有水蒸气,所以②中应盛装浓硫酸,故A正确;TiCl4的熔、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,故B正确;反应过程中钛的化合价不变,C项错误;因四氯化钛极易水解,所以应在装置④和⑤之间增加一个防止水蒸气进入④的装置,故D正确。]
2.三氯化碘(ICl3)在药物合成中用途非常广泛。已知ICl3的熔点为33 ℃,沸点为73 ℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
请回答下列问题:
(1)按照气流方向连接接口顺序为a→_______。
装置A中导管m的作用是________。
(2)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞,C中的现象为______________。
(3)氯气与单质碘需在温度稍低于70 ℃下反应,则装置E适宜的加热方式为_______。装置E中发生反应的化学方程式: ______________。
(4)该装置存在的明显缺陷是_________________________。
[答案] (1)d→e→b→c→g→h→f(接口b与c、g与h可互换) 使浓盐酸顺利滴下 (2)锥形瓶中液面下降,长颈漏斗中液面上升
有关实验装置或装置试剂作用的答题模板
真题感悟·明确考向
03
1.(2022·广东选择性考试,T8)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是( )
D [氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,D装置不能达到实验目的。]
序号 物质a C中实验现象 通入Cl2前 通入Cl2后
Ⅰ 水 得到无色溶液 产生棕黑色沉淀,且放置后不发生变化
Ⅱ 5% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
Ⅲ 40% NaOH溶液 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
(1)B中试剂是________。
(2)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为__________。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_______。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____,溶液绿色缓慢加深,原因是MnO2被________(填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③取Ⅱ中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是_____________(写离子方程式)。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:______。
[解析] 在装置A中HCl与KMnO4发生反应制取Cl2,由于盐酸具有挥发性,为排除HCl对Cl2性质的干扰,在装置B中盛有饱和NaCl溶液,除去Cl2中的杂质HCl,在装置C中通过改变溶液的pH,验证不同条件下Cl2与MnSO4反应,装置D是尾气处理装置,目的是除去多余Cl2,防止造成大气污染。
谢谢观看 THANK YOU!
同课章节目录
