第22讲 无机非金属材料与环境保护(基础课) 课件(共76张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第22讲 无机非金属材料与环境保护(基础课) 课件(共76张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 19:31:54 | ||
图片预览











文档简介
(共76张PPT)
第22讲 无机非金属材料与环境保护(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.了解碳、硅及其重要化合物的性质及应用。 2.了解硅的工业制备。 3.了解无机非金属材料的性质及用途。 4.了解环境污染及保护与绿色化学。 5.了解“碳达峰”和“碳中和”。
知识点一 碳的单质与氧化物
必备知识梳理
关键能力训练
01
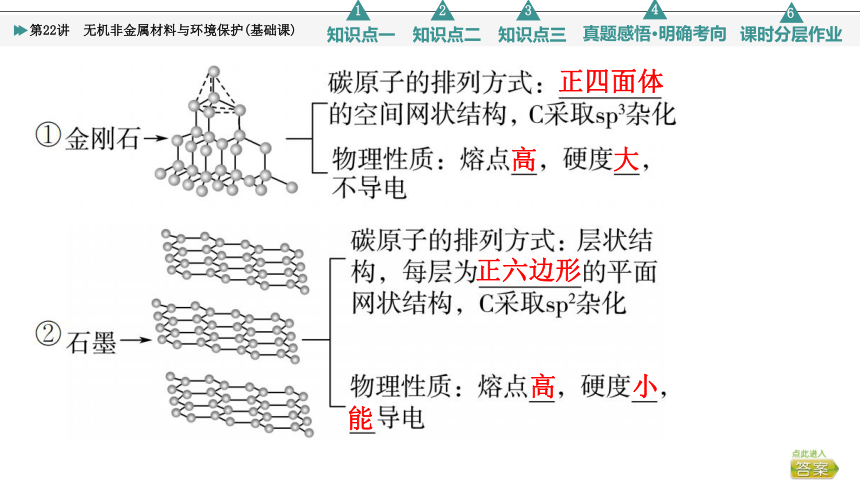
1.碳单质
(1)结构类型与物理性质
存在形式有金刚石、石墨、无定形碳、足球烯,它们互为同素异形体。
正四面体
高
大
正六边形
高
小
能
五
六
(2)重要化学性质(用化学方程式表示)
2.碳的氧化物
(1)一氧化碳的性质及应用
①物理性质:无色无味的气体,难溶于水,能使人中毒。中毒的原因是与人体内________相结合,使人因缺氧而中毒。
血红蛋白
②化学性质及应用(写出有关化学方程式)
a.可燃性:___________________,可作燃料。
b.还原性:CO还原Fe2O3的反应为__________________________,可用于冶炼金属。
(2)CO2的制备、性质、用途及检验
①实验室制备:CaCO3+2HCl===_______________________。
CaCl2+CO2↑+H2O
2MgO+C
③用途:制饮料、碳酸盐,作灭火剂,干冰用作制冷剂,也可用于人工降雨。
检验CO2中CO是否存在的实验装置
确定混合气体中含有CO的实验现象是D中的物质由黑色变成红色,B中无明显现象,F中的澄清石灰水变浑浊。
判断正误(正确的打“√”,错误的打“×”)
(1)金刚石和石墨由相同的元素组成,因此它们具有相同的性质。( )
(2)石墨转变为金刚石的反应属于氧化还原反应。( )
(3)C、CO均可以与MgO反应生成Mg。( )
(4)水煤气的制备利用了C的还原性,C还原H2O生成H2和CO。( )
(5)CO2可以用大理石与稀H2SO4反应来制备。( )
(6)向CaCl2溶液中通入CO2气体,溶液变浑浊,继续通入CO2至过量,浑浊消失。( )
(7)CO2可以作任何物质燃烧的灭火剂。( )
(8)能使澄清石灰水变浑浊的气体是CO2。( )
[答案] (1)× (2)× (3)× (4)√ (5)× (6)× (7)× (8)×
碳及其氧化物的性质与应用
1.科技的进步为二氧化碳资源化利用提供了广阔的前景。下列说法错误的是( )
A.CO2是自然界碳循环中的重要物质
B.CO2加氢转化为乙烯,CO2被还原
C.CO2电催化时,在阳极转化为燃料
D.CO2与环氧丙烷可合成可降解塑料
C [含碳燃料燃烧以及动植物呼吸都会产生二氧化碳,植物光合作用消耗二氧化碳,所以CO2是自然界碳循环中的重要物质,故A正确;CO2加氢转化为乙烯,C元素的化合价降低,CO2得电子,被还原,故B正确;CO2中C元素的化合价为+4价,只能发生得电子的还原反应,CO2在阴极得电子转化为燃料,阳极为失电子的氧化反应,故C错误;CO2与环氧丙烷发生加聚反应,可合成可降解塑料,故D正确。]
2.(2022·扬州模拟)通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )
A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
B [该反应应为吸热反应,A错误;碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳,因此除去Na2CO3固体中少量NaHCO3可用热分解的方法,B正确;过氧化尿素使品红溶液褪色是利用它的强氧化性,而二氧化硫使品红溶液褪色是利用它与品红化合生成不稳定的无色物质,原理不相同,C错误;由碳氧原子个数比可知,二氧化碳与氢气合成甲醇的原子利用率不是100%,D错误。]
“碳达峰”与“碳中和”
3.(2022·济南模拟)我国科学家成功利用CO2人工合成淀粉,使淀粉生产方式从农业种植转为工业制造成为可能,其原理如图所示。下列说法错误的是( )
A.甲醇可用于燃料电池的正极活性物质
B.化妆品中添加二羟基丙酮的主要作用为保湿
C.淀粉可用于制备葡萄糖
D.该过程有利于实现“碳达峰、碳中和”
A [甲醇可用于燃料电池的负极活性物质,A错误;二羟基丙酮分子中有两个羟基,能与水分子间形成氢键,故具有保湿作用,B正确;淀粉水解可生成葡萄糖,C正确;该过程能减少二氧化碳的排放,有助于实现“碳达峰、碳中和”,D正确。]
4.(2021·山东等级考,T1)有利于实现“碳达峰、碳中和”的是( )
A.风能发电 B.粮食酿酒
C.燃煤脱硫 D.石油裂化
A [碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低;碳中和是指通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。]
“碳达峰”“碳中和”中的“碳”是指二氧化碳,从碳循环的角度分析,有两种实现途径:一是减少含碳燃料的使用,降低二氧化碳的排放量,如节约用电,节省能源,充分利用氢能、太阳能等无碳能源(要注意无碳能源与新型清洁能源不同);二是增大吸收二氧化碳的力度,以减少二氧化碳的总量,如植树造林、研究“碳捕捉与储存”技术等。
CO、CO2的性质实验探究
5.确定混合气体(CO、CO2)中含有CO气体的实验设计方法如图所示。
请回答下列问题:
(1)填写下列指定装置的作用。
A:______。 B:______。
E:_____。 F:______。
(2)写出C中的化学方程式:______。
(3)确定混合气体中含有CO气体的实验现象:_______。
(4)该装置存在一定的安全隐患,改进方法为______。
[解析] CO的检验一般是用氧化剂氧化为CO2,检验CO2的生成进而说明含CO,但要注意原气体中CO2的干扰。
知识点二 无机非金属材料
02
必备知识梳理
关键能力训练
1.硅单质
硅元素在自然界中主要以二氧化硅和硅酸盐等化合态的形式存在于地壳中。
(1)单质硅的性质
①晶体硅是灰黑色、有金属光泽、硬而脆的固体,其结构类似于金刚石,熔、沸点很高、硬度大,导电能力介于导体和绝缘体之间,是良好的______材料。
②硅与强碱溶液生成氢气(特征反应):
Si+2NaOH+H2O===__________________。
半导体
Na2SiO3+2H2↑
(2)高纯硅制备的一般流程及涉及的主要化学反应
①_________________________________,
②_________________________,
③_________________________。
2.二氧化硅
(1)晶体类型:共价晶体。
(2)酸性氧化物:SiO2+2NaOH===_________________。
(3)高温下,与Na2CO3、CaCO3反应制玻璃:
Na2SiO3+H2O
Na2SiO3+CO2↑
CaSiO3+CO2↑
(4)与氢氟酸反应(特殊)___________________________ (写化学方程式)。
SiO2+4HF===SiF4↑+2H2O
3.硅酸及其盐
(1)硅酸
①硅酸(H2SiO3)是一种难溶于水的弱酸。
②与强碱反应:H2SiO3+2OH-===_____________。
(2)硅酸盐
①硅酸盐的结构
在硅酸盐中,Si和O构成了__________,即每个Si结合4个O,Si在四面体中心,O在四面体的4个顶角;许多这样的四面体还可以再通过顶角的O相互连接。
②硅酸盐的性质:硬度高、难溶于水、耐高温、耐腐蚀等。
③硅酸钠(Na2SiO3)——俗称泡花碱
硅氧四面体
a.白色、可溶于水的粉末状固体,其水溶液俗称______,有黏性,水溶液显__性。
b.与较强的酸反应生成硅酸(写化学方程式):
如Na2SiO3溶液与稀硫酸反应:__________________________________
________;
与CO2水溶液反应:________________________________________。
水玻璃
碱
Na2SiO3+H2SO4===H2SiO3↓+
Na2SO4
Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3
4.硅酸盐材料——传统无机非金属材料
黏土、石灰石
纯碱、石灰石、石英砂
高温
(1)生产水泥时加入适量石膏调节水泥________。水泥、沙子和碎石等与水混合可以得到混凝土。
(2)玻璃没有固定的熔点,是混合物,在某一温度范围内逐渐软化,可吹成各种形状的制品。不是晶体,称为玻璃态物质。
硬化速率
5.新型无机非金属材料
(1)晶体硅:广泛应用于信息技术和新能源技术等领域,制硅芯片、硅太阳能电池等。
(2)光导纤维:主要成分为______,传输光信号,制作光缆。
SiO2
(3)新型陶瓷
①高温结构陶瓷:如氮化硅陶瓷具有较高的硬度和耐磨蚀等。再如碳化硅(SiC)俗称金刚砂,SiC具有优异的高温抗氧化性能,可用作耐高温结构材料和耐高温半导体材料。
②生物陶瓷:对机体无排异反应,不会引起代谢作用异常。
③压电陶瓷:具有压电效应。
(4)碳纳米材料
①富勒烯是由碳原子构成的一系列笼形分子的总称。
②石墨烯是只有一个碳原子直径厚度的单层石墨,具有独特的电阻率低、热导率高的特点和很高的强度。
③碳纳米管可以看成是由石墨片层卷成的管状物,具有纳米尺度的直径。碳纳米管的比表面积大,有相当高的强度和优良的电学性能。
硅及其化合物的主要性质与应用
1.(2022·常德模拟)高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。工业上制备高纯硅有多种方法,其中的一种工艺流程如图所示。
已知:流化床反应器的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是( )
2.下列关于硅和二氧化硅的说法正确的是______(填序号)。
①SiO2与NaOH、HF均反应,故SiO2为两性氧化物
②NaOH溶液、氢氟酸均不能用玻璃试剂瓶盛装
③二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
⑤SiO2与H2O反应生成硅酸,与强碱反应生成硅酸盐
⑥向Na2SiO3溶液和Na2CO3溶液中通入过量CO2均无沉淀生成
[答案] ③
无机非金属材料
3.北京冬奥会彰显了我国的科技实力,下列说法错误的是( )
A.冬奥会采用氢能源保障车有利于“碳达峰、碳中和”
B.速滑馆“冰丝带”用CO2作制冷剂制冰发生化学变化
C.冬奥礼仪服装用到的石墨烯材料既能导热又能导电
D.制作“飞扬”火炬的碳纤维复合材料属于新型材料
B [冬奥会采用氢能源保障车,减少了燃油汽车的使用,减少了碳排放,有利于“碳达峰、碳中和”,A项正确;CO2作制冷剂制冰,利用的是固态(或液态)二氧化碳升华(或汽化)时吸热,属于物理变化,B项错误;石墨烯是由碳原子构成的二维层状的碳材料,既能导热又能导电,C项正确;碳纤维复合材料属于新型复合材料,D项正确。]
4.(2022·永州模拟)我国很早开始生产陶器和瓷器,并在民间广泛使用。明朝宋应星编写的《天工开物·陶埏》中记载:“水火既济而土合。万室之国,日勤千人而不足,民用亦繁矣哉。”下列说法错误的是( )
A.陶瓷是传统的无机非金属材料,与光导纤维的主要成分相同
B.制作传统陶瓷的主要原料为黏土
C.陶瓷材料在高温下不易被氧化,并对酸、碱具有良好的抗腐蚀能力
D.唐三彩陶器的黄色、褐色主要是因为添加了着色剂——氧化铁
A [光导纤维的主要成分为二氧化硅,与陶瓷的主要成分为硅酸盐不同,A项错误;制作传统陶瓷的主要原料是黏土,B项正确;陶瓷的主要成分是硅酸盐,性质稳定,高温下不易被氧化,并对酸、碱具有较好的抗腐蚀能力,C项正确;唐三彩陶器的黄色、褐色主要是因为添加了不同量的氧化铁,D项正确。]
知识点三 环境污染及保护与绿色化学
03
必备知识梳理
关键能力训练
1.常见环境污染
(1)环境问题
主要是指由于人类不合理地开发和利用自然资源而造成的生态环境破坏,以及工农业生产和人类生活所造成的环境污染。一般说的“三废”:主要是指____、____和废渣。
废气
废水
(2)污染物的来源
大气污染物主要来自化石燃料的燃烧和工业生产过程产生的废气及其携带的颗粒物。这些污染物在太阳辐射等因素的作用下形成次生污染物。
(3)常见环境污染及其成因
①酸雨——有关的物质为SO2和氮氧化合物。
SO3
H2SO3
b.硝酸型酸雨:NOx排入大气中后,与空气(O2)、水反应生成HNO3随雨雪降到地面。
②光化学烟雾——主要是__________和碳氢化合物造成的。
③臭氧层空洞——主要是________、氮氧化合物等的排放引起的。
④温室效应——主要是由于大气中_____等的含量的不断增加造成的。CH4等烃类也能引起温室效应。
氮氧化合物
氟氯代烃
CO2
⑤白色污染——聚乙烯等难降解____的大量使用。
⑥水华、赤潮——含大量氮、磷的生活污水及工农业废污水的任意排放造成水体________。
⑦PM2.5——大气中直径小于或等于__________ m的颗粒物,它主要来自化石燃料的燃烧(如机动车尾气、燃煤等)。
塑料
富营养化
2.5×10-6
⑧雾霾——雾和霾的统称。空气中的灰尘、硫酸、硝酸等组成的气溶胶系统造成视觉障碍的叫__。二氧化硫、氮氧化物以及颗粒物(PM)这三项是雾霾主要污染物,前两者为气态污染物,最后一项颗粒物才是加重雾霾天气污染的罪魁祸首。
⑨居室污染——甲醛、苯、甲苯、氡对空气的污染。来源于建筑、装修材料等。
霾
2.绿色化学——环境友好化学
(1)核心:其核心思想就是改变“先污染后治理”的观念和做法,利用化学原理和技术手段,减少或消除产品在生产和应用中涉及的有害化学物质,实现从源头减少或消除环境污染。
(2)特征
①采用无毒、无害的原料;
②在无毒、无害的条件(包括催化剂、溶剂)下进行;
③产品应该是环境友好的;
④具有“原子经济性”,即反应具有高选择性、极少副产物,甚至实现“______”。此外,它还应当满足“物美价廉”的传统标准。
零排放
100%
化合
1.下列说法不正确的是( )
A.工业上用氨水消除燃煤烟气中的SO2
B.纳米铁粉主要通过物理吸附除去污水中的Cu2+、Hg2+、Ag+等重金属离子
C.空间站宇航员采用多次蒸馏的方法,从尿液中分离出纯净水,实现了水的再生循环
D.中国科学院在国际上首次实现了从CO2到淀粉的全合成,有利于促进“碳中和”
B [纳米铁粉能与污水中的Cu2+、Hg2+、Ag+等重金属离子发生置换反应达到除去重金属离子的目的,与物理吸附无关,故B错误。]
2.(2022·潍坊模拟)“打造青山常在、绿水长流、空气常新的美丽中国,让锦绣河山造福人民”。下列水处理方法错误的是( )
A.用臭氧进行自来水消毒
B.向酸性废水中加生石灰进行中和
C.用FeS除去工业废水中的Cu2+和Hg2+
D.用Na2SO4除去硬水中的Mg2+和Ca2+
D [硫酸镁溶于水,硫酸钙微溶于水,不能用Na2SO4除去硬水中的Mg2+和Ca2+,D错误。]
3.推进绿色发展,建设美丽中国。下列做法应提倡的是( )
A.限制二氧化碳排放,减少酸雨产生
B.加大化肥、农药的施用,提高粮食产量
C.将塑料焚烧处理,减轻白色污染
D.开发新能源,减少化石燃料的使用
[答案] D
4.在“绿色化学”工艺中,理想状态是反应物原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济要求的是( )
A.乙烯聚合为聚乙烯高分子材料
B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜
D.用二氧化硅制备高纯硅
[答案] A
①生物硝化法处理废水,会导致水体pH逐渐下降,试用离子方程式表示____________________。
②微生物保持活性的pH范围为7~8,可以加入________来调节溶液的pH。
(2)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:______。
②NO与NO2按物质的量之比为1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是________。
真题感悟·明确考向
04
1.(2022·全国乙卷,T7)生活中处处有化学,下列叙述正确的是( )
A.HB铅笔芯的成分为二氧化铅
B.碳酸氢钠可做食品膨松剂
C.青铜和黄铜是不同结构的单质铜
D.焰火中红色来源于钠盐灼烧
[答案] B
1
3
5
2
4
2.(2022·海南等级考)化学与日常生活息息相关。下列说法错误的是( )
A.使用含氟牙膏能预防龋齿
B.小苏打的主要成分是Na2CO3
C.可用食醋除去水垢中的碳酸钙
D.使用食品添加剂不应降低食品本身营养价值
[答案] B
1
3
5
2
4
3.(2022·河北选择性考试,T1)定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )
A.传统陶瓷是典型的绝缘材料
B.陶瓷主要成分为SiO2和MgO
C.陶瓷烧制的过程为物理变化
D.白瓷的白色是因铁含量较高
1
3
5
2
4
A [陶瓷的主要成分为硅酸盐,而不是SiO2和MgO,B错误;陶瓷烧制过程发生复杂的化学反应,有新物质生成,属于化学变化,C错误;由于Fe2+、Fe3+和铁的氧化物均有颜色,故陶瓷中含铁量越多,陶瓷的颜色越深,白瓷的白色是因为铁含量较低甚至几乎不含,D错误。]
1
3
5
2
4
4.(2022·全国甲卷,T7)化学与生活密切相关。下列叙述正确的是( )
A.漂白粉与盐酸可混合使用以提高消毒效果
B.温室气体是形成酸雨的主要物质
C.棉花、麻和蚕丝均为碳水化合物
D.干冰可用在舞台上制造“云雾”
D [漂白粉与盐酸混合可以产生Cl2,不能混用,A错误;温室气体主要指CO2,CO2与酸雨无关,B错误;蚕丝的主要成分为蛋白质,C错误。]
2
3
4
1
5
5.(2021·海南等级考,T1)2020年9月22日,中国向全世界宣布,努力争取2060年前实现碳中和。下列措施不利于大气中CO2减少的是 ( )
A.用氨水捕集废气中的CO2,将其转化为氮肥
B.大力推广使用风能、水能、氢能等清洁能源
C.大力推广使用干冰实现人工增雨,缓解旱情
D.通过植树造林,利用光合作用吸收大气中的CO2
1
3
5
2
4
C [大力推广使用干冰实现人工增雨,会增加大气中二氧化碳的含量,不利于大气中二氧化碳的减少。]
1
3
5
2
4
谢谢观看 THANK YOU!
第22讲 无机非金属材料与环境保护(基础课)
第二部分 元素及其化合物
第四章 非金属及其化合物
1.了解碳、硅及其重要化合物的性质及应用。 2.了解硅的工业制备。 3.了解无机非金属材料的性质及用途。 4.了解环境污染及保护与绿色化学。 5.了解“碳达峰”和“碳中和”。
知识点一 碳的单质与氧化物
必备知识梳理
关键能力训练
01
1.碳单质
(1)结构类型与物理性质
存在形式有金刚石、石墨、无定形碳、足球烯,它们互为同素异形体。
正四面体
高
大
正六边形
高
小
能
五
六
(2)重要化学性质(用化学方程式表示)
2.碳的氧化物
(1)一氧化碳的性质及应用
①物理性质:无色无味的气体,难溶于水,能使人中毒。中毒的原因是与人体内________相结合,使人因缺氧而中毒。
血红蛋白
②化学性质及应用(写出有关化学方程式)
a.可燃性:___________________,可作燃料。
b.还原性:CO还原Fe2O3的反应为__________________________,可用于冶炼金属。
(2)CO2的制备、性质、用途及检验
①实验室制备:CaCO3+2HCl===_______________________。
CaCl2+CO2↑+H2O
2MgO+C
③用途:制饮料、碳酸盐,作灭火剂,干冰用作制冷剂,也可用于人工降雨。
检验CO2中CO是否存在的实验装置
确定混合气体中含有CO的实验现象是D中的物质由黑色变成红色,B中无明显现象,F中的澄清石灰水变浑浊。
判断正误(正确的打“√”,错误的打“×”)
(1)金刚石和石墨由相同的元素组成,因此它们具有相同的性质。( )
(2)石墨转变为金刚石的反应属于氧化还原反应。( )
(3)C、CO均可以与MgO反应生成Mg。( )
(4)水煤气的制备利用了C的还原性,C还原H2O生成H2和CO。( )
(5)CO2可以用大理石与稀H2SO4反应来制备。( )
(6)向CaCl2溶液中通入CO2气体,溶液变浑浊,继续通入CO2至过量,浑浊消失。( )
(7)CO2可以作任何物质燃烧的灭火剂。( )
(8)能使澄清石灰水变浑浊的气体是CO2。( )
[答案] (1)× (2)× (3)× (4)√ (5)× (6)× (7)× (8)×
碳及其氧化物的性质与应用
1.科技的进步为二氧化碳资源化利用提供了广阔的前景。下列说法错误的是( )
A.CO2是自然界碳循环中的重要物质
B.CO2加氢转化为乙烯,CO2被还原
C.CO2电催化时,在阳极转化为燃料
D.CO2与环氧丙烷可合成可降解塑料
C [含碳燃料燃烧以及动植物呼吸都会产生二氧化碳,植物光合作用消耗二氧化碳,所以CO2是自然界碳循环中的重要物质,故A正确;CO2加氢转化为乙烯,C元素的化合价降低,CO2得电子,被还原,故B正确;CO2中C元素的化合价为+4价,只能发生得电子的还原反应,CO2在阴极得电子转化为燃料,阳极为失电子的氧化反应,故C错误;CO2与环氧丙烷发生加聚反应,可合成可降解塑料,故D正确。]
2.(2022·扬州模拟)通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )
A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
B [该反应应为吸热反应,A错误;碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳,因此除去Na2CO3固体中少量NaHCO3可用热分解的方法,B正确;过氧化尿素使品红溶液褪色是利用它的强氧化性,而二氧化硫使品红溶液褪色是利用它与品红化合生成不稳定的无色物质,原理不相同,C错误;由碳氧原子个数比可知,二氧化碳与氢气合成甲醇的原子利用率不是100%,D错误。]
“碳达峰”与“碳中和”
3.(2022·济南模拟)我国科学家成功利用CO2人工合成淀粉,使淀粉生产方式从农业种植转为工业制造成为可能,其原理如图所示。下列说法错误的是( )
A.甲醇可用于燃料电池的正极活性物质
B.化妆品中添加二羟基丙酮的主要作用为保湿
C.淀粉可用于制备葡萄糖
D.该过程有利于实现“碳达峰、碳中和”
A [甲醇可用于燃料电池的负极活性物质,A错误;二羟基丙酮分子中有两个羟基,能与水分子间形成氢键,故具有保湿作用,B正确;淀粉水解可生成葡萄糖,C正确;该过程能减少二氧化碳的排放,有助于实现“碳达峰、碳中和”,D正确。]
4.(2021·山东等级考,T1)有利于实现“碳达峰、碳中和”的是( )
A.风能发电 B.粮食酿酒
C.燃煤脱硫 D.石油裂化
A [碳达峰是指我国承诺2030年前,二氧化碳的排放不再增长,达到峰值之后逐步降低;碳中和是指通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放量,实现二氧化碳“零排放”。]
“碳达峰”“碳中和”中的“碳”是指二氧化碳,从碳循环的角度分析,有两种实现途径:一是减少含碳燃料的使用,降低二氧化碳的排放量,如节约用电,节省能源,充分利用氢能、太阳能等无碳能源(要注意无碳能源与新型清洁能源不同);二是增大吸收二氧化碳的力度,以减少二氧化碳的总量,如植树造林、研究“碳捕捉与储存”技术等。
CO、CO2的性质实验探究
5.确定混合气体(CO、CO2)中含有CO气体的实验设计方法如图所示。
请回答下列问题:
(1)填写下列指定装置的作用。
A:______。 B:______。
E:_____。 F:______。
(2)写出C中的化学方程式:______。
(3)确定混合气体中含有CO气体的实验现象:_______。
(4)该装置存在一定的安全隐患,改进方法为______。
[解析] CO的检验一般是用氧化剂氧化为CO2,检验CO2的生成进而说明含CO,但要注意原气体中CO2的干扰。
知识点二 无机非金属材料
02
必备知识梳理
关键能力训练
1.硅单质
硅元素在自然界中主要以二氧化硅和硅酸盐等化合态的形式存在于地壳中。
(1)单质硅的性质
①晶体硅是灰黑色、有金属光泽、硬而脆的固体,其结构类似于金刚石,熔、沸点很高、硬度大,导电能力介于导体和绝缘体之间,是良好的______材料。
②硅与强碱溶液生成氢气(特征反应):
Si+2NaOH+H2O===__________________。
半导体
Na2SiO3+2H2↑
(2)高纯硅制备的一般流程及涉及的主要化学反应
①_________________________________,
②_________________________,
③_________________________。
2.二氧化硅
(1)晶体类型:共价晶体。
(2)酸性氧化物:SiO2+2NaOH===_________________。
(3)高温下,与Na2CO3、CaCO3反应制玻璃:
Na2SiO3+H2O
Na2SiO3+CO2↑
CaSiO3+CO2↑
(4)与氢氟酸反应(特殊)___________________________ (写化学方程式)。
SiO2+4HF===SiF4↑+2H2O
3.硅酸及其盐
(1)硅酸
①硅酸(H2SiO3)是一种难溶于水的弱酸。
②与强碱反应:H2SiO3+2OH-===_____________。
(2)硅酸盐
①硅酸盐的结构
在硅酸盐中,Si和O构成了__________,即每个Si结合4个O,Si在四面体中心,O在四面体的4个顶角;许多这样的四面体还可以再通过顶角的O相互连接。
②硅酸盐的性质:硬度高、难溶于水、耐高温、耐腐蚀等。
③硅酸钠(Na2SiO3)——俗称泡花碱
硅氧四面体
a.白色、可溶于水的粉末状固体,其水溶液俗称______,有黏性,水溶液显__性。
b.与较强的酸反应生成硅酸(写化学方程式):
如Na2SiO3溶液与稀硫酸反应:__________________________________
________;
与CO2水溶液反应:________________________________________。
水玻璃
碱
Na2SiO3+H2SO4===H2SiO3↓+
Na2SO4
Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3
4.硅酸盐材料——传统无机非金属材料
黏土、石灰石
纯碱、石灰石、石英砂
高温
(1)生产水泥时加入适量石膏调节水泥________。水泥、沙子和碎石等与水混合可以得到混凝土。
(2)玻璃没有固定的熔点,是混合物,在某一温度范围内逐渐软化,可吹成各种形状的制品。不是晶体,称为玻璃态物质。
硬化速率
5.新型无机非金属材料
(1)晶体硅:广泛应用于信息技术和新能源技术等领域,制硅芯片、硅太阳能电池等。
(2)光导纤维:主要成分为______,传输光信号,制作光缆。
SiO2
(3)新型陶瓷
①高温结构陶瓷:如氮化硅陶瓷具有较高的硬度和耐磨蚀等。再如碳化硅(SiC)俗称金刚砂,SiC具有优异的高温抗氧化性能,可用作耐高温结构材料和耐高温半导体材料。
②生物陶瓷:对机体无排异反应,不会引起代谢作用异常。
③压电陶瓷:具有压电效应。
(4)碳纳米材料
①富勒烯是由碳原子构成的一系列笼形分子的总称。
②石墨烯是只有一个碳原子直径厚度的单层石墨,具有独特的电阻率低、热导率高的特点和很高的强度。
③碳纳米管可以看成是由石墨片层卷成的管状物,具有纳米尺度的直径。碳纳米管的比表面积大,有相当高的强度和优良的电学性能。
硅及其化合物的主要性质与应用
1.(2022·常德模拟)高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。工业上制备高纯硅有多种方法,其中的一种工艺流程如图所示。
已知:流化床反应器的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是( )
2.下列关于硅和二氧化硅的说法正确的是______(填序号)。
①SiO2与NaOH、HF均反应,故SiO2为两性氧化物
②NaOH溶液、氢氟酸均不能用玻璃试剂瓶盛装
③二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
⑤SiO2与H2O反应生成硅酸,与强碱反应生成硅酸盐
⑥向Na2SiO3溶液和Na2CO3溶液中通入过量CO2均无沉淀生成
[答案] ③
无机非金属材料
3.北京冬奥会彰显了我国的科技实力,下列说法错误的是( )
A.冬奥会采用氢能源保障车有利于“碳达峰、碳中和”
B.速滑馆“冰丝带”用CO2作制冷剂制冰发生化学变化
C.冬奥礼仪服装用到的石墨烯材料既能导热又能导电
D.制作“飞扬”火炬的碳纤维复合材料属于新型材料
B [冬奥会采用氢能源保障车,减少了燃油汽车的使用,减少了碳排放,有利于“碳达峰、碳中和”,A项正确;CO2作制冷剂制冰,利用的是固态(或液态)二氧化碳升华(或汽化)时吸热,属于物理变化,B项错误;石墨烯是由碳原子构成的二维层状的碳材料,既能导热又能导电,C项正确;碳纤维复合材料属于新型复合材料,D项正确。]
4.(2022·永州模拟)我国很早开始生产陶器和瓷器,并在民间广泛使用。明朝宋应星编写的《天工开物·陶埏》中记载:“水火既济而土合。万室之国,日勤千人而不足,民用亦繁矣哉。”下列说法错误的是( )
A.陶瓷是传统的无机非金属材料,与光导纤维的主要成分相同
B.制作传统陶瓷的主要原料为黏土
C.陶瓷材料在高温下不易被氧化,并对酸、碱具有良好的抗腐蚀能力
D.唐三彩陶器的黄色、褐色主要是因为添加了着色剂——氧化铁
A [光导纤维的主要成分为二氧化硅,与陶瓷的主要成分为硅酸盐不同,A项错误;制作传统陶瓷的主要原料是黏土,B项正确;陶瓷的主要成分是硅酸盐,性质稳定,高温下不易被氧化,并对酸、碱具有较好的抗腐蚀能力,C项正确;唐三彩陶器的黄色、褐色主要是因为添加了不同量的氧化铁,D项正确。]
知识点三 环境污染及保护与绿色化学
03
必备知识梳理
关键能力训练
1.常见环境污染
(1)环境问题
主要是指由于人类不合理地开发和利用自然资源而造成的生态环境破坏,以及工农业生产和人类生活所造成的环境污染。一般说的“三废”:主要是指____、____和废渣。
废气
废水
(2)污染物的来源
大气污染物主要来自化石燃料的燃烧和工业生产过程产生的废气及其携带的颗粒物。这些污染物在太阳辐射等因素的作用下形成次生污染物。
(3)常见环境污染及其成因
①酸雨——有关的物质为SO2和氮氧化合物。
SO3
H2SO3
b.硝酸型酸雨:NOx排入大气中后,与空气(O2)、水反应生成HNO3随雨雪降到地面。
②光化学烟雾——主要是__________和碳氢化合物造成的。
③臭氧层空洞——主要是________、氮氧化合物等的排放引起的。
④温室效应——主要是由于大气中_____等的含量的不断增加造成的。CH4等烃类也能引起温室效应。
氮氧化合物
氟氯代烃
CO2
⑤白色污染——聚乙烯等难降解____的大量使用。
⑥水华、赤潮——含大量氮、磷的生活污水及工农业废污水的任意排放造成水体________。
⑦PM2.5——大气中直径小于或等于__________ m的颗粒物,它主要来自化石燃料的燃烧(如机动车尾气、燃煤等)。
塑料
富营养化
2.5×10-6
⑧雾霾——雾和霾的统称。空气中的灰尘、硫酸、硝酸等组成的气溶胶系统造成视觉障碍的叫__。二氧化硫、氮氧化物以及颗粒物(PM)这三项是雾霾主要污染物,前两者为气态污染物,最后一项颗粒物才是加重雾霾天气污染的罪魁祸首。
⑨居室污染——甲醛、苯、甲苯、氡对空气的污染。来源于建筑、装修材料等。
霾
2.绿色化学——环境友好化学
(1)核心:其核心思想就是改变“先污染后治理”的观念和做法,利用化学原理和技术手段,减少或消除产品在生产和应用中涉及的有害化学物质,实现从源头减少或消除环境污染。
(2)特征
①采用无毒、无害的原料;
②在无毒、无害的条件(包括催化剂、溶剂)下进行;
③产品应该是环境友好的;
④具有“原子经济性”,即反应具有高选择性、极少副产物,甚至实现“______”。此外,它还应当满足“物美价廉”的传统标准。
零排放
100%
化合
1.下列说法不正确的是( )
A.工业上用氨水消除燃煤烟气中的SO2
B.纳米铁粉主要通过物理吸附除去污水中的Cu2+、Hg2+、Ag+等重金属离子
C.空间站宇航员采用多次蒸馏的方法,从尿液中分离出纯净水,实现了水的再生循环
D.中国科学院在国际上首次实现了从CO2到淀粉的全合成,有利于促进“碳中和”
B [纳米铁粉能与污水中的Cu2+、Hg2+、Ag+等重金属离子发生置换反应达到除去重金属离子的目的,与物理吸附无关,故B错误。]
2.(2022·潍坊模拟)“打造青山常在、绿水长流、空气常新的美丽中国,让锦绣河山造福人民”。下列水处理方法错误的是( )
A.用臭氧进行自来水消毒
B.向酸性废水中加生石灰进行中和
C.用FeS除去工业废水中的Cu2+和Hg2+
D.用Na2SO4除去硬水中的Mg2+和Ca2+
D [硫酸镁溶于水,硫酸钙微溶于水,不能用Na2SO4除去硬水中的Mg2+和Ca2+,D错误。]
3.推进绿色发展,建设美丽中国。下列做法应提倡的是( )
A.限制二氧化碳排放,减少酸雨产生
B.加大化肥、农药的施用,提高粮食产量
C.将塑料焚烧处理,减轻白色污染
D.开发新能源,减少化石燃料的使用
[答案] D
4.在“绿色化学”工艺中,理想状态是反应物原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济要求的是( )
A.乙烯聚合为聚乙烯高分子材料
B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜
D.用二氧化硅制备高纯硅
[答案] A
①生物硝化法处理废水,会导致水体pH逐渐下降,试用离子方程式表示____________________。
②微生物保持活性的pH范围为7~8,可以加入________来调节溶液的pH。
(2)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:______。
②NO与NO2按物质的量之比为1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是________。
真题感悟·明确考向
04
1.(2022·全国乙卷,T7)生活中处处有化学,下列叙述正确的是( )
A.HB铅笔芯的成分为二氧化铅
B.碳酸氢钠可做食品膨松剂
C.青铜和黄铜是不同结构的单质铜
D.焰火中红色来源于钠盐灼烧
[答案] B
1
3
5
2
4
2.(2022·海南等级考)化学与日常生活息息相关。下列说法错误的是( )
A.使用含氟牙膏能预防龋齿
B.小苏打的主要成分是Na2CO3
C.可用食醋除去水垢中的碳酸钙
D.使用食品添加剂不应降低食品本身营养价值
[答案] B
1
3
5
2
4
3.(2022·河北选择性考试,T1)定窑是宋代五大名窑之一,其生产的白瓷闻名于世。下列说法正确的是( )
A.传统陶瓷是典型的绝缘材料
B.陶瓷主要成分为SiO2和MgO
C.陶瓷烧制的过程为物理变化
D.白瓷的白色是因铁含量较高
1
3
5
2
4
A [陶瓷的主要成分为硅酸盐,而不是SiO2和MgO,B错误;陶瓷烧制过程发生复杂的化学反应,有新物质生成,属于化学变化,C错误;由于Fe2+、Fe3+和铁的氧化物均有颜色,故陶瓷中含铁量越多,陶瓷的颜色越深,白瓷的白色是因为铁含量较低甚至几乎不含,D错误。]
1
3
5
2
4
4.(2022·全国甲卷,T7)化学与生活密切相关。下列叙述正确的是( )
A.漂白粉与盐酸可混合使用以提高消毒效果
B.温室气体是形成酸雨的主要物质
C.棉花、麻和蚕丝均为碳水化合物
D.干冰可用在舞台上制造“云雾”
D [漂白粉与盐酸混合可以产生Cl2,不能混用,A错误;温室气体主要指CO2,CO2与酸雨无关,B错误;蚕丝的主要成分为蛋白质,C错误。]
2
3
4
1
5
5.(2021·海南等级考,T1)2020年9月22日,中国向全世界宣布,努力争取2060年前实现碳中和。下列措施不利于大气中CO2减少的是 ( )
A.用氨水捕集废气中的CO2,将其转化为氮肥
B.大力推广使用风能、水能、氢能等清洁能源
C.大力推广使用干冰实现人工增雨,缓解旱情
D.通过植树造林,利用光合作用吸收大气中的CO2
1
3
5
2
4
C [大力推广使用干冰实现人工增雨,会增加大气中二氧化碳的含量,不利于大气中二氧化碳的减少。]
1
3
5
2
4
谢谢观看 THANK YOU!
同课章节目录
