第3讲 物质的量在化学反应中的计算(能力课)(54张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第3讲 物质的量在化学反应中的计算(能力课)(54张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 19:50:35 | ||
图片预览











文档简介
(共54张PPT)
第3讲 物质的量在化学反应中的
计算(能力课)
第一部分 化学基本概念
第一章 物质的量
1.领悟物质的量在化学方程式中的计算。 2.掌握化学反应有关计算的两种方法——守恒法与关系式法。
考点一 物质的量在化学方程式计算中的应用
核心知能突破
关键能力训练
01
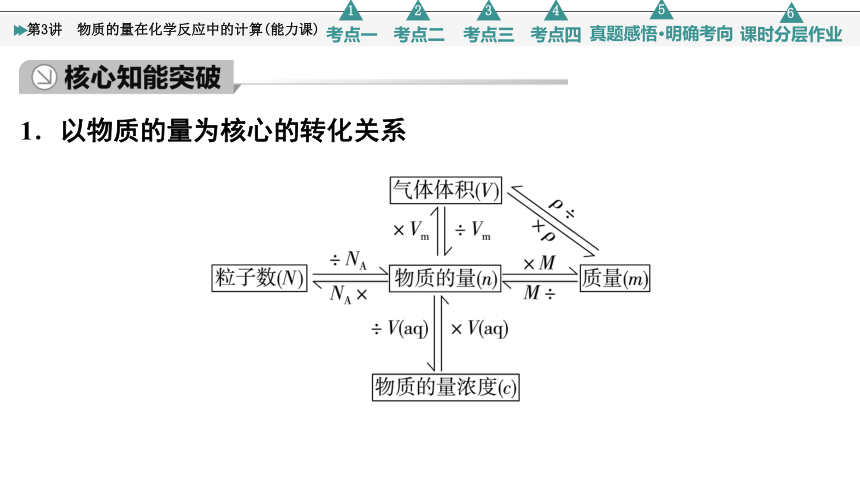
1.以物质的量为核心的转化关系
2.化学方程式的计算
(1)基本原理
2Na +2H2O===2NaOH+H2↑
化学计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
n之比: 2 mol ∶2 mol ∶ 2 mol∶ 1 mol
结论:化学方程式中各物质的化学计量数之比等于组成各物质的粒子数之比,也等于各物质的物质的量之比。
(2)解题步骤
①根据题意写出并配平化学方程式。
②依据题中所给信息及化学方程式判断过量物质,用完全反应物质的量进行计算。
③把已知的和需要求解的量分别写在化学方程式有关化学式的下面,两个量及单位“上下一致,左右相当”。
④选择有关量(如物质的量、气体体积、质量等)的关系作为计算依据,列比例式,求未知量。
(2020·海南等级考,节选)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应式:Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O
某次实验称取0.280 0 g样品,滴定时消耗浓度为0.030 00 mol·L-1的K2Cr2O7溶液25.10 mL,则样品中铁含量为________%。
[答案] 90.36
1.在标准状况下,15.6 g Na2O2投入足量水中,充分反应,生成NaOH的物质的量为多少?生成O2的体积为多少?转移电子数目为多少(设NA为阿伏加德罗常数的值)?(写解题步骤)
[答案] 生成NaOH 0.4 mol,生成O2 2.24 L,转移电子数为0.2NA。
2.用惰性电极电解200 mL CuSO4溶液,当生成6.4 g Cu时,所得溶液的pH为________(假设溶液体积不变)。
[答案] 0
考点二 守恒法在化学反应计算中的应用
02
核心知能突破
关键能力训练
守恒法是一种整合的思维方法,运用守恒定律,不纠结过程细节,只考虑反应体系中研究对象化学量的始态和终态。
1.原子守恒(元素质量守恒)
化学反应的实质是原子的重新组合,反应前后各原子的种类和数目保持不变。
2.得失电子守恒
氧化还原反应中,元素原子化合价升高的总价数=元素原子化合价降低的总价数,即还原剂失电子的总数=氧化剂得电子的总数。
3.电荷守恒
在离子反应方程式中,反应前后的阴、阳离子所带的电荷总数相等。
(2020·天津等级考,节选)为测定CuSO4溶液的浓度,甲、乙两同学设计了以下方案。
实验原理:CuSO4+BaCl2===BaSO4↓+CuCl2
实验步骤:
足量BaCl2溶液
↓
固体质量为w g,则c(CuSO4)=______mol·L-1。
[解析] 根据硫原子守恒可知
守恒法解答思路
1.(原子守恒)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到______ g固体。
[解析] 经过反应,蒸发中和后的溶液,最后所得固体为NaCl,根据氯原子守恒:n(NaCl)=n(HCl)=0.050 L×2 mol·L-1=0.1 mol,m(NaCl)=0.1 mol×58.5 g·mol-1=5.85 g。
[答案] 5.85
2.(电子守恒)如图是一种废钒催化剂回收工艺路线,“氧化”中欲使3 mol的VO2+变为VO ,则需要氧化剂KClO3至少为________mol。
[解析] 根据电子守恒可得:n(KClO3)×6=3 mol×(5-4),n(KClO3)=0.5 mol。
[答案] 0.5
[答案] 2 000
考点三 关系式法在多步反应计算中的应用
03
核心知能突破
关键能力训练
关系式是表示两种或多种物质之间“量”的关系的一种简化式子,在多步反应中,它可以把始态的反应物与终态的生成物之间“量”的关系表示出来,把多步计算简化成一步计算。
1.利用多步连续反应中化学计量关系推导。
2.利用元素质量守恒推导:如NH3的催化氧化制HNO3,利用N守恒可推关系式:NH3~HNO3。
3.利用得失电子守恒推导:如K2Cr2O7氧化Fe2+,利用得失电子守恒可推关系式:Cr2O ~6Fe2+。
黄铁矿的主要成分是FeS2,已知4FeS2+11O2 2Fe2O3+8SO2,某硫酸厂在进行黄铁矿成分测定时,取0.100 0 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020 00 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
已知:SO2+2Fe3++2H2O===SO +2Fe2++4H+;Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O。
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________(保留一位小数)。
(2)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为________L,制得98%硫酸的质量为________t。
(2)由S守恒得
FeS2 ~ 2SO2 ~ 2H2SO4
1 mol 2 mol 196 g
则n(SO2)=1.5×105 mol
标准状况下V(SO2)=3.36×106 L,
m(H2SO4)=1.5×107 g=15 t。
[答案] (1)90.0% (2)3.36×106 15
关系式的确定思路
方法一:在进行多步反应的计算时,一般的解题步骤为
方法二:利用得失电子守恒或元素质量守恒直接导出物质的量关系式,然后进行计算。
1.Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL 葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗碘标准液10.00 mL。滴定反应的离子方程式为______________,该样品中Na2S2O5的残留量为________g·L-1(以SO2计)。
2.测定CaO2·8H2O样品纯度的方法是:称取0.300 g样品于锥形瓶中,加入50 mL水和15 mL 2 mol·L-1 CH3COOH溶液,振荡使样品溶解生成过氧化氢,再加入几滴MnSO4稀溶液,立即用0.020 0 mol·L-1 KMnO4标准溶液滴定到终点,消耗25.00 mL标准溶液。
(1)样品中CaO2·8H2O的质量分数为_______________。
(2)上述过程中若使用稀硫酸而不使用稀醋酸溶解样品,则测得样品的纯度将________(填“偏高”“偏低”或“不变”)。
[解析] (1)根据CaO2·8H2O―→H2O2和5H2O2+2MnO +6H+===2Mn2++5O2↑+8H2O
可得关系式:5CaO2·8H2O~2KMnO4
n(CaO2·8H2O)=2.5n(KMnO4)=1.25×10-3 mol
(2)选用硫酸,则CaO2·8H2O与稀硫酸反应生成的微溶物CaSO4会覆盖在样品表面,使反应难以持续进行,导致H2O2产量偏低,测得的样品纯度偏低。
[答案] (1)90% (2)偏低
考点四 热重分析法确定物质的组成
04
核心知能突破
关键能力训练
热重分析法即热重量分析法,是在控制温度下,进行测量物质的量与温度或时间的关系的方法。
为研究一水草酸钙(CaC2O4·H2O)的热分解性质,进行如下实验:准确
×100%)随温度的变化如图所示。
(1)300 ℃时残留固体的成分为________。
(2)900 ℃时残留固体的成分为________。
[答案] (1)CaC2O4 (2)CaO
热重分析法的一般思路
(1)先确定分解前样品物质的物质的量或假设1 mol。
(2)失重一般是先失水,再失非金属氧化物。
(3)计算每步固体剩余的质量(m余)
(4)晶体中金属质量不再减少,仍在m余中。
(5)失重最后一般为金属氧化物,由元素质量守恒得m氧,由n金属∶n氧,即可求出失重后物质的化学式。
1.将Ce(SO4)2·4H2O(摩尔质量为404 g·mol-1)在空气中加热,样品的固体残留率随温度的变化如图所示。
当固体残留率为70.3%时,所得固体可能为________(填字母)。
A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4
[解析] 04 g·mol-1×70.3%≈284 g·mol-1,A项的摩尔质量为332 g·mol-1,B项的摩尔质量为568 g·mol-1,C项的摩尔质量为252 g·mol-1,根据元素质量守恒得808 g·mol-1×70.3%≈568 g·mol-1。
[答案] B
2.称取3.60 g草酸亚铁晶体(FeC2O4·2H2O,相对分子质量是180)用热重分析法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示,请分析图并回答下列问题:
(1)过程Ⅰ发生反应的化学方程式为____________。
(2)300 ℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式___________________。
[解析] (2)草酸亚铁晶体中的铁元素质量为3.6 g× ×100%=1.12 g,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为1.60 g-1.12 g=0.48 g,铁元素和氧元素的质量比为1.12 g∶0.48 g=7∶3,设铁的氧化物的化学式为FexOy,则有56x∶16y=7∶3,x∶y=2∶3,铁的氧化物的化学式为Fe2O3。
[答案] (1)FeC2O4·2H2O FeC2O4+2H2O↑
(2)Fe2O3(计算过程略,参考解析)
真题感悟·明确考向
05
1.(2022·辽宁选择性考试,T17节选)取2.50 g产品,加蒸馏水定容至100 mL 摇匀。取20.00 mL于锥形瓶中,用0.050 0 mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为________。
1
3
2
4
[解析] 根据得失电子守恒可得关系式
[答案] 17.0%
1
3
2
4
2.(2021·全国甲卷,T27节选)(1)结晶水测定:称量干燥坩埚的质量为m1,加入胆矾后总质量为m2,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为m3。根据实验数据,胆矾分子中结晶水的个数为________________(写表达式)。
(2)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
①胆矾未充分干燥
②坩埚未置于干燥器中冷却
③加热时有少量胆矾迸溅出来
1
3
2
4
[解析] (1)由题意知,结晶水的质量为m2-m3,硫酸铜的质量为m3-m1,设胆矾的化学式为CuSO4·xH2O,根据分子个数比等于物质的量
1
3
2
4
(2)胆矾未充分干燥,会使测定的水的质量偏高,则会导致结晶水数目测定值偏高,①符合题意;坩埚未置于干燥器中冷却,会使测定的水的质量偏低,则会导致结晶水数目测定值偏低,②不符合题意;加热时有少量胆矾迸溅出来,会使测定的水的质量偏高,则会导致结晶水数目测定值偏高,③符合题意。
1
3
2
4
1
3
2
4
3.(2021·山东等级考,T6)X、Y均为短周期金属元素,同温同压下,0.1 mol X的单质与足量稀盐酸反应,生成H2体积为V1 L;0.1 mol Y的单质与足量稀硫酸反应,生成H2体积为V2 L。下列说法错误的是( )
1
3
2
4
4.(2022·浙江1月选考,T27)某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50 g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06 g;残留的固体产物是Al2O3,质量为1.02 g。计算:
(1)x=__________________(写出计算过程)。
(2)气体产物中n(O2)=________ mol。
2
3
4
1
[解析] 根据题意可知,该分解反应的方程式为2[Al(NO3)3·xH2O]
Al2O3+4NO2↑+O2↑+2HNO3+(2x-1)H2O,然后列关系式求解。
2
3
4
1
[答案] (1)9
计算过程:2[Al(NO3)3·xH2O] ~ Al2O3
2(213+18x)g 102 g
7.50 g 1.02 g
x=9
(2)0.010 0
2
3
4
1
谢谢观看 THANK YOU!
第3讲 物质的量在化学反应中的
计算(能力课)
第一部分 化学基本概念
第一章 物质的量
1.领悟物质的量在化学方程式中的计算。 2.掌握化学反应有关计算的两种方法——守恒法与关系式法。
考点一 物质的量在化学方程式计算中的应用
核心知能突破
关键能力训练
01
1.以物质的量为核心的转化关系
2.化学方程式的计算
(1)基本原理
2Na +2H2O===2NaOH+H2↑
化学计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
n之比: 2 mol ∶2 mol ∶ 2 mol∶ 1 mol
结论:化学方程式中各物质的化学计量数之比等于组成各物质的粒子数之比,也等于各物质的物质的量之比。
(2)解题步骤
①根据题意写出并配平化学方程式。
②依据题中所给信息及化学方程式判断过量物质,用完全反应物质的量进行计算。
③把已知的和需要求解的量分别写在化学方程式有关化学式的下面,两个量及单位“上下一致,左右相当”。
④选择有关量(如物质的量、气体体积、质量等)的关系作为计算依据,列比例式,求未知量。
(2020·海南等级考,节选)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应式:Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O
某次实验称取0.280 0 g样品,滴定时消耗浓度为0.030 00 mol·L-1的K2Cr2O7溶液25.10 mL,则样品中铁含量为________%。
[答案] 90.36
1.在标准状况下,15.6 g Na2O2投入足量水中,充分反应,生成NaOH的物质的量为多少?生成O2的体积为多少?转移电子数目为多少(设NA为阿伏加德罗常数的值)?(写解题步骤)
[答案] 生成NaOH 0.4 mol,生成O2 2.24 L,转移电子数为0.2NA。
2.用惰性电极电解200 mL CuSO4溶液,当生成6.4 g Cu时,所得溶液的pH为________(假设溶液体积不变)。
[答案] 0
考点二 守恒法在化学反应计算中的应用
02
核心知能突破
关键能力训练
守恒法是一种整合的思维方法,运用守恒定律,不纠结过程细节,只考虑反应体系中研究对象化学量的始态和终态。
1.原子守恒(元素质量守恒)
化学反应的实质是原子的重新组合,反应前后各原子的种类和数目保持不变。
2.得失电子守恒
氧化还原反应中,元素原子化合价升高的总价数=元素原子化合价降低的总价数,即还原剂失电子的总数=氧化剂得电子的总数。
3.电荷守恒
在离子反应方程式中,反应前后的阴、阳离子所带的电荷总数相等。
(2020·天津等级考,节选)为测定CuSO4溶液的浓度,甲、乙两同学设计了以下方案。
实验原理:CuSO4+BaCl2===BaSO4↓+CuCl2
实验步骤:
足量BaCl2溶液
↓
固体质量为w g,则c(CuSO4)=______mol·L-1。
[解析] 根据硫原子守恒可知
守恒法解答思路
1.(原子守恒)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到______ g固体。
[解析] 经过反应,蒸发中和后的溶液,最后所得固体为NaCl,根据氯原子守恒:n(NaCl)=n(HCl)=0.050 L×2 mol·L-1=0.1 mol,m(NaCl)=0.1 mol×58.5 g·mol-1=5.85 g。
[答案] 5.85
2.(电子守恒)如图是一种废钒催化剂回收工艺路线,“氧化”中欲使3 mol的VO2+变为VO ,则需要氧化剂KClO3至少为________mol。
[解析] 根据电子守恒可得:n(KClO3)×6=3 mol×(5-4),n(KClO3)=0.5 mol。
[答案] 0.5
[答案] 2 000
考点三 关系式法在多步反应计算中的应用
03
核心知能突破
关键能力训练
关系式是表示两种或多种物质之间“量”的关系的一种简化式子,在多步反应中,它可以把始态的反应物与终态的生成物之间“量”的关系表示出来,把多步计算简化成一步计算。
1.利用多步连续反应中化学计量关系推导。
2.利用元素质量守恒推导:如NH3的催化氧化制HNO3,利用N守恒可推关系式:NH3~HNO3。
3.利用得失电子守恒推导:如K2Cr2O7氧化Fe2+,利用得失电子守恒可推关系式:Cr2O ~6Fe2+。
黄铁矿的主要成分是FeS2,已知4FeS2+11O2 2Fe2O3+8SO2,某硫酸厂在进行黄铁矿成分测定时,取0.100 0 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020 00 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
已知:SO2+2Fe3++2H2O===SO +2Fe2++4H+;Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O。
(1)样品中FeS2的质量分数是(假设杂质不参加反应)________(保留一位小数)。
(2)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为________L,制得98%硫酸的质量为________t。
(2)由S守恒得
FeS2 ~ 2SO2 ~ 2H2SO4
1 mol 2 mol 196 g
则n(SO2)=1.5×105 mol
标准状况下V(SO2)=3.36×106 L,
m(H2SO4)=1.5×107 g=15 t。
[答案] (1)90.0% (2)3.36×106 15
关系式的确定思路
方法一:在进行多步反应的计算时,一般的解题步骤为
方法二:利用得失电子守恒或元素质量守恒直接导出物质的量关系式,然后进行计算。
1.Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL 葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗碘标准液10.00 mL。滴定反应的离子方程式为______________,该样品中Na2S2O5的残留量为________g·L-1(以SO2计)。
2.测定CaO2·8H2O样品纯度的方法是:称取0.300 g样品于锥形瓶中,加入50 mL水和15 mL 2 mol·L-1 CH3COOH溶液,振荡使样品溶解生成过氧化氢,再加入几滴MnSO4稀溶液,立即用0.020 0 mol·L-1 KMnO4标准溶液滴定到终点,消耗25.00 mL标准溶液。
(1)样品中CaO2·8H2O的质量分数为_______________。
(2)上述过程中若使用稀硫酸而不使用稀醋酸溶解样品,则测得样品的纯度将________(填“偏高”“偏低”或“不变”)。
[解析] (1)根据CaO2·8H2O―→H2O2和5H2O2+2MnO +6H+===2Mn2++5O2↑+8H2O
可得关系式:5CaO2·8H2O~2KMnO4
n(CaO2·8H2O)=2.5n(KMnO4)=1.25×10-3 mol
(2)选用硫酸,则CaO2·8H2O与稀硫酸反应生成的微溶物CaSO4会覆盖在样品表面,使反应难以持续进行,导致H2O2产量偏低,测得的样品纯度偏低。
[答案] (1)90% (2)偏低
考点四 热重分析法确定物质的组成
04
核心知能突破
关键能力训练
热重分析法即热重量分析法,是在控制温度下,进行测量物质的量与温度或时间的关系的方法。
为研究一水草酸钙(CaC2O4·H2O)的热分解性质,进行如下实验:准确
×100%)随温度的变化如图所示。
(1)300 ℃时残留固体的成分为________。
(2)900 ℃时残留固体的成分为________。
[答案] (1)CaC2O4 (2)CaO
热重分析法的一般思路
(1)先确定分解前样品物质的物质的量或假设1 mol。
(2)失重一般是先失水,再失非金属氧化物。
(3)计算每步固体剩余的质量(m余)
(4)晶体中金属质量不再减少,仍在m余中。
(5)失重最后一般为金属氧化物,由元素质量守恒得m氧,由n金属∶n氧,即可求出失重后物质的化学式。
1.将Ce(SO4)2·4H2O(摩尔质量为404 g·mol-1)在空气中加热,样品的固体残留率随温度的变化如图所示。
当固体残留率为70.3%时,所得固体可能为________(填字母)。
A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4
[解析] 04 g·mol-1×70.3%≈284 g·mol-1,A项的摩尔质量为332 g·mol-1,B项的摩尔质量为568 g·mol-1,C项的摩尔质量为252 g·mol-1,根据元素质量守恒得808 g·mol-1×70.3%≈568 g·mol-1。
[答案] B
2.称取3.60 g草酸亚铁晶体(FeC2O4·2H2O,相对分子质量是180)用热重分析法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示,请分析图并回答下列问题:
(1)过程Ⅰ发生反应的化学方程式为____________。
(2)300 ℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式___________________。
[解析] (2)草酸亚铁晶体中的铁元素质量为3.6 g× ×100%=1.12 g,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为1.60 g-1.12 g=0.48 g,铁元素和氧元素的质量比为1.12 g∶0.48 g=7∶3,设铁的氧化物的化学式为FexOy,则有56x∶16y=7∶3,x∶y=2∶3,铁的氧化物的化学式为Fe2O3。
[答案] (1)FeC2O4·2H2O FeC2O4+2H2O↑
(2)Fe2O3(计算过程略,参考解析)
真题感悟·明确考向
05
1.(2022·辽宁选择性考试,T17节选)取2.50 g产品,加蒸馏水定容至100 mL 摇匀。取20.00 mL于锥形瓶中,用0.050 0 mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为________。
1
3
2
4
[解析] 根据得失电子守恒可得关系式
[答案] 17.0%
1
3
2
4
2.(2021·全国甲卷,T27节选)(1)结晶水测定:称量干燥坩埚的质量为m1,加入胆矾后总质量为m2,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为m3。根据实验数据,胆矾分子中结晶水的个数为________________(写表达式)。
(2)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
①胆矾未充分干燥
②坩埚未置于干燥器中冷却
③加热时有少量胆矾迸溅出来
1
3
2
4
[解析] (1)由题意知,结晶水的质量为m2-m3,硫酸铜的质量为m3-m1,设胆矾的化学式为CuSO4·xH2O,根据分子个数比等于物质的量
1
3
2
4
(2)胆矾未充分干燥,会使测定的水的质量偏高,则会导致结晶水数目测定值偏高,①符合题意;坩埚未置于干燥器中冷却,会使测定的水的质量偏低,则会导致结晶水数目测定值偏低,②不符合题意;加热时有少量胆矾迸溅出来,会使测定的水的质量偏高,则会导致结晶水数目测定值偏高,③符合题意。
1
3
2
4
1
3
2
4
3.(2021·山东等级考,T6)X、Y均为短周期金属元素,同温同压下,0.1 mol X的单质与足量稀盐酸反应,生成H2体积为V1 L;0.1 mol Y的单质与足量稀硫酸反应,生成H2体积为V2 L。下列说法错误的是( )
1
3
2
4
4.(2022·浙江1月选考,T27)某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50 g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06 g;残留的固体产物是Al2O3,质量为1.02 g。计算:
(1)x=__________________(写出计算过程)。
(2)气体产物中n(O2)=________ mol。
2
3
4
1
[解析] 根据题意可知,该分解反应的方程式为2[Al(NO3)3·xH2O]
Al2O3+4NO2↑+O2↑+2HNO3+(2x-1)H2O,然后列关系式求解。
2
3
4
1
[答案] (1)9
计算过程:2[Al(NO3)3·xH2O] ~ Al2O3
2(213+18x)g 102 g
7.50 g 1.02 g
x=9
(2)0.010 0
2
3
4
1
谢谢观看 THANK YOU!
同课章节目录
