第5讲 离子反应 离子方程式(基础课)(共52张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第5讲 离子反应 离子方程式(基础课)(共52张PPT)-2024届高考化学一轮复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 00:00:00 | ||
图片预览







文档简介
(共52张PPT)
第5讲 离子反应 离子方程式
(基础课)
第一部分 化学基本概念
第二章 化学物质及其变化
1.了解电解质的分类及其电离。 2.理解电解质溶液导电的原理。 3.了解离子反应的概念、发生的条件和离子方程式的书写。
知识点一 电解质及其电离
必备知识梳理
关键能力训练
01
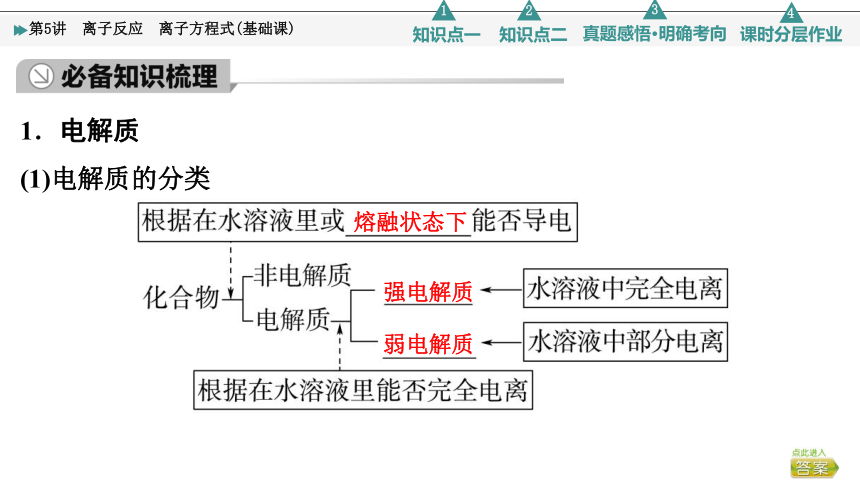
1.电解质
(1)电解质的分类
熔融状态下
强电解质
弱电解质
(2)电解质的强弱与物质类别的关系
①强电解质:______、______、绝大多数盐,如HNO3、NaOH、CaCO3等
②弱电解质:______、______和____等,如乙酸、一水合氨等
(3)常见的强酸、强碱
①强酸:HCl、HNO3、H2SO4、HClO4、HBr、HI等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
强酸
强碱
弱酸
弱碱
水
①过渡元素形成的碱一般为弱碱,如Fe(OH)3、AgOH等。
②羧酸为弱酸,酚为弱酸。
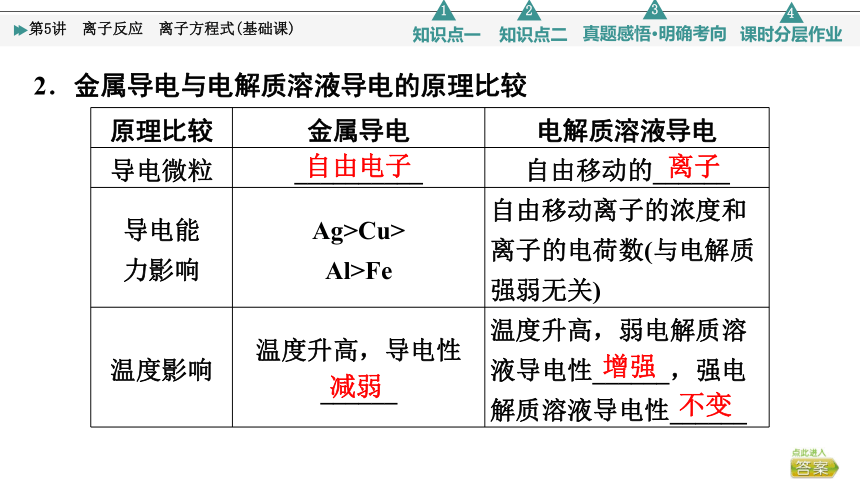
2.金属导电与电解质溶液导电的原理比较
原理比较 金属导电 电解质溶液导电
导电微粒 __________ 自由移动的______
导电能 力影响 Ag>Cu> Al>Fe 自由移动离子的浓度和离子的电荷数(与电解质强弱无关)
温度影响 温度升高,导电性______ 温度升高,弱电解质溶液导电性______,强电解质溶液导电性______
自由电子
离子
减弱
增强
不变
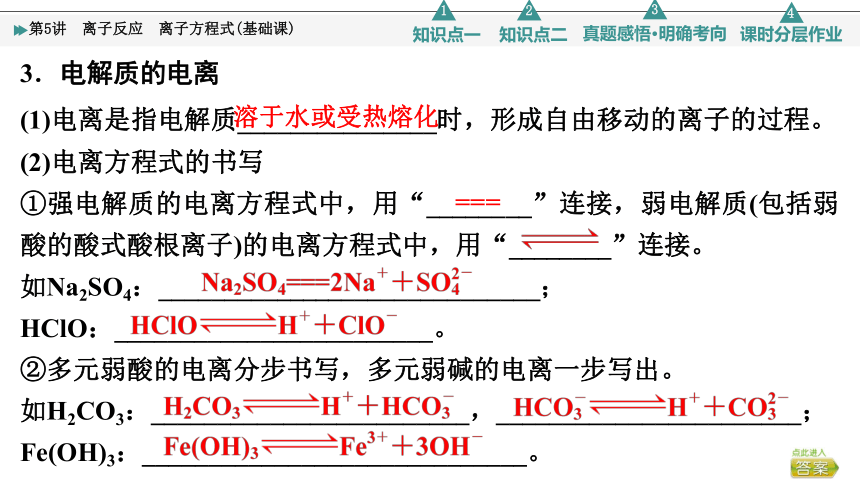
3.电解质的电离
(1)电离是指电解质_______________时,形成自由移动的离子的过程。
(2)电离方程式的书写
①强电解质的电离方程式中,用“________”连接,弱电解质(包括弱酸的酸式酸根离子)的电离方程式中,用“________”连接。
如Na2SO4:_____________________________;
HClO:________________________。
②多元弱酸的电离分步书写,多元弱碱的电离一步写出。
如H2CO3:________________________,_______________________;
Fe(OH)3:_____________________________。
溶于水或受热熔化
===
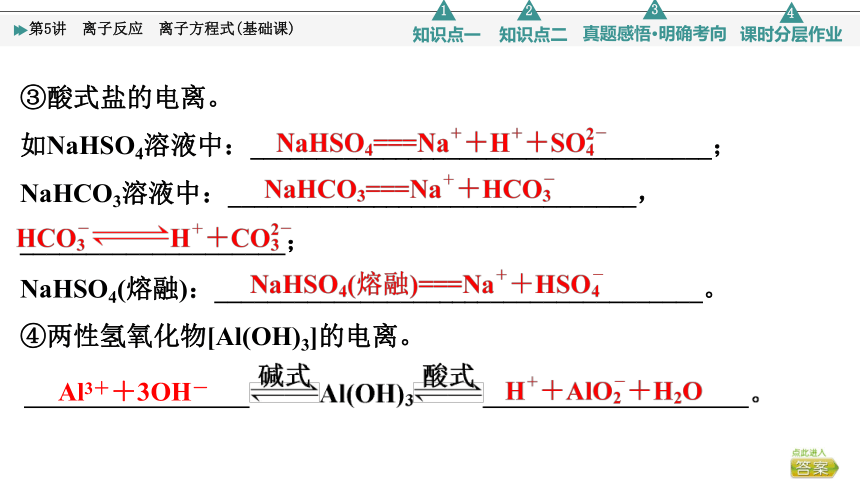
③酸式盐的电离。
如NaHSO4溶液中:___________________________________;
NaHCO3溶液中:_______________________________,
____________________;
NaHSO4(熔融):_____________________________________。
④两性氢氧化物[Al(OH)3]的电离。
Al3++3OH-
⑤特殊电离方程式:
电解质及溶液的导电性
1.下表中物质的分类组合完全正确的是( )
选项 A B C D
强电解质 KNO3 H2SO4 BaSO4 HClO4
弱电解质 HF CaCO3 HClO CH3COONH4
非电解质 SO2 金属Al H2O C2H5OH
A [B项中的CaCO3属于强电解质,Al为单质,既不属于电解质,也不属于非电解质,错误;C项中的H2O为弱电解质,错误;D项中的CH3COONH4为强电解质,错误。]
2.下列物质中,溶于水时导电但熔化或液态时不导电的电解质是( )
A.Na2CO3 B.H2SO4
C.SO3 D.NH3
[答案] B
3.下列物质导电性最强的是( )
A.0.1 mol/L NaHSO4溶液
B.0.1 mol/L 的CaCl2溶液
C.0.1 mol/L 的Na3PO4溶液
D.0.1 mol/L 的Mg(NO3)2溶液
C [溶液的导电能力取决于自由移动离子的浓度和离子的电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强,C正确。]
(1)某物质的水溶液导电,该物质不一定为电解质,还要看该物质在水中是否电离。如CO2、NH3、SO3的水溶液导电,但CO2、NH3、SO3为非电解质。
(2)电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如金属单质和电解质溶液等。
(3)强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱,如极稀的NaCl溶液的导电能力不如浓氨水的导电能力强。溶液的导电能力取决于自由移动离子的浓度和离子的电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强。
电解质的电离及电离方程式
4.(2022·黄冈检测)下列电离方程式正确的是( )
B [A项,电离方程式应为NaHCO3===Na++HCO ;B项,BOH为弱碱,电离过程可逆;C项,HA为弱酸,电离过程可逆;D项,CaCO3难溶,但属于强电解质,全部电离。]
5.写出下列电离方程式
(1)NaHSO4熔化电离:____________,NaHSO4溶于水电离:___________。
(2)Al(OH)3的酸式电离:__________________。
(3)H2S溶于水电离:____________________。
(4)Cu(OH)2溶于水电离:________________。
(5)甘氨酸的碱式电离:_____________。
知识点二 离子反应与离子方程式
02
必备知识梳理
关键能力训练
1.离子反应
(1)概念:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
(2)离子反应的条件
②氧化还原反应:如置换反应等。
③络合反应:如Fe3+与SCN-的络合反应等。
(3)离子反应的本质:溶液中某些离子的减少。
难溶
2.离子方程式
(1)定义:用实际参加反应的__________来表示反应的式子。
(2)书写步骤(以CaCO3与盐酸的反应为例)
离子符号
CaCO3+2HCl===CaCl2+CO2↑+H2O
+2H++2Cl-===Ca2++2Cl-+CO2↑+H2O
CaCO3+2H+===Ca2+
+CO2↑+H2O
CaCO3
(3)意义:不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。如氢氧化钠溶液和盐酸反应、氢氧化钾溶液和硝酸反应的离子方程式,都可用_________________________表示。
H++OH-===H2O
①易溶的强电解质(强酸、强碱、大多数可溶性盐)写成离子形式。难溶电解质、弱电解质、水、气体、氧化物、单质写成化学式。
②酸式盐
③微溶物:对于反应物,是否写成离子形式由其是否为溶液状态决定,如石灰乳写成化学式Ca(OH)2,澄清石灰水写成Ca2+和OH-;对于生成物,一般写化学式,如生成CaSO4时不能写成Ca2+和SO
1.写出下列反应的化学方程式和离子方程式。
(1)稀H2SO4与CuO反应:______________________。
(2)CaCO3与稀盐酸反应:______________________。
(3)氨水与AlCl3溶液反应:______________________。
(4)NaHCO3溶液与NaOH溶液反应:______________________。
(5)Cl2与澄清石灰水反应:______________________。
[答案] (1)H2SO4+CuO===CuSO4+H2O 2H++CuO===Cu2++H2O
(2)CaCO3+2HCl===CaCl2+CO2↑+H2O
CaCO3+2H+===Ca2++CO2↑+H2O
(3)3NH3·H2O+AlCl3===Al(OH)3↓+3NH4Cl
3NH3·H2O+Al3+===Al(OH)3↓+3NH
(4)NaHCO3+NaOH===Na2CO3+H2O
HCO +OH-===CO +H2O
(5)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O Cl2+2OH-===Cl-+ClO-+H2O
2.根据下列离子方程式写出相应化学方程式。
[答案] (1)NaOH+NH4Cl===NH3·H2O+NaCl(合理即可)
(2)Na2CO3+2HNO3===2NaNO3+H2O+CO2↑(合理即可)
1.(2022·泰安模拟)下列离子方程式书写正确的是( )
A.氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
B.向胆矾溶液中加入少量过氧化钠:2Na2O2+2Cu2++2H2O===2Cu(OH)2↓+4Na++O2↑
C.CO2通入少量澄清石灰水中:CO2+Ca2++2OH-===CaCO3↓+H2O
D.在硫酸氢钠溶液中加入小块钠:2Na+2H2O===2Na++2OH-+H2↑
B [A项,Fe(OH)2被HNO3氧化为Fe3+,错误;C项,CO2通入少量澄清石灰水中生成可溶的Ca(HCO3)2,错误;D项,Na与H+反应,错误。]
2.(2022·长沙模拟)下列有关海水综合利用的离子方程式不正确的是( )
A.海水提镁中用石灰乳沉镁:Mg2++2OH-===Mg(OH)2↓
A [石灰乳在离子方程式中应写化学式,该离子方程式为Mg2++Ca(OH)2===Mg(OH)2+Ca2+,故A错误。]
3.离子反应在日常生活中很普遍,写出下列反应的离子方程式。
(1)稀盐酸除去铁锈:______________________。
(2)工业上制取“84”消毒液:______________________。
(3)小苏打治疗胃酸过多:______________________。
(4)FeCl3腐蚀铜印刷电路板:______________________。
(5)食醋除去水垢:______________________。
(6)“曾青得铁则化为铜”湿法冶金:______________________。
[答案] (1)Fe2O3+6H+===2Fe3++3H2O
(2)Cl2+2OH-===Cl-+ClO-+H2O (3)HCO +H+===CO2↑+H2O (4)2Fe3++Cu===2Fe2++Cu2+ (5)CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O (6)Cu2++Fe===Cu+Fe2+
4.写出下列反应的离子方程式。
(1)FeO溶于稀HNO3:______________________。
(2)NH4Cl溶液与NaOH溶液共热反应:______________________。
(3)FeCl2溶液中加入H2O2溶液:______________________。
(4)NO2溶于水中:______________________。
(5)氨气通入醋酸中:______________________。
(6)Cu与浓HNO3反应:______________________。
(7)Na2CO3溶液呈碱性:______________________。
(1)三大浓酸:浓盐酸、浓硝酸中溶质全部电离,可拆分为离子形式;浓硫酸中溶质主要以分子H2SO4形式存在,用化学式H2SO4形式。
(2)盐类水解的离子方程式用“ ”,不用“↓”“↑”;相互促进的完全水解反应的离子方程式用“===”“↓”“↑”。
(3)溶液中铵盐与碱反应时,浓溶液或加热放出NH3,稀溶液不加热写NH3·H2O。
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·浙江6月选考,T13)下列反应的离子方程式不正确的是( )
1
3
2
4
D [盐酸中滴加Na2SiO3溶液,反应生成硅酸沉淀,A正确;亚硫酸的酸性强于碳酸,因此,Na2CO3溶液中通入过量SO2,反应生成亚硫酸氢钠和二氧化碳,B正确;乙醇与K2Cr2O7酸性溶液发生氧化还原反应,乙醇被氧化为乙酸, Cr2O 被还原为Cr3+,C正确;类比氯气与碱反应可知,溴与冷的NaOH溶液反应生成溴化钠、次溴酸钠和水,该反应的离子方程式为Br2+2OH-===Br-+BrO-+H2O,D不正确。]
1
3
2
4
2.(2021·北京等级考,T7)下列方程式不能准确解释相应实验现象的是( )
A.酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O
B.金属钠在空气中加热生成淡黄色固体:4Na+O2===2Na2O
C.铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O===2AlO +3H2↑
D.将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S===3S↓+2H2O
1
3
2
4
B [CH3COONa溶液呈碱性是因为CH3COO-发生了水解,A正确;金属钠在空气中加热生成淡黄色固体过氧化钠,B错误;铝与NaOH溶液反应生成偏铝酸钠和氢气,C正确;将SO2通入氢硫酸中生成S单质和水,D正确。]
1
3
2
4
3.(2021·全国乙卷,T9)下列过程中的化学反应,相应的离子方程式正确的是( )
1
3
2
4
A [用碳酸钠溶液处理水垢中的硫酸钙,发生难溶电解质的转化,硫酸钙转化为碳酸钙,A正确;过量铁粉加入稀硝酸中,最终生成Fe2+,B错误;向硫酸铝溶液中滴加少量氢氧化钾溶液,反应的离子方程式为Al3++3OH-===Al(OH)3↓,C错误;氯化铜溶液中通入硫化氢,H2S是弱酸,应写化学式,反应的离子方程式为Cu2++H2S===CuS↓+2H+,D错误。]
1
3
2
4
4.(2021·浙江6月选考,T13)不能正确表示下列变化的离子方程式是 ( )
2
3
4
1
2
3
4
1
根据题中情境完成有关离子方程式。
1.固体V2O5是两性氧化物,在强酸性溶液中以钒氧基离子(VO3+)形式存在,在强碱性溶液中以钒酸根离子(VO )形式存在。VO3+具有强氧化性,能将Cl-氧化为Cl2,本身被还原成VO+。写出V2O5溶于下列溶液中发生反应的离子方程式。
(1)溶于硫酸:_____________________,
(2)溶于氢氧化钠溶液:__________________,
(3)溶于盐酸:________________。
[答案] (1)V2O5+6H+===2VO3++3H2O
(2)V2O5+2OH-===2VO +H2O
(3)V2O5+6H++4Cl-===2VO++2Cl2↑+3H2O
2.已知N2H4与NH3的性质相似,分别写出N2H4与少量盐酸、过量盐酸反应的离子方程式:_______________、______________________。
3.钛铁矿(主要成分为FeTiO3)用盐酸“酸浸”后,钛主要以TiOCl 形式存在,写出相应反应的离子方程式:________________。
[答案] FeTiO3+4H++4Cl-===TiOCl +Fe2++2H2O
谢谢观看 THANK YOU!
第5讲 离子反应 离子方程式
(基础课)
第一部分 化学基本概念
第二章 化学物质及其变化
1.了解电解质的分类及其电离。 2.理解电解质溶液导电的原理。 3.了解离子反应的概念、发生的条件和离子方程式的书写。
知识点一 电解质及其电离
必备知识梳理
关键能力训练
01
1.电解质
(1)电解质的分类
熔融状态下
强电解质
弱电解质
(2)电解质的强弱与物质类别的关系
①强电解质:______、______、绝大多数盐,如HNO3、NaOH、CaCO3等
②弱电解质:______、______和____等,如乙酸、一水合氨等
(3)常见的强酸、强碱
①强酸:HCl、HNO3、H2SO4、HClO4、HBr、HI等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
强酸
强碱
弱酸
弱碱
水
①过渡元素形成的碱一般为弱碱,如Fe(OH)3、AgOH等。
②羧酸为弱酸,酚为弱酸。
2.金属导电与电解质溶液导电的原理比较
原理比较 金属导电 电解质溶液导电
导电微粒 __________ 自由移动的______
导电能 力影响 Ag>Cu> Al>Fe 自由移动离子的浓度和离子的电荷数(与电解质强弱无关)
温度影响 温度升高,导电性______ 温度升高,弱电解质溶液导电性______,强电解质溶液导电性______
自由电子
离子
减弱
增强
不变
3.电解质的电离
(1)电离是指电解质_______________时,形成自由移动的离子的过程。
(2)电离方程式的书写
①强电解质的电离方程式中,用“________”连接,弱电解质(包括弱酸的酸式酸根离子)的电离方程式中,用“________”连接。
如Na2SO4:_____________________________;
HClO:________________________。
②多元弱酸的电离分步书写,多元弱碱的电离一步写出。
如H2CO3:________________________,_______________________;
Fe(OH)3:_____________________________。
溶于水或受热熔化
===
③酸式盐的电离。
如NaHSO4溶液中:___________________________________;
NaHCO3溶液中:_______________________________,
____________________;
NaHSO4(熔融):_____________________________________。
④两性氢氧化物[Al(OH)3]的电离。
Al3++3OH-
⑤特殊电离方程式:
电解质及溶液的导电性
1.下表中物质的分类组合完全正确的是( )
选项 A B C D
强电解质 KNO3 H2SO4 BaSO4 HClO4
弱电解质 HF CaCO3 HClO CH3COONH4
非电解质 SO2 金属Al H2O C2H5OH
A [B项中的CaCO3属于强电解质,Al为单质,既不属于电解质,也不属于非电解质,错误;C项中的H2O为弱电解质,错误;D项中的CH3COONH4为强电解质,错误。]
2.下列物质中,溶于水时导电但熔化或液态时不导电的电解质是( )
A.Na2CO3 B.H2SO4
C.SO3 D.NH3
[答案] B
3.下列物质导电性最强的是( )
A.0.1 mol/L NaHSO4溶液
B.0.1 mol/L 的CaCl2溶液
C.0.1 mol/L 的Na3PO4溶液
D.0.1 mol/L 的Mg(NO3)2溶液
C [溶液的导电能力取决于自由移动离子的浓度和离子的电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强,C正确。]
(1)某物质的水溶液导电,该物质不一定为电解质,还要看该物质在水中是否电离。如CO2、NH3、SO3的水溶液导电,但CO2、NH3、SO3为非电解质。
(2)电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如金属单质和电解质溶液等。
(3)强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱,如极稀的NaCl溶液的导电能力不如浓氨水的导电能力强。溶液的导电能力取决于自由移动离子的浓度和离子的电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强。
电解质的电离及电离方程式
4.(2022·黄冈检测)下列电离方程式正确的是( )
B [A项,电离方程式应为NaHCO3===Na++HCO ;B项,BOH为弱碱,电离过程可逆;C项,HA为弱酸,电离过程可逆;D项,CaCO3难溶,但属于强电解质,全部电离。]
5.写出下列电离方程式
(1)NaHSO4熔化电离:____________,NaHSO4溶于水电离:___________。
(2)Al(OH)3的酸式电离:__________________。
(3)H2S溶于水电离:____________________。
(4)Cu(OH)2溶于水电离:________________。
(5)甘氨酸的碱式电离:_____________。
知识点二 离子反应与离子方程式
02
必备知识梳理
关键能力训练
1.离子反应
(1)概念:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
(2)离子反应的条件
②氧化还原反应:如置换反应等。
③络合反应:如Fe3+与SCN-的络合反应等。
(3)离子反应的本质:溶液中某些离子的减少。
难溶
2.离子方程式
(1)定义:用实际参加反应的__________来表示反应的式子。
(2)书写步骤(以CaCO3与盐酸的反应为例)
离子符号
CaCO3+2HCl===CaCl2+CO2↑+H2O
+2H++2Cl-===Ca2++2Cl-+CO2↑+H2O
CaCO3+2H+===Ca2+
+CO2↑+H2O
CaCO3
(3)意义:不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。如氢氧化钠溶液和盐酸反应、氢氧化钾溶液和硝酸反应的离子方程式,都可用_________________________表示。
H++OH-===H2O
①易溶的强电解质(强酸、强碱、大多数可溶性盐)写成离子形式。难溶电解质、弱电解质、水、气体、氧化物、单质写成化学式。
②酸式盐
③微溶物:对于反应物,是否写成离子形式由其是否为溶液状态决定,如石灰乳写成化学式Ca(OH)2,澄清石灰水写成Ca2+和OH-;对于生成物,一般写化学式,如生成CaSO4时不能写成Ca2+和SO
1.写出下列反应的化学方程式和离子方程式。
(1)稀H2SO4与CuO反应:______________________。
(2)CaCO3与稀盐酸反应:______________________。
(3)氨水与AlCl3溶液反应:______________________。
(4)NaHCO3溶液与NaOH溶液反应:______________________。
(5)Cl2与澄清石灰水反应:______________________。
[答案] (1)H2SO4+CuO===CuSO4+H2O 2H++CuO===Cu2++H2O
(2)CaCO3+2HCl===CaCl2+CO2↑+H2O
CaCO3+2H+===Ca2++CO2↑+H2O
(3)3NH3·H2O+AlCl3===Al(OH)3↓+3NH4Cl
3NH3·H2O+Al3+===Al(OH)3↓+3NH
(4)NaHCO3+NaOH===Na2CO3+H2O
HCO +OH-===CO +H2O
(5)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O Cl2+2OH-===Cl-+ClO-+H2O
2.根据下列离子方程式写出相应化学方程式。
[答案] (1)NaOH+NH4Cl===NH3·H2O+NaCl(合理即可)
(2)Na2CO3+2HNO3===2NaNO3+H2O+CO2↑(合理即可)
1.(2022·泰安模拟)下列离子方程式书写正确的是( )
A.氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
B.向胆矾溶液中加入少量过氧化钠:2Na2O2+2Cu2++2H2O===2Cu(OH)2↓+4Na++O2↑
C.CO2通入少量澄清石灰水中:CO2+Ca2++2OH-===CaCO3↓+H2O
D.在硫酸氢钠溶液中加入小块钠:2Na+2H2O===2Na++2OH-+H2↑
B [A项,Fe(OH)2被HNO3氧化为Fe3+,错误;C项,CO2通入少量澄清石灰水中生成可溶的Ca(HCO3)2,错误;D项,Na与H+反应,错误。]
2.(2022·长沙模拟)下列有关海水综合利用的离子方程式不正确的是( )
A.海水提镁中用石灰乳沉镁:Mg2++2OH-===Mg(OH)2↓
A [石灰乳在离子方程式中应写化学式,该离子方程式为Mg2++Ca(OH)2===Mg(OH)2+Ca2+,故A错误。]
3.离子反应在日常生活中很普遍,写出下列反应的离子方程式。
(1)稀盐酸除去铁锈:______________________。
(2)工业上制取“84”消毒液:______________________。
(3)小苏打治疗胃酸过多:______________________。
(4)FeCl3腐蚀铜印刷电路板:______________________。
(5)食醋除去水垢:______________________。
(6)“曾青得铁则化为铜”湿法冶金:______________________。
[答案] (1)Fe2O3+6H+===2Fe3++3H2O
(2)Cl2+2OH-===Cl-+ClO-+H2O (3)HCO +H+===CO2↑+H2O (4)2Fe3++Cu===2Fe2++Cu2+ (5)CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O (6)Cu2++Fe===Cu+Fe2+
4.写出下列反应的离子方程式。
(1)FeO溶于稀HNO3:______________________。
(2)NH4Cl溶液与NaOH溶液共热反应:______________________。
(3)FeCl2溶液中加入H2O2溶液:______________________。
(4)NO2溶于水中:______________________。
(5)氨气通入醋酸中:______________________。
(6)Cu与浓HNO3反应:______________________。
(7)Na2CO3溶液呈碱性:______________________。
(1)三大浓酸:浓盐酸、浓硝酸中溶质全部电离,可拆分为离子形式;浓硫酸中溶质主要以分子H2SO4形式存在,用化学式H2SO4形式。
(2)盐类水解的离子方程式用“ ”,不用“↓”“↑”;相互促进的完全水解反应的离子方程式用“===”“↓”“↑”。
(3)溶液中铵盐与碱反应时,浓溶液或加热放出NH3,稀溶液不加热写NH3·H2O。
真题感悟·明确考向
03
真题 感悟
情境 探究
1.(2022·浙江6月选考,T13)下列反应的离子方程式不正确的是( )
1
3
2
4
D [盐酸中滴加Na2SiO3溶液,反应生成硅酸沉淀,A正确;亚硫酸的酸性强于碳酸,因此,Na2CO3溶液中通入过量SO2,反应生成亚硫酸氢钠和二氧化碳,B正确;乙醇与K2Cr2O7酸性溶液发生氧化还原反应,乙醇被氧化为乙酸, Cr2O 被还原为Cr3+,C正确;类比氯气与碱反应可知,溴与冷的NaOH溶液反应生成溴化钠、次溴酸钠和水,该反应的离子方程式为Br2+2OH-===Br-+BrO-+H2O,D不正确。]
1
3
2
4
2.(2021·北京等级考,T7)下列方程式不能准确解释相应实验现象的是( )
A.酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O
B.金属钠在空气中加热生成淡黄色固体:4Na+O2===2Na2O
C.铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O===2AlO +3H2↑
D.将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S===3S↓+2H2O
1
3
2
4
B [CH3COONa溶液呈碱性是因为CH3COO-发生了水解,A正确;金属钠在空气中加热生成淡黄色固体过氧化钠,B错误;铝与NaOH溶液反应生成偏铝酸钠和氢气,C正确;将SO2通入氢硫酸中生成S单质和水,D正确。]
1
3
2
4
3.(2021·全国乙卷,T9)下列过程中的化学反应,相应的离子方程式正确的是( )
1
3
2
4
A [用碳酸钠溶液处理水垢中的硫酸钙,发生难溶电解质的转化,硫酸钙转化为碳酸钙,A正确;过量铁粉加入稀硝酸中,最终生成Fe2+,B错误;向硫酸铝溶液中滴加少量氢氧化钾溶液,反应的离子方程式为Al3++3OH-===Al(OH)3↓,C错误;氯化铜溶液中通入硫化氢,H2S是弱酸,应写化学式,反应的离子方程式为Cu2++H2S===CuS↓+2H+,D错误。]
1
3
2
4
4.(2021·浙江6月选考,T13)不能正确表示下列变化的离子方程式是 ( )
2
3
4
1
2
3
4
1
根据题中情境完成有关离子方程式。
1.固体V2O5是两性氧化物,在强酸性溶液中以钒氧基离子(VO3+)形式存在,在强碱性溶液中以钒酸根离子(VO )形式存在。VO3+具有强氧化性,能将Cl-氧化为Cl2,本身被还原成VO+。写出V2O5溶于下列溶液中发生反应的离子方程式。
(1)溶于硫酸:_____________________,
(2)溶于氢氧化钠溶液:__________________,
(3)溶于盐酸:________________。
[答案] (1)V2O5+6H+===2VO3++3H2O
(2)V2O5+2OH-===2VO +H2O
(3)V2O5+6H++4Cl-===2VO++2Cl2↑+3H2O
2.已知N2H4与NH3的性质相似,分别写出N2H4与少量盐酸、过量盐酸反应的离子方程式:_______________、______________________。
3.钛铁矿(主要成分为FeTiO3)用盐酸“酸浸”后,钛主要以TiOCl 形式存在,写出相应反应的离子方程式:________________。
[答案] FeTiO3+4H++4Cl-===TiOCl +Fe2++2H2O
谢谢观看 THANK YOU!
同课章节目录
