第8讲 氧化还原反应的概念和规律(基础课)(55张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第8讲 氧化还原反应的概念和规律(基础课)(55张PPT)-2024届高考化学一轮复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 00:00:00 | ||
图片预览








文档简介
(共55张PPT)
第8讲 氧化还原反应的概念和规律(基础课)
第一部分 化学基本概念
第二章 化学物质及其变化
1.了解氧化还原反应的特征和本质。 2.了解氧化还原反应的概念及其联系。 3.掌握电子转移的表示方法。 4.掌握常见的氧化剂、还原剂及其性质强弱。 5.理解氧化还原反应中的价态转化规律和反应先后规律及其这些规律的应用。
知识点一 氧化还原反应的概念及其相互联系
必备知识梳理
关键能力训练
01
1.氧化还原反应的本质和特征
元素化合价变化
电子转移
2.氧化剂与还原剂
得到
偏向
氧化
失去
偏离
还原
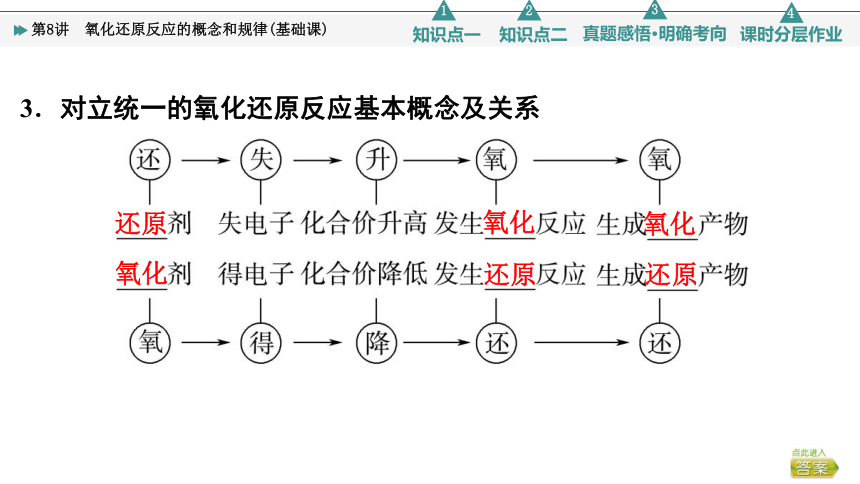
3.对立统一的氧化还原反应基本概念及关系
还原
氧化
氧化
氧化
还原
还原
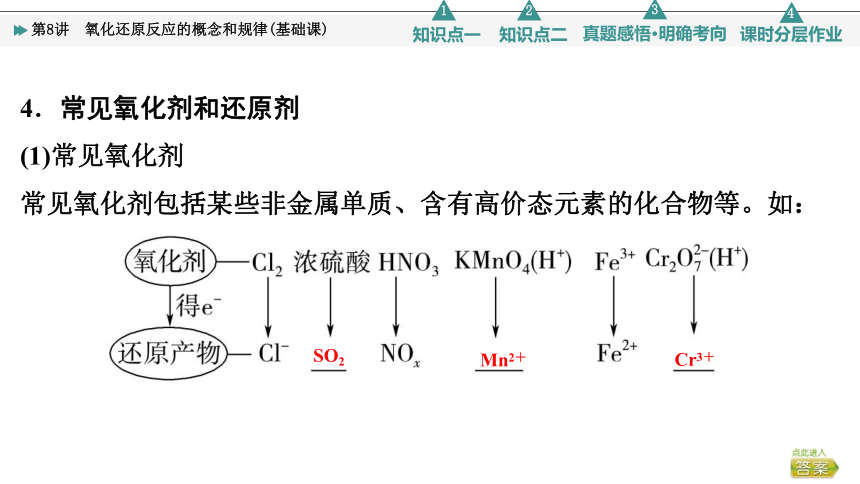
4.常见氧化剂和还原剂
(1)常见氧化剂
常见氧化剂包括某些非金属单质、含有高价态元素的化合物等。如:
SO2
Mn2+
Cr3+
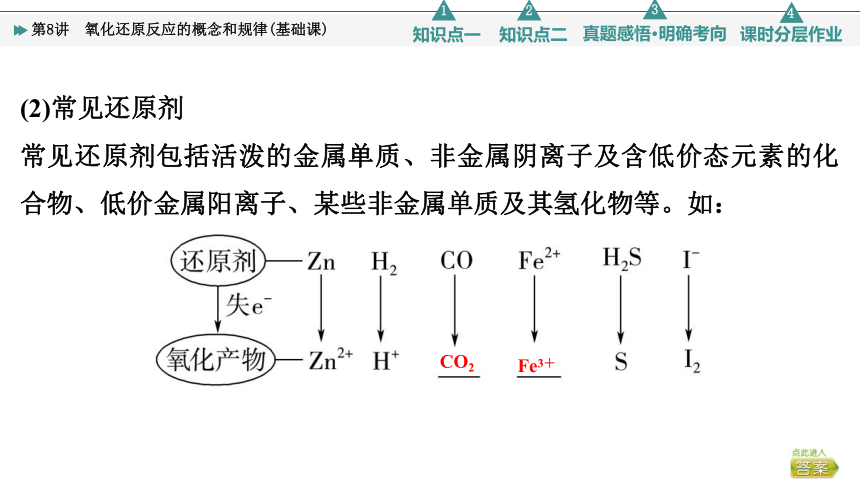
(2)常见还原剂
常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
CO2
Fe3+
5.电子转移的两种表示方法
(1)双线桥法:标变价―→画箭头―→标得失―→定数目。
示例:C与浓硫酸反应:
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到”“失去”字样。
①氧化还原反应中,可能一种物质或一种元素既被氧化(还原剂)又被还原(氧化剂),也可能一种物质既是氧化产物又是还原产物。
②化合价升降数=电子得失数=电子转移数。
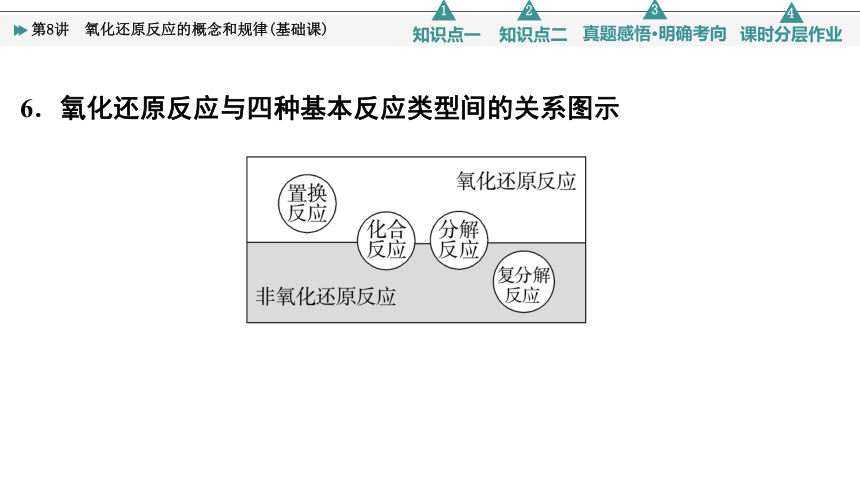
6.氧化还原反应与四种基本反应类型间的关系图示
有单质参加的化合反应或有单质生成的分解反应一定为氧化还原反应,但有单质参加或生成的化学反应不一定都是氧化还原反应,如3O2 2O3不是氧化还原反应。
对于2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
请回答下列问题:
(1)此反应中,被氧化的元素为________,氧化剂是________。
(2)此反应中HCl表现的性质有________。
(3)氧化产物为________,还原产物为________。
(4)标准状况下,生成2.24 L Cl2,转移电子数为________(设NA为阿伏加德罗常数的值)。
(5)用单线桥表示该反应的电子转移方向与数目。_________。
[答案] (1)Cl或氯 KMnO4 (2)还原性、酸性 (3)Cl2 MnCl2 (4)0.2NA
1.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度高达2 700 ℃,对于该反应,下列说法正确的是 ( )
A.该反应属于置换反应
B.N2H4为氧化剂,发生还原反应
C.N2O4为氧化剂,发生氧化反应
D.N2既是氧化产物又是还原产物
D [该反应中无单质参加反应,N2H4为还原剂,发生氧化反应,N2O4为氧化剂,发生还原反应,N2既是氧化产物又是还原产物。]
2.饮用水中的NO 对人类健康会产生危害,为了降低饮用水中NO
的浓度,某饮用水研究人员指出,在碱性条件下用铝粉将NO 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O(设NA为阿伏加德罗常数的值)。
下列有关该反应的说法中,正确的是( )
A.反应中铝元素的化合价升高,被还原
B.若有10 mol铝原子参与反应,则转移的电子总数为30
C.用双线桥表示的电子转移为 +2H2O
D.可以用单线桥将电子转移表示为 +4NaOH===10NaAlO2+3N2↑+2H2O
3.(2022·益阳模拟)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A.NF3既表现了氧化性又表现了还原性
B.HF是还原产物
C.还原剂和氧化剂的物质的量之比是2∶1
D.3 mol NF3参加反应转移电子2 mol
4.(1)对于3NO2+H2O===2HNO3+NO反应,当有1.5 mol NO2完全反应时,转移电子数为________(设NA为阿伏加德罗常数的值)。
(2)已知将过氧化钠加入硫酸亚铁盐溶液中发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,每4 mol Na2O2发生反应转移________ mol e-。
[解析] (1)1.5 mol NO2中有 ×1.5 mol NO2作还原剂,即N(e-)=
×1.5×NA=NA。
(2)4 mol Na2O2中有3 mol Na2O2作氧化剂,即n(e-)=6 mol。
[答案] (1)NA (2)6
转移电子的计算思路
[ne-=n(氧化剂)或n(还原剂)×N(变价原子数)×ΔN(化合价变化数)]。
知识点二 物质的氧化性与还原性
02
必备知识梳理
关键能力训练
1.氧化性、还原性的含义及判断
(1)氧化性:指________的性质(或能力);还原性:指________的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的______程度,与得、失电子数目的多少无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。
得电子
失电子
难易
(3)从元素的价态判断
①最高价态——只有________,如:Fe3+、H2SO4、KMnO4等。
②最低价态——只有________,如:金属单质、Cl-、S2-等。
③中间价态——既有________,又有________,如:Fe2+、S、Cl2等。
氧化性
还原性
氧化性
还原性
2.氧化性与还原性强弱比较
(1)依据氧化还原反应方程式判断
氧化剂+还原剂===还原产物+氧化产物
氧化性:氧化剂____氧化产物(填“>”或“<”,下同);
还原性:还原剂____还原产物。
(2)依据反应条件及反应的剧烈程度判断
反应条件(如是否加热、有无催化剂和反应物浓度大小等)要求越低,反应越剧烈,物质的氧化性或还原性越强。
>
>
(3)依据产物中元素价态的高低来判断
①相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例如:
>
②相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如:
>
同一种物质氧化性或还原性强弱的一般规律:浓度越大,温度越高,性质越强。
判断正误(正确的打“√”,错误的打“×”)
(1)强氧化剂与强还原剂一定能发生氧化还原反应。( )
(2)阳离子只有氧化性,阴离子只有还原性。( )
(3)SO 、NO 中非氧元素的化合价均为最高价,一定能表现出强氧化性。( )
(4)Cu与浓HNO3、稀HNO3反应的还原产物分别为NO2、NO,说明稀HNO3的氧化性比浓HNO3强。( )
(5)同一元素不同价态的化合物中,元素的化合价越高,物质的氧化性越强。( )
(6)物质氧化性或还原性的强弱取决于得到或失去电子的数目。( )
[答案] (1)× (2)× (3)× (4)× (5)× (6)×
氧化性与还原性的比较
1.已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O >I2
C [化合物KCrO2中K为+1价,O为-2价,所以Cr为+3价,选项A正确;由①可知Cr2O3与氢氧化钠和硫酸反应均得到盐和水,所以是两性氧化物,选项B正确;向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液,这个过程表现的是H2O2的氧化性,与其还原性无关,选项C错误;将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝说明K2Cr2O7将碘化钾氧化为I2,所以说明氧化性:Cr2O >I2,选项D正确。]
2.(2022·深圳模拟)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2+6FeI2===2FeCl3+4FeI3
B.Cl2+FeI2===FeCl2+I2
C.Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-===2Fe2++I2
A [根据信息,I-的还原性强于Fe2+,因此Cl2先氧化I-,A错误;还原性I->Fe2+,氯气先和I-反应,过量的氯气再和Fe2+反应,B正确;Co2O3的氧化性强于Cl2,反应中有氯气生成,C正确;Fe3+的氧化性强于I2,因此两者发生反应,D正确。]
3.在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应。已知:
①半反应式:Cu2O-2e-+2H+===2Cu2++H2O
②五种物质:FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI
C [①中Cu2O→Cu2+,铜元素化合价升高,发生的是氧化反应,A项正确;为使①顺利发生,要选择氧化性强的物质作氧化剂,而Fe2(SO4)3可作①的氧化剂,B项正确;配平反应③为5Fe2++MnO +8H+===5Fe3++Mn2++4H2O,反应在酸性条件下进行,③的半反应中不能生成OH-,C项错误;根据上述分析可知氧化性:Fe3+>Cu2+,根据③可知氧化性:MnO >Fe3+,即氧化性:MnO >Fe3+>Cu2+,D项正确。]
氧化性与还原性的实验探究
4.(2022·武汉模拟)已知下列四组实验:①向KMnO4晶体上滴加浓盐酸,产生氯气;②向FeCl2溶液中通入少量氯气,溶液变黄色;③向FeCl2溶液中加入少量溴水,溶液变黄色;④分别取实验②和实验③中生成的溶液,分别滴在淀粉 KI试纸上,试纸都变蓝色。则下列判断不正确的是( )
A.实验①能够证明Cl-具有还原性
B.上述实验能够证明氧化性:Cl2>Br2
C.上述实验能够证明氧化性:MnO >Cl2>Fe3+>I2
D.由上述实验也可推测氯气能使湿润的淀粉 KI试纸变蓝
B [高锰酸钾能将浓盐酸氧化为氯气,高锰酸钾作氧化剂,HCl作还原剂,证明Cl-具有还原性,A项正确;氯气能将亚铁离子氧化为三价铁离子,氯气作氧化剂,溴水将亚铁离子氧化为三价铁离子,溴单质作氧化剂,说明氧化性:Cl2>Fe3+,Br2>Fe3+,但是不能证明氧化性:Cl2>Br2,B项错误;每个反应的氧化剂的氧化性大于氧化产物的氧化性,故由A、B项分析可知,氧化性:MnO >Cl2、Cl2>Fe3+,三价铁离子将碘离子氧化为单质碘,Fe2+是还原产物,单质碘是氧化产物,所以氧化性:Fe3+>I2,则能够证明氧化性:MnO >Cl2>Fe3+>I2,C项正确;由实验可推知氧化性:Cl2>Fe3+>I2,实验④试纸变蓝是因为Fe3+将I-氧化成I2从而可推测Cl2也能氧化I-为I2,能使湿润淀粉 KI试纸变蓝,D项正确。]
5.某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验:
实验①:取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出实验②中发生氧化还原反应的离子方程式:___________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________(填字母)。
A.Br2>I2 B.Fe3+>Br2
C.Br2>Fe3+ D.I->Br-
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验方案加以证明。
①FeCl3溶液 ②碘水 ③KI溶液 ④稀硫酸
⑤淀粉液
(提示:实验方案包括实验步骤、现象及结论)_____________。
[解析] 实验①:取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色,说明有碘单质生成,说明Br2的氧化性强于I2;实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色,说明有Fe3+生成,说明Br2的氧化性强于Fe3+。欲证明氧化性:Fe3+>I2,只需证明Fe3+与I-反应有I2生成即可。
[答案] (1)2Fe2++Br2===2Fe3++2Br-
(2)AC (3)取少量FeCl3溶液于试管中,依次加入KI溶液和淀粉液,振荡,淀粉变蓝,证明Fe3+的氧化性强于I2
真题感悟·明确考向
03
真题 感悟
情境 探究
1
3
2
1
3
2
2.(2022·浙江1月选考,T10)关于反应4CO2+SiH4 4CO+2H2O+SiO2,下列说法正确的是 ( )
A.CO是氧化产物
B.SiH4发生还原反应
C.氧化剂与还原剂的物质的量之比为1∶4
D.生成1 mol SiO2时,转移8 mol电子
D [由方程式可知,CO是还原产物;SiH4发生氧化反应;氧化剂与还原剂分别为CO2和SiH4,反应中物质的量之比为4∶1;每生成1 mol SiO2,转移8 mol 电子。]
1
3
2
3.(2021·浙江1月选考,T10)关于反应8NH3+6NO2===7N2+12H2O,下列说法正确的是( )
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的物质的量之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
1
3
2
D [该反应为归中反应,NH3中氮化合价元素从-3价升高至0价,氮元素被氧化,NO2中氮元素化合价从+4价降低至0价,得到电子,依据反应关系,还原剂与氧化剂的物质的量之比为4∶3,氧化产物与还原产物的物质的量之比为4∶3,故A、B、C不正确,D正确。]
1
3
2
利用绿矾(FeSO4·5H2O)可制备一种新型、高效、多功能绿色水处理剂高铁酸钾(K2FeO4)。
已知:高铁酸钾氧化性比Cl2、O2、ClO2、KMnO4更强;主要反应:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
(1)该反应中的氧化剂是________,还原剂是________________。
(2)简要说明K2FeO4作为水处理剂时所起的作用为_______。
(3)当生成1 mol O2时,该反应转移的电子数为________(设NA为阿伏加德罗常数的值)。
(4)该反应中,被氧化的Na2O2与被还原的Na2O2的质量比为________。
[解析] (1)该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价。得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以氧化剂是Na2O2,还原剂是Na2O2、FeSO4。(2)K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附除去水中的悬浮杂质。
[答案] (1)Na2O2 Na2O2、FeSO4 (2)高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降 (3)10NA (4)1∶5
谢谢观看 THANK YOU!
第8讲 氧化还原反应的概念和规律(基础课)
第一部分 化学基本概念
第二章 化学物质及其变化
1.了解氧化还原反应的特征和本质。 2.了解氧化还原反应的概念及其联系。 3.掌握电子转移的表示方法。 4.掌握常见的氧化剂、还原剂及其性质强弱。 5.理解氧化还原反应中的价态转化规律和反应先后规律及其这些规律的应用。
知识点一 氧化还原反应的概念及其相互联系
必备知识梳理
关键能力训练
01
1.氧化还原反应的本质和特征
元素化合价变化
电子转移
2.氧化剂与还原剂
得到
偏向
氧化
失去
偏离
还原
3.对立统一的氧化还原反应基本概念及关系
还原
氧化
氧化
氧化
还原
还原
4.常见氧化剂和还原剂
(1)常见氧化剂
常见氧化剂包括某些非金属单质、含有高价态元素的化合物等。如:
SO2
Mn2+
Cr3+
(2)常见还原剂
常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
CO2
Fe3+
5.电子转移的两种表示方法
(1)双线桥法:标变价―→画箭头―→标得失―→定数目。
示例:C与浓硫酸反应:
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到”“失去”字样。
①氧化还原反应中,可能一种物质或一种元素既被氧化(还原剂)又被还原(氧化剂),也可能一种物质既是氧化产物又是还原产物。
②化合价升降数=电子得失数=电子转移数。
6.氧化还原反应与四种基本反应类型间的关系图示
有单质参加的化合反应或有单质生成的分解反应一定为氧化还原反应,但有单质参加或生成的化学反应不一定都是氧化还原反应,如3O2 2O3不是氧化还原反应。
对于2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
请回答下列问题:
(1)此反应中,被氧化的元素为________,氧化剂是________。
(2)此反应中HCl表现的性质有________。
(3)氧化产物为________,还原产物为________。
(4)标准状况下,生成2.24 L Cl2,转移电子数为________(设NA为阿伏加德罗常数的值)。
(5)用单线桥表示该反应的电子转移方向与数目。_________。
[答案] (1)Cl或氯 KMnO4 (2)还原性、酸性 (3)Cl2 MnCl2 (4)0.2NA
1.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度高达2 700 ℃,对于该反应,下列说法正确的是 ( )
A.该反应属于置换反应
B.N2H4为氧化剂,发生还原反应
C.N2O4为氧化剂,发生氧化反应
D.N2既是氧化产物又是还原产物
D [该反应中无单质参加反应,N2H4为还原剂,发生氧化反应,N2O4为氧化剂,发生还原反应,N2既是氧化产物又是还原产物。]
2.饮用水中的NO 对人类健康会产生危害,为了降低饮用水中NO
的浓度,某饮用水研究人员指出,在碱性条件下用铝粉将NO 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O(设NA为阿伏加德罗常数的值)。
下列有关该反应的说法中,正确的是( )
A.反应中铝元素的化合价升高,被还原
B.若有10 mol铝原子参与反应,则转移的电子总数为30
C.用双线桥表示的电子转移为 +2H2O
D.可以用单线桥将电子转移表示为 +4NaOH===10NaAlO2+3N2↑+2H2O
3.(2022·益阳模拟)三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A.NF3既表现了氧化性又表现了还原性
B.HF是还原产物
C.还原剂和氧化剂的物质的量之比是2∶1
D.3 mol NF3参加反应转移电子2 mol
4.(1)对于3NO2+H2O===2HNO3+NO反应,当有1.5 mol NO2完全反应时,转移电子数为________(设NA为阿伏加德罗常数的值)。
(2)已知将过氧化钠加入硫酸亚铁盐溶液中发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,每4 mol Na2O2发生反应转移________ mol e-。
[解析] (1)1.5 mol NO2中有 ×1.5 mol NO2作还原剂,即N(e-)=
×1.5×NA=NA。
(2)4 mol Na2O2中有3 mol Na2O2作氧化剂,即n(e-)=6 mol。
[答案] (1)NA (2)6
转移电子的计算思路
[ne-=n(氧化剂)或n(还原剂)×N(变价原子数)×ΔN(化合价变化数)]。
知识点二 物质的氧化性与还原性
02
必备知识梳理
关键能力训练
1.氧化性、还原性的含义及判断
(1)氧化性:指________的性质(或能力);还原性:指________的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的______程度,与得、失电子数目的多少无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。
得电子
失电子
难易
(3)从元素的价态判断
①最高价态——只有________,如:Fe3+、H2SO4、KMnO4等。
②最低价态——只有________,如:金属单质、Cl-、S2-等。
③中间价态——既有________,又有________,如:Fe2+、S、Cl2等。
氧化性
还原性
氧化性
还原性
2.氧化性与还原性强弱比较
(1)依据氧化还原反应方程式判断
氧化剂+还原剂===还原产物+氧化产物
氧化性:氧化剂____氧化产物(填“>”或“<”,下同);
还原性:还原剂____还原产物。
(2)依据反应条件及反应的剧烈程度判断
反应条件(如是否加热、有无催化剂和反应物浓度大小等)要求越低,反应越剧烈,物质的氧化性或还原性越强。
>
>
(3)依据产物中元素价态的高低来判断
①相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例如:
>
②相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如:
>
同一种物质氧化性或还原性强弱的一般规律:浓度越大,温度越高,性质越强。
判断正误(正确的打“√”,错误的打“×”)
(1)强氧化剂与强还原剂一定能发生氧化还原反应。( )
(2)阳离子只有氧化性,阴离子只有还原性。( )
(3)SO 、NO 中非氧元素的化合价均为最高价,一定能表现出强氧化性。( )
(4)Cu与浓HNO3、稀HNO3反应的还原产物分别为NO2、NO,说明稀HNO3的氧化性比浓HNO3强。( )
(5)同一元素不同价态的化合物中,元素的化合价越高,物质的氧化性越强。( )
(6)物质氧化性或还原性的强弱取决于得到或失去电子的数目。( )
[答案] (1)× (2)× (3)× (4)× (5)× (6)×
氧化性与还原性的比较
1.已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O >I2
C [化合物KCrO2中K为+1价,O为-2价,所以Cr为+3价,选项A正确;由①可知Cr2O3与氢氧化钠和硫酸反应均得到盐和水,所以是两性氧化物,选项B正确;向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液,这个过程表现的是H2O2的氧化性,与其还原性无关,选项C错误;将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝说明K2Cr2O7将碘化钾氧化为I2,所以说明氧化性:Cr2O >I2,选项D正确。]
2.(2022·深圳模拟)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2+6FeI2===2FeCl3+4FeI3
B.Cl2+FeI2===FeCl2+I2
C.Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-===2Fe2++I2
A [根据信息,I-的还原性强于Fe2+,因此Cl2先氧化I-,A错误;还原性I->Fe2+,氯气先和I-反应,过量的氯气再和Fe2+反应,B正确;Co2O3的氧化性强于Cl2,反应中有氯气生成,C正确;Fe3+的氧化性强于I2,因此两者发生反应,D正确。]
3.在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应。已知:
①半反应式:Cu2O-2e-+2H+===2Cu2++H2O
②五种物质:FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI
C [①中Cu2O→Cu2+,铜元素化合价升高,发生的是氧化反应,A项正确;为使①顺利发生,要选择氧化性强的物质作氧化剂,而Fe2(SO4)3可作①的氧化剂,B项正确;配平反应③为5Fe2++MnO +8H+===5Fe3++Mn2++4H2O,反应在酸性条件下进行,③的半反应中不能生成OH-,C项错误;根据上述分析可知氧化性:Fe3+>Cu2+,根据③可知氧化性:MnO >Fe3+,即氧化性:MnO >Fe3+>Cu2+,D项正确。]
氧化性与还原性的实验探究
4.(2022·武汉模拟)已知下列四组实验:①向KMnO4晶体上滴加浓盐酸,产生氯气;②向FeCl2溶液中通入少量氯气,溶液变黄色;③向FeCl2溶液中加入少量溴水,溶液变黄色;④分别取实验②和实验③中生成的溶液,分别滴在淀粉 KI试纸上,试纸都变蓝色。则下列判断不正确的是( )
A.实验①能够证明Cl-具有还原性
B.上述实验能够证明氧化性:Cl2>Br2
C.上述实验能够证明氧化性:MnO >Cl2>Fe3+>I2
D.由上述实验也可推测氯气能使湿润的淀粉 KI试纸变蓝
B [高锰酸钾能将浓盐酸氧化为氯气,高锰酸钾作氧化剂,HCl作还原剂,证明Cl-具有还原性,A项正确;氯气能将亚铁离子氧化为三价铁离子,氯气作氧化剂,溴水将亚铁离子氧化为三价铁离子,溴单质作氧化剂,说明氧化性:Cl2>Fe3+,Br2>Fe3+,但是不能证明氧化性:Cl2>Br2,B项错误;每个反应的氧化剂的氧化性大于氧化产物的氧化性,故由A、B项分析可知,氧化性:MnO >Cl2、Cl2>Fe3+,三价铁离子将碘离子氧化为单质碘,Fe2+是还原产物,单质碘是氧化产物,所以氧化性:Fe3+>I2,则能够证明氧化性:MnO >Cl2>Fe3+>I2,C项正确;由实验可推知氧化性:Cl2>Fe3+>I2,实验④试纸变蓝是因为Fe3+将I-氧化成I2从而可推测Cl2也能氧化I-为I2,能使湿润淀粉 KI试纸变蓝,D项正确。]
5.某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验:
实验①:取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)写出实验②中发生氧化还原反应的离子方程式:___________。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________(填字母)。
A.Br2>I2 B.Fe3+>Br2
C.Br2>Fe3+ D.I->Br-
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验方案加以证明。
①FeCl3溶液 ②碘水 ③KI溶液 ④稀硫酸
⑤淀粉液
(提示:实验方案包括实验步骤、现象及结论)_____________。
[解析] 实验①:取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色,说明有碘单质生成,说明Br2的氧化性强于I2;实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色,说明有Fe3+生成,说明Br2的氧化性强于Fe3+。欲证明氧化性:Fe3+>I2,只需证明Fe3+与I-反应有I2生成即可。
[答案] (1)2Fe2++Br2===2Fe3++2Br-
(2)AC (3)取少量FeCl3溶液于试管中,依次加入KI溶液和淀粉液,振荡,淀粉变蓝,证明Fe3+的氧化性强于I2
真题感悟·明确考向
03
真题 感悟
情境 探究
1
3
2
1
3
2
2.(2022·浙江1月选考,T10)关于反应4CO2+SiH4 4CO+2H2O+SiO2,下列说法正确的是 ( )
A.CO是氧化产物
B.SiH4发生还原反应
C.氧化剂与还原剂的物质的量之比为1∶4
D.生成1 mol SiO2时,转移8 mol电子
D [由方程式可知,CO是还原产物;SiH4发生氧化反应;氧化剂与还原剂分别为CO2和SiH4,反应中物质的量之比为4∶1;每生成1 mol SiO2,转移8 mol 电子。]
1
3
2
3.(2021·浙江1月选考,T10)关于反应8NH3+6NO2===7N2+12H2O,下列说法正确的是( )
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的物质的量之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
1
3
2
D [该反应为归中反应,NH3中氮化合价元素从-3价升高至0价,氮元素被氧化,NO2中氮元素化合价从+4价降低至0价,得到电子,依据反应关系,还原剂与氧化剂的物质的量之比为4∶3,氧化产物与还原产物的物质的量之比为4∶3,故A、B、C不正确,D正确。]
1
3
2
利用绿矾(FeSO4·5H2O)可制备一种新型、高效、多功能绿色水处理剂高铁酸钾(K2FeO4)。
已知:高铁酸钾氧化性比Cl2、O2、ClO2、KMnO4更强;主要反应:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
(1)该反应中的氧化剂是________,还原剂是________________。
(2)简要说明K2FeO4作为水处理剂时所起的作用为_______。
(3)当生成1 mol O2时,该反应转移的电子数为________(设NA为阿伏加德罗常数的值)。
(4)该反应中,被氧化的Na2O2与被还原的Na2O2的质量比为________。
[解析] (1)该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价。得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以氧化剂是Na2O2,还原剂是Na2O2、FeSO4。(2)K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附除去水中的悬浮杂质。
[答案] (1)Na2O2 Na2O2、FeSO4 (2)高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降 (3)10NA (4)1∶5
谢谢观看 THANK YOU!
同课章节目录
