第9讲 氧化还原反应方程式的书写与计算(能力课)(共51张PPT)-2024届高考化学一轮复习
文档属性
| 名称 | 第9讲 氧化还原反应方程式的书写与计算(能力课)(共51张PPT)-2024届高考化学一轮复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 20:31:34 | ||
图片预览








文档简介
(共51张PPT)
第9讲 氧化还原反应方程式的书写与计算(能力课)
第一部分 化学基本概念
第二章 化学物质及其变化
1.掌握氧化还原方程式的配平方法。 2.掌握氧化还原反应的电子守恒法计算。 3.熟练书写一定情境下的氧化还原方程式。
考点一 氧化还原反应方程式的配平
核心知能突破
关键能力训练
01
1.三大配平原则
2.化合价升降法配平五步骤
[示例] __C+__H2SO4(浓)——__CO2↑+__SO2↑+__H2O
3.四种配平技巧
(1)倒配法:适用于氧化剂与还原剂为同一物质时,可以由生成物―→反应物方向配平。如:
(2)补加法:适用于部分被氧化或被还原的物质反应,配平主物质后把未被氧化或未被还原的物质补进,确定最终系数。如:
(3)整体配平法:适合当一种物质中有两种元素化合价升高或降低,需求整个物质的化合价升降数,然后配平。如:
(4)电荷守恒法:适用于离子方程式,当主要物质配平后,利用电荷守恒配平其他物质。如:
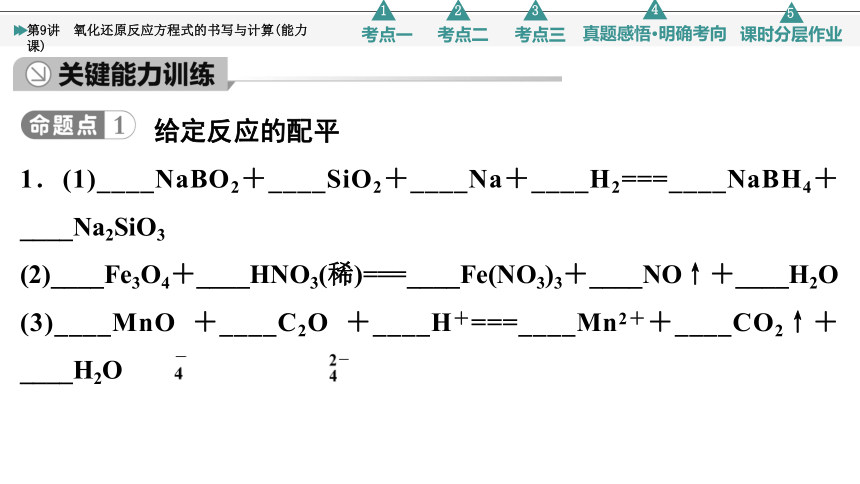
给定反应的配平
1.(1)____NaBO2+____SiO2+____Na+____H2===____NaBH4+____Na2SiO3
(2)____Fe3O4+____HNO3(稀)===____Fe(NO3)3+____NO↑+____H2O
(3)____MnO +____C2O +____H+===____Mn2++____CO2↑+____H2O
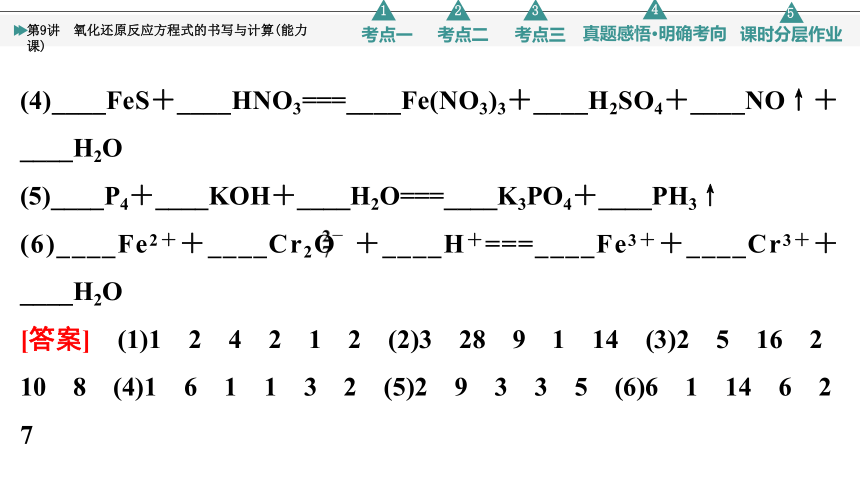
(4)____FeS+____HNO3===____Fe(NO3)3+____H2SO4+____NO↑+____H2O
(5)____P4+____KOH+____H2O===____K3PO4+____PH3↑
(6)____Fe2++____Cr2O +____H+===____Fe3++____Cr3++____H2O
[答案] (1)1 2 4 2 1 2 (2)3 28 9 1 14 (3)2 5 16 2 10 8 (4)1 6 1 1 3 2 (5)2 9 3 3 5 (6)6 1 14 6 2 7
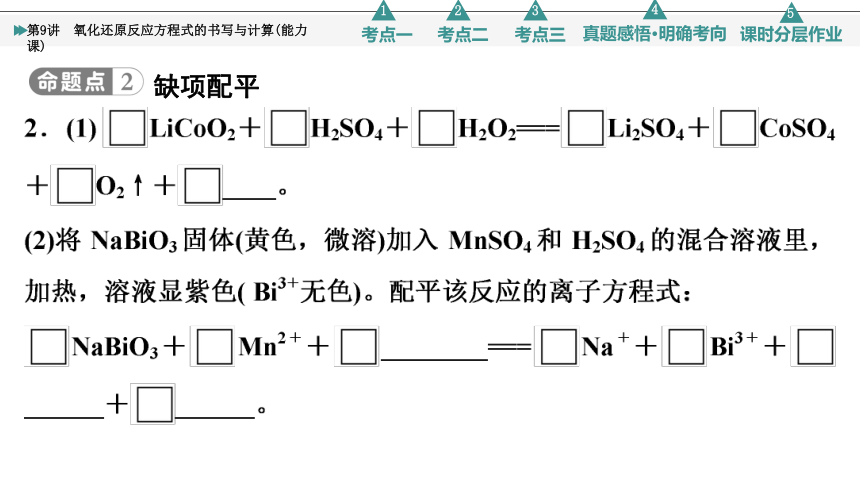
缺项配平
[答案] (1)2 3 1 1 2 1 4 H2O
(2)5 2 14 H+ 5 5 2 MnO 7 H2O
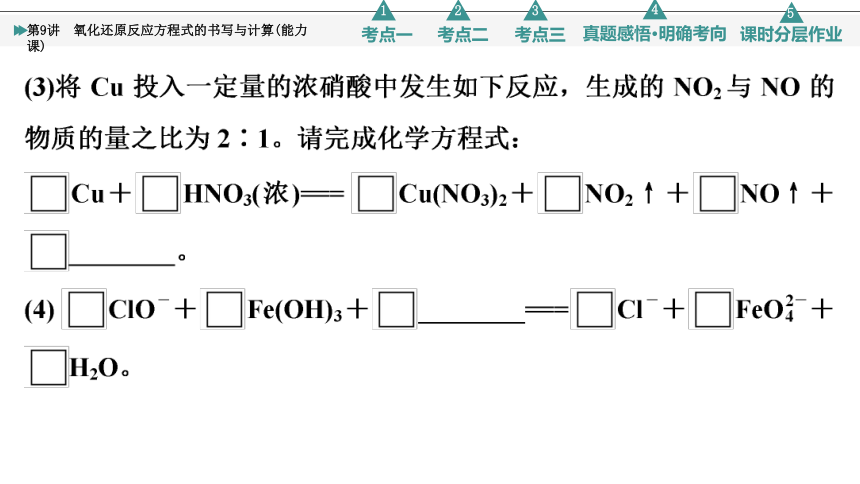
(3)5 16 5 4 2 8 H2O
(4)3 2 4 OH- 3 2 5
(5)28 5 24 KOH 28 3 2 12 H2O
(6)4 5 12 H+ 4 5 11 H2O
缺项配平的原则
条件 补项原则
酸性条 件下 反应物缺H(氢)或多O(氧)补H+生成H2O,反应物少O(氧)补H2O(水)生成H+
碱性条 件下 反应物缺H(氢)或多O(氧)补H2O(水)生成OH-,反应物少O(氧)补OH-生成H2O
注意:当方程式中主物质缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
考点二 新情境下的氧化还原反应方程式书写
02
核心知能突破
关键能力训练
新情境下的氧化还原反应的方程式书写流程
KMnO4能与热的硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,该反应的离子方程式是_______。
[思维流程]
根据有关情境信息书写
1.根据有关信息,完成下列方程式。
(1)皮革厂的废水中含有一定量的氨氮(以NH3、NH 形式存在),NaClO将废水中的NH 转化为N2,反应的离子方程式为_____________。
(2)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染。催化反硝化法中,H2能将NO 还原为N2。
上述反应的离子方程式为___________。
(3)Fe的一种含氧酸根FeO 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是_____________。
根据化工流程书写
2.碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如图:
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为ⅥA族元素,TeO2被浓NaOH溶液溶解,其溶解的离子方程式为__________________。
(2)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为 ____________________;
“还原”过程中,发生反应的离子方程式为_________________。
考点三 电子守恒在化学计算中的应用
03
核心知能突破
关键能力训练
1.计算依据
氧化剂得到的电子总数与还原剂失去的电子总数相等,即得、失电子守恒。
2.守恒法解题的思维流程
在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有5 mol H2O参加反应,被水还原的溴为( )
[思路点拨]
[答案] C
电子守恒的基本计算
1.24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5
B [设Cr在还原产物中的化合价为+x,由得失电子守恒知:0.05 mol·L-1×24×10-3 L×(6-4)=0.02 mol·L-1×20×10-3 L×2×(6-x),x=3。]
2.(2022·福州模拟)高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液的方法制备K2FeO4,发生反应:①Cl2+KOH―→KCl+KClO+KClO3+H2O(未配平);②2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O。
下列说法正确的是( )
A.反应①中每消耗4 mol KOH,吸收标准状况下22.4 L Cl2
B.氧化性:K2FeO4>KClO
C.若反应①中n(ClO-)∶n(ClO )=5∶1,则氧化剂与还原剂的物质的量之比为2∶1
D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时消耗0.3 mol Cl2
D [反应①的生成物有KCl、KClO、KClO3,其中K、Cl的物质的量之比为1∶1,所以每消耗4 mol KOH,吸收2 mol氯气,标准状况下2 mol氯气的体积为22.4 L·mol-1×2 mol=44.8 L,A错误;反应②K2FeO4为氧化产物,KClO为氧化剂,则氧化性:K2FeO4 电子守恒在多步反应中的应用
3.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.60 mL B.45 mL
C.30 mL D.15 mL
4.某硫酸厂为测定沸腾炉中所得气体中SO2的体积分数,取280 mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用0.020 00 mol/L K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。已知:Cr2O +Fe2++H+―→Cr3++Fe3++H2O(未配平)。
(1)SO2通入Fe2(SO4)3溶液中,发生反应离子方程式为_____________。
(2)沸腾炉中所得气体中SO2的体积分数为________(小数点后保留两位)。
[解析] (1)SO2中S为+4价,被氧化成+6价,产物为SO ,Fe3+被还原成Fe2+,产物中氧原子数增多,表明反应物中有水,产物中有H+,仍须用得失电子守恒来配平离子方程式;(2)根据得失电子守恒可知:n(SO2)×2=n(Cr2O )×6=0.020 00 mol/L×0.025 L×6=0.003 mol,n(SO2)=0.001 5 mol,体积分数为12.00%。
[答案] (1)SO2+2Fe3++2H2O===SO +2Fe2++4H+ (2)12.00%
真题感悟·明确考向
04
真题 感悟
情境 探究
1.(2022·山东等级考,T8)实验室制备KMnO4过程为:①高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4;②水溶后冷却,调溶液pH至弱碱性,K2MnO4歧化生成KMnO4和MnO2;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4。下列说法正确的是( )
A.①中用瓷坩埚作反应器
B.①中用NaOH作强碱性介质
C.②中K2MnO4只体现氧化性
D.MnO2转化为KMnO4的理论转化率约为66.7%
1
3
2
D [①由于瓷坩埚易被强碱腐蚀,故不能用瓷坩埚作反应器,A说法不正确;制备KMnO4时为防止引入杂质离子,①中用KOH作强碱性介质,不能用NaOH,B说法不正确;②中K2MnO4既体现氧化性又体现还原性,C说法不正确;根据化合价的变化分析,K2MnO4发生歧化反应生成KMnO4和MnO2的物质的量之比为2∶1,根据Mn元素守恒可知,MnO2中的Mn元素只有 转化为KMnO4,因此,MnO2转化为KMnO4的理论转化率约为66.7%,D说法正确。]
1
3
2
2.(2021·广东选择性考试,T18节选)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
(1)该氧化物为________。
(2)已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为________。
1
3
2
[解析] (1)由题给芯片制造的刻蚀过程示意图可知,加入H2O2刻蚀液,GaAs逐渐溶解,当H2O2刻蚀液接触AlAs时,反应生成一种致密的氧化膜,由此可知,Ga、As均可溶于H2O2刻蚀液,AlAs中的铝被氧化为致密的Al2O3膜。(2)GaAs与H2O2反应时,As由-3价变为+5价,O由-1价变为-2价,由氧化还原反应中得失电子守恒规律可知,氧化剂(H2O2)与还原剂(GaAs)的物质的量之比为4∶1。
[答案] (1)Al2O3 (2)4∶1
1
3
2
3.(2022·河北选择性考试,节选)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
回答下列问题:
(1)还原工序中,不生成S单质的反应的化学方程式为_____________。
(2)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为________,氧化工序发生反应的离子方程式为__________________。
(3)若用还原工序得到的滤液制备Fe2O3·xH2O和(NH4)2SO4,所加试剂为________和________(填化学式,不引入杂质)。
1
3
2
1
3
2
1
3
2
二氧化氯(ClO2)是一种安全高效的消毒剂,可在极低的浓度下杀灭病毒。ClO2易与碱反应生成亚氯酸盐和氯酸盐。
自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。
②已知:2Na2S2O3+I2===Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。
请探究下列问题:
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2,反应的离子方程式为_______________。
(2)写出①中主要反应的化学方程式为_______________。
(3)所取水样中ClO2的浓度为______ mg·L-1。
[答案] (1)H2C2O4+2ClO +2H+===2CO2↑+2ClO2↑+2H2O
(2)2ClO2+2KI===2KClO2+I2 (3)1.35
谢谢观看 THANK YOU!
第9讲 氧化还原反应方程式的书写与计算(能力课)
第一部分 化学基本概念
第二章 化学物质及其变化
1.掌握氧化还原方程式的配平方法。 2.掌握氧化还原反应的电子守恒法计算。 3.熟练书写一定情境下的氧化还原方程式。
考点一 氧化还原反应方程式的配平
核心知能突破
关键能力训练
01
1.三大配平原则
2.化合价升降法配平五步骤
[示例] __C+__H2SO4(浓)——__CO2↑+__SO2↑+__H2O
3.四种配平技巧
(1)倒配法:适用于氧化剂与还原剂为同一物质时,可以由生成物―→反应物方向配平。如:
(2)补加法:适用于部分被氧化或被还原的物质反应,配平主物质后把未被氧化或未被还原的物质补进,确定最终系数。如:
(3)整体配平法:适合当一种物质中有两种元素化合价升高或降低,需求整个物质的化合价升降数,然后配平。如:
(4)电荷守恒法:适用于离子方程式,当主要物质配平后,利用电荷守恒配平其他物质。如:
给定反应的配平
1.(1)____NaBO2+____SiO2+____Na+____H2===____NaBH4+____Na2SiO3
(2)____Fe3O4+____HNO3(稀)===____Fe(NO3)3+____NO↑+____H2O
(3)____MnO +____C2O +____H+===____Mn2++____CO2↑+____H2O
(4)____FeS+____HNO3===____Fe(NO3)3+____H2SO4+____NO↑+____H2O
(5)____P4+____KOH+____H2O===____K3PO4+____PH3↑
(6)____Fe2++____Cr2O +____H+===____Fe3++____Cr3++____H2O
[答案] (1)1 2 4 2 1 2 (2)3 28 9 1 14 (3)2 5 16 2 10 8 (4)1 6 1 1 3 2 (5)2 9 3 3 5 (6)6 1 14 6 2 7
缺项配平
[答案] (1)2 3 1 1 2 1 4 H2O
(2)5 2 14 H+ 5 5 2 MnO 7 H2O
(3)5 16 5 4 2 8 H2O
(4)3 2 4 OH- 3 2 5
(5)28 5 24 KOH 28 3 2 12 H2O
(6)4 5 12 H+ 4 5 11 H2O
缺项配平的原则
条件 补项原则
酸性条 件下 反应物缺H(氢)或多O(氧)补H+生成H2O,反应物少O(氧)补H2O(水)生成H+
碱性条 件下 反应物缺H(氢)或多O(氧)补H2O(水)生成OH-,反应物少O(氧)补OH-生成H2O
注意:当方程式中主物质缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
考点二 新情境下的氧化还原反应方程式书写
02
核心知能突破
关键能力训练
新情境下的氧化还原反应的方程式书写流程
KMnO4能与热的硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,该反应的离子方程式是_______。
[思维流程]
根据有关情境信息书写
1.根据有关信息,完成下列方程式。
(1)皮革厂的废水中含有一定量的氨氮(以NH3、NH 形式存在),NaClO将废水中的NH 转化为N2,反应的离子方程式为_____________。
(2)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染。催化反硝化法中,H2能将NO 还原为N2。
上述反应的离子方程式为___________。
(3)Fe的一种含氧酸根FeO 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是_____________。
根据化工流程书写
2.碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如图:
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为ⅥA族元素,TeO2被浓NaOH溶液溶解,其溶解的离子方程式为__________________。
(2)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为 ____________________;
“还原”过程中,发生反应的离子方程式为_________________。
考点三 电子守恒在化学计算中的应用
03
核心知能突破
关键能力训练
1.计算依据
氧化剂得到的电子总数与还原剂失去的电子总数相等,即得、失电子守恒。
2.守恒法解题的思维流程
在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有5 mol H2O参加反应,被水还原的溴为( )
[思路点拨]
[答案] C
电子守恒的基本计算
1.24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5
B [设Cr在还原产物中的化合价为+x,由得失电子守恒知:0.05 mol·L-1×24×10-3 L×(6-4)=0.02 mol·L-1×20×10-3 L×2×(6-x),x=3。]
2.(2022·福州模拟)高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液的方法制备K2FeO4,发生反应:①Cl2+KOH―→KCl+KClO+KClO3+H2O(未配平);②2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O。
下列说法正确的是( )
A.反应①中每消耗4 mol KOH,吸收标准状况下22.4 L Cl2
B.氧化性:K2FeO4>KClO
C.若反应①中n(ClO-)∶n(ClO )=5∶1,则氧化剂与还原剂的物质的量之比为2∶1
D.若反应①的氧化产物只有KClO,则得到0.2 mol K2FeO4时消耗0.3 mol Cl2
D [反应①的生成物有KCl、KClO、KClO3,其中K、Cl的物质的量之比为1∶1,所以每消耗4 mol KOH,吸收2 mol氯气,标准状况下2 mol氯气的体积为22.4 L·mol-1×2 mol=44.8 L,A错误;反应②K2FeO4为氧化产物,KClO为氧化剂,则氧化性:K2FeO4
3.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.60 mL B.45 mL
C.30 mL D.15 mL
4.某硫酸厂为测定沸腾炉中所得气体中SO2的体积分数,取280 mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用0.020 00 mol/L K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。已知:Cr2O +Fe2++H+―→Cr3++Fe3++H2O(未配平)。
(1)SO2通入Fe2(SO4)3溶液中,发生反应离子方程式为_____________。
(2)沸腾炉中所得气体中SO2的体积分数为________(小数点后保留两位)。
[解析] (1)SO2中S为+4价,被氧化成+6价,产物为SO ,Fe3+被还原成Fe2+,产物中氧原子数增多,表明反应物中有水,产物中有H+,仍须用得失电子守恒来配平离子方程式;(2)根据得失电子守恒可知:n(SO2)×2=n(Cr2O )×6=0.020 00 mol/L×0.025 L×6=0.003 mol,n(SO2)=0.001 5 mol,体积分数为12.00%。
[答案] (1)SO2+2Fe3++2H2O===SO +2Fe2++4H+ (2)12.00%
真题感悟·明确考向
04
真题 感悟
情境 探究
1.(2022·山东等级考,T8)实验室制备KMnO4过程为:①高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4;②水溶后冷却,调溶液pH至弱碱性,K2MnO4歧化生成KMnO4和MnO2;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4。下列说法正确的是( )
A.①中用瓷坩埚作反应器
B.①中用NaOH作强碱性介质
C.②中K2MnO4只体现氧化性
D.MnO2转化为KMnO4的理论转化率约为66.7%
1
3
2
D [①由于瓷坩埚易被强碱腐蚀,故不能用瓷坩埚作反应器,A说法不正确;制备KMnO4时为防止引入杂质离子,①中用KOH作强碱性介质,不能用NaOH,B说法不正确;②中K2MnO4既体现氧化性又体现还原性,C说法不正确;根据化合价的变化分析,K2MnO4发生歧化反应生成KMnO4和MnO2的物质的量之比为2∶1,根据Mn元素守恒可知,MnO2中的Mn元素只有 转化为KMnO4,因此,MnO2转化为KMnO4的理论转化率约为66.7%,D说法正确。]
1
3
2
2.(2021·广东选择性考试,T18节选)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
(1)该氧化物为________。
(2)已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为________。
1
3
2
[解析] (1)由题给芯片制造的刻蚀过程示意图可知,加入H2O2刻蚀液,GaAs逐渐溶解,当H2O2刻蚀液接触AlAs时,反应生成一种致密的氧化膜,由此可知,Ga、As均可溶于H2O2刻蚀液,AlAs中的铝被氧化为致密的Al2O3膜。(2)GaAs与H2O2反应时,As由-3价变为+5价,O由-1价变为-2价,由氧化还原反应中得失电子守恒规律可知,氧化剂(H2O2)与还原剂(GaAs)的物质的量之比为4∶1。
[答案] (1)Al2O3 (2)4∶1
1
3
2
3.(2022·河北选择性考试,节选)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
回答下列问题:
(1)还原工序中,不生成S单质的反应的化学方程式为_____________。
(2)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为________,氧化工序发生反应的离子方程式为__________________。
(3)若用还原工序得到的滤液制备Fe2O3·xH2O和(NH4)2SO4,所加试剂为________和________(填化学式,不引入杂质)。
1
3
2
1
3
2
1
3
2
二氧化氯(ClO2)是一种安全高效的消毒剂,可在极低的浓度下杀灭病毒。ClO2易与碱反应生成亚氯酸盐和氯酸盐。
自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。
②已知:2Na2S2O3+I2===Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。
请探究下列问题:
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2,反应的离子方程式为_______________。
(2)写出①中主要反应的化学方程式为_______________。
(3)所取水样中ClO2的浓度为______ mg·L-1。
[答案] (1)H2C2O4+2ClO +2H+===2CO2↑+2ClO2↑+2H2O
(2)2ClO2+2KI===2KClO2+I2 (3)1.35
谢谢观看 THANK YOU!
同课章节目录
