3.4.1 羧酸课件(共27张PPT)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.4.1 羧酸课件(共27张PPT)2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 21:03:01 | ||
图片预览




文档简介
(共27张PPT)
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第1课时 羧酸
生活中的羧酸
CH3—CH—COOH
OH
乳酸
HCOOH
甲酸(蚁酸)
乙二酸
COOH
COOH
HO—C—COOH
CH2—COOH
CH2—COOH
柠檬酸
一、羧酸
1.定义:由烃基(或氢原子)与羧基相连而构成的化合物
官能团:—COOH
2.饱和一元脂肪酸的通式:CnH2nO2
【注意】饱和一元羧酸与比它多一个碳原子的饱和一元醇Cm+1H2(m+1)+2O等式量(相对分子质量)
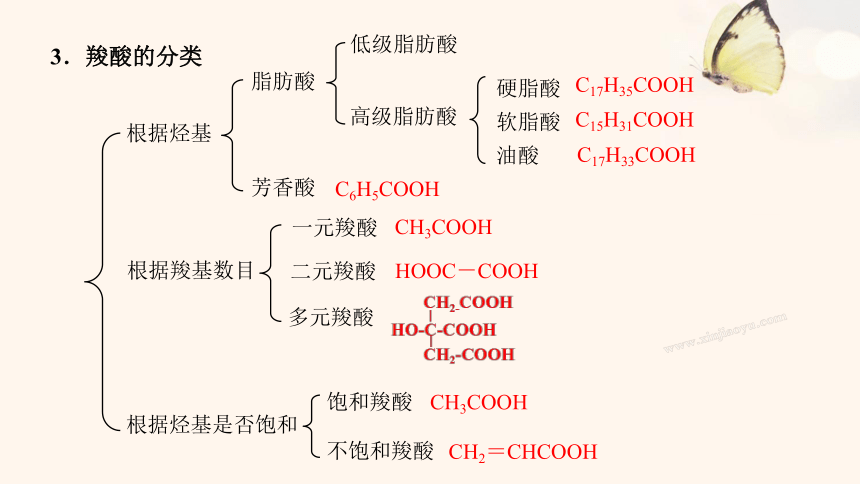
根据羧基数目
根据烃基
CH3COOH
CH2=CHCOOH
硬脂酸
软脂酸
油酸
脂肪酸
芳香酸
C6H5COOH
一元羧酸
二元羧酸
多元羧酸
HOOC-COOH
低级脂肪酸
高级脂肪酸
C17H35COOH
C17H33COOH
C15H31COOH
根据烃基是否饱和
饱和羧酸
不饱和羧酸
CH3COOH
3.羧酸的分类
4.羧酸的命名
(1)选含羧基的最长的碳链为主链,称某酸
(2)从靠近羧基的一端开始依次给主链碳原子编号
(3)在“某酸”名称之前加上取代基的位次号和名称
【注意】由于醛基总是位于碳链的一端,所以羧基碳总是在第一位!
2-甲基丙酸
3 2 1
CH3CH2COOH
CH3
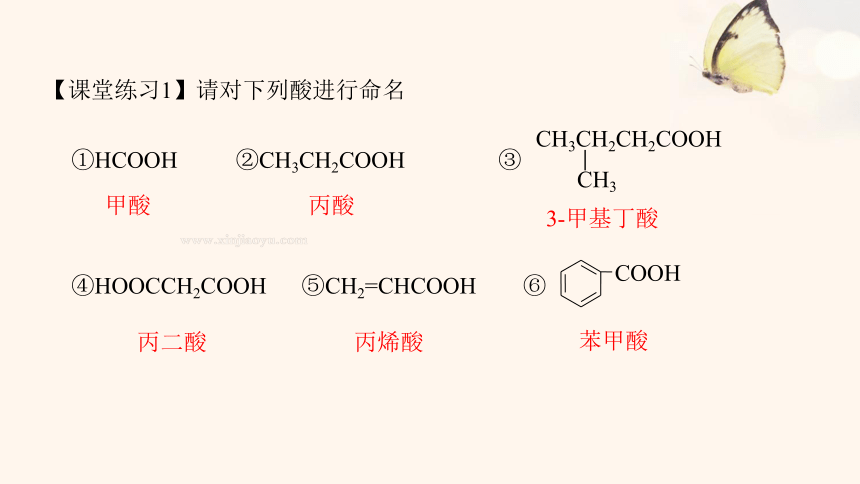
【课堂练习1】请对下列酸进行命名
①HCOOH ②CH3CH2COOH ③
④HOOCCH2COOH ⑤CH2=CHCOOH ⑥
3-甲基丁酸
甲酸
丙酸
丙二酸
丙烯酸
苯甲酸
CH3CH2CH2COOH
CH3
COOH
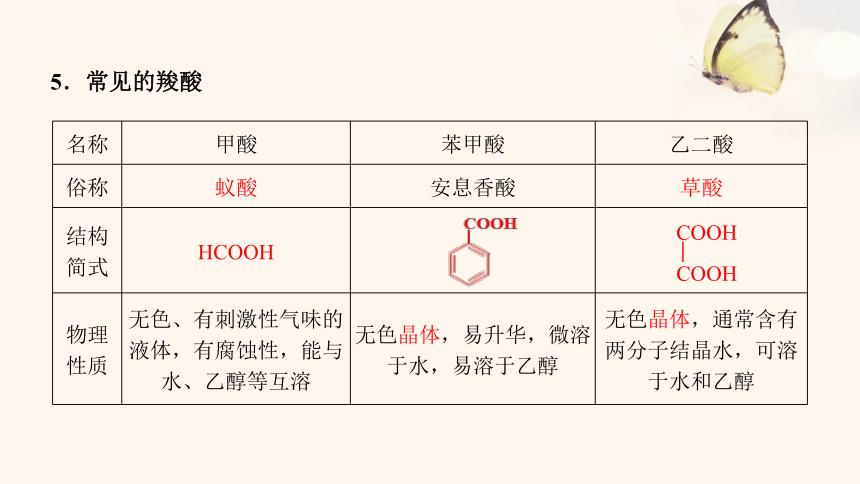
5.常见的羧酸
名称 甲酸 苯甲酸 乙二酸
俗称 蚁酸 安息香酸 草酸
结构 简式 HCOOH
物理 性质 无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶 无色晶体,易升华,微溶于水,易溶于乙醇 无色晶体,通常含有两分子结晶水,可溶于水和乙醇
COOH
COOH
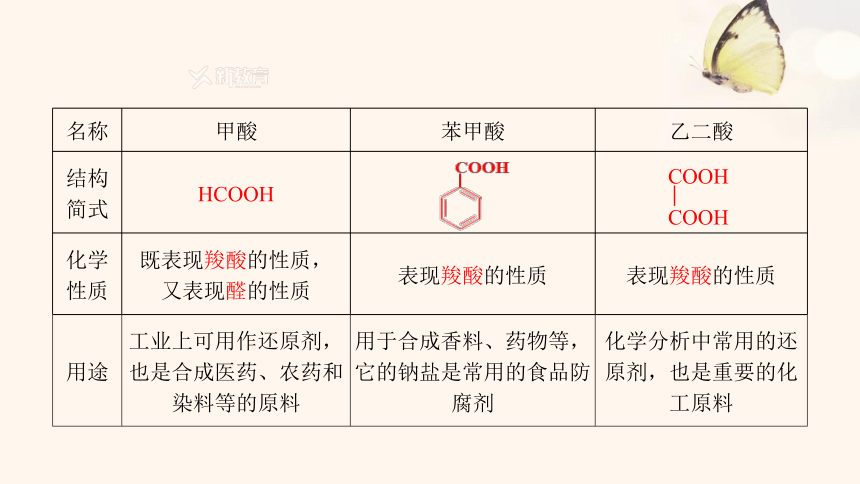
名称 甲酸 苯甲酸 乙二酸
结构 简式 HCOOH
化学 性质 既表现羧酸的性质, 又表现醛的性质 表现羧酸的性质 表现羧酸的性质
用途 工业上可用作还原剂,也是合成医药、农药和染料等的原料 用于合成香料、药物等,它的钠盐是常用的食品防腐剂 化学分析中常用的还原剂,也是重要的化工原料
COOH
COOH
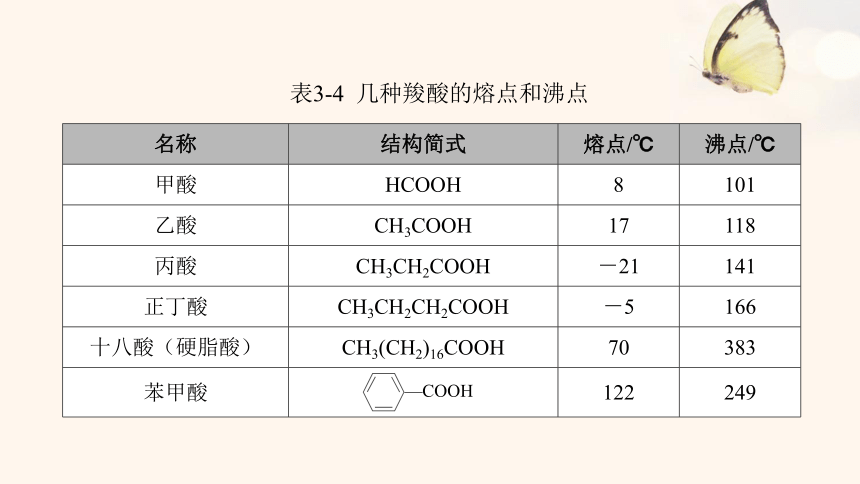
表3-4 几种羧酸的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 122 249
—COOH
1.熔沸点
(1)随分子中碳原子数的增加,熔沸点逐渐升高,随支链增多熔沸点逐渐降低。
(2)羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
2.溶解性
(1)甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
(2)随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。
(3)高级脂肪酸是不溶于水的蜡状固体。
二、物理性质
断键方式:
δ-
C
O
H
R
O
δ+
碳氧键易断裂
﹒取代反应
﹒酯化反应
氧氢键易断裂
﹒酸性
δ+
δ-
分析羧酸化学键的极性,指出容易断键的位置。想一想可能会发生什么类型的反应?
三、化学性质
1.弱酸性:具有酸的通性
一元羧酸电离的方程式:
R—COOH R—COO- + H+
(1)与指示剂反应:
(2)与活泼金属起置换反应(与氢前金属反应)
(3)与碱性氧化物反应
(4)中和反应
(5)与某些盐反应
使紫色石蕊试液变红
2CH3COOH + 2Na === 2CH3COONa + H2↑
2CH3COOH + Cu2O === 2CH3COOCu + H2O
CH3COOH + NaOH === CH3COONa + H2O
2CH3COOH + CaCO3 === Ca(CH3COO)2 +H2O + CO2↑
【实验探究】乙酸、碳酸和苯酚酸性强弱
A装置现象 及解释 有 色气体产生,说明酸性:乙酸 碳酸;
方程式:
C装置现象 及解释 溶液 ,说明酸性:碳酸 苯酚
方程式:
B装置作用
实验结论 酸性:乙酸 碳酸 苯酚
无
>
>
>
>
>
变浑浊
除去CO2中的乙酸蒸气,防止对碳酸酸性大于苯酚的检验产生干扰
2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O
CO2+H2O+C6H5ONa → C6H5OH+NaHCO3
代表物 结构简式 羟基氢的活泼性 酸性 (与碳酸相比) 与钠反应 与NaOH的 反应 与Na2CO3的
反应
乙醇 CH3CH2OH
苯酚 C6H5OH
乙酸 CH3COOH
【小结】比较醇、酚、羧酸中O—H的活泼性
【结论】 氧氢键的活泼性:羧酸>酚>醇。
增强
中性
比碳酸弱
比碳酸强
能
能
能
不能
能
能
不能
能,
不产生CO2
能,
产生CO2
现象:①饱和Na2CO3溶液的液面上有透明的
油状液体生成
②能闻到香味
2.酯化反应
【注意事项】
①试剂加入顺序为乙醇、浓硫酸、冰醋酸
②浓硫酸起催化剂和吸水剂作用
③实验需要缓慢加热,以防乙酸和乙醇大量挥发,液体剧烈沸腾;防止副反应发生
④导气管在液面上是为了防倒吸
⑤饱和碳酸钠的作用是:吸收乙醇,反应乙酸,降低乙酸乙酯的溶解
⑥提高乙酸乙酯产率措施:用浓硫酸吸水 , 加热将酯蒸出 , 适当增加乙醇的用量
3.常见的酯化反应
(1)一元羧酸与二元醇或二元羧酸与一元醇的酯化反应
①乙酸与乙二醇
②乙二酸与乙醇
+ 2CH3CH2OH
COOH
COOH
COOCH2CH3
COOCH2CH3
+ 2H2O
2CH3COOH +
CH2OH
CH2OH
CH3COOCH2
CH3COOCH2
+ 2H2O
2.多元羧酸与多元醇之间的酯化反应:如乙二酸与乙二醇
①生成普通酯:
②生成环酯
③生成高分子化合物
COOH
COOH
CH2OH
CH2OH
HOOC—COOCH2CH2OH+2H2O
+
COOH
COOH
CH2OH
CH2OH
+2H2O
+
COOCH2
COOCH2
COOH
COOH
CH2OH
CH2OH
+2n H2O
+
n
n
[ OC—COOCH2CH2O ]n
【课堂小结】
1.阿魏酸化学名称为4-羟基-3-甲氧基肉桂酸,可以作医药、保健品、化妆品原料和
食品添加剂,结构简式为 。在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团。下列试剂、现象、结论都正确的是( )
选项 试剂 现象 结论
A 氯化铁溶液 溶液变蓝色 含有酚羟基
B 银氨溶液 产生银镜 含有醛基
C 碳酸氢钠溶液 产生气泡 含有羧基
D 溴水 溶液褪色 含有碳碳双键
C
【当堂检测】
2.下列将CH3CHO和CH3COOH分离的正确方法是( )
A.蒸馏
B.加入Na2CO3溶液后,通过分液的方法分离
C.加入烧碱溶液后蒸馏出乙醛,再加入浓硫酸,蒸馏出乙酸
D.和Na反应后,通过蒸馏的方法分离
C
【解析】CH3CHO、CH3COOH均溶于水,均易挥发,沸点不同。
A.CH3CHO、CH3COOH均易挥发,直接加热蒸馏不能得到纯净物,故A错误;
B.乙酸能够与碳酸钠反应,产物乙酸钠与乙醛混溶,不能分液分离,故B错误;
C.先加入烧碱溶液,产物乙酸钠与乙醛的沸点差异增大,蒸馏乙醛,再加入浓H2SO4,与乙酸钠反应生成乙酸,蒸出乙酸,故C正确;
D.乙酸与Na反应生成乙酸钠,蒸馏分离得到乙酸钠,需将乙酸钠转化为乙酸,未达到分离目的,故D错误。
3.草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是_______________________________,由此可知草酸晶体分解的产物中有______。装置B的主要作用:________________________________________
_______________________________________________________________________。
有气泡冒出且澄清石灰水变浑浊
CO2
冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验
(2)设计实验:
①证明草酸的酸性比碳酸的强(简述操作步骤和现象,下同):
②用简单的方法鉴别草酸和甲酸:
向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生
用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是甲酸的2倍
本节内容结束
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第1课时 羧酸
生活中的羧酸
CH3—CH—COOH
OH
乳酸
HCOOH
甲酸(蚁酸)
乙二酸
COOH
COOH
HO—C—COOH
CH2—COOH
CH2—COOH
柠檬酸
一、羧酸
1.定义:由烃基(或氢原子)与羧基相连而构成的化合物
官能团:—COOH
2.饱和一元脂肪酸的通式:CnH2nO2
【注意】饱和一元羧酸与比它多一个碳原子的饱和一元醇Cm+1H2(m+1)+2O等式量(相对分子质量)
根据羧基数目
根据烃基
CH3COOH
CH2=CHCOOH
硬脂酸
软脂酸
油酸
脂肪酸
芳香酸
C6H5COOH
一元羧酸
二元羧酸
多元羧酸
HOOC-COOH
低级脂肪酸
高级脂肪酸
C17H35COOH
C17H33COOH
C15H31COOH
根据烃基是否饱和
饱和羧酸
不饱和羧酸
CH3COOH
3.羧酸的分类
4.羧酸的命名
(1)选含羧基的最长的碳链为主链,称某酸
(2)从靠近羧基的一端开始依次给主链碳原子编号
(3)在“某酸”名称之前加上取代基的位次号和名称
【注意】由于醛基总是位于碳链的一端,所以羧基碳总是在第一位!
2-甲基丙酸
3 2 1
CH3CH2COOH
CH3
【课堂练习1】请对下列酸进行命名
①HCOOH ②CH3CH2COOH ③
④HOOCCH2COOH ⑤CH2=CHCOOH ⑥
3-甲基丁酸
甲酸
丙酸
丙二酸
丙烯酸
苯甲酸
CH3CH2CH2COOH
CH3
COOH
5.常见的羧酸
名称 甲酸 苯甲酸 乙二酸
俗称 蚁酸 安息香酸 草酸
结构 简式 HCOOH
物理 性质 无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶 无色晶体,易升华,微溶于水,易溶于乙醇 无色晶体,通常含有两分子结晶水,可溶于水和乙醇
COOH
COOH
名称 甲酸 苯甲酸 乙二酸
结构 简式 HCOOH
化学 性质 既表现羧酸的性质, 又表现醛的性质 表现羧酸的性质 表现羧酸的性质
用途 工业上可用作还原剂,也是合成医药、农药和染料等的原料 用于合成香料、药物等,它的钠盐是常用的食品防腐剂 化学分析中常用的还原剂,也是重要的化工原料
COOH
COOH
表3-4 几种羧酸的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 122 249
—COOH
1.熔沸点
(1)随分子中碳原子数的增加,熔沸点逐渐升高,随支链增多熔沸点逐渐降低。
(2)羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
2.溶解性
(1)甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。
(2)随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。
(3)高级脂肪酸是不溶于水的蜡状固体。
二、物理性质
断键方式:
δ-
C
O
H
R
O
δ+
碳氧键易断裂
﹒取代反应
﹒酯化反应
氧氢键易断裂
﹒酸性
δ+
δ-
分析羧酸化学键的极性,指出容易断键的位置。想一想可能会发生什么类型的反应?
三、化学性质
1.弱酸性:具有酸的通性
一元羧酸电离的方程式:
R—COOH R—COO- + H+
(1)与指示剂反应:
(2)与活泼金属起置换反应(与氢前金属反应)
(3)与碱性氧化物反应
(4)中和反应
(5)与某些盐反应
使紫色石蕊试液变红
2CH3COOH + 2Na === 2CH3COONa + H2↑
2CH3COOH + Cu2O === 2CH3COOCu + H2O
CH3COOH + NaOH === CH3COONa + H2O
2CH3COOH + CaCO3 === Ca(CH3COO)2 +H2O + CO2↑
【实验探究】乙酸、碳酸和苯酚酸性强弱
A装置现象 及解释 有 色气体产生,说明酸性:乙酸 碳酸;
方程式:
C装置现象 及解释 溶液 ,说明酸性:碳酸 苯酚
方程式:
B装置作用
实验结论 酸性:乙酸 碳酸 苯酚
无
>
>
>
>
>
变浑浊
除去CO2中的乙酸蒸气,防止对碳酸酸性大于苯酚的检验产生干扰
2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O
CO2+H2O+C6H5ONa → C6H5OH+NaHCO3
代表物 结构简式 羟基氢的活泼性 酸性 (与碳酸相比) 与钠反应 与NaOH的 反应 与Na2CO3的
反应
乙醇 CH3CH2OH
苯酚 C6H5OH
乙酸 CH3COOH
【小结】比较醇、酚、羧酸中O—H的活泼性
【结论】 氧氢键的活泼性:羧酸>酚>醇。
增强
中性
比碳酸弱
比碳酸强
能
能
能
不能
能
能
不能
能,
不产生CO2
能,
产生CO2
现象:①饱和Na2CO3溶液的液面上有透明的
油状液体生成
②能闻到香味
2.酯化反应
【注意事项】
①试剂加入顺序为乙醇、浓硫酸、冰醋酸
②浓硫酸起催化剂和吸水剂作用
③实验需要缓慢加热,以防乙酸和乙醇大量挥发,液体剧烈沸腾;防止副反应发生
④导气管在液面上是为了防倒吸
⑤饱和碳酸钠的作用是:吸收乙醇,反应乙酸,降低乙酸乙酯的溶解
⑥提高乙酸乙酯产率措施:用浓硫酸吸水 , 加热将酯蒸出 , 适当增加乙醇的用量
3.常见的酯化反应
(1)一元羧酸与二元醇或二元羧酸与一元醇的酯化反应
①乙酸与乙二醇
②乙二酸与乙醇
+ 2CH3CH2OH
COOH
COOH
COOCH2CH3
COOCH2CH3
+ 2H2O
2CH3COOH +
CH2OH
CH2OH
CH3COOCH2
CH3COOCH2
+ 2H2O
2.多元羧酸与多元醇之间的酯化反应:如乙二酸与乙二醇
①生成普通酯:
②生成环酯
③生成高分子化合物
COOH
COOH
CH2OH
CH2OH
HOOC—COOCH2CH2OH+2H2O
+
COOH
COOH
CH2OH
CH2OH
+2H2O
+
COOCH2
COOCH2
COOH
COOH
CH2OH
CH2OH
+2n H2O
+
n
n
[ OC—COOCH2CH2O ]n
【课堂小结】
1.阿魏酸化学名称为4-羟基-3-甲氧基肉桂酸,可以作医药、保健品、化妆品原料和
食品添加剂,结构简式为 。在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团。下列试剂、现象、结论都正确的是( )
选项 试剂 现象 结论
A 氯化铁溶液 溶液变蓝色 含有酚羟基
B 银氨溶液 产生银镜 含有醛基
C 碳酸氢钠溶液 产生气泡 含有羧基
D 溴水 溶液褪色 含有碳碳双键
C
【当堂检测】
2.下列将CH3CHO和CH3COOH分离的正确方法是( )
A.蒸馏
B.加入Na2CO3溶液后,通过分液的方法分离
C.加入烧碱溶液后蒸馏出乙醛,再加入浓硫酸,蒸馏出乙酸
D.和Na反应后,通过蒸馏的方法分离
C
【解析】CH3CHO、CH3COOH均溶于水,均易挥发,沸点不同。
A.CH3CHO、CH3COOH均易挥发,直接加热蒸馏不能得到纯净物,故A错误;
B.乙酸能够与碳酸钠反应,产物乙酸钠与乙醛混溶,不能分液分离,故B错误;
C.先加入烧碱溶液,产物乙酸钠与乙醛的沸点差异增大,蒸馏乙醛,再加入浓H2SO4,与乙酸钠反应生成乙酸,蒸出乙酸,故C正确;
D.乙酸与Na反应生成乙酸钠,蒸馏分离得到乙酸钠,需将乙酸钠转化为乙酸,未达到分离目的,故D错误。
3.草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是_______________________________,由此可知草酸晶体分解的产物中有______。装置B的主要作用:________________________________________
_______________________________________________________________________。
有气泡冒出且澄清石灰水变浑浊
CO2
冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验
(2)设计实验:
①证明草酸的酸性比碳酸的强(简述操作步骤和现象,下同):
②用简单的方法鉴别草酸和甲酸:
向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生
用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是甲酸的2倍
本节内容结束
